Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cuantificación individual Microvessel Permeabilidad en aislado de rata Blood-perfundido Preparación de pulmón
En este artículo
Resumen
La preparación aislada de pulmón perfundido con sangre hace que sea posible visualizar las redes de microvasos en la superficie del pulmón. A continuación se describe un método para cuantificar la permeabilidad de la microvasculatura individuales en pulmones aislados utilizando imágenes de fluorescencia en tiempo real.
Resumen
La preparación aislada de pulmón perfundido con sangre es ampliamente utilizado para visualizar y definir la señalización en los microvasos individuales. Mediante el acoplamiento de esta preparación con imágenes en tiempo real, se hace factible para determinar los cambios de permeabilidad en los microvasos pulmonares individuales. Aquí se describe los pasos para aislar a los pulmones de ratas y perfundir con sangre autóloga. A continuación, se describe los pasos para infundir fluoróforos o agentes a través de un micro-catéter en una región de pulmón pequeño. El uso de estos procedimientos descritos, se determinó la permeabilidad aumenta en microvasos pulmonares de rata en respuesta a inyecciones de lipopolisacárido bacteriano. Los datos revelaron que el lipopolisacárido aumentó fuga de líquido a través de ambos segmentos venulares y microvasos capilares. Por lo tanto, este método hace posible la comparación de las respuestas de permeabilidad entre los segmentos vasculares y por lo tanto, definir cualquier heterogeneidad en la respuesta. Mientras que los métodos comúnmente utilizados para definir la permeabilidad pulmonar requieren postprocesado de muestras de tejido de los pulmones, eluso de imágenes en tiempo real evita este requisito como se desprende de la presente método. Por lo tanto, la preparación de pulmón aislado combinado con imágenes en tiempo real, ofrece varias ventajas sobre los métodos tradicionales para determinar la permeabilidad microvascular pulmonar, sin embargo, es un método sencillo de desarrollar y poner en práctica.
Introducción
Aumento de la permeabilidad microvascular en los pulmones conduce al desarrollo de edema alveolar y el intercambio de gases en peligro y es una característica importante de la lesión pulmonar aguda (ALI) 1-3. Por lo tanto, las estimaciones de la permeabilidad vascular son importantes para definir el grado de la lesión pulmonar y la eficacia de las intervenciones terapéuticas propuestas. Análisis gravimétrico, tales como la relación húmedo a seco de pulmón libre de sangre y microvascular coeficiente de filtración se utilizan ampliamente métodos para estimar 4,5 permeabilidad. Otros métodos incluyen la cuantificación de la retención de sondas radioactivas o fluorescentes en el tejido pulmonar 6-8. Sin embargo, los métodos anteriores requieren un procesamiento postexperiment de muestras de tejido pulmonar hacia la aclaración de los datos de permeabilidad. Además, dado que un animal puede ser utilizado para un solo protocolo de tratamiento, puede ser necesario el número de animales grandes para un estudio completo. Una característica común de los métodos anteriores es que determinan la permeabilidad vascular media paratodos los vasos sanguíneos dentro de la muestra de tejido. Sin embargo, está bien establecido que los micro y macro vasos pulmonares son fenotípicamente diferentes 9. Por lo tanto, las respuestas de permeabilidad pueden ser heterogéneos entre los diversos segmentos de los vasos, así 9,10. Por lo tanto, la cuantificación de la permeabilidad media de todos los vasos pulmonares en una muestra de tejido puede no reflejar adecuadamente esta heterogeneidad.
En la preparación aislada de pulmón perfundido con sangre, los vasos sanguíneos en la superficie del pulmón pueden ser visualizados por un microscopio vertical 4,11,12. Esto permite que las respuestas que caracterizan en los vasos individuales y por lo tanto, abordar cualquier heterogeneidad en las respuestas 13. Además, mediante la utilización de imágenes de fluorescencia de microvasos, ensayos de fluorescencia basado se pueden incorporar. Además, un microcatéter de la aurícula izquierda se puede utilizar para suministrar agentes y sondas de fluorescencia en los vasos sanguíneos 11,14. El microcatéter limita la entrega a una región de pulmón pequeño, por lo tanto exposando sólo los vasos sanguíneos dentro de la región a los agentes infundidos y fluoróforos. Esto permite que múltiples regiones pequeñas dentro del mismo pulmón a ser utilizados para experimentos separados, que conduce a una reducción global de animales necesarios para un estudio.
Imágenes en tiempo real permite la captura de cambios dinámicos en la vascular y la fluorescencia extravascular de microvasos individuales de la preparación de pulmón aislado. Por lo tanto, para cada uno de los microvasos dentro de un campo de imagen, cambios en la fluorescencia durante la infusión de fluoróforos y washoff se pueden grabar, y se cuantificaron fuera de línea 14. El uso de valores de máxima y residual fluorescencia vascular, un índice de permeabilidad para cada uno de los microvasos dentro del campo de la imagen puede ser determinada. Para determinar los cambios de permeabilidad en respuesta a los agentes inflamatorios o perjudiciales, el agente deseado puede administrarse primero y luego el índice de permeabilidad determinada. Además, el campo de imagen se puede ajustar en cualquier lugar dentro de la región de pulmón infundido por elmicrocatéter, permitiendo así un alto grado de flexibilidad en la selección de la red vascular deseada. Por lo tanto, la preparación de pulmón aislado perfundido con sangre en tándem con formación de imágenes en tiempo real proporciona un modelo experimental atractiva para cuantificar la permeabilidad en microvasos pulmonares individuales.
Protocolo
Todos los experimentos realizados en animales fueron aprobadas por el Comité de la Universidad de Tennessee Health Science Center Institucional Cuidado de Animales y el uso.
1. Tubo para Preparados perfusión del pulmón de la rata
- Preparar un sistema de tubos con tubos de Tygon (# 18) para la perfusión de la sangre como se muestra en la Figura 1. Conectar transductores de presión (P23XL) y colocar el tubo en la platina del microscopio.
- Ajuste la temperatura del baño de agua a 37 ° C.
- Conectar la entrada y la salida de pulmón temporalmente con tubo de Tygon.
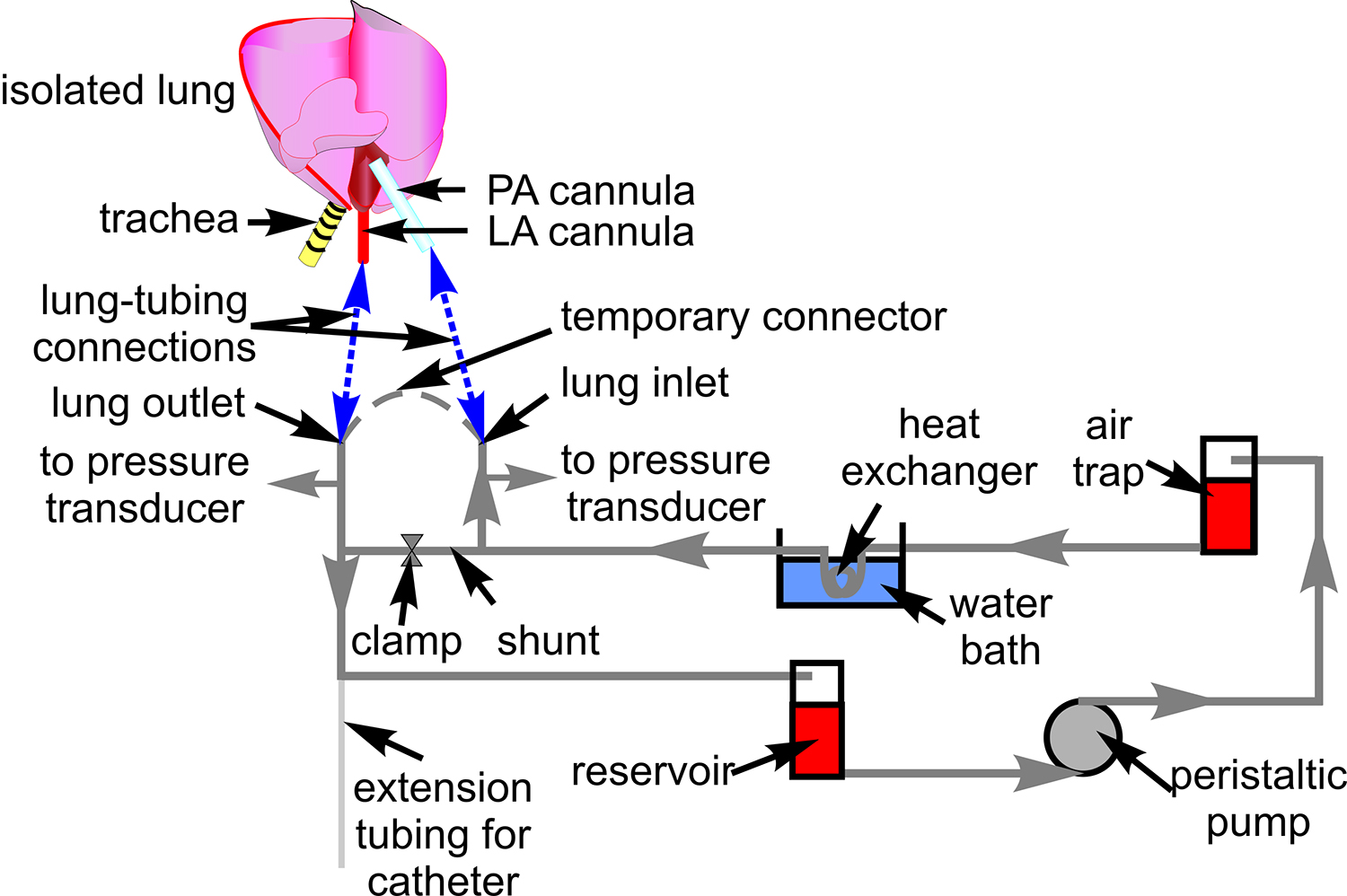
Figura 1. Tubos de perfusión de sangre. El esquema muestra la configuración de la tubería usada para hacer circular la sangre a través de la preparación de pulmón aislado. También se indican los componentes asociados a través del cual la tubería is enrutado. Un esquema del corazón y de pulmón se incluye para mostrar sitios de conexión entre el tubo y la arteria pulmonar (AP), y fibrilación (LA) de la cánula (líneas azules discontinuas) a la izquierda.
2. Preparación de los pulmones de ratas aislados
- Anestesie ratas (ratas Sprague-Dawley macho; 250-300 g) con ketamina (80-100 mg / kg) y con xilazina (5-10 mg / kg). Después de asegurarse de un plano quirúrgico de anestesia, colocar el animal en posición supina.
- Realizar la traqueostomía, inserte una cánula traqueal (PE-90) y asegure con sutura quirúrgica.
- Infundir heparina (100-200 U) en el corazón por punción cardíaca (21 G aguja de mariposa), espere 60 segundos y la sangre Exsanguinate (~ 12 a 15 ml de sangre).
- Prepare dos cánulas (tubos Tygon, 3 mm de diámetro; 4 cm de largo; acampanados en un extremo) y rellenar con solución salina.
- Lleve a cabo una toracotomía. Hacer una incisión (3 mm) en el ventrículo derecho y deslice el extremo acampanado de una cánula en la incisión hacia la pulmonararteria. Asegure cánula de la arteria pulmonar con suturas quirúrgicas.
- Una incisión (3 mm) de la punta del ventrículo izquierdo y deslice el extremo acampanado de la segunda cánula dentro de la incisión. Guía de la cánula en la aurícula izquierda. Asegure cánula en el ventrículo izquierdo con una cinta umbilical (2 mm de ancho).
- Diseccionar cualquier tejido conectivo, y quitar el pulmón y el corazón junto con las cánulas adjuntas. Coloca los pulmones y el corazón en una placa de Petri. Vuelva a colocar el pulmón para que la superficie diafragmática es en la parte superior. Las tres cánulas deben enfrentar la misma dirección.
- Colocar la preparación de pulmón en un escenario que puede ser manipulado en las direcciones XY. Cualquier etapa que viene con un microscopio se puede modificar para mantener el tubo o una etapa a medida construido, si es necesario.
3. Perfusión sanguínea de los pulmones de ratas aisladas
- Mezclar la sangre se desangraron con una albúmina volumen igual (5%) y añadir la solución al depósito. Arranque la bomba peristáltica y establecer el flujo de rcomió a 14 ml / min. Deje que la sangre para llenar el tubo.
- Con la derivación abierta, retire el conector de entrada-salida de pulmón temporal. Fije la arteria pulmonar y la cánula de la aurícula izquierda a la entrada y la salida de pulmón, respectivamente. Asegúrese de que no haya burbujas de aire en la tubería.
- Conectar la cánula traqueal a un tercer transductor de presión (P23XL). Inflar los pulmones con un 30% de oxígeno a través de la cánula traqueal y mantener la presión en 5 cm H 2 O.
- Cierre la derivación con una pinza para comenzar la perfusión pulmonar. Mantener la arteria pulmonar y la presión de la aurícula izquierda a ~ 10 y 3 cm H 2 O, respectivamente.
4. Preparación de pulmón para microvascular Infusión
- Elevar el extremo posterior del tubo de extensión para el catéter por encima del nivel del pulmón y seguro.
- Preparar un catéter de infusión mediante la inserción de unos 30 cm de un tubo PE10 40 cm de largo en una tubería PE90 ~ 30 cm de largo. Conectar el extremo expuesto de la tubería PE10 a una aguja (30 g) arecapitulativos a una jeringa (1 cc).
- Insertar la combinación de catéter en el extremo posterior elevada de la tubería de extensión. Guía de la combinación de catéter a través de la aurícula izquierda y en el pulmón hasta que encuentre resistencia. A continuación, empuje el catéter PE10 sola vez en el pulmón hasta que encuentre resistencia. Tenga en cuenta que la aplicación de una fuerza excesiva al insertar el catéter lesionar el pulmón.
- Llene la jeringa de 1 cc con solución de Ringer y adherirse a una bomba de jeringa. Ajuste la velocidad de infusión a 10 l / min.
- Lugar de la perfusión se convertirá en pálida en comparación con el resto del pulmón.
- Humedezca el pulmón con solución salina y cubra el pulmón con una envoltura de plástico con un agujero lo suficientemente grande como para dejar el lugar de la infusión al descubierto.
- Hisopo un poco de grasa llave de paso en la parte inferior de una junta tórica (por encargo) y colocar un cubreobjetos de vidrio (# 1,5, 22 mm de diámetro) en la parte inferior de la junta tórica. Coloque suavemente la junta tórica con el cubreobjetos sobre el lugar de la infusión. Fije la junta tórica con una hol tubo de ensayo estándarder. La combinación cubreobjetos / junta tórica no distorsiona las estructuras alveolares por debajo de ella, como se informó recientemente 15.
- Coloque un objetivo (20X) de un microscopio de fluorescencia por encima de la junta tórica y se centran en la superficie del pulmón.
5. Imaging fluorescente dextrano tránsito por Microvasos
- Preparar el microscopio para fluorescencia FITC imágenes.
- Seleccionar una región a ser fotografiado y adquirir imágenes a la velocidad de 1/minuto usando el software de adquisición de imágenes.
- Comience la infusión de FITC-dextrano 20 kD (0,5 mg / ml) usando la bomba de jeringa. La fluorescencia en los vasos sanguíneos se incrementará gradualmente y alcanzar un máximo. Continuar la infusión durante 60 min.
- Luego cambiar a la infusión de Ringer para lavar fluorescencia luminal. Mantener la infusión durante más de 10 min. Continuar la adquisición de imágenes en 1/min durante el lavado-off.
6. Análisis de Imágenes
- Abra el archivo de adquisición de imágenes.
- Coloque las regionesde interés sobre los microvasos dentro del marco de la imagen.
- Reproducir el archivo de imagen cuadro por cuadro y registrar la intensidad de fluorescencia en cada región de interés para todos los fotogramas.
- Trazar el cambio en la intensidad de fluorescencia para cada región de interés como una función de tiempo.
- Cuantificar la máxima intensidad de fluorescencia y la intensidad de la fluorescencia residual después de 10 min de washoff.
- Calcular la relación de máxima a la intensidad de fluorescencia residual en cada región de interés para obtener el índice de permeabilidad para los microvasos asociados con esa región de interés.
Resultados
Una preparación de pulmón perfundido con sangre aislado conectado al tubo de perfusión y el equipo relacionado se muestra en la Figura 2. Para fines de demostración, se utilizó una rata Sprague Dawley, aunque los procedimientos descritos en el presente documento se pueden usar con cualquier especie de rata. Infusiones través de un microcatéter de la aurícula izquierda sólo llegan a una pequeña región del pulmón. La región infundido puede ser identificado por la decoloración inducida por
Discusión
La preparación de pulmón perfundido con sangre aislado junto con imágenes en tiempo real proporciona una herramienta sencilla para la determinación de cambios de permeabilidad en los microvasos pulmonares individuales. Hemos aplicado este método para definir los cambios de permeabilidad en respuesta a la infusión de LPS. Nuestros datos sugieren claramente que la infusión de LPS provocó un aumento de la permeabilidad microvascular. Además, los datos también indican que los cambios de permeabilidad inducidos por...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los estudios fueron apoyados por NIH HL75503 de KP.
Materiales
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
Referencias
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados