Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung der Mikrogefäßdurchlässigkeit im Einzel isolierten Blutdurchbluteten Lungen Rat Vorbereitung
In diesem Artikel
Zusammenfassung
Die isolierten durchbluteten Lungenpräparat macht es möglich, Mikrogefäßnetzwerken auf der Lungenoberfläche zu visualisieren. Hier beschreiben wir einen Ansatz zur Durchlässigkeit der einzelnen Mikrogefäße in isolierten Lungen quantifizieren mit Echtzeit-Fluoreszenz-Bildgebung.
Zusammenfassung
Die isolierten durchbluteten Lungenpräparat ist weit verbreitet, zu visualisieren und zu definieren Signalisierung in einzelnen Mikrogefäßen. Durch Kopplung dieser Zubereitung mit Echtzeit-Bildgebung, wird es möglich, Veränderungen der Durchlässigkeit der einzelnen Lungenmikrogefäßen zu bestimmen. Hier beschreiben wir Schritte, um Rattenlungen isolieren und durchströmen sie mit Eigenblut. Dann skizzieren wir Schritte, um Fluorophore oder Agenten über einen Mikrokatheter in eine kleine Lungenbereich ziehen lassen. Mit diesen beschriebenen Verfahren haben wir festgestellt Lässigkeit erhöht in Rattenlunge Mikrogefäße als Reaktion auf Infusionen von bakteriellen Lipopolysaccharide. Die Daten zeigten, dass Lipopolysaccharid erhöhte Flüssigkeitsleck über beide venulären und Kapillar-Mikrogefäßsegmente. Somit macht es dieses Verfahren möglich, die Durchlässigkeit Reaktionen unter Gefäßsegmente zu vergleichen und definieren keine Heterogenität in der Antwort. Während häufigsten verwendeten Methoden, um Lungendurchlässigkeit definieren erfordern Nachbearbeitung von Lungengewebeproben, dieVerwendung von Echtzeit-Bildgebung entfällt diese Anforderung aus dem vorliegenden Verfahren als deutlich. So bietet die isolierte Lungenpräparat kombiniert mit Echtzeit-Bildgebung mehrere Vorteile gegenüber herkömmlichen Methoden der Lungenmikrovaskuläre Permeabilität zu bestimmen, noch ist eine einfache Methode zu entwickeln und umzusetzen.
Einleitung
Erhöhte mikrovaskuläre Permeabilität in der Lunge führt zu einer Entwicklung der alveolären Ödem und beeinträchtigt den Gasaustausch und ist ein wesentliches Merkmal des akuten Lungenversagens (ALI) 03.01. Somit sind die Schätzungen der vaskulären Permeabilität bei der Festlegung des Umfangs der Lungenschädigung und die Wirksamkeit der vorgeschlagenen therapeutischen Maßnahmen wichtig. Gravimetrische Analyse wie Blut kostenlos Lungen nass-Trocken-Verhältnis und mikrovaskulären Filtrationskoeffizient sind weit verbreitete Methoden, die Durchlässigkeit 4,5 schätzen. Andere Methoden umfassen die Quantifizierung der Retention von radioaktiven oder fluoreszierenden Sonden im Lungengewebe 6-8. Allerdings sind die obigen Verfahren erfordern postexperiment Verarbeitung von Lungengewebeproben zu der Aufklärung der Permeabilität Daten. Darüber hinaus, da ein Tier nur für einen einzigen Behandlungsprotokoll verwendet werden, große Tierzahlen kann für eine vollständige Untersuchung erforderlich sein. Ein gemeinsames Merkmal der oben genannten Verfahren ist, dass sie die mittlere Gefäßdurchlässigkeit fürAlle Blutgefäße innerhalb der Gewebeprobe. Es ist jedoch bekannt, dass Lungen Mikro-und Makrogefäße phänotypisch unterschiedlichen 9. Daher kann Lässigkeit heterogene Reaktionen zwischen den verschiedenen Gefäßsegmente als auch 9,10 sein. So Quantifizierung mittlere Durchlässigkeit aller Lungengefäße in einer Gewebeprobe kann nicht angemessen widerspiegelt diese Heterogenität.
In der isolierten durchbluteten Lungen Vorbereitung können Blutgefäße auf der Lungenoberfläche von einem aufrechten Mikroskop 4,11,12 visualisiert werden. Dies ermöglicht die Charakterisierung Antworten in Einzelgefäße und damit, Adressierung keine Heterogenität in den Antworten 13. Zusätzlich kann durch die Verwendung von Fluoreszenz-Bildgebungsmikrogefäße können fluoreszenzbasierten Assays eingebaut werden. Ferner kann eine linke Herzmikrokatheter verwendet werden, um Agenten und Fluoreszenzsonden in Blutgefäße 11,14 liefern werden. Der Mikrokatheter begrenzt die Lieferung an einen kleinen Lungenbereich, also abposiert nur die Blutgefäße in der Region zu den infundiert Mittel und Fluorophore. Dadurch können mehrere kleine Regionen innerhalb der Lunge zu verschiedenen Experimenten verwendet werden, was zu einer Gesamtverringerung der Tiere für eine Untersuchung erforderlich ist.
Echtzeit-Bildgebung ermöglicht eine Erfassung der dynamischen Veränderungen im vaskulären und extravaskulären Fluoreszenz der einzelnen Mikrogefäße des isolierten Lungenpräparat. Somit wird für jede Mikrogefäß innerhalb eines Bildfeldes, Änderungen der Fluoreszenz während der Infusion von Fluorophoren und Auswaschen aufgezeichnet werden können, und quantifiziert offline 14. Mit Werten der maximalen und Restgefäß Fluoreszenz kann eine Durchlässigkeit Index für jedes Mikrogefäß im Imaging-Bereich bestimmt werden. Änderungen der Permeabilität als Reaktion auf schädliche oder entzündliche Agenzien zu bestimmen, können die gewünschten Mittel zuerst verabreicht werden und dann wird der Durchlässigkeitsindex bestimmt. Darüber hinaus kann das Bildfeld überall in der Lunge durch die Region infundiert eingestellt werdenMikrokatheter, wodurch eine hohe Flexibilität in der Auswahl der gewünschten Gefäßnetz. Somit ist die isolierten Blutdurchbluteten Lungenpräparat im Tandem mit Echtzeit-Bildgebung bietet eine attraktive experimentellen Modell die Durchlässigkeit in einzelnen Mikrogefäßen der Lunge zu quantifizieren.
Protokoll
Alle Versuche an Tieren durchgeführt wurden, wie durch die Institutional Animal Care und Verwenden Committee der University of Tennessee Health Science Center genehmigt.
1. Schläuche zur Perfusion Rattenlunge Vorbereitungen
- Bereiten Sie ein Schlauchsystem mit Tygon-Schlauch (# 18) für die Durchblutung, wie in Abbildung 1 dargestellt. Verbinden Druckwandler (P23XL) und legen Sie den Schlauch auf dem Mikroskoptisch.
- Eingestellt Wasserbadtemperatur auf 37 ° C
- Schließen Sie die Lunge und Austritts vorübergehend mit Tygon-Schlauch.
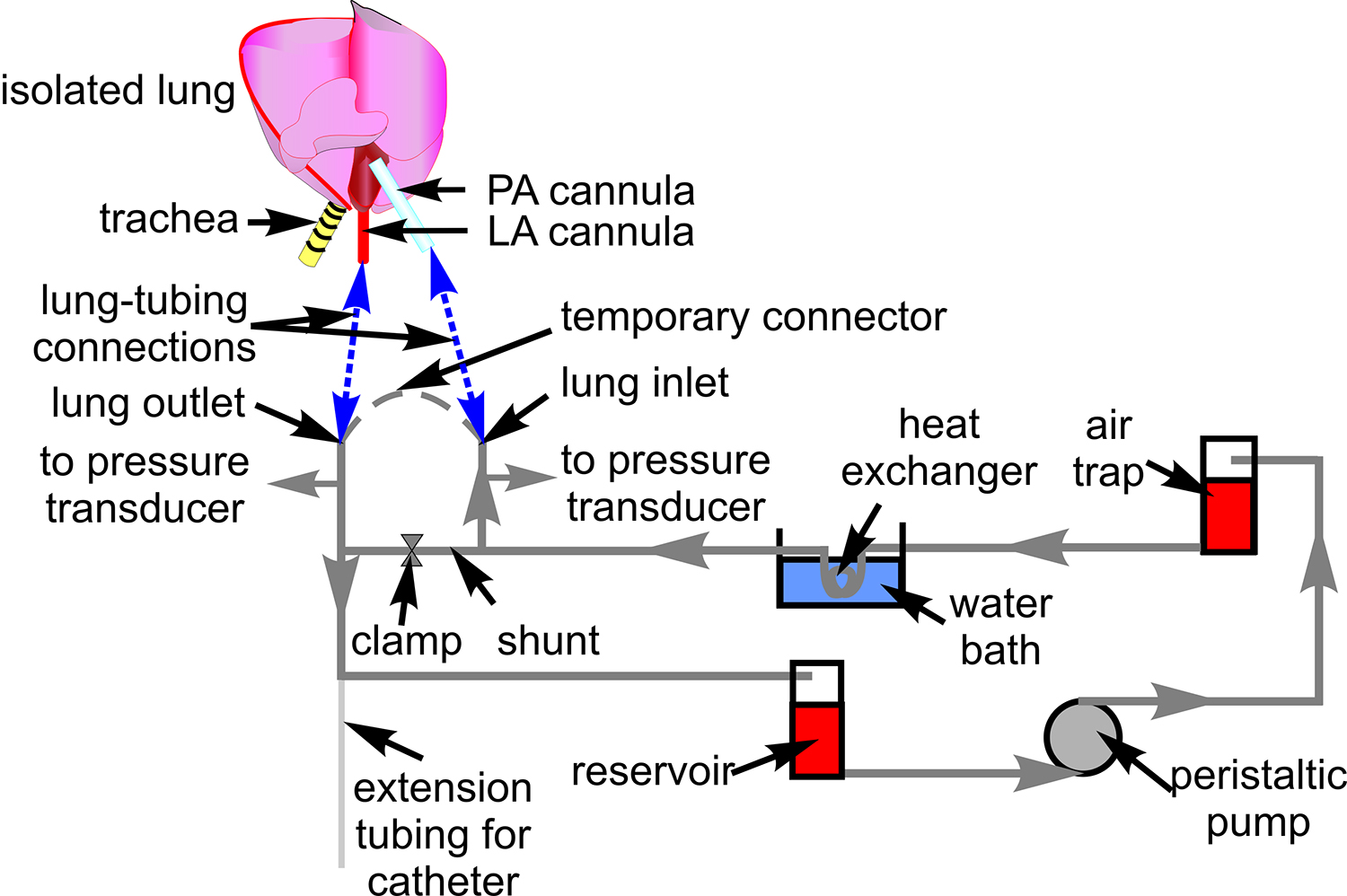
Abbildung 1. Blutinfusionsschlauch. Das Schema zeigt den Schlauch Setup für zirkulierenden Blut durch die isolierte Lungen Zubereitung verwendet. Angedeutet sind assoziiert Komponenten, durch die der Schlauch is geleitet. Eine schematische Darstellung des Herzens und der Lunge ist enthalten, um Websites von Verbindung zwischen der Rohrleitung und Lungenarterie (PA) zu zeigen, und linken Vorhof (LA) Kanüle (blau gestrichelte Linien).
2. Herstellung von isolierten Rattenlungen
- Anesthetize Ratten (Sprague-Dawley Ratten, 250-300 g) mit Ketamin (80-100 mg / kg) und mit Xylazin (5-10 mg / kg). Nach Sicherstellung eines chirurgischen Ebene der Anästhesie, legen Sie das Tier in Rückenlage.
- Führen Tracheotomie, legen Sie eine Trachealkanüle (PE-90) und mit chirurgischem Nahtmaterial.
- Infuse Heparin (100-200 U) in das Herz durch Herzpunktion (21 G Butterfly-Nadel), warten Sie 60 Sekunden und exsanguinate Blut (~ 12-15 ml Blut).
- Bereiten Sie zwei Kanülen (Tygon-Schlauch, 3 mm Durchmesser 4 cm lang, an einem Ende abgefackelt) füllen und mit Kochsalzlösung.
- Führen Sie eine Thorakotomie. Einen Einschnitt (3 mm) auf der rechten Herzkammer und schieben Sie die erweiterten Ende einer Kanüle in den Schnitt in Richtung der LungenArterie. Sichern Kanüle Lungenarterie mit chirurgischem Nahtmaterial.
- Inzision (3 mm) die Spitze der linken Herzkammer und schieben Sie das erweiterte Ende der zweiten Kanüle in den Schnitt. Führen Sie die Kanüle in den linken Vorhof. Sicherung Kanüle in den linken Ventrikel mit einem Nabelband (2 mm Breite).
- Präparieren Sie jede Bindegewebe, und zusammen in die Lunge und Herz mit den beigefügten Kanülen. Zeigen Lunge und Herz auf eine Petrischale. Positionieren Sie die Lunge, so dass der Zwerchfellfläche nach oben zeigt. Die drei Kanülen sollten die gleiche Richtung zeigen.
- Legen Sie das Lungenpräparat auf einer Bühne, die in den XY-Richtung manipuliert werden können. Jede Bühne, die mit einem Mikroskop kommt, kann geändert werden, um den Schlauch oder eine maßgeschneiderte Bühne gebaut, wenn nötig zu halten.
3. Blut Perfusion der isolierten Rattenlungen
- Mischen Sie das Blut ausgeblutet mit einer gleichen Menge Albumin (5%) und in den Behälter. Starten Sie die Schlauchpumpe und Durchfluss gesetzt raß bis 14 ml / min. Das Blut, um den Schlauch zu füllen.
- Mit der Shunt geöffnet, entfernen Sie die temporären Lungen Einlass-Auslass-Anschluss. Befestigen der Lungenarterie und der linken atrialen Kanüle in die Lunge Einlaß bzw. Auslaß. Stellen Sie sicher, dass sich keine Luftblasen in den Schläuchen.
- Verbinden der Trachealkanüle einer dritten Druckwandler (P23XL). Pumpen Sie die Lungen mit 30% Sauerstoff über die Trachealkanüle und Druck aufrecht zu erhalten, auf 5 cm H 2 O.
- Schließen Sie den Shunt mit einer Klammer an Lungendurchblutung beginnen. Aufrechterhaltung Lungenarterie und der linken atrialen Druck bei etwa 10 cm 3 und H 2 O sind.
4. Vorbereitung Lung für mikrovaskuläre Infusion
- Erhöhen des hinteren Endes des Verlängerungsschlauch für den Katheter über dem Niveau der Lunge und sicher.
- Bereiten Sie einen Infusionskatheter durch Einfügen von ca. 30 cm aus einer 40 cm langen Schlauch in eine PE10 ~ 30 cm lang PE90-Schlauch. Verbinden des freigelegten Endes des PE10-Schlauch mit einer Nadel (30 G)befestigt an einer Spritze (1 ml).
- Legen Sie die Katheter-Kombination in der angehobenen hinteren Ende des Verlängerungsschlauch. Führen Sie den Katheter Kombination durch den linken Vorhof und in die Lunge, bis sie auf Widerstand stößt. Dann drücken Sie den PE10 Katheter allein weiter in die Lunge, bis sie auf Widerstand stößt. Beachten Sie, dass die Anwendung übermäßiger Kraft beim Einführen des Katheters wird die Lunge verletzen.
- Füllen Sie den 1-ml-Spritze mit Ringerlösung und heften sich an einer Spritzenpumpe. Stellen Infusionsrate auf 10 ml / min.
- Infusionsstelle werden im Vergleich zum Rest der Lunge blass.
- Befeuchten Sie die Lunge mit Kochsalzlösung und decken die Lunge mit Plastikfolie mit einem Loch, das groß genug ist, um die Infusionsstelle aufgedeckt verlassen.
- Tupfen Sie etwas Schliffett auf der Unterseite eines O-Ring (nach Maß) und setzen Sie ein Deckglas (# 1.5, 22 mm Durchmesser) auf dem Boden der O-Ring. Positionieren Sie vorsichtig den O-Ring mit dem Deckglas auf der Infusionsstelle. Sichern Sie den O-Ring mit einem Standard-Test-Rohr-holder. Das Deckglas / O-Ring-Kombination nicht die Wabenstrukturen verzerren darunter, wie kürzlich berichtet, 15.
- Positionieren Sie ein Ziel (20X) von einem Fluoreszenz-Mikroskop über dem O-Ring und konzentrieren sich auf die Lungenoberfläche.
5. Fluorescent Imaging Dextran Transit durch Mikrogefäße
- Bereiten Sie das Mikroskop für die Bildgebung FITC Fluoreszenz.
- Wählen Sie eine Region, die abgebildet werden und die Bilder zu erwerben zum Preis von 1/Minute mit Bildaufnahme-Software.
- Beginn der Infusion von FITC-Dextran 20 kD (0,5 mg / ml) unter Verwendung der Spritzenpumpe. Fluoreszenz in den Blutgefäßen erhöht sich allmählich, und ein Maximum erreichen. Weiter Infusion für 60 min.
- Dann Ringer-Infusion wechseln zu waschen luminalen Fluoreszenz. Pflegen Infusion über 10 min. Weiter Bildaufnahme in 1/min beim Abwaschen.
6. Bildanalyse
- Öffnen Sie die Bildaufnahme-Datei.
- Platz Regionenvon Interesse über Mikrogefäßen innerhalb des Bildrahmens.
- Spielen Sie die Bilddatei, Frame-by-Frame und notieren Sie die Fluoreszenzintensität bei jeder Region von Interesse für alle Rahmen.
- Zeichnen Sie die Änderung in der Fluoreszenzintensität für jeden interessierenden Bereich als Funktion der Zeit.
- Quantifizieren Sie die maximale Fluoreszenzintensität und der Restfluoreszenzintensität nach 10 min Auswaschen.
- Berechnung des Verhältnisses der maximalen Restfluoreszenzintensität in jedem Bereich von Interesse, die Durchlässigkeitsindex für Mikrogefäßen mit dieser Region von Interesse verbunden zu bekommen.
Ergebnisse
Isoliertes bluteten Lungen Zubereitung der Infusionsschlauch und zugehörige Ausrüstung verbunden ist, in Fig. 2 gezeigt. Zu Demonstrationszwecken verwendeten wir eine Sprague-Dawley-Ratten, obwohl die hierin beschriebenen Verfahren können mit beliebigen Spezies Ratte verwendet werden. Infusionen über einen linksatrialen Mikro erreichen nur einen kleinen Bereich der Lunge. Das aufgegossene Region kann durch die Infusion induzierte Verfärbung (Fig. 3) identifiziert werden. Die Lunge ...
Diskussion
Die isolierten durchbluteten Lungenpräparat in Verbindung mit Echtzeit-Bildgebung liefert ein einfaches Tool zur Bestimmung der Durchlässigkeit Veränderungen in einzelnen Mikrogefäßen der Lunge. Diese Methode wurde die Durchlässigkeit sich in Reaktion auf Infusionen von LPS zu definieren. Unsere Daten legen nahe, dass deutlich LPS-Infusion verursacht einen Anstieg der mikrovaskulären Durchlässigkeit. Ferner können die Daten auch, dass Veränderungen der Durchlässigkeit durch LPS induzierten waren in beiden Ven...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Studien wurden durch die NIH HL75503 KP unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
Referenzen
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten