A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جيل وتنقية الإنسان INO80 ونين إعادة عرض مجمعات وSubcomplexes
In This Article
Summary
يصف هذا البروتوكول إجراء لتوليد وتنقية النوع البري والإصدارات متحولة من مجمع INO80 إعادة عرض الكروماتين البشري. حاتمة الموسومة يتم التعبير عن إصدارات مفارز INO80 مستقر في خلايا HEK293، ويتم تنقية المجمعات والمجمعات كاملة تفتقر إلى مجموعات محددة من قبل مفارز immunoaffinity اللوني.
Abstract
INO80 المجمعات الكروماتين إعادة تنظيم ديناميات النيوكليوسومات والحمض النووي الوصول عن طريق حفز ATP التي تعتمد على إعادة جسيم نووي. تتكون المجمعات INO80 الإنسان من 14 مفارز البروتين بما في ذلك Ino80، وهو SNF2 مثل أتباز، الذي يخدم على حد سواء كما الوحيدات الحفازة وسقالة لتجميع المجمعات. مهام مفارز الأخرى والآليات التي تساهم في إعادة النشاط لونين مجمع INO80 وتبقى غير مفهومة، ويرجع ذلك جزئيا إلى التحدي المتمثل في توليد التجميع الثانوي INO80 في الخلايا البشرية أو أنظمة تعبير مغايرة. يصف هذا البروتوكول إن الرب إجراء من شأنه أن يسمح تنقية INO80 الكروماتين subcomplexes إعادة البشري التي تفتقر حدة فرعية أو مجموعة فرعية من الوحدات الفرعية. الموسومة N-عضال حاتمة FLAG يتم تقديمها Ino80 [كدنا مستقر في الكلى الجنينية البشرية (HEK) 293 خطوط الخلايا باستخدام FLP بوساطة إعادة التركيب. في حالة عدم وجود فرعية من مفارز مجمع INO80 هي بالبريد حذفها، واحد عن البروتينات Ino80 بدلا متحولة التي تفتقر إلى منصة اللازمة لتجميع تلك الوحدات الصغرى. في حالة وحدة فرعية الفردية هي أن تنفد، واحدة transfects الرناوات siRNAs تستهدف هذه الوحدة الفرعية إلى خط الخلية HEK 293 التعبير عن ثابت FLAG الموسومة Ino80 أتباز. يتم إعداد مقتطفات النووية، ويتم تنفيذ FLAG مناعي لإثراء الكسور البروتين تحتوي على مشتقات Ino80. ويمكن بعد ذلك يتم تحليل التراكيب من subcomplexes INO80 تنقيته باستخدام أساليب مثل immunoblotting والفضة تلطيخ، ومطياف الكتلة. وINO80 وINO80 subcomplexes المولدة وفقا لهذا البروتوكول يمكن تحليلها باستخدام مختلف المقايسات الحيوية، والتي تم وصفها في البروتوكول إن الرب المصاحب. الأساليب المذكورة هنا يمكن تكييفها للدراسات من الخصائص الهيكلية والوظيفية في أي الثدييات فرعية متعددة الكروماتين إعادة عرض والمجمعات تعديل.
Introduction
الحفظ تطويريا المجمعات إعادة عرض الكروماتين الأسرة SNF2 هي المنظمين الرئيسيين للتنظيم الكروماتين وDNA الوصول 1. إعادة عرض هذه المجمعات تشمل دائما مثل SNF2 أتباز فرعية المركزية، التي،، يجمع في بعض الحالات مع مختلف البروتينات الإكسسوارات وتشكل فرعية متعددة، الجمعيات الكلي الجزيئية. لدراسة التفاصيل الجزيئية لعملية إعادة عرض الكروماتين تعتمد على ATP، فمن المهم أن نفهم مساهمات مجموعات فرعية معينة من الوحدات الفرعية و / أو هياكل المجال لأنشطة المجمعات. مثل هذه التحليلات تتطلب القدرة على توليد المجمعات متحولة العالية النقاء التي تفتقر إلى البروتين مفارز معينة أو هياكل المجال.
وقد ركزت الدراسات السابقة هيكل وظيفة من ATP التي تعتمد على المجمعات الكروماتين إعادة عرض على نطاق واسع في النظام النموذجي الخميرة بسبب manipulability متفوقة من الجينوم الخميرة (انظر، على سبيل المثال، الحكام 1-4). نظرا لصونتكوين فرعية والوظائف بين المجمعات إعادة orthologous، قدمت دراسات لهيكل وظيفة من المجمعات إعادة الخميرة نظرة ثاقبة على نظرائهم في حقيقيات النوى أعلى. ومع ذلك، لا توجد أنواع محددة ملموسة الخلافات بين المجمعات إعادة عرض، الناتجة عن المكسب أو الخسارة من أنواع محددة مفارز، ربح أو خسارة من المجالات أنواع محددة من مفارز المحفوظة، وتقلب تسلسل ضمن مجالات الحفظ مفارز المحفوظة. من حيث المبدأ يمكن أن يكون الدافع وراء هذه الاختلافات بسبب الحاجة للخلايا حقيقية النواة أعلى على التكيف مع بيئات الجزيئية والخلوية الجديدة. وبالتالي، فإن فهم كيفية مساهمة مفارز من أعلى المجمعات إعادة حقيقية النواة لعملية إعادة النيوكليوسومات هو قيمة، لأنه يسلط الضوء ليس فقط على الآليات الأساسية لعملية إعادة عرض الكروماتين ATP-تعتمد، ولكن أيضا يمكن أن توفر معلومات قيمة حول الآليات التي بنية الكروماتين والتعبير الجيني في اثوينظم حقيقيات النوى لها.
حتى الآن، كانت هناك فقط تقتصر الدراسات البنيوية والوظيفية متعددة فرعية-الثدييات المجمعات إعادة عرض الكروماتين، ويرجع ذلك جزئيا إلى الصعوبات في الحصول على تعريفها كيميائيا الكروماتين المجمعات إعادة عرض وsubcomplexes. لقد التحايل جزئيا على هذه الصعوبات مع الإجراءات الموضحة أدناه، والذي يستخدم في تنقية immunoaffinity لإعداد سليمة INO80 أو INO80 subcomplexes من خلايا الإنسان التعبير عن ثابت N-عضال FLAG حاتمة الموسومة النوع البري أو الإصدارات متحولة من Ino80 5-7 (الشكل 1) . للحصول على المجمعات INO80 سليمة من الخلايا البشرية، ويستخدم FLP بوساطة إعادة التركيب لتوليد خطوط الخلايا المعدلة وراثيا HEK293 التعبير عن ثابت حاتمة FLAG cDNAs الموسومة ترميز مفارز مجمع INO80 8-10. لأن الإفراط في التعبير عن مفارز INO80 يمكن أن تكون سامة إلى حد ما، فمن الضروري عزل والحفاظ على خطوط الخلايا نسيلي تحت شارك انتقائيةnditions لضمان استقرار التعبير التحوير خلال العديد من الممرات اللازمة للتوسع في مزارع الخلايا على نطاق واسع. للحصول على subcomplexes INO80 أصغر التي تحتوي على مجموعة فرعية فقط من الوحدات الفرعية، وقد استخدمنا بنجاح النهجين (الشكل 2A، B). في البداية، وتوليد HEK293 FLP-في خطوط الخلايا معربا عن ستابلي الإصدارات متحولة من Ino80 التي تفتقر المجالات المطلوبة للتفاعل مع وحدات فرعية محددة 5. بدلا من ذلك، يستخدم ضربة قاضية سيرنا بوساطة في استنزاف الوحيدات المطلوب من خلايا إبداء الموسومة FLAG INO80 فرعية المناسبة (بيانات غير منشورة). أخيرا، لتنقية المجمعات INO80 الإنسان، يتم استخدام FLAG اللوني القائم الاغاروز 11 إلى إثراء جزء التي تحتوي على مقتطفات من INO80 النووية، وبالتالي الحد من فعالية وجود تلوث البروتينات عصاري خلوي في جزء نهائي يتضمن النقي INO80 أو INO80 subcomplexes.
Protocol
1. الجيل وثقافة HEK293 خطوط الخلايا مستقرة التعبير عن كامل المدة أو الإصدارات متحولة من حاتمة FLAG الموسومة Ino80 أو غيرها من الوحدات الصغرى مجمع INO80
- استنساخ [كدنا ترميز كامل طول أو متحولة البشري Ino80 أتباز أو فرعية أخرى INO80 في الثدييات ناقلات التعبير pcDNA5 / FRT مع، N محطة FLAG علامة حاتمة في الإطار.
- تأكيد تسلسل cDNAs المدرج بواسطة تسلسل الحمض النووي قبل المتابعة.
- لأداء ترنسفكأيشن، وتنمو FLP-في الخلايا HEK293 في 10 سم أطباق زراعة الأنسجة في المتوسط تحتوي على DMEM (Dulbecco لتعديل النسر متوسطة)، و 5٪ الجلوتامين، و 10٪ FBS (مصل بقري جنيني).
- عندما تصل خلايا ~ 70٪ confluency، إضافة إلى كل طبق زراعة الأنسجة خليط من 40 ميكرولتر من FuGENE6 ترنسفكأيشن الكاشف، 0.5 ميكروغرام من المناسب pcDNA5 / FRT التعبير البلازميد، و 9.5 ميكروغرام من pOG44، الذي يشفر recombinase FLP، في الحجم الإجمالي 800 ميكرولتر.
- بعد 48 ساعة، ويعرض للتريبسين قplit الخلايا في نسبة 1:30 إلى 10 سم الأطباق، وتنمو لهم في DMEM مع 5٪ الجلوتامين، FBS 10٪، و 100 ميكروغرام / مل هيغروميسين B عن 3-4 أسابيع. تغيير مستنبت كلما يبدأ بالتحول الى اللون الأصفر (عادة كل 3-5 أيام).
- لتحديد استنساخ الإيجابية التي تعبر عن أعلى مستوى من البروتين الموسومة FLAG، حدد هيغروميسين الفردي مقاومة للB المستعمرات ونقلها إلى بئر واحد من 24 لوحة جيدا.
- بمجرد أن تصل إلى خلايا 80٪ confluency، وخلايا الحصاد من كل بئر في ~ 1 مل PBS وبيليه بواسطة الطرد المركزي في 1000 x ج لمدة 5 دقائق.
- بعد إزالة طاف، resuspend الكرية خلية في 60 ميكرولتر من SDS-PAGE عينة العازلة.
- نصف يخضع لبيليه الخلية معلق إلى الصفحة SDS والنشاف الغربي لمراقبة تعبير عن FLAG الموسومة البروتين الطعم. حفظ النصف الآخر ليحلل المستقبل.
- إذا لم يتم اكتشاف البروتين البشري Ino80 الموسومة FLAG في الخلية لست]، قم بتوسيع خلية الشعبية التي النسيلي الأوليlation مزيد من الطلاء الخلايا من الآبار واحدة من 24 لوحة جيدا في 15 سم أطباق زراعة الأنسجة.
- حصاد الخلايا من أطباق 15 سم، في resuspend بالقرب من الخلايا متموجة في الجليد الباردة PBS ونقل إلى أنبوب مخروطي 50 مل.
- جلب إلى الحجم النهائي من 50 مل بإضافة PBS إضافية.
- خلايا بيليه في 1،000 x ج لمدة 5 دقائق، وإزالة أكبر قدر ممكن من طاف.
- resuspend الكرية خلية في 1 مل من العازلة Lys450 (20 ملي HEPES، ودرجة الحموضة 7.9 هيدروكسيد الصوديوم، كلوريد الصوديوم 450 ملم، 0.5٪ TritonX-100، 10 ملي بوكل، 4 ملم MgCl 2، 0.2 ملي EDTA، 10٪ الجلسرين، 1 ملم DTT، 200 ميكرومتر PMSF، و1: 1،000 البروتياز كوكتيل المانع).
ملاحظة: هنا وفي أماكن أخرى، إضافة دائما DTT، PMSF، ومثبط البروتياز كوكتيل لمخازن فورا قبل البدء في التجربة. - البروتينات الناتجة من المحللة خلية كاملة الموسومة FLAG-المناعية راسب باستخدام 20 ميكرولتر من مكافحة FLAG الاغاروز هلام، وتحليل eluates FLAG بواسطة النشاف الغربي. [لمزيد من التفاصيل من إمانالإجراء oprecipitation، انظر الخطوة 5.]
- إعداد الأسهم المجمدة من خطوط الخلايا نسيلي المطلوب 12 وتخزينها في النيتروجين السائل حتى الاستخدام.
2. تزايد خطوط الخلايا HEK293 في زجاجات الأسطوانة
لإعداد نطاق واسع من المجمعات INO80، وخلايا الثقافة في 10-20 زجاجات الأسطوانة. العائد نموذجي من كل زجاجة الأسطوانة هو ~ 1 مل من الخلايا معبأة.
- إلى كل زجاجة الدوارة، وإضافة 200 مل DMEM، 5٪ الجلوتامين، و 10٪ مصل العجل، دون هيغروميسين B.
- نقل كافة الخلايا من شبه متموجة 15 سم صحن واحد في كل زجاجة الأسطوانة
- زجاجات مكان الأسطوانة إلى 37 ° C بكرة زجاجة الحاضنة وتدور عند 0.2 دورة في الدقيقة.
- خلايا مرة واحدة تصل إلى 70٪ ~ confluency، صب قبالة وتجاهل المتوسطة.
- إضافة ~ PBS 50 مل من الجليد البارد لكل زجاجة. عقد زجاجات أفقيا، دوامة بلطف لتخفيف أحادي الطبقة الخلية.
- نقل الخلايا إلى معلق 250 مل بلاستجيم زجاجات المخروطية ومكان على الجليد.
- شطف زجاجات الأسطوانة مع برنامج تلفزيوني إضافي، نقلها بالتتابع من زجاجة الزجاجة. عندما حل شطف لم يعد واضحا (عادة بعد استخدامها لشطف حوالي 5 زجاجات)، إضافة إلى تعليق الخلية.
- خلايا بيليه بواسطة الطرد المركزي في 400 x ج لمدة 10 دقيقة.
- بلطف resuspend الخلايا في برنامج تلفزيوني، والجمع بينهما في واحدة 250 مل زجاجة المخروطية، والحفاظ على الجليد حتى مزيد من المعالجة.
3. بوساطة سيرنا ضربة قاضية من INO80 الوحدات الصغرى في الخلايا معربا عن آخر الموسومة FLAG INO80 الوحدة الفرعية
للحصول على subcomplexes INO80 تفتقر حدة فرعية واحدة، واستخدام FLAG-immunopurification لتنقية المجمعات INO80 من خلايا سيرنا معاملة أو الخلايا معربا عن shRNA مستقر. هو الأمثل "عكس" سيرنا وصف (صغير بالتدخل RNA) بروتوكول ترنسفكأيشن هنا لHEK293 خلايا تنمو في 15 سم أطباق. البروتوكول هو واحد 15 سم طبق من الخلايا وشوULD زيادتها وفقا لذلك اعتمادا على عدد من الخلايا اللازمة. لإعداد كميات مفيدة كيميائيا من مجمع INO80 من الخلايا المعالجة سيرنا، ينبغي للمرء زيادة على الثقافات التي تزرع في 40 15 سم أطباق. هذه سوف تسفر عن حوالي 2-4 مل من بيليه الخلية معبأة.
- زراعة خلايا HEK293 التعبير عن ثابت الوحيدات المطلوب من المجمع القريب INO80 إلى confluency في 15 سم أطباق.
- إضافة حجم من سيرنا العازلة إعادة تعليق (20 ملي بوكل، 6 ملي HEPES، ودرجة الحموضة 7.5، و 0.2 ملم MgCl 2) كافية لإعداد محلول المخزون 50 ميكرومتر من سيرنا إلى أنبوب يحتوي على مجفف بالتجميد سيرنا. ماصة الحل صعودا وهبوطا عدة مرات واحتضان على nutator لمدة 30 دقيقة في RT لضمان حل سيرنا بالكامل.
- إعداد كوكتيل ترنسفكأيشن تحتوي على الرناوات siRNAs وكاشف ترنسفكأيشن. خلط 10 ميكرولتر من محلول المخزون 50 ميكرومتر سيرنا مع 32 ميكرولتر Lipofectamine RNAiMAX وإضافته إلى 4 مل من غروب-MEM انخفاض مصل المتوسطة مع خلط لطيف جدا. آلانخفاض جميع الكواشف لكي تتوازن لRT قبل الاستخدام.
- احتضان الخليط في RT لمدة 30 دقيقة.
- إعداد خلايا FLP-HEK293 في التعبير عن ثابت الوحيدات INO80 المطلوب لترنسفكأيشن.
- خلال حضانة الخطوة 3.4، وغسل الخلايا في أطباق 15 سم مرة واحدة مع PBS RT.
- بعد إزالة PBS، علاج الخلايا مع 1 مل التربسين فقط حتى تبدأ لرفع قبالة لوحة.
- إضافة على الفور 10 مل من المتوسط كاملة (DMEM الجلوتامين + 5٪ + 10٪ FBS) إلى trypsinized الخلايا والمزيج بلطف. جمع الخلايا بواسطة الطرد المركزي في 1000 x ج لمدة 5 دقائق على RT.
- resuspend الكرية خلية في ~ 4 مل المتوسطة كاملة، والاعتماد على إعادة تعليق خلية باستخدام haemocytometer.
- تمييع الخلايا مع المتوسطة كاملة إلى تركيز ~ 5.4 × 10 6 / مل.
- إلى كل طبق 15 سم، إضافة 15 مل الكامل مستنبت تليها 4 مل ترنسفكأيشن كوكتيل. دوامة بلطف لضمان المتوسطة وترنسفكأيشن كوكتيل هي thoroughly مختلطة. أخيرا، إضافة واحد مل من تعليق خلية ومرة أخرى دوامة بلطف لتفريق الخلايا بشكل موحد.
- بعد 60 ساعة من الثقافة في 37 درجة مئوية و 5٪ CO 2 حاضنة، وإزالة بلطف المتوسطة، وخلايا resuspend في الجليد الباردة PBS، والشروع فورا في إعداد مقتطفات النووية.
4. إعداد مقتطفات النووية
تم تعديل هذا الإجراء من بروتوكول Dignam 13 ويمكن زيادتها إلى أعلى أو أسفل اعتمادا على حجم بدءا الكريات الخلية. عادة، 1 مل من عوائد معبأة بيليه خلية 1 مل من مستخلص النووي النهائي. يجب أن تكون جميع مخازن الجليد الباردة، ويجب أن يتم تنفيذ جميع الخطوات في غرفة باردة أو على الجليد إذا غرفة باردة مناسب ليست متاحة.
- عزل النوى:
- بلطف نقل الخلايا إلى الحجم مناسب (15 أو 50 مل) تخرج أنبوب مخروطي الشكل وتدور في 1،000 x ج لمدة 10 دقيقة في 4 درجات مئوية.
- إزالة طاف، وقياس حجم خلية معبأة اااالسماح. 1 مل من الخلايا معبأة يناظر ~ 3 × 10 8 HEK293 الخلايا.
- إضافة 5 مجلدات معبأة خلية من الاحتياطي A (10 ملي HEPES، ودرجة الحموضة 7.9، 1.5 ملم MgCl 2 و 10 ملي بوكل، وأضاف حديثا 1 ملم DTT، 200 ميكرومتر PMSF، و1: 1،000 البروتياز كوكتيل المانع). resuspend الكرية خلية من قبل pipetting لطيف.
- احتضان على الجليد لمدة 10 دقيقة بالضبط.
- بيليه الخلايا في 1،000 x ج لمدة 10 دقيقة في 4 درجات مئوية، وإزالة طاف.
- حجم الخلية بيليه أن تزيد لتصل إلى 2 أضعاف خلال الحضانة في مخزن A.
- resuspend الخلايا في مجلدين خلية معبأة من العازلة A، ونقل تعليق خلية إلى بحجم مناسب Dounce الأنسجة الخالط. إذا بدءا من أقل من 2 مل من الخلايا معبأة، واستخدام الخالط 7 مل. ل2-4 مل خلايا معبأة، واستخدام الخالط 15 مل. و10 أو أكثر مل من الخلايا معبأة، واستخدام الخالط 40 مل.
- التجانس تعليق الخلية مع مدقة الزجاج فضفاض من الخالط الامم المتحدة Dounceسمسم 90٪ من الخلايا وصمة عار بإيجابية مع 1٪ التريبان الأزرق.
- نقل تعليق إلى 45 مل عالية السرعة الطرد المركزي أنبوب وتدور في 25،000 x ج لمدة 20 دقيقة على 4 درجات مئوية في JA-17 أو ما شابه ذلك الدوار (انظر جدول المواد / المعدات).
- من بيليه النووي، وإزالة طاف، والذي يحتوي على البروتينات عصاري خلوي أو البروتينات التي تتسرب من خلال تجزئة النواة.
- استخراج النوى مع الملح:
- إضافة العازلة C (20MM HEPES، ودرجة الحموضة 7.9، 25٪ الجلسرين، 1.5 ملم MgCl 2، 0.2 ملي EDTA، وأضاف حديثا 1 ملم DTT، 200 ميكرومتر PMSF، و1: 1،000 البروتياز كوكتيل المانع) إلى بيليه النووي؛ استخدام 2.5 مل العازلة C لكل 3 مل من حجم الخلية بدءا معبأة (~ 1 × 10 9 خلايا).
- باستخدام قضيب الزجاج أو ماصة، طرد بيليه النووي من جدار الأنبوب ونقل الخليط بأكمله إلى الخالط Dounce من الحجم المناسب.
- Resuspend ونوى من قبل المجانسة عشرخليط الإلكترونية مع اثنين من السكتات الدماغية من مدقة فضفاضة.
- نقل جزء النووي معلق في كوب المبردة. اختيار دورق مثل أن تعليق سوف تملأ الكأس إلى 0.5 سم على الأقل عميقة.
- لاستخراج البروتينات النووية من لونين أو هياكل غير قابلة للذوبان أخرى، زيادة تدريجية في تركيز الملح من تعليق إلى 0.42 M كلوريد الصوديوم عن طريق إضافة قطرة قطرة من 5 M كلوريد الصوديوم مع التحريك بلطف تعليق مع ماصة أو الزجاج قضيب على الجليد. مرة واحدة كل 5 M كلوريد الصوديوم تمت إضافة، ينبغي أن تصبح الحل لزج جدا أو هلامية. حساب حجم 5 M كلوريد الصوديوم اللازمة لتحقيق الحل لتركيز النهائي من كلوريد الصوديوم 0.42 M وفقا للمعادلة التالية:
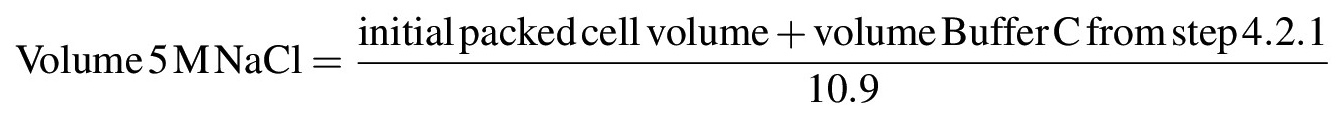
- نقل بعناية تعليق لزج إلى 10 مل أنابيب البولي ل70.1 نوع تي الدوار (أو ما يعادلها) أو 70 مل زجاجات البولي لنوع تي 45 سص الدوار مماثلة (انظر جدول المواد / المعدات). ختم بإحكام مع parafilm إذا باستخدام 10 مل أنابيب أو مع التجمع غطاء حالة استخدام 70 مل الزجاجات.
- صخرة ببطء أنابيب مختومة في 4 درجة مئوية لمدة 30 دقيقة باستخدام nutator.
- تدور العينات في نوع تي 45 أو 70.1 تي الدوار لمدة 30 دقيقة في 120،000 XG في 4 درجات مئوية.
- نقل طاف لأنبوب من البلاستيك أو زجاجة واحدة. هذا طاف هو استخراج النووي، ويحتوي على لونين بيليه والحطام نووي آخر.
- تقسيم استخراج النووي مأخوذة في الحجم ملائم، تجميده في النيتروجين السائل وتخزينه في -80 درجة مئوية.
5. Immunoaffinity تنقية للINO80 الإنسان أو INO80 Subcomplexes
- لذوبان الجليد استخراج النووي المجمدة، وأنابيب مكان يحتوي على مستخلص على الفوق أو لفة أنابيب بين يديه حتى تصبح المواد المجمدة الطين. ثم وضع أنابيب على الجليد أو في غرفة باردة حتى استخراج تماما رhawed.
- نقل استخراج النووي إذابة إلى 10 مل أنابيب البولي نابذة فائقة السرعة، وتدور في 100،000 x ج لمدة 20 دقيقة على 4 درجات مئوية في 70.1 نوع تي الدوار أو ما يعادلها لإزالة أي راسب التي قد تكون تشكلت خلال دورة تجميد ذوبان الجليد.
- نقل طاف لأنبوب مخروطي 15 مل. إضافة جديدة كوكتيل DTT، PMSF، والبروتياز المانع لتركيزات النهائية من 1 ملم DTT، 200 ميكرومتر PMSF، و1: 1،000 البروتياز كوكتيل المانع.
- لإعداد مكافحة FLAG الاغاروز لimmunopurification، ونقل 200 ميكرولتر من 50٪ من الطين الخرز الاغاروز مكافحة FLAG إلى 1.5 مل أنبوب microcentrifuge باستخدام P200 أو ماصة مماثلة مع طرف من التي تم خفض نهاية قبالة مع مشرط نظيف أو شفرة الحلاقة.
- بيليه الخرز بواسطة الطرد المركزي في microcentrifuge الفوق في 8،000 x ج لمدة 30 ثانية. إزالة طاف، وتغسل حبات الخرز عن طريق إعادة التعليق في 1 مل من العازلة Lys450، وحبات بيليه في 8000 x ج لمدة 30 ثانية. غسل بEADS مرتين أخريين.
- resuspend والخرز الاغاروز مكافحة FLAG غسلها في حوالي 100 ميكرولتر من استخراج النووي باستخدام P200 أو ما شابه حجم قابل للتعديل ماصة مع طرف من التي تم خفض نهاية قبالة مع مشرط أو شفرة حلاقة نظيفة وباستخدام نفس معلومات سرية، ونقل حبات معلق إلى 15 مل أنبوب مخروطي يحتوي على مستخلص. كرر عدة مرات حتى يتم نقل كل من الخرز إلى أنبوب 15 مل.
- احتضان الخليط استخراج / حبة لمدة 4 ساعة عند 4 درجات مئوية مع دوران بطيء على محور دوار المختبر. اختياري: وتشمل benzonase بتركيز 25 وحدة / مل لإزالة تلويث الحمض النووي.
- جمع الاغاروز FLAG بواسطة الطرد المركزي في 1000 x ج لمدة 5 دقائق في 4 درجات مئوية.
- resuspend في 10 مل Lys450 لغسل، احتضان 5 دقائق في 4 درجات مئوية مع هزاز لطيف على nutator. بيليه الخرز في 1،000 x ج لمدة 5 دقائق في 4 درجات مئوية.
- resuspend في 100-150 ميكرولتر من الخرز Lys450 ونقل إلى أنبوب microcentrifuge 1.5 مل. شاركntinue لشطف أنبوب مخروطي 15 مل مع 100-150 ميكرولتر من Lys450 حتى يتم نقل جميع الخرز لأنبوب microcentrifuge.
- تدور باستمرار حبات في 8،000 x ج لمدة 30 ثانية في 4 درجات مئوية في microcentrifuge. يغسل ثلاث مرات أكثر مع 1 مل Lys450 ومرة واحدة مع العازلة 1ML EB100 (10 ملي HEPES الرقم الهيدروجيني 7.9، 10٪ الجلسرين، 100 مم كلوريد الصوديوم، 1.5 ملم MgCl 2، 0.05٪ TritonX-100، وأضيفت حديثا 1 ملم DTT، 200 ميكرومتر PMSF و1: 1،000 البروتياز كوكتيل المانع).
- إلى أزل البروتينات المربوطة، إضافة 200 ميكرولتر EB100 العازلة التي تحتوي على 0.25 ملغ / مل 1X FLAG الببتيد. احتضان 30 دقيقة في 4 درجات مئوية كل على nutator.
- بيليه الخرز في 8000 x ج لمدة 30 ثانية في 4 درجات مئوية في microcentrifuge. نقل طاف، والذي يحتوي على مجمع INO80 مزال، إلى أنبوب microcentrifuge الطازجة.
- تكرار شطف أربع مرات أكثر، وتجميع كل supernatants في أنبوب واحد.
- لإزالة أي بقايا حبات FLAG-الاغاروز من البروتين جزء مزال،تمرير شطافة من خلال عمود الدوران فارغة.
- تركيز البروتين جزء مزال ~ 10 أضعاف باستخدام جهاز الطرد المركزي فلتر جدا (50،000 الجزيئي قطع الوزن).
- لإزالة ببتيد FLAG، تمرير المركزة البروتين جزء بالتتابع من خلال الأعمدة تحلية اثنين.
- تقسيم النقى البروتين المحلاة جزء في 20 مكل، مجمدة في النيتروجين السائل، وتخزينها في -80 درجة مئوية.
- تحليل تكوين فرعية من INO80 أو subcomplexes INO80 على المواد الهلامية ملطخة الفضة أو النشاف الغربي، وتقدير تركيزاتها بواسطة النشاف شبه الكمي الغربي باستخدام استعدادات مفارز INO80 المؤتلف التركيز المعروفة باسم المعايير.
النتائج
ويبين الشكل 1 مخطط تدفق يلخص الإجراءات المستخدمة لتوليد وتنقية، وتميز INO80 ATP التي تعتمد على المجمعات إعادة عرض لونين الإنسان.
كما هو موضح في الشكلين 2 و 3، وتمكن هذه الإجراءات توليد كلا نوع INO80 وINO80 subcomplexes...
Discussion
وقد أعاق الدراسات البنيوية والوظيفية متعددة فرعية المجمعات الثدييات الكروماتين إعادة عرض من حقيقيات النوى أعلى من صعوبة إعداد كيميائيا كميات مفيدة من هذه المجمعات التي تحتوي على وحدات فرعية متحولة أو تفتقر إلى بعض مفارز تماما. هناك عدد من العقبات الفنية: أولا، كان ?...
Disclosures
تعلن الكتاب أنه ليس لديهم المصالح المالية المتنافسة.
Acknowledgements
ويدعم العمل في المختبر المؤلفين من خلال منحة من المعهد الوطني للعلوم الطبية العامة (GM41628) ومنحة لمعهد نيفيز للبحوث الطبية من صندوق البحوث الطبية نيلسون هيلين في مؤسسة المجتمع كانساس سيتي الكبرى.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium | Cellgro | 10-013-CV | |
| Glutamax-I (stablized glutamine) | Life Technologies | 35050-079 | |
| Fetal Bovine Serum | SAFC | 12176C | |
| FuGENE6 transfection reagent | Promega | E2312 | |
| Hygromycin B, sterile in PBS | AG Scientific | H-1012-PBS | |
| pcDNA5/FRT vector | Life Technologies | V6010-20 | |
| Flp-In HEK293 cells | Life Technologies | R780-07 | |
| pOG44 Flp-Recombinase Expression Vector | Life Technologies | V600520 | |
| EZview Red ANTI-FLAG M2 Affinity Gel | Sigma | F2426 | |
| calf serum | SAFC | 12138C | |
| TARGETplus SMARTsiRNA pool | Dharmacon / Thermo Scientific | various | |
| 5x siRNA resuspension buffer | Dharmacon / Thermo Scientific | #B-002000-UB-100 | |
| Lipofectamine RNAiMAX | Life Technologies | 13778 | |
| Opti-MEM Reduced Serum Medium | Life Technologies | 51985-091 | |
| PBS | Cellgro | 45000 | VWR |
| TrypLE (trypsin) | Life Technologies | 12604 | |
| 1x FLAG Peptide | Sigma | F3290 | |
| Micro Bio-Spin Chromatography Column | Bio-Rad | 737-5021 | |
| Amicon Ultra Centrifugal Filter Device (50k MWCO) | Amicon | UFC805024 | Fisher Scientific |
| Zeba Desalting Columns | Thermo Scientific | 89882 | |
| Anti-FLAG M2 antibody, mouse | Sigma | F3165 | |
| Anti-FLAG M2 antibody, rabbit | Sigma | F7425 | |
| Protease Inhibitor Cocktail | Sigma | P8340 | |
| benzonase | Novagen | 70664 | |
| Equipment | |||
| JS-4.2 rotor in a J6 centrifuge | Beckman-Coulter | 339080 | |
| JA-17 rotor | Beckman-Coulter | 369691 | |
| 10 ml polycarbonate tubes | Beckman-Coulter | 355630 | |
| 70 ml polycarbonate bottles | Beckman-Coulter | 355655 | |
| Type 45 Ti rotor | Beckman-Coulter | 339160 | |
| Type 70.1 Ti rotor | Beckman-Coulter | 342184 | |
| BD Clay Adams Nutator Mixer | BD Diagnostics | 15172-203 | VWR |
| Glas-Col Tube/Vial Rotator | Glas-Col | 099A RD4512 | |
| PCR thermal cycler PTC 200 | MJ Research | PTC 200 | |
| roller bottle incubator | Bellco biotechnology | 353348 | |
| Immobilon-FL Transfer Membrane 7 x 8.4 | Millipore | IPFL07810 | |
| lubricated 1.5 ml microcentrifuge tubes | Costar | 3207 | |
References
- Clapier, C. R., Cairns, B. R. The biology of chromatin remodeling complexes, Annual Review of Biochemistry. 78, 273-304 (2009).
- Szerlong, H., Hinada, K., Viswanathan, R., Erdjument-Bromage, H., Tempst, P., Cairns, B. R. The HSA domain binds nuclear actin-related proteins to regulate chromatin-remodeling ATPases. Nature Struct. Mol. Biol. 15 (5), 469-476 (2008).
- Shen, X., Mizuguchi, G., Hamiche, A., Wu, C. A chromatin remodelling complex involved in transcription and DNA processing. Nature. 406 (6795), 541-544 (2000).
- Shen, X., Ranallo, R., Choi, E., Wu, C. Involvement of actin-related proteins in ATP-dependent chromatin remodelling. Mol. Cell. 12, 147-155 (2003).
- Chen, L., et al. Subunit organization of the human INO80 chromatin remodeling complex: an evolutionarily conserved core complex catalyzes ATP-dependent nucleosome remodeling. Journal of Biological Chemistry. 286 (13), 11283-11289 (2011).
- Sauer, B. Site-specific recombination: developments and applications. 5 (5), 521-527 (1994).
- Gorman, S., Fox, D. T., Wahl, G. M. Recombinase-mediated gene activation and site-specific integration in mammalian cells. Science. 251 (4999), 1351-1355 (1991).
- Jin, J., et al. A mammalian chromatin remodeling complex with similarities to the yeast INO80 complex. Journal of Biological Chemistry. 280 (50), 41207-41212 (2005).
- Cai, Y., et al. YY1 functions with INO80 to activate transcription. Nature Structural and Molecular Biology. 14 (9), 872-874 (2007).
- Yao, T., et al. Distinct Modes of Regulation of the Uch37 Deubiquitinating Enzyme in the Proteasome and in the Ino80 Chromatin-Remodeling Complex. Mol.Cell. 31 (6), 909-917 (2008).
- Brizzard, B. L., Chubet, R. G., Vizard, D. L. Immunoaffinity purification of FLAG epitope-tagged bacterial alkaline phosphatase using a novel monoclonal antibody and peptide elution, Biotechniques. 16 (4), 730-735 (1994).
- Barker, K. . At the Bench: A Laboratory Navigator. 10, 207-245 (2005).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian cell nuclei. Nucleic. Acids. Res. 11 (5), 1475-1489 (1983).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved