Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación y purificación de Humanos INO80 remodelación de la cromatina complejos y Subcomplejos
En este artículo
Resumen
Este protocolo describe un procedimiento para la generación y purificación de tipo salvaje y versiones mutantes del complejo de remodelación de la cromatina INO80 humano. Etiquetadas con epítopo versiones de subunidades INO80 se expresaron de manera estable en células HEK293, y los complejos completos y complejos que carecen de conjuntos específicos de subunidades se purifican mediante cromatografía de inmunoafinidad.
Resumen
Complejos remodeladores de cromatina INO80 regulan la dinámica de nucleosomas y la accesibilidad de ADN al catalizar la remodelación de nucleosomas dependiente de ATP. Ino80 Humanos constan de 14 subunidades de proteínas incluyendo Ino80, un SNF2-como ATPasa, que sirve tanto como la subunidad catalítica y el andamio para el ensamblaje de los complejos. Funciones de las otras subunidades y los mecanismos por los que contribuyen a la actividad de remodelación de la cromatina del complejo INO80 siguen siendo poco conocidos, en parte debido al desafío de generar subconjuntos INO80 en células humanas o sistemas de expresión heteróloga. Este protocolo JOVE describe un procedimiento que permite la purificación de subcomplexes remodelación de la cromatina INO80 humanos que carecen de una subunidad o un subconjunto de subunidades. N-terminal BANDERA epítopo etiquetados cDNA Ino80 se introducen de manera estable en el riñón embrionario humano (HEK) 293 líneas celulares que utilizan la recombinación mediada por FLP. En el caso de que un subconjunto de subunidades del complejo INO80 es abe borrado, uno expresa las proteínas mutantes Ino80 vez que carecen de la plataforma necesaria para el montaje de esas subunidades. En el caso de una subunidad individual es a agotarse, uno transfecta siRNAs dirigidos a esta subunidad en una línea celular HEK 293 que expresan establemente FLAG etiquetados Ino80 ATPasa. Nuclear extractos se preparan, e inmunoprecipitación FLAG se realiza para enriquecer las fracciones de proteínas que contienen derivados Ino80. Las composiciones de subcomplexes INO80 purificados a continuación, se pueden analizar utilizando métodos tales como la inmunotransferencia, la tinción con plata, y espectrometría de masas. Los subcomplexes INO80 y INO80 generados de acuerdo con este protocolo se pueden analizar posteriormente utilizando diversos ensayos bioquímicos, que se describen en el protocolo JOVE acompaña. Los métodos descritos aquí se pueden adaptar para los estudios de las propiedades estructurales y funcionales de cualquier remodelación de la cromatina multi-subunidad de mamíferos y en complejos de modificadores.
Introducción
Complejos remodeladores de cromatina familiares SNF2 conservadas evolutivamente son reguladores clave de la organización de la cromatina y la accesibilidad de ADN 1. Estos complejos de remodelación siempre incluyen una subunidad ATPasa-SNF2 como central, que, en algunos casos, se reúne con diversas proteínas accesorias y forma de múltiples subunidades asambleas macromoleculares. Para estudiar los detalles moleculares del proceso de remodelación de la cromatina dependiente de ATP, es importante para entender las contribuciones de los subconjuntos dados de subunidades y / o estructuras de dominio a las actividades de los complejos. Tales análisis requieren la capacidad de generar complejos de mutantes altamente purificados que carecen de subunidades de proteínas particulares o estructuras de dominio.
Anteriores estudios de estructura-función de los complejos de remodelación de la cromatina dependientes de ATP han ampliamente centrado en el sistema modelo de levadura debido a la manipulabilidad superior del genoma de la levadura (véase, por ejemplo, refs 1-4). Dada la conservación de loscomposición de la subunidad y funcionalidad entre los complejos de remodelación de ortólogos, los estudios sobre la estructura y función de los complejos de remodelación de levadura han aportado importantes conocimientos sobre sus homólogos en eucariotas superiores. No obstante, existen especies específicas apreciables diferencias entre los complejos de remodelación, que resulta de la ganancia o pérdida de especies específicas de subunidades, la ganancia o pérdida de los dominios específicos de especies de subunidades conservados, y la secuencia de la variabilidad dentro de dominios conservados de subunidades conservados. Estas diferencias no pueden en principio ser impulsados por la necesidad de que las células eucarióticas superiores para adaptarse a nuevos entornos moleculares y celulares. Por lo tanto, la comprensión de cómo las subunidades de los complejos de remodelación de eucariotas superiores contribuyen al proceso de remodelación nucleosoma es valiosa, ya que no sólo arroja luz sobre los mecanismos básicos del proceso de remodelación de la cromatina dependiente de ATP, pero también puede proporcionar información valiosa sobre los mecanismos por los que la estructura de la cromatina y la expresión génica en higsus eucariotas están regulados.
Hasta el momento, sólo se han limitado los estudios estructurales y funcionales de los complejos de remodelación de la cromatina de mamíferos múltiples subunidades, debido en parte a las dificultades en la obtención de los complejos de remodelación de la cromatina bioquímicamente definidos y subcomplexes. Hemos eludido parcialmente estas dificultades con los procedimientos descritos a continuación, en el que la purificación de inmunoafinidad se utiliza para preparar INO80 o INO80 subcomplexes intactos de las células humanas que expresan establemente N-terminal FLAG epítopo etiquetado de tipo salvaje o versiones mutantes de Ino80 5-7 (Figura 1) . Para obtener complejos de INO80 intactos de las células humanas, la recombinación mediada por FLP se utiliza para generar líneas celulares transgénicas HEK293 que expresan de forma estable epítopo FLAG ADNc etiquetados que codifican subunidades de los complejos INO80 8-10. Debido a la sobre expresión de subunidades INO80 puede ser algo tóxicos, es necesario aislar y mantener líneas celulares clonales menores de co selectivanditions para asegurar la expresión transgénica estable durante los muchos pasajes necesarios para la expansión de los cultivos celulares a gran escala. Para obtener subcomplexes INO80 más pequeños que contienen solamente un subconjunto de subunidades, hemos utilizado con éxito dos enfoques (Figura 2A, B). En la primera, generamos líneas celulares HEK293 Flp-In que expresan de forma estable versiones mutantes de Ino80 que carecen de dominios requeridos para la interacción con las subunidades específicas 5. Alternativamente, mediada desmontables-siRNA se utiliza para agotar la subunidad deseada a partir de células que expresan una subunidad INO80 marcado con FLAG apropiado (datos no publicados). Por último, para purificar los complejos INO80 humanos, FLAG cromatografía basada agarosa 11 se utiliza para enriquecer la fracción que contiene INO80-a partir de extractos nucleares, lo que reduce de manera efectiva la presencia de proteínas contaminantes citosólicas en la fracción final que contiene INO80 o INO80 subcomplexes purificados.
Protocolo
1. Generación y Cultura de HEK293 líneas estables celulares que expresan versiones mutantes de la BANDERA de cuerpo entero o epítopo de etiquetado Ino80 o otras subunidades INO80 complejas
- Clon de ADNc de longitud completa que codifica o mutante humana Ino80 ATPasa u otra subunidad INO80 en el vector de expresión de mamífero pcADN5 / FRT con un terminal N etiqueta de epítopo FLAG en el marco.
- Confirme la secuencia de los ADNc insertados por secuenciación de ADN antes de proceder.
- Para realizar la transfección, Flp-In crecer células HEK293 en 10 cm de platos de cultivo de tejidos en un medio que contiene DMEM (medio Eagle modificado de Dulbecco), 5% de glutamina, y 10% de FBS (suero fetal bovino).
- Cuando las células alcanzan ~ 70% de confluencia, añadir a cada placa de cultivo tisular de una mezcla de 40 l de reactivo de transfección FuGENE6, 0,5 g del plásmido de expresión pcDNA5 / FRT adecuada, y 9,5 g de pOG44, que codifica la recombinasa Flp, en un volumen total de 800 l.
- 48 horas más tarde, y s trypsinizePlit células en una relación de 01:30 en 10 cm de platos, y hacerlas crecer en DMEM con 5% de glutamina, 10% de FBS y 100 g / ml de higromicina B para 3 - 4 semanas. Cambie el medio de cultivo cada vez que empieza a volverse amarilla (normalmente cada 3 - 5 días).
- Para identificar los clones positivos que expresan el nivel más alto de la proteína marcada con FLAG, seleccionar colonias higromicina B individuo resistente y transferirlos a un solo pocillo de una placa de 24 pocillos.
- Una vez que las células alcanzan 80% de confluencia, las células de la cosecha de cada pocillo en ~ 1 ml de PBS y sedimento por centrifugación a 1000 xg durante 5 min.
- Después de retirar el sobrenadante, resuspender el sedimento celular en 60 l de tampón de muestra de SDS-PAGE.
- Asunto medio del sedimento de células se resuspendió a la página SDS y Western Blot para controlar la expresión de la proteína marcada con FLAG cebo; guardar la otra mitad para análisis futuros.
- Si no se detecta una proteína humana Ino80 bandera de etiquetado en lisados celulares, expanda la popu inicial de células clonalmento más en placas células de los pocillos individuales de una placa de 24 pocillos en 15 cm de platos de cultivo de tejidos.
- Para cosechar las células de 15 cm de platos, resuspender cerca de las células confluentes en PBS enfriado con hielo y la transferencia a un tubo cónico de 50 ml.
- Llevar a un volumen final de 50 ml mediante la adición de PBS adicional.
- Precipitar las células a 1.000 g durante 5 min, y eliminar lo más posible del sobrenadante.
- Resuspender el sedimento celular en 1 ml de tampón de Lys450 (20 mM HEPES-NaOH pH 7,9, NaCl 450 mM, 0,5% Triton X-100, 10 mM de KCl, 4 mM de MgCl 2, EDTA 0,2 mM, glicerol al 10%, DTT 1 mM, 200 M PMSF y 1: 1000 cóctel inhibidor de proteasas).
NOTA: aquí y en otros lugares, siempre agregar la TDT, PMSF y cóctel inhibidor de la proteasa para tampones inmediatamente antes de comenzar un experimento. - Inmuno-precipitado proteínas del lisado de células enteras resultante FLAG-etiquetados utilizando 20 l de gel de agarosa anti-FLAG, y analizar los eluidos BANDERA de Western Blot. [Para más detalles sobre immunprocedimiento oprecipitation, ver paso 5]
- Preparar material congelado de líneas celulares clonales deseados 12 y almacenarlos en nitrógeno líquido hasta su uso.
2. Growing HEK293 líneas celulares en frascos rotatorios
Para la preparación a gran escala de complejos INO80, células de cultivo en 10 - 20 botellas de rodillos; un rendimiento típico de cada frasco rotativo es ~ 1 ml de concentrado de hematíes.
- Para cada botella rodillo, añadir 200 ml de DMEM, 5% de glutamina, y 10% de suero de ternera, sin higromicina B.
- Transferir todas las células de un solo cerca de 15 cm confluente plato en cada botella rodillo
- Botellas Lugar de rodillos en un 37 ° C rodillo botella incubadora y giran a 0,2 rpm.
- Una vez que las células alcanzan ~ 70% de confluencia, verter y desechar el medio.
- Añadir PBS ~ 50 ml de hielo frío a cada botella. La celebración de botellas en posición horizontal, homogeneizar suavemente para aflojar la monocapa celular.
- Transferir las células se volvieron a suspender a 250 ml plastbotellas cónicas ic y el lugar en el hielo.
- Enjuague las botellas de rodillos con PBS adicional, transfiriéndolo secuencialmente de botella a botella. Cuando la solución de enjuague ya no está claro (normalmente después de haber sido usada para enjuagar unos 5 botellas), añadir a la suspensión celular.
- Precipitar las células por centrifugación a 400 xg durante 10 min.
- Resuspender las células en PBS, combinarlos en un solo frasco cónico de 250 ml, y mantener en hielo hasta su posterior procesamiento.
3. siRNA mediada Derribo de INO80 Subunidades en células que expresan Otra bandera de etiquetado INO80 Subunidad
Para obtener subcomplexes INO80 que carecen de una única subunidad, uso FLAG-inmunopurificación para purificar Ino80 de células siRNA tratados o células que expresan establemente shRNA. El siRNA "marcha atrás" (pequeños ARN de interferencia) protocolo de transfección descrito aquí está optimizado para las células HEK293 que crecen en placas de 15 cm. El protocolo es para un solo plato de 15 cm de células y shoULD ser ampliado en consecuencia en función del número de células necesarias. Para preparar cantidades bioquímicamente útiles del complejo INO80 a partir de células tratadas con siRNA, se debe ampliar a las culturas crecido en 40 de 15 cm de platos; éstas producen aproximadamente el 2 - 4 ml de pellet hematocrito.
- Se cultivan las células HEK293 que expresan establemente la subunidad deseada del complejo INO80 hasta casi confluencia en placas de 15 cm.
- Añadir un volumen de tampón de resuspensión de siRNA (mM KCl 20 mM, HEPES 6-pH 7,5, y 0,2 mM de MgCl 2) suficiente para preparar una solución madre 50 mM de ARNsi a un tubo que contiene liofilizado siRNA. Pipetear la solución arriba y abajo un par de veces y se incuba en un nutator durante 30 minutos a temperatura ambiente para garantizar el siRNA se haya disuelto completamente.
- Preparar un cóctel de transfección que contiene siRNAs y reactivo de transfección. Mezclar 10 l de la solución madre 50 mM siRNA con 32 l Lipofectamine RNAiMAX y añadirlo a 4 ml de Opti-MEM medio de suero reducido con mezcla muy suave; albajo todos los reactivos alcancen la temperatura ambiente antes de su uso.
- Incubar la mezcla a TA durante 30 min.
- Preparar las células Flp-In HEK293 que expresan establemente la subunidad INO80 deseada para la transfección.
- Durante la incubación de la Etapa 3.4, lavar las células en las placas de 15 cm una vez con PBS RT.
- Después de la eliminación de PBS, el tratamiento de las células con 1 ml de tripsina hasta que empiecen a levantar la placa.
- Inmediatamente después, añadir 10 ml de medio completo (DMEM + 5% de glutamina + 10% de FBS) a las células se trataron con tripsina y mezclar suavemente. Recoger las células por centrifugación a 1000 xg durante 5 min a TA.
- Resuspender el sedimento celular en ~ 4 ml de medio completo, y contar el resuspensión de células usando un hemocitómetro.
- Diluir las células con medio completo a una concentración de ~ 5,4 x 10 6 / ml.
- Para cada plato 15 cm, añadir 15 ml de medio de cultivo completo seguido por 4 ml de cóctel de transfección. Agitar suavemente para asegurar el medio de transfección y cócteles son thoroughly mezclado. Por último, añadir un ml de suspensión de células y de nuevo agitar suavemente para dispersar las células de manera uniforme.
- Después de 60 horas de cultivo en un 37 ° C, 5% de CO2, retire con cuidado medio, suspender las células en hielo frío PBS, y proceder de inmediato a preparar extractos nucleares.
4 Preparación de extractos nucleares
Este procedimiento se ha modificado desde el protocolo de Dignam 13 y se puede escalar hacia arriba o hacia abajo, dependiendo del tamaño de iniciar sedimentos celulares. Típicamente, 1 ml de concentrado de rendimientos sedimento celular 1 ml de extracto nuclear final. Todos los tampones deben ser fría como el hielo, y todos los pasos deben realizarse en una habitación fría o con hielo si una habitación fría conveniente no esté disponible.
- Aislamiento de los núcleos:
- Transferir suavemente las células de un tamaño adecuado (15 o 50 ml) se graduó tubo cónico y centrifugado a 1000 xg durante 10 min a 4 ° C.
- Eliminar el sobrenadante, y medir el volumen de la pel celular aglomeradodejar. 1 ml de concentrado de eritrocitos corresponde a ~ 3 x 10 8 células HEK293.
- Añadir 5 volúmenes envasados celulares de tampón A (10 mM HEPES, pH 7,9, 1,5 mM de MgCl 2, 10 mM KCl y recién añadido DTT 1 mM, 200 mM PMSF y 1: 1000 de cóctel inhibidor de proteasa). Resuspender el sedimento celular por pipeteo suave.
- Incubar en hielo durante exactamente 10 min.
- Sedimentar las células a 1.000 xg durante 10 min a 4 ° C, y eliminar el sobrenadante.
- El tamaño del sedimento celular debería aumentar hasta 2 veces durante la incubación en tampón A.
- Resuspender las células en dos volúmenes de células empaquetadas de tampón A, y transferir la suspensión celular a un tamaño apropiado homogeneizador de tejidos Dounce. Si a partir de menos de 2 ml de concentrado de hematíes, utilizar un homogeneizador 7 ml; para 2 - 4 ml concentrado de hematíes, utilizar un homogeneizador 15 ml; y de 10 o más ml de concentrado de hematíes, utilizar un homogeneizador 40 ml.
- Homogeneizar la suspensión celular con la mano del mortero de vidrio sueltas del homogeneizador Dounce ONUhasta 90% de las células teñir positivamente con 1% de azul de tripano.
- Transferir la suspensión a un tubo de centrífuga de alta velocidad de 45 ml y centrifugar a 25.000 xg durante 20 min a 4 ° C en un rotor JA-17 o similar (véase la Tabla de Materiales / Equipos).
- Desde el sedimento nuclear, separar el sobrenadante, que contiene proteínas o proteínas que se filtran fuera del núcleo durante el fraccionamiento citosólicas.
- La extracción de núcleos con sal:
- Añadir Tampón C (HEPES 20 mM, pH 7,9, 25% de glicerol, 1,5 mM de MgCl2, 0,2 mM EDTA, y recién añadido DTT 1 mM, PMSF 200 mM, y 1: 1000 de cóctel inhibidor de la proteasa) al sedimento nuclear; utilizar 2,5 ml Tampón C por cada 3 ml de comenzar el hematocrito (~ 1 x 10 9 células).
- Usando una varilla de vidrio o una pipeta, desalojar el sedimento nuclear de la pared del tubo y transferir toda la mezcla a un homogeneizador Dounce de un tamaño apropiado.
- Resuspender los núcleos por homogeneización ªmezcla e con dos golpes de una mano de mortero suelto.
- Transferir la fracción nuclear se resuspendió en un vaso de precipitados enfriado. Elija un vaso de precipitados de tal modo que la suspensión se llenará el vaso de precipitados a por lo menos 0,5 cm de profundidad.
- Para extraer las proteínas nucleares de la cromatina o de otras estructuras insolubles, aumentar gradualmente la concentración de sal de la suspensión a NaCl 0,42 M mediante la adición gota a gota de NaCl 5 M mientras se agita suavemente la suspensión con una pipeta o varilla de vidrio en hielo; Una vez que todo el M NaCl 5 ha sido añadido, la solución debe ser muy viscoso o similar a un gel. Calcular el volumen de 5 M de NaCl necesaria para llevar la solución a una concentración final de NaCl 0,42 M de acuerdo con la siguiente fórmula:
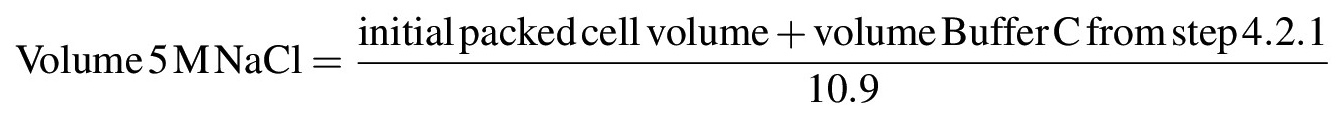
- Transferir cuidadosamente la suspensión viscosa en 10 ml tubos de policarbonato para un tipo de 70,1 rotor Ti (o equivalentes) botellas de policarbonato o 70 ml para un tipo 45 Ti or rotor similar (véase la Tabla de Materiales / Equipos). Selle herméticamente con Parafilm si utiliza tubos de 10 ml o con el conjunto de la tapa si está utilizando 70 ml botellas.
- Roca lentamente los tubos sellados a 4 ° C durante 30 min usando un nutator.
- Haga girar las muestras de un tipo de 45 o 70.1 Ti Ti rotor durante 30 minutos a 120.000 xg a 4 ° C.
- Transferir el sobrenadante a un tubo de plástico simple o botella. Este sobrenadante es el extracto nuclear, y el sedimento contiene la cromatina nuclear y otros desechos.
- Dividir el extracto nuclear en alícuotas convenientemente dimensionados, congelar en nitrógeno líquido y almacenarlo a -80 ° C.
5. Inmunoafinidad Purificación del INO80 humano o INO80 Subcomplejos
- Para descongelar el extracto nuclear congelada, coloque los tubos que contienen el extracto de los tubos de sobremesa o rollo entre las manos hasta que el material congelado se convierte en una suspensión. A continuación, coloque los tubos en hielo o en la cámara frigorífica hasta que el extracto es completamente thawed.
- Transferir el extracto nuclear descongelado a tubos de ultracentrífuga de policarbonato de 10 ml, y centrifugado a 100.000 xg durante 20 min a 4 ° C en un rotor Ti Tipo 70.1 o equivalente para eliminar cualquier precipitado que se pueden haber formado durante el ciclo de congelación-descongelación.
- Transferir el sobrenadante a un tubo cónico de 15 ml. Añadir fresco cóctel TDT, PMSF, y inhibidor de proteasa a concentraciones finales de 1 mM DTT, 200 mM PMSF y 1: 1000 cóctel inhibidor de proteasas.
- Para preparar agarosa anti-FLAG para la inmunopurificación, transferir 200 l de suspensión al 50% de perlas de agarosa anti-FLAG a un tubo de microcentrífuga de 1,5 ml usando una pipeta P200 o similar con una punta de la que el extremo se ha cortado con un escalpelo limpio o cuchilla de afeitar.
- Sedimentar las perlas por centrifugación en una microcentrífuga de sobremesa a 8.000 xg durante 30 seg. Eliminar el sobrenadante y lavar las perlas mediante resuspensión de las perlas en 1 ml de tampón de Lys450, y sedimentar las perlas a 8.000 xg durante 30 seg. Lave la bEADS dos veces más.
- Resuspender las perlas de agarosa anti-FLAG lavadas en aproximadamente 100 l de extracto nuclear usando un P200 o una pipeta de volumen ajustable similar con una punta de la que el extremo se ha cortado con un escalpelo limpio o cuchilla de afeitar y, empleando la misma punta, la transferencia las perlas se resuspendieron en el tubo cónico de 15 ml que contiene el extracto. Repita varias veces hasta que todas las cuentas han sido transferidas al tubo de 15 ml.
- Incubar la mezcla de extracto / perlas durante 4 horas a 4 ° C con rotación lenta en un rotor de laboratorio. OPCIONAL: Incluir benzonasa a una concentración de 25 unidades / ml para eliminar la contaminación de ADN.
- Recoge la agarosa FLAG por centrifugación a 1000 × g durante 5 min a 4 ° C.
- Volver a suspender en 10 ml Lys450 para lavar, incubar 5 min a 4 ° C con agitación suave en un nutator. Sedimentar las cuentas a 1.000 xg durante 5 min a 4 ° C.
- Resuspender en 100 - 150 l de Lys450 y transferencia de cuentas a un tubo de 1.5 ml. Continue para enjuagar el tubo cónico de 15 ml con 100 - 150 l de Lys450 hasta que todos los granos se han transferido al tubo de microcentrífuga.
- Centrifugar las cuentas a 8.000 xg durante 30 segundos a 4 ° C en una microcentrífuga. Lavar tres veces más con 1 ml Lys450 y una vez con 1 ml de tampón EB100 (10 mM HEPES pH 7,9, 10% de glicerol, NaCl 100 mM, 1,5 mM de MgCl 2, 0,05% Triton X-100, y recién añadió DTT 1 mM, PMSF 200 mM , y 1: 1000 cóctel inhibidor de proteasas).
- Para eluir las proteínas unidas, añadir tampón EB100 200 l que contiene 0,25 mg ml 1x péptido / FLAG. Incubar 30 min a 4 ° C cada uno en una nutator.
- Sedimentar las cuentas a 8.000 xg durante 30 segundos a 4 ° C en una microcentrífuga. Transferir el sobrenadante, que contiene el complejo INO80 eluido, a un tubo de microcentrífuga fresco.
- Repetir la elución cuatro veces más, y poner en común todos los sobrenadantes en un solo tubo.
- Para eliminar las cuentas residual FLAG-agarosa de la fracción de proteína eluida,pasar el eluato a través de una columna de centrifugación vacío.
- Se concentra la fracción de proteína se eluyó ~ 10 veces usando un dispositivo de filtro centrífugo de ultra (corte de peso molecular 50.000).
- Para eliminar el péptido FLAG, pasar la fracción de proteína concentrada secuencialmente a través de dos columnas de desalación.
- Divida la fracción de proteína purificada, desalado en 20 alícuotas, se congelaron en nitrógeno líquido y se almacenan a -80 ° C.
- Analizar la composición de la subunidad de INO80 o subcomplexes INO80 en geles teñidos con plata o por el Western Blot, y estimar su concentración por el Western Blot semi-cuantitativo utilizando preparaciones de subunidades INO80 recombinantes de concentración conocida como estándares.
Resultados
La figura 1 muestra un diagrama de flujo que resume los procedimientos que se utilizan para generar, purificar y caracterizar los complejos de remodelación de la cromatina INO80 ATP-dependientes humanos.
Como se ilustra en las figuras 2 y 3, estos procedimientos permiten la generación de ambos tipo INO80 y INO80 subcomplexes salvajes que carecen de varias subunidades, permitiendo así que los análisis bioquímicos posteriores de la contri...
Discusión
Los estudios estructurales y funcionales de múltiples subunidades complejos de remodelación de la cromatina de mamíferos a partir de eucariotas superiores se han visto obstaculizados por la dificultad de preparar bioquímicamente cantidades útiles de tales complejos que contienen subunidades mutantes o que carecen de ciertas subunidades completo. Hay un número de obstáculos técnicos: En primer lugar, la manipulación genética en células de mamíferos ha sido técnicamente difícil y consume mucho tiempo. A dife...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
El trabajo en el laboratorio de los autores es apoyada por una subvención del Instituto Nacional de Ciencias Médicas Generales (GM41628) y con una donación al Instituto Stowers de Investigación Médica de la Fundación para la Investigación Médica Nelson Helen en la Fundación de la Comunidad metropolitana de Kansas City.
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium | Cellgro | 10-013-CV | |
| Glutamax-I (stablized glutamine) | Life Technologies | 35050-079 | |
| Fetal Bovine Serum | SAFC | 12176C | |
| FuGENE6 transfection reagent | Promega | E2312 | |
| Hygromycin B, sterile in PBS | AG Scientific | H-1012-PBS | |
| pcDNA5/FRT vector | Life Technologies | V6010-20 | |
| Flp-In HEK293 cells | Life Technologies | R780-07 | |
| pOG44 Flp-Recombinase Expression Vector | Life Technologies | V600520 | |
| EZview Red ANTI-FLAG M2 Affinity Gel | Sigma | F2426 | |
| calf serum | SAFC | 12138C | |
| TARGETplus SMARTsiRNA pool | Dharmacon / Thermo Scientific | various | |
| 5x siRNA resuspension buffer | Dharmacon / Thermo Scientific | #B-002000-UB-100 | |
| Lipofectamine RNAiMAX | Life Technologies | 13778 | |
| Opti-MEM Reduced Serum Medium | Life Technologies | 51985-091 | |
| PBS | Cellgro | 45000 | VWR |
| TrypLE (trypsin) | Life Technologies | 12604 | |
| 1x FLAG Peptide | Sigma | F3290 | |
| Micro Bio-Spin Chromatography Column | Bio-Rad | 737-5021 | |
| Amicon Ultra Centrifugal Filter Device (50k MWCO) | Amicon | UFC805024 | Fisher Scientific |
| Zeba Desalting Columns | Thermo Scientific | 89882 | |
| Anti-FLAG M2 antibody, mouse | Sigma | F3165 | |
| Anti-FLAG M2 antibody, rabbit | Sigma | F7425 | |
| Protease Inhibitor Cocktail | Sigma | P8340 | |
| benzonase | Novagen | 70664 | |
| Equipment | |||
| JS-4.2 rotor in a J6 centrifuge | Beckman-Coulter | 339080 | |
| JA-17 rotor | Beckman-Coulter | 369691 | |
| 10 ml polycarbonate tubes | Beckman-Coulter | 355630 | |
| 70 ml polycarbonate bottles | Beckman-Coulter | 355655 | |
| Type 45 Ti rotor | Beckman-Coulter | 339160 | |
| Type 70.1 Ti rotor | Beckman-Coulter | 342184 | |
| BD Clay Adams Nutator Mixer | BD Diagnostics | 15172-203 | VWR |
| Glas-Col Tube/Vial Rotator | Glas-Col | 099A RD4512 | |
| PCR thermal cycler PTC 200 | MJ Research | PTC 200 | |
| roller bottle incubator | Bellco biotechnology | 353348 | |
| Immobilon-FL Transfer Membrane 7 x 8.4 | Millipore | IPFL07810 | |
| lubricated 1.5 ml microcentrifuge tubes | Costar | 3207 | |
Referencias
- Clapier, C. R., Cairns, B. R. The biology of chromatin remodeling complexes, Annual Review of Biochemistry. 78, 273-304 (2009).
- Szerlong, H., Hinada, K., Viswanathan, R., Erdjument-Bromage, H., Tempst, P., Cairns, B. R. The HSA domain binds nuclear actin-related proteins to regulate chromatin-remodeling ATPases. Nature Struct. Mol. Biol. 15 (5), 469-476 (2008).
- Shen, X., Mizuguchi, G., Hamiche, A., Wu, C. A chromatin remodelling complex involved in transcription and DNA processing. Nature. 406 (6795), 541-544 (2000).
- Shen, X., Ranallo, R., Choi, E., Wu, C. Involvement of actin-related proteins in ATP-dependent chromatin remodelling. Mol. Cell. 12, 147-155 (2003).
- Chen, L., et al. Subunit organization of the human INO80 chromatin remodeling complex: an evolutionarily conserved core complex catalyzes ATP-dependent nucleosome remodeling. Journal of Biological Chemistry. 286 (13), 11283-11289 (2011).
- Sauer, B. Site-specific recombination: developments and applications. 5 (5), 521-527 (1994).
- Gorman, S., Fox, D. T., Wahl, G. M. Recombinase-mediated gene activation and site-specific integration in mammalian cells. Science. 251 (4999), 1351-1355 (1991).
- Jin, J., et al. A mammalian chromatin remodeling complex with similarities to the yeast INO80 complex. Journal of Biological Chemistry. 280 (50), 41207-41212 (2005).
- Cai, Y., et al. YY1 functions with INO80 to activate transcription. Nature Structural and Molecular Biology. 14 (9), 872-874 (2007).
- Yao, T., et al. Distinct Modes of Regulation of the Uch37 Deubiquitinating Enzyme in the Proteasome and in the Ino80 Chromatin-Remodeling Complex. Mol.Cell. 31 (6), 909-917 (2008).
- Brizzard, B. L., Chubet, R. G., Vizard, D. L. Immunoaffinity purification of FLAG epitope-tagged bacterial alkaline phosphatase using a novel monoclonal antibody and peptide elution, Biotechniques. 16 (4), 730-735 (1994).
- Barker, K. . At the Bench: A Laboratory Navigator. 10, 207-245 (2005).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian cell nuclei. Nucleic. Acids. Res. 11 (5), 1475-1489 (1983).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados