A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحقيق في نشر وسمية البروتينات مثل بريون باستخدام Metazoan نموذج حي
In This Article
Summary
Prion-like propagation of protein aggregates has recently emerged as being implicated in many neurodegenerative diseases. The goal of this protocol is to describe, how to use the nematode C. elegans as a model system to monitor protein spreading and to investigate prion-like phenomena.
Abstract
Prions are unconventional self-propagating proteinaceous particles, devoid of any coding nucleic acid. These proteinaceous seeds serve as templates for the conversion and replication of their benign cellular isoform. Accumulating evidence suggests that many protein aggregates can act as self-propagating templates and corrupt the folding of cognate proteins. Although aggregates can be functional under certain circumstances, this process often leads to the disruption of the cellular protein homeostasis (proteostasis), eventually leading to devastating diseases such as Alzheimer’s disease (AD), Parkinson’s disease (PD), Amyotrophic lateral sclerosis (ALS), or transmissible spongiform encephalopathies (TSEs). The exact mechanisms of prion propagation and cell-to-cell spreading of protein aggregates are still subjects of intense investigation. To further this knowledge, recently a new metazoan model in Caenorhabditis elegans, for expression of the prion domain of the cytosolic yeast prion protein Sup35 has been established. This prion model offers several advantages, as it allows direct monitoring of the fluorescently tagged prion domain in living animals and ease of genetic approaches. Described here are methods to study prion-like behavior of protein aggregates and to identify modifiers of prion-induced toxicity using C. elegans.
Introduction
وترتبط العديد من الأمراض العصبية، بما في ذلك مرض الزهايمر (AD)، ومرض باركنسون (PD)، الضموري العضلي التصلب الجانبي (ALS)، والاعتلال الإسفنجي المعدية (TSEs)، مع البروتينات المعرضة للتجميع، وبالتالي تعرف باسم البروتين misfolding اضطرابات (تطوير إدارة الأداء ). TSEs أو أمراض بريون تشكل فئة فريدة من تطوير إدارة الأداء في أنها يمكن أن تكون معدية في كل من البشر والحيوانات 1. على المستوى الجزيئي، والبريونات تكرار من خلال تجنيد وتحويل أحادى α-الحلزون الغنية المشفرة المضيف بي ار بي الخلوي (بي ار بي C) في المرضية ورقة β الغنية بي ار بي الشوري التشكل 2،3. وقد تم تحديد المجاميع البروتين نشر النفس أيضا في الفطريات، التي تشترك في الخصائص المهمة مع البريونات الثدييات 4،5. بالإضافة إلى ذلك، والبريونات الثدييات قادرة على الانتقال من خلية الى خلية وتصيب خلايا ساذجة 6،7.
في حين تطوير إدارة الأداء الغيرإيه من TSEs ليست معدية، إلا أنهما يشتركان مبدأ المسببة للأمراض مشتركة مع الأمراض بريون 8،9. على الرغم من أن البروتينات ترتبط كل من تطوير إدارة الأداء لا ترتبط في هيكل أو وظيفة، وأنهم جميعا المجاميع شكل من خلال عملية تشبه بلورة تسمى منوى أو المصنفة البلمرة. وعلاوة على ذلك البذور البروتينية تنمو من خلال تجنيد الإسوية القابلة للذوبان على 2،10،11. كفاءة لنشر الذاتي تختلف في الجسم الحي، وهذا يتوقف على الخصائص الجوهرية للبروتين، والتي جنبا إلى جنب مع العوامل الخلوية إضافية مثل المحرمين الجزيئي تحدد في نهاية المطاف معدلات التنوي الكلي، البذر، والتجزؤ ونشر 12-15. وبالتالي، يجب ان يكون هناك توازن دقيق بين هذه العوامل التي تسمح نشر كفاءة من البروتين التجميع. قد يفسر هذا أيضا لماذا فقط بعض المجاميع amyloidogenic تؤوي خصائص بريون، وبالتالي ليس كل تطوير إدارة الأداء والمعدية. ويبدو أن البريونات لتمثيل س 'أعلى فناني الأداءاتحاد كرة القدم طيف واسع من المجاميع البروتينية الذاتي تكرار، مما يجعلها أداة قوية لدراسة تطوير إدارة الأداء 8،13.
يثير الاهتمام والفضول، وسمية المرتبطة المجاميع المرتبطة المرض غالبا ما يكون غير خلية عنصر مستقل 16،17. وهذا يعني أنها تؤثر على الخلايا المجاورة التي لا تعبر عن الجين المقابل، على النقيض من تأثير مستقل الخلية بدقة، مما يعني أن فقط الخلايا معربا عن المعرض الجين النمط الظاهري محدد. وقد تجلى ذلك بشكل مقنع عن طريق التعبير الأنسجة محددة أو هدم البروتينات منها في نماذج عديدة من أمراض الاعصاب 18-26. وقد اقترحت آليات مختلفة كأساس لهذه الخلايا غير سمية الحكم الذاتي في تطوير إدارة الأداء، بما في ذلك إمدادات تقلص المواد الغذائية، وخلل في الإشارات العصبية، الغلوتامات التحفيز الزائدة، وneuroinflammation 16،27،28. وبالإضافة إلى ذلك، migh حركة تشبه بريون من المجاميع المرتبطة المرض بين الخلايار المساهمة في هذا الجانب 29،30. وتشير أدلة متزايدة على أن الادراج البروتين أخرى من البريونات يمكن أن تنقل من خلية الى خلية، وهو ما قد يفسر نشر سمة من الأمراض التي لوحظت في العديد تطوير إدارة الأداء 30-36. ومع ذلك، لم يتم بعد تحديد ما إذا كانت هناك علاقة سببية واضحة بين الحركة بين الخلايا البروتينات المرض وتأثير سام على الخلايا المجاورة. ولذلك، فهم أفضل للمسارات الخلوية التي تكمن وراء انتقال خلية الى خلية خلية وغير سمية الحكم الذاتي أمر ضروري وأساسي لتطوير علاجات جديدة. ومع ذلك، لا يفهم كثير من جوانب بريون مثل نشر والخلوية العوامل التي تؤثر على انتقال الخلية الى خلية من البروتينات تتجمع في metazoans جيدا، ولا سيما على مستوى العضوي.
الديدان الخيطية ايليجانس انواع معينة لديها العديد من المزايا التي توفر إمكانات ل اكتشاف جوانب جديدة من تشبه بريون SPREADIنانوغرام في metazoans 17. انها شفافة، والسماح لفي الجسم الحي تتبع البروتينات من الموسومة fluorescently في الكائن الحي. وعلاوة على ذلك، يتم الحفاظ العديد من العمليات الخلوية والفسيولوجية المتضررين من المرض من الديدان إلى الإنسان، وC. ايليجانس هي أيضا قابلة للطائفة واسعة من التلاعب الجيني والتحليلات الجزيئية والكيمياء الحيوية 37-39. بالضبط 959 الخلايا الجسدية تشكل خنثى الكبار مع خطة الهيئة البسيطة التي لا يزال لديها العديد من أنواع الأنسجة متميزة، بما في ذلك العضلات، والخلايا العصبية والأمعاء.
لوضع نموذج جديد في بريون C. ايليجانس، اخترنا للتعبير عن خارجيا وتتميز كذلك الجلوتامين / الأسباراجين (Q / N) الغنية بريون NM المجال من عصاري خلوي بروتين بريون Sup35 الخميرة، حيث لا توجد بروتينات بريون الذاتية المعروفة في الديدان 4،40. وقد البريونات الخميرة لا تقدر بثمن في توضيح الآليات الأساسية لتكرار بريون 41-44. وعلاوة على ذلك، NM هو التنوبالحادي وعصاري خلوي البروتين مثل بريون التي قد تظهر لتلخيص دورة الحياة الكاملة للبريون في الثقافة خلايا الثدييات 45،46. وبالمثل، عندما أعرب في C. ايليجانس، المجال بريون Sup35 اعتمدت بشكل جيد لمتطلبات مختلفة للنشر في الخلايا metazoan بالمقارنة مع خلايا الخميرة والملامح الرئيسية عرضت من بريون البيولوجيا ارتبط 40. NM التجميع مع النمط الظاهري السامة العميق، بما في ذلك تعطيل سلامة الميتوكوندريا ومظهر من مختلف الحويصلات الالتهام الذاتي ذات الصلة على المستوى الخلوي، فضلا عن اعتقال الجنينية واليرقات، تأخر في النمو، واضطراب واسع النطاق للبيئة طي البروتين على المستوى العضوي. لافت للنظر، يسلك المجال بريون خلية مستقلة وغير خلية سمية مستقلة، مما يؤثر على الأنسجة المجاورة التي لم أعرب التحوير. وعلاوة على ذلك، يتم مراقبة النقل حويصلي في مجال بريون داخل وبين خلايا في الوقت الحقيقي في الجسم الحي 40.
نحن هنا وصف كيفية فحص نشر مثل بريون في C. ايليجانس. سوف نشرح كيفية مراقبة النقل داخل الأقاليم وفيما بين الخلايا من الحويصلات التي تحتوي على المجال بريون باستخدام الوقت الفاصل بين مضان المجهري. سوف نؤكد على أن استخدام أجهزة الاستشعار الأنسجة محددة قابلة للطي وأعرب بتواجد مطلق للصحفيين الإجهاد لتقييم آثار خلية خلية مستقلة تتمتع بالحكم الذاتي وغير على اللياقة البدنية الخلوية. وأخيرا، فإننا سوف تصف الإجراء من الجينوم واسعة تدخل الحمض النووي الريبي (رني) شاشة أجريت مؤخرا لتحديد معدلات جديدة من سمية التي يسببها بريون. في الجمع، ويمكن لهذه الأساليب تساعد على ندف بصرف النظر مسارات الجينية التي تساهم في الحركة بين الخلايا البروتينات وغير خلية سميتها مستقلة.
Protocol
1. رصد العابر للنشر من البروتينات مثل بريون بواسطة فيفو في الوقت الفاصل بين التصوير
ملاحظة: تنمو C. ايليجانس البرية من نوع (WT) (N2) وخطوط المعدلة وراثيا وفقا للأساليب القياسية ومراقبة بعناية درجة حرارة زراعة 47.
- توليد خطوط المعدلة وراثيا من C. ايليجانس معربا عن البروتين مثل بريون، الموسومة ب أحادى البروتين الفلوري الأحمر (mRFP). مشاهدة هذا الفيديو الذي يوضح كيفية استخدام حقن مكروي 48. لمزيد من التفاصيل والأساليب التي تصف كيفية دمج هذه السطور خارج الصبغي، انظر 49.
- إعداد السكان متزامنة عبر وضع البيض او تبيض وفقا للأساليب القياسية 50.
- المزامنة وضع البيض
- نقل 10-20 البالغين حامل على طبق من ذهب والسماح لهم وضع البيض ل1 - 2 ساعة. إزالة البالغين من لوحة وترك ذرية تنمو حتى سن المرجوة.
<لى> التزامن التي كتبها تبيض - جمع السكان غير المتزامنة من البالغين حامل وتبييض لهم محلول قلوي هيبوكلوريت (250 ملي هيدروكسيد الصوديوم و 1: 4 (ت / ت) التخفيف من التبييض التجاري في H 2 O). غسل البيض مرتين (218 x ج لمدة 1 دقيقة) مع M9 عازلة 47 (21 mMNa 2 HPO 4 · 7H 2 O، 22 mMKH 2 PO 4، 86 mMNaCl، 1 mMMgSO 4 · 7H 2 O، إضافة درهم 2 O ما يصل الى 1 L).
- تسمح لهم ليفقس في المخزن M9 مع طيف الانفعالات O / N عند 20 درجة مئوية. وتطوير دودة اعتقال في مرحلة L1 في حالة عدم وجود مصدر الغذاء، وترك السكان متزامنة. نقل L1s على نيماتودا جديدة نمو وسائل الإعلام (NGM) لوحات مع المصنف OP50 E. البكتيريا القولونية، والسماح للذرية تتطور حتى سن 47 المرجوة.
- المزامنة وضع البيض
- إعداد 2٪ منصات الاغاروز (في H 2 O) على شريحة المجهر كما هو موضح 50.
- إعداد اثنين ميلالشرائح croscope مع الشريط وضع العلامات وضعت على طولها كامل لاستخدامها الفواصل. ضع شريحة المجهر الثالثة بينهما.
- حل 2٪ الاغاروز في H 2 O وماصة قطرة واحدة على شريحة نظيفة.
- ضع الشريحة الرابعة عمودي على الشرائح الثلاث الأخرى على الجزء العلوي من انخفاض أجار. اضغط برفق إلى أسفل لشد سادة لسمك نفس الشريط وضع العلامات.
- اتركها لتجف لمدة 1 دقيقة قبل إزالة الفواصل وسحب بلطف الشرائح عن بعضها البعض. سوف لوحة أجار التمسك واحد منهم.
- ماصة ~ 10 ميكرولتر مخدر (2 مم الليفاميزول في المخزن M9) إلى لوحة ونقل ~ 10 الحيوانات باستخدام معول سلك البلاتين. مع تغطية زلة غطاء (~ 22 × 22 ملم) والتقاط صور في حدود 1 ساعة.
- بدلا من ذلك، للحصول على الأفلام على مدى فترة طويلة من الزمن أو لزيادة خفض إمكانية أي حركة الحيوانات، واستخدام مزيج من مخدر وحبة تجميد 51.
- إعداد 10٪ الآغاارتفع منصات (في المخزن M9) كما هو موضح 51 وإضافة الديدان إلى 3 ميكرولتر حل معايير حجم nanosphere (الخرز البوليسترين، 100 نانومتر)، بالإضافة إلى 3 ميكرولتر مخدر (4 ملي الليفاميزول في المخزن M9). تغطية بلطف مع انزلاق الغطاء. لتجنب جفاف، وختم زلة تغطية مع VALAP (مزيج من كميات متساوية من الفازلين، اللانولين، وشمع البارافين).
- صورة من الحراك الديدان باستخدام مجهر متحد البؤر.
ويتم الحصول على نتائج باستخدام غزل القرص AF متحد البؤر المجهر مجهزة الكاميرا EM-CCD والميكروسكوب الأتمتة وتحليل الصور برامج مثل MetaMorph والخطوط العريضة لتفاصيل أدناه، ولكن يمكن أيضا أن نظم التصوير متحد البؤر مقارنة أخرى أن تستخدم: ملاحظة.- استخدام الهدف النفط 63X أو 100X / 1.4NA ووضع شريحة المجهر تحتوي على ديدان في حامل شريحة المجهر.
- فتح البرنامج. ضبط قوة الليزر والمرشحات لmRFP التصوير. استخدام الليزر 561 نانومتر في 10٪ من الطاقة والانبعاثات مرشح> 600 نانومتر. فتح "متعددة الأبعاد اقتناء". تحت "الرئيسية" علامة التبويب، حدد المربعات ل "Timelapse" و "تشغيل المجلات" (الأجهزة التركيز التلقائي: إيقاف).
- تحت "إنقاذ" علامة التبويب تحديد أو إنشاء مجلد الدليل حيث يجب حفظ الملفات. تعيين اسم إلى الملف.
- تحت عنوان "طول الموجة" علامة التبويب اختيار الإضاءة المناسبة وضبط التعرض وكسب. استخدام "YokoQuad الأحمر" (أو وضع الإضاءة يعادل لmRFP التصوير) مع التعرض ما بين 100 و 300 ميللي ثانية، وكسب الكاميرا ما بين 100 و 300، وهذا يتوقف على عينة فردية (تقييم باستخدام صورة حية).
- تحت "Timelapse" علامة التبويب حدد "عدد من النقاط الزمنية" = 301، "مدة" = 5 دقائق و"الوقت / الفاصل" = 1 ثانية.
- تحت عنوان "المجلات" علامة التبويب اختيار مجلة: "AFC SET Z HOLD" و "AFC العودة للZ HOLD"، النوع: &# 8220؛ الخاصة "(مرتين)، نقطة الأولية:" بداية التوقيت نقطة "و" نهاية نقطة زمنية ". هذا الخيار ضبط تلقائي للصورة هو المهم الصورة نفس القسم على مدى فترة أطول من الزمن.
- عندما يتم الإعداد، اضغط على "اكتساب". وصفد الفيديو timelapse كملفات TIFF منفصلة.
- فتح جميع ملفات .tiff من سلسلة زمنية معينة في يماغيج. انتقل إلى "صورة" → "الأكوام" → "صور لالأكوام". اختياريا، وضبط السطوع والتباين، إضافة شريط الحجم، الخ تصدير الفيلم تحت عنوان "ملف" → "حفظ باسم" → "AVI ..." (للحصول على مثال، انظر الفيديو 1 و 2 الموافق الشكل 1).
2. عن طريق الطي مجسات ومراسلون الإجهاد المعنية بالتحقيق في خلية مستقلة وغير خلية ذاتية الحكم يؤثر على استتباب بروتيني وسمية
- توليد خطوط المعدلة وراثيا التي coexpress جهاز استشعار للطي أو الإجهاد أوردتهص جنبا إلى جنب مع البروتين مثل بريون. للحصول على طرق حول كيفية إنشاء الصلبان أو توليد خطوط المعدلة وراثيا، انظر 48،49،52. انظر الجدول رقم 1 للحصول على قائمة C. سلالات ايليجانس التي يمكن استخدامها.
- إعداد السكان متزامنة من الحيوانات المعدلة وراثيا وزراعتها حتى سن المطلوب كما هو موضح أعلاه (القسم 1.2) 50.
- باستخدام stereomicroscope، ودراسة النمط الظاهري المعنيين من أجهزة الاستشعار للطي أو مراسل الإجهاد.
- لاستشعار للطي، وتحديد عدد الحيوانات إيواء المجاميع في كل يوم بعد التزامن (للحصول على مثال، انظر الشكل 2E وF).
- لمراسل والإجهاد، واختبار إذا coexpression نتائج البروتين مثل بريون في مضان زيادة لمراسل (للحصول على مثال، انظر الشكل 3).
3. شاشة الجينوم على نطاق لقمع سمية التي يسببها بريون في C. ايليجانس
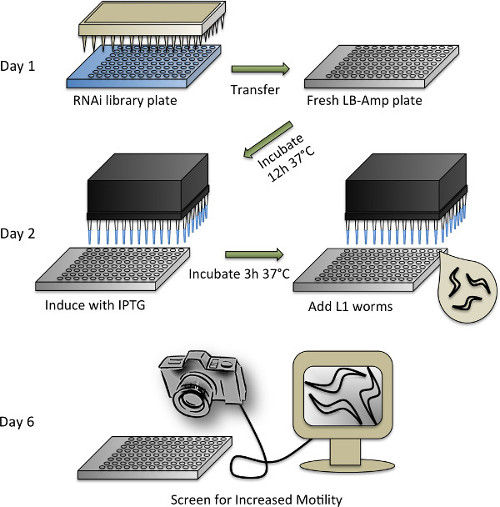
الرقم 4. تمثيل تخطيطي للبروتوكول فحص رني. انظر القسم بروتوكول 3 للحصول على وصف مفصل للخطوات الفردية.
- تزامن C. الديدان ايليجانس والازدواجية في مكتبة رني
- للشاشة رني، استخدام المكتبة Ahringer رني (أو المكتبة فيدال رني) 53،54. Rearray المكتبة رني من 384 شكل البئر الأصلي إلى 96 لوحات جيدة عن طريق ملء لوحات مع 100 ميكرولتر وسائل الاعلام LB-أمبير (50 ميكروغرام / مل الأمبيسلين في LB) تستكمل مع 10٪ الجلسرين وتطعيم باستخدام المكرر 96-دبوس. ينمو بمعدل 37 درجة CO / N مع الإثارة وتخزينها في -80 ° C.
- الحفاظ على C. ايليجانس WT وخطوط المعدلة وراثيا في 20 ° C على لوحات NGM المصنف مع OP50 E. البكتيريا القولونية وفقا للأساليب القياسية 47.
- مزامنة المعدلة وراثيا مجال بريون وWT (مراقبة) الديدان الخيطية التي تبيض (انظر القسم 1.2).
- في نفس اليوم الذي الديدان والمبيضة، وإعداد وسائل الاعلام LB تستكمل مع 50 ميكروغرام / مل الأمبيسلين. استخدام موزع كاشف الآلي للاستغناء (أو ماصة يدويا) 65 ميكرولتر من وسائل الإعلام LB-أمبير في كل بئر من 96 لوحة جيدا.
- إزالة 96 جيدا لوحات مكتبة Ahringer رني من -80 ° C وتقديمهم للغطاء العقيمة اصطف مع المناشف الورقية. على الفور إزالة ختم الشريط من خلال عقد لوحة رأسا على عقب حين لوحات لا تزال مجمدة، والحرص على تجنب التلوث من الجليد على السطح الخارجي لللوحات. Reinvert لوحات والسماح لهم ذوبان الجليد لمدة 30 دقيقة.
- تراجع واحد معقمة 96 دبوس المكرر إلى واحد رني لوحة المكتبة، ومن ثم إلى واحدة جديدة لوحة LB-AMP. استخدام المكرر معقمة جديدة لكل لوحة. اغلاق جميع لوحات مع شريط لاصق احباط والعودة لوحات مكتبة ل-80 ° C. على نسخ متماثلة يمكن أن تكون غارقة في التبييض، وتشطف،وتعقيمها لاستخدامها مرة أخرى.
- السماح لوحات رني المكررة أن ينمو O / N في حاضنة المقرر ان 37 ° C و 300 دورة في الدقيقة. لاستخدام HT115 E. القولونية بكتيريا إيواء ناقلات الفارغة (L4440) كعنصر تحكم، وتنمو بشكل منفصل في أنبوب الثقافة وثم ماصة 65 ميكرولتر من الثقافة مع ماصة الأقنية إلى ربع اثنين من 96 لوحات جيدة.
- تحريض البكتيرية إنتاج الرنا المزدوج الجديلة وإضافة الديدان
- تمييع الآيزوبروبيل-β-D-thiogalactopyranosid (IPTG) إلى تركيز 5 مم في DDH 2 O. استخدام محطة العمل الآلي مع رئيس متعددة للاستغناء (أو الماصة يدويا) 10 ميكرولتر من المخفف IPTG في كل بئر من البكتيريا ورني لوحات السيطرة. ختم ووضع لوحات العودة إلى الحاضنة. دعهم يهز لمدة 3 ساعة على 37 درجة مئوية.
- في حين البكتيريا تهز، وإعداد الديدان. خلط M9 / دودة تعليق جيدا، وماصة عينة صغيرة (~ 5-10 ميكرولتر) إلى شريحة المجهر والزجاج. عدعدد الديدان تحت stereomicroscope وحساب عدد الديدان في ميكرولتر.
- باستخدام تقنية معقمة، وإعداد محلول تستكمل M9 (M9 +) مع تركيزات النهائية التالية: 0.20 ملغ / مل IPTG، 8.0 ميكروغرام / مل نسبة الكولسترول في الدم، 50 ميكروغرام / مل الأمبيسلين و 9.6 ميكروغرام / مل التتراسيكلين، 0.0835 ميكروغرام / مل Fungizone، و 15 الديدان في 50 ميكرولتر.
- جعل حلول منفصلة لالمعدلة وراثيا مجال بريون والديدان WT. الحجم النهائي من الحل الدودة M9 + اللازمة سيعتمد على عدد من لوحات رني نسخ (انظر أدناه)، بالإضافة إلى ~ 30 مل من حجم القتلى التي ستبقى في الخزان، إذا تم استخدام موزع الآلي.
- بعد تحريض 3 ساعة من إنتاج الرنا المزدوج الجديلة البكتيرية، واتخاذ لوحات من الحاضنة والسماح لهم تبرد لRT (~ 30 دقيقة) لتجنب الحرارة مشددا على الحيوانات.
- الاستغناء 50 ميكرولتر M9 + نطاق بريون حل دودة المعدلة وراثيا إلى كل بئر من لوحات رني واحدة من لوحات فارغة مكافحة ناقلات الأمراض. جعلتأكد من خلط حل دودة قبل كل خطوة كما تميل الحيوانات إلى الرواسب في قاع الخزان.
- الاستغناء الديدان WT في لوحة التحكم الثاني. ترك لوحات تفض للسماح للتهوية. للحفاظ على ثقافة السائل من التبخر، كومة 4-5 لوحات معا والتفاف مع منشفة ورقية رطبة ورقائق الألومنيوم. احتضان عند 200 دورة في الدقيقة عند 20 درجة مئوية لمدة 4 أيام.
- النقاط
ملاحظة: بعد 4 أيام في الحاضنة، والديدان يكون في اليوم الثاني من مرحلة البلوغ ونحن على استعداد للكشف. السماح للحيوانات التكيف مع الظروف غير الهز لمدة 30 دقيقة قبل الفحص لضمان سحق دون عائق.- باستخدام كاميرا الصقر 4M60 متصلة بجهاز كمبيوتر مع الشاشة، شاشة بصريا لزيادة سحق بالمقارنة مع مراقبة تعامل مجال بريون الحيوانات المعدلة وراثيا.
- تجميع قائمة من المشاهدات الأولية لتأكيد استخدام wrMTrck (انظر القسم التالي).
4. تأكيد الأوليةالشاشة الزيارات
- الحركة الفحص على لوحات الصلبة
- إعداد لوحات مع NGM تستكمل مع 100 ميكروغرام / مل الأمبيسلين، 12.5 ميكروغرام / مل التتراسيكلين و1 ملم IPTG، وفقا لأساليب القياسية 47. إذا كان ذلك ممكنا، واستخدام آلة صب لوحة أن أؤكد لجميع لوحات لديها نفس الارتفاع من وسائل الإعلام، والتي سوف تسمح لعملية الاستحواذ الفيديو أكثر بساطة.
- تنمو الحيوانات المستنسخة رني مختلفة في ~ 1 مل LB + 50 ميكروغرام / مل الأمبيسلين، O / N عند 37 درجة مئوية و 250 دورة في الدقيقة.
- في اليوم التالي، حمل التعبير عن الرنا المزدوج الجديلة مع IPTG 1 ملم لمدة 3 ساعة. البذور لوحات مع 150 ميكرولتر من كل استنساخ رني البكتيرية، وتنتشر في طبقة رقيقة. السماح للبكتيريا الجافة لمدة 2 أيام في RT في الظلام. إعداد 3 لوحات في رني استنساخ.
- مزامنة السكان دودة من قبل تبيض وفقا للأساليب القياسية 50 (انظر القسم 1.2)، والسماح لليا يفقس البيض / N في M9 وسائل الإعلام.
- أخذ عينة من تعليق دودة وتحديد مقدار نواعمatodes في ميكرولتر في stereomicroscope. ثم، ماصة الحجم المناسب للM9 بالإضافة إلى الديدان في كل لوحة التجريبية بحيث يحتوي على 25 - 30 الديدان L1. تنمو الديدان الخيطية عند 20 درجة مئوية لمدة 4 أيام حتى تصل إلى الديدان يوم 2 من مرحلة البلوغ.
- التحليل الكمي للدودة الحركة مع البرنامج المساعد wrMTrck ليماغيج
ملاحظة: تم تسجيل أشرطة الفيديو باستخدام stereomicroscope في 10X التكبير مع هاماماتسو أرك-R2 كاميرا رقمية C10600-10B وهاماماتسو برامج التصوير PCI بسيط.- بدوره على الكاميرا وبسيط برامج التصوير PCI. انقر على "لايف" للسماح لتعديل أوضاع التصوير.
- إعداد الشروط الفيديو على النحو التالي: كسب = 0؛ ضوء الوضع = السامية. مؤشر السرعة = 1؛ Binning = 2. انقر فوق "تلقائي فضح" ومن ثم ضبط ظروف الإضاءة، والانتقال المرايا المجهر والسطوع والتباين بطلب.
ملاحظة: الفيديو تحتاج إلى وجود تباين عالية دون أن overexposed، بحيث تظهر الحيوانات الأشكال السوداء كما على خلفية مشرقة. - انقر على "الوقت المسح الضوئي" واختيار مجلد واسم ملف. مجموعة "تأخير الميدان" إلى 20 ميللي ثانية و "أوقفوا في وقت" إلى 30 ثانية. اضغط على "مراجعة لايف" من أجل اختيار منطقة من لوحة لتسجيل (حيث معظم الديدان هي). اضغط على لوحة 3 أو 4 مرات على المسرح، بسرعة تأكيد مكانتها في مجال الرؤية واضغط على "ابدأ".
- بعد انتهاء تسجيل الفيلم، انقر بزر الماوس الأيمن على الصورة واختر "تصدير المونتاج تسلسل" لتصدير الفيلم من شكل .cxd لافي.
- تحليل أشرطة الفيديو الحركة
- فتح برنامج يماغيج، انتقل إلى "الإضافات" علامة التبويب، ثم "wrmtrck" وحدد "دفعة wrMTrck". حدد الدليل الذي يحتوي على كافة الملفات ليتم تحليلها.
- في إطار الإدخال الرئيسي للwrMTrck_Batch، تحميل قيم الإدخال على النحو المفصل في شملت رقمالبريد 5C. شرح لكل من المعلمات ويمكن العثور عليها في التعليمات التي تصاحب البرنامج المساعد. انقر على "موافق" والسماح للتشغيل تحليل الحركة.
- إلى الإشراف النتائج والتأكد من أن جميع المسارات الكشف هي من C. الفعلي ايليجانس والقضاء على القطع الأثرية، وفتح كل من ملفات .txt إنشاء كل فيلم ونسخ المعلومات إلى ملف برنامج تحليل البيانات. فتح ملفات "* _labels.zip" خلق وتشغيل الناتجة "* _labels.tif" للتحقق يدويا والقضاء على المسارات دودة كاذبة.
النتائج
مراقبة بيخلوي نشر من البروتينات مثل بريون من قبل في الجسم الحي الوقت الفاصل بين التصوير
المعدلة وراثيا C. خطوط ايليجانس معربا عن المجال بريون بشكل خاص مناسبة تماما لتحليل جوانب معينة من مثل بريون البروتين?...
Discussion
الأساليب المذكورة هنا تساعد على توضيح نشر والخلية معقدة المستقلة وغير المستقلة سمية الخلايا من البروتينات مثل بريون. اكتشفنا مؤخرا أن يؤخذ على عصاري خلوي مجال بريون المعرضة للتجميع ما يصل إلى الحويصلات بغشاء في عملية الالتهام الذاتي ذات الصلة. مجموعة فرعية معينة من...
Disclosures
The authors declare no competing financial interests.
Acknowledgements
We thank Cindy Voisine and Yoko Shibata for helpful discussion and critical comments on the manuscript. We acknowledge the High Throughput Analysis Laboratory (HTAL) and the Biological Imaging Facility (BIF) at Northwestern University for their assistance. This work was funded by grants from the National Institutes of Health (NIGMS, NIA, NINDS), the Ellison Medical Foundation, and the Daniel F. and Ada L. Rice Foundation (to R.I.M.). C.I.N.-K. was supported by the Deutsche Forschungsgemeinschaft (KR 3726/1-1).
Materials
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Nanosphere size standards 100 nm | ThermoScientific | 3100A | |
| Levamisole | Sigma | L-9756 | |
| IPTG | Sigma | 15502-10G | |
| Ahringer RNAi library | Source BioScience LifeSciences | http://www.lifesciences.sourcebioscience .com/clone-products/non-mammalian/c-elegans/c-elegans-rnai-library/ | |
| Equipment | |||
| Sorvall Legend XTR Refrigerated Centrifuge, 120VAC | ThermoScientific | 75004521 | http://www.coleparmer.com/Product/Thermo_Scientific_Sorvall_Legend_ XTR_Refrigerated_Centrifuge_120 VAC/EW-17707-60 |
| 96 pin replicator | Scionomix | http://www.scinomix.com/all-products/96-pin-replicator/ | |
| HiGro high-capacity, incubating shaker | Digilab | http://www.digilabglobal.com/higro | |
| Multidrop Combi Reagent Dispenser | Titertrek | http://groups.molbiosci.northwestern.edu/hta/titertek.htm | |
| Biomek FX AP96 Automated Workstation | Beckman Coulter | http://groups.molbiosci.northwestern.edu/hta/biomek_multi.htm | |
| Innova44 shaker | New Brunswick | http://www.eppendorf.com/int///index.php?sitemap=2.3&pb=d78efbc05310ec 04&action=products&contentid=1& catalognode=83389 | |
| M205 FA | Leica | http://www.leica-microsystems.com/de/produkte/stereomikroskope-makroskope/fluoreszenz/details/product/leica-m205-fa/ | |
| ORCA-R2 C10600-10BDigital CCD camera | Hamamatsu | http://www.hamamatsu.com/jp/en/community/life_science_camera/product/search/C10600-10B/index.html | |
| Spinning Disc AF Confocal Microscope | Leica | http://www.leica-microsystems.com/products/light-microscopes/life-science-research/fluorescence-microscopes/details/product/leica-sd-af/ | |
| Falcon 4M60 camera | Teledyne Dalsa | http://www.teledynedalsa.com/imaging/products/cameras/area-scan/falcon/PT-41-04M60/ | |
| Software | |||
| MetaMorph Microscopy Automation & Image Analysis Software | Molecular Devices | http://www.moleculardevices.com/products/software/meta-imaging-series/metamorph.html | |
| Hamamatsu SimplePCI Image Analysis Software | Meyer Instruments | http://meyerinst.com/imaging-software/hamamatsu/index.htm | |
| ImageJ | NIH | http://rsbweb.nih.gov/ij/download.html | |
| wrMTrck plugin for ImageJ | http://www.phage.dk/plugins/wrmtrck.html | ||
| C. elegans strains | |||
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | http://www.cgc.cbs.umn.edu/strain.php?id=10570 | |
| AM815 rmIs323[myo-3p::sup35(r2e2)::rfp] | Morimoto lab | available from our laboratory | |
| See table 1 for a source for folding sensor and stress reporter strains |
References
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Jarrett, J. T., Lansbury, P. T. Seeding 'one-dimensional crystallization' of amyloid: a pathogenic mechanism in Alzheimer's disease and scrapie. Cell. 73 (6), 1055-1058 (1993).
- Caughey, B., Kocisko, D. A., Raymond, G. J., Lansbury, P. T. Aggregates of scrapie-associated prion protein induce the cell-free conversion of protease-sensitive prion protein to the protease-resistant state. Chem Biol. 2 (12), 807-817 (1995).
- Wickner, R. B. [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae. Science. 264 (5158), 566-569 (1994).
- Chien, P., Weissman, J. S., DePace, A. H. Emerging principles of conformation-based prion inheritance. Annu Rev Biochem. 73, 617-656 (2004).
- Kimberlin, R. H., Walker, C. A. Pathogenesis of mouse scrapie: patterns of agent replication in different parts of the CNS following intraperitoneal infection. J R Soc Med. 75 (8), 618-624 (1982).
- Beekes, M., McBride, P. A., Baldauf, E. Cerebral targeting indicates vagal spread of infection in hamsters fed with scrapie. J Gen Virol. 79 (3), 601-607 (1998).
- Jucker, M., Walker, L. C. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 501 (7465), 45-51 (2013).
- Aguzzi, A. Cell biology: Beyond the prion principle. Nature. 459 (7249), 924-925 (2009).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proc Natl Acad Sci U S A. 96 (8), 4604-4609 (1999).
- Wood, S. J., et al. alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease. J Biol Chem. 274 (28), 19509-19512 (1999).
- Wang, Y. Q., et al. Relationship between prion propensity and the rates of individual molecular steps of fibril assembly. J Biol Chem. 286 (14), 12101-12107 (2011).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 123 (8), 1191-1201 (2010).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Winkler, J., Tyedmers, J., Bukau, B., Mogk, A. Chaperone networks in protein disaggregation and prion propagation. J Struct Biol. 179 (2), 152-160 (2012).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Nussbaum-Krammer, C. I., Morimoto, R. I. Caenorhabditis elegans as a model system for studying non-cell-autonomous mechanisms in protein-misfolding diseases. Dis Model Mech. 7 (1), 31-39 (2014).
- Lino, M. M., Schneider, C., Caroni, P. Accumulation of SOD1 mutants in postnatal motoneurons does not cause motoneuron pathology or motoneuron disease. J Neurosci. 22 (12), 4825-4832 (2002).
- Li, J. Y., et al. Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagation. Nat Med. 14 (5), 501-503 (2008).
- Desplats, P., et al. Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein. Proc Natl Acad Sci U S A. 106 (31), 13010-13015 (2009).
- Clement, A. M., et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice. Science. 302 (5642), 113-117 (2003).
- Gu, X., et al. Pathological cell-cell interactions elicited by a neuropathogenic form of mutant Huntingtin contribute to cortical pathogenesis in HD mice. Neuron. 46 (3), 433-444 (2005).
- Yamanaka, K., et al. Mutant SOD1 in cell types other than motor neurons and oligodendrocytes accelerates onset of disease in ALS mice. Proc Natl Acad Sci U S A. 105 (21), 7594-7599 (2008).
- Garden, G. A., et al. Polyglutamine-expanded ataxin-7 promotes non-cell-autonomous purkinje cell degeneration and displays proteolytic cleavage in ataxic transgenic mice. J Neurosci. 22 (12), 4897-4905 (2002).
- Raeber, A. J., et al. Astrocyte-specific expression of hamster prion protein (PrP) renders PrP knockout mice susceptible to hamster scrapie. EMBO J. 16 (20), 6057-6065 (1997).
- Yazawa, I., et al. Mouse model of multiple system atrophy alpha-synuclein expression in oligodendrocytes causes glial and neuronal degeneration. Neuron. 45 (6), 847-859 (2005).
- Lobsiger, C. S., Cleveland, D. W. Glial cells as intrinsic components of non-cell-autonomous neurodegenerative disease. Nat Neurosci. 10 (11), 1355-1360 (2007).
- Sambataro, F., Pennuto, M. Cell-autonomous and non-cell-autonomous toxicity in polyglutamine diseases. Prog Neurobiol. 97 (2), 152-172 (2012).
- Polymenidou, M., Cleveland, D. W. Prion-like spread of protein aggregates in neurodegeneration. J Exp Med. 209 (5), 889-893 (2012).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 11 (4), 301-307 (2010).
- Braak, H., Braak, E., Bohl, J. Staging of Alzheimer-related cortical destruction. Eur Neurol. 33 (6), 403-408 (1993).
- Meyer-Luehmann, M., et al. Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host. Science. 313 (5794), 1781-1784 (2006).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Clavaguera, F., et al. Transmission and spreading of tauopathy in transgenic mouse brain. Nat Cell Biol. 11 (7), 909-913 (2009).
- Nonaka, T., et al. Prion-like Properties of Pathological TDP-43 Aggregates from Diseased Brains. Cell Rep. 4 (1), 124-134 (2013).
- Lundmark, K., et al. Transmissibility of systemic amyloidosis by a prion-like mechanism. Proc Natl Acad Sci U S A. 99 (10), 6979-6984 (2002).
- Lai, C. H., Chou, C. Y., Ch'ang, L. Y., Liu, C. S., Lin, W. Identification of novel human genes evolutionarily conserved in Caenorhabditis elegans by comparative proteomics. Genome Res. 10 (5), 703-713 (2000).
- Xu, X., Kim, S. K. The early bird catches the worm: new technologies for the Caenorhabditis elegans toolkit. Nat Rev Genet. 12 (11), 793-801 (2011).
- Boulin, T., Hobert, O. From genes to function: the C. elegans genetic toolbox. Wiley Interdiscip Rev Dev Biol. 1 (1), 114-137 (2012).
- Nussbaum-Krammer, C. I., Park, K. W., Li, L., Melki, R., Morimoto, R. I. Spreading of a prion domain from cell-to-cell by vesicular transport in Caenorhabditis elegans. PLoS Genet. 9 (3), e1003351 (2013).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi. Science. 268 (5212), 880-884 (1995).
- Liu, J. J., Lindquist, S. Oligopeptide-repeat expansions modulate 'protein-only' inheritance in yeast. Nature. 400 (6744), 573-576 (1999).
- Halfmann, R., et al. Prions are a common mechanism for phenotypic inheritance in wild yeasts. Nature. 482 (7385), 363-368 (2012).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6 (11), e294 (2008).
- Krammer, C., et al. The yeast Sup35NM domain propagates as a prion in mammalian cells. Proc Natl Acad Sci U S A. 106 (2), 462-467 (2009).
- Hofmann, J. P., et al. Cell-to-cell propagation of infectious cytosolic protein aggregates. Proc Natl Acad Sci U S A. 110 (15), 5951-5956 (2013).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833 (2008).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Shaham, S. Methods in cell biology. Wormbooks. , (2006).
- Kim, E., Sun, L., Gabel, C. V., Fang-Yen, C. Long-term imaging of Caenorhabditis elegans using nanoparticle-mediated immobilization). PLoS One. 8 (1), e53419 (2013).
- Fay, D. Genetic mapping and manipulation: Chapter 1-Introduction and basics. WormBook. , (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Rual, J. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- Kern, A., Ackermann, B., Clement, A. M., Duerk, H., Behl, C. HSF1-controlled and age-associated chaperone capacity in neurons and muscle cells of C. elegans. PLoS One. 5 (1), e8568 (2010).
- Becker, J., Walter, W., Yan, W., Craig, E. A. Functional interaction of cytosolic hsp70 and a DnaJ-related protein, Ydj1p, in protein translocation in vivo. Mol Cell Biol. 16 (8), 4378-4386 (1996).
- Salvaterra, P. M., McCaman, R. E. Choline acetyltransferase and acetylcholine levels in Drosophila melanogaster: a study using two temperature-sensitive mutants. J Neurosci. 5 (4), 903-910 (1985).
- Goloubinoff, P., Mogk, A., Zvi, A. P., Tomoyasu, T., Bukau, B. Sequential mechanism of solubilization and refolding of stable protein aggregates by a bichaperone network. Proc Natl Acad Sci U S A. 96 (24), 13732-13737 (1999).
- Schroder, H., Langer, T., Hartl, F. U., Bukau, B. D. n. a. K. DnaJ and GrpE form a cellular chaperone machinery capable of repairing heat-induced protein damage. EMBO J. 12 (11), 4137-4144 (1993).
- Rampelt, H., et al. Metazoan Hsp70 machines use Hsp110 to power protein disaggregation. EMBO J. 31 (21), 4221-4235 (2012).
- Gupta, R., et al. Firefly luciferase mutants as sensors of proteome stress. Nat Methods. 8 (10), 879-884 (2011).
- Gidalevitz, T., Ben-Zvi, A., Ho, K. H., Brignull, H. R., Morimoto, R. I. Progressive disruption of cellular protein folding in models of polyglutamine diseases. Science. 311 (5766), 1471-1474 (2006).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proc Natl Acad Sci U S A. 106 (35), 14914-14919 (2009).
- Karady, I., et al. Using Caenorhabditis elegans as a model system to study protein homeostasis in a multicellular organism. J Vis Exp. (82), e50840 (2013).
- Gidalevitz, T., Krupinski, T., Garcia, S., Morimoto, R. I. Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity. PLoS Genet. 5 (3), e1000399 (2009).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. J Neurosci. 26 (29), 7597-7606 (2006).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. J Biol Chem. 283 (1), 194-201 (2008).
- Libina, N., Berman, J. R., Kenyon, C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell. 115 (4), 489-502 (2003).
- Schatzl, H. M., et al. A hypothalamic neuronal cell line persistently infected with scrapie prions exhibits apoptosis. J Virol. 71 (11), 8821-8831 (1997).
- Keith, S. A., Amrit, F. R., Ratnappan, R., Ghazi, A. The C. elegans healthspan and stress-resistance assay toolkit. Methods. , (2014).
- Pierce-Shimomura, J. T., et al. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc Natl Acad Sci U S A. 105 (52), 20982-20987 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved