Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исследуя распространение и токсичности прионами как белков с использованием многоклеточных животных модельного организма
В этой статье
Резюме
Prion-like propagation of protein aggregates has recently emerged as being implicated in many neurodegenerative diseases. The goal of this protocol is to describe, how to use the nematode C. elegans as a model system to monitor protein spreading and to investigate prion-like phenomena.
Аннотация
Prions are unconventional self-propagating proteinaceous particles, devoid of any coding nucleic acid. These proteinaceous seeds serve as templates for the conversion and replication of their benign cellular isoform. Accumulating evidence suggests that many protein aggregates can act as self-propagating templates and corrupt the folding of cognate proteins. Although aggregates can be functional under certain circumstances, this process often leads to the disruption of the cellular protein homeostasis (proteostasis), eventually leading to devastating diseases such as Alzheimer’s disease (AD), Parkinson’s disease (PD), Amyotrophic lateral sclerosis (ALS), or transmissible spongiform encephalopathies (TSEs). The exact mechanisms of prion propagation and cell-to-cell spreading of protein aggregates are still subjects of intense investigation. To further this knowledge, recently a new metazoan model in Caenorhabditis elegans, for expression of the prion domain of the cytosolic yeast prion protein Sup35 has been established. This prion model offers several advantages, as it allows direct monitoring of the fluorescently tagged prion domain in living animals and ease of genetic approaches. Described here are methods to study prion-like behavior of protein aggregates and to identify modifiers of prion-induced toxicity using C. elegans.
Введение
Многие нейродегенеративные заболевания, включая болезнь Альцгеймера (AD), болезнь Паркинсона (БП), боковой амиотрофический склероз (ALS), и трансмиссивных губчатых энцефалопатий (ТГЭ), связаны с агрегацией склонны белков и, следовательно, вместе известны как белковых неправильного сворачивания расстройства (PMDS ). ТГЭ или прионные болезни представляют собой уникальный класс PMDS в том, что они могут быть заразными в обоих людей и животных 1. На молекулярном уровне, прионы репликации путем набора и преобразования мономерный α-спираль-богатый узла в кодировке сотовой PrP (PrP C) в патологический β-листа богатой PrP Sc конформации 2,3. Самораспространяющиеся белковые агрегаты были также выявлены в грибах, которые разделяют важные характеристики с прионов млекопитающих 4,5. Кроме того, прионы млекопитающих способны перемещаться из клетки к клетке и заражать наивных клеток 6,7.
В то время как PMDS Othэ чем ТГЭ не заразны, они разделяют общую патогенную принцип с прионами 8,9. Хотя белки, связанные с каждой из PMDS не связаны в структуру или функцию, они все образуют агрегаты с помощью процесса кристаллизации, как называют зарождение и высевали полимеризации; Кроме того белковые семена расти, привлекая их растворимые изоформы 2,10,11. Эффективность на самоопределение распространяться варьируется в естественных условиях, в зависимости от собственных свойств белка, которые вместе с дополнительными клеточных факторов, таких как молекулярных шаперонов в конечном счете, определяют темпы совокупного зарождения, посев, фрагментации и распространения 12-15. Таким образом, должна существовать тонкий баланс между этими факторами, что позволяет эффективно распространение агрегации белков. Это может также объяснить, почему только некоторые амилоидогенные агрегаты убежищем характеристики прионов, и, таким образом, не все PMDS заразны. Прионы, кажется, представляют O 'топ-исполнителей,FA широкий спектр самовоспроизводящихся белковых агрегатов, что делает их мощным инструментом для изучения PMDS 8,13.
Интересно, токсичность, связанная с болезнью, связанные с агрегатами часто имеет автономную компонент не клеток 16,17. Это означает, что они влияют на соседние клетки, которые не экспрессируют соответствующий ген, в отличие от строго клеточно-автономными эффекта, откуда следует, что только клетки, экспрессирующие ген проявляют специфическую фенотип. Это было убедительно продемонстрирована путем экспрессии ткане-специфической или сбить из соответствующих белков в многочисленных моделей нейродегенеративных заболеваний 18-26. Различные механизмы были предложены в качестве основы для этого не-клеточной автономной токсичности в PMDS, в том числе подачи питательных веществ, уменьшается дисбаланс в нейрональной передачи сигналов, глутамат эксайтотоксичности и нейровоспаления 16,27,28. Кроме того, прион, как движение болезни связаны агрегатов между клетками mighт к этому аспекту 29,30. Увеличение данные свидетельствуют о том, что белковые включения других, чем прионов может передаваться от клетки к клетке, которая может объяснить характеристика распространения патологии наблюдается во многих PMDS 30-36. Тем не менее, до сих пор не определена, есть ли ясно причинно-следственная связь между межклеточной движения белков заболевания и токсического действия на соседних клетках. Таким образом, более глубокое понимание клеточных путей, которые лежат в основе передачи от клетки к клетке и без клеток автономный токсичности необходимо и важно для развития новых терапии. Тем не менее, многие аспекты прионов, как распространение и клеточных факторов, которые влияют на клетки к клетке передачи неправильно упакованных белков в многоклеточных не очень хорошо понимал, в частности, на организменном уровне.
Нематода Caenorhabditis Элеганс имеет ряд преимуществ, которые обеспечивают потенциал для открыть для себя новые грани прионов, как spreadiНГ многоклеточных 17. Она прозрачна, что позволяет в естественных условиях отслеживания флуоресцентно меченных белков в живом организме. Кроме того, многие клеточные и физиологические процессы, пострадавших от болезни сохраняются от червей до человека, и С. Elegans также поддаются широкого спектра генетических манипуляций и молекулярных и биохимических анализов 37-39. Ровно 959 соматические клетки составляют взрослых гермафродитом с простым строением тела, что до сих пор имеет несколько различных типов тканей, в том числе мышц, нейроны и кишечника.
Чтобы установить новую модель прионов в С. Элеганс, мы решили экзогенно выразить также характеризуется глутамин / аспарагин (Q / N), обогащенный прионов домена нм цитозольном дрожжи прионного белка Sup35, так как нет никаких известных эндогенные белки прионы в червей 4,40. Прионов дрожжей, внесли неоценимый вклад в выяснении основных механизмов прионов репликации 41-44. Кроме того, нм ельул цитозольный прионов, как белок, который, как было показано резюмировать весь жизненный цикл прионов в культуре клеток млекопитающих 45,46. Кроме того, при выраженной в С Элеганс, домен прионов Sup35 принят на удивление хорошо с различными требованиями к распространению в многоклеточных клеток по сравнению с дрожжевых клеток и выставлены ключевых особенностей прионов биологии агрегации 40. Н.М. было связано с глубоким токсичных фенотипа, в том числе нарушения митохондриального целостности и внешнего вида различные аутофагии, связанные пузырьки на клеточном уровне, а также в зачаточном состоянии и личинок арест, задержка развития, и широко распространено нарушение сворачивания белков среды на организменном уровне. Поразительно, домен прионов обладает клеток автономных и без клеток автономный токсичность, затрагивая соседние ткани, в которой не было высказано трансген. Кроме того, везикулярного транспортного домена прионов внутри и между клетками мониторинг в режиме реального времени В естественных условиях 40.
Здесь мы опишем, как исследовать прионов, как распространение в С Элеганс. Мы расскажем о том, чтобы следить за внутри- и межклеточных транспорт везикул, содержащих домен прионов с помощью покадровой флуоресцентной микроскопии. Подчеркнем, использование тканеспецифических складных датчиков и повсеместно выразил стресс журналистам, чтобы оценить клеток автономных и безалкогольные клеток автономных влияние на клеточный фитнеса. Наконец, мы опишем процедуру недавно проведенного широкого РНК-интерференция (RNAi) экран генома для выявления новых модификаторов прионов, вызванной токсичности. В сочетании, эти методы могут помочь дразнить друг от друга генетические путей, участвующих в межклеточной движения белков и их не клеточной автономной токсичности.
протокол
1. Мониторинг трансцеллюлярного Распространение прионами как белков в естественных условиях ЗАМЕДЛЕННАЯ изображений
ПРИМЕЧАНИЕ: Grow С Elegans дикого типа (WT) (N2) и трансгенные линии в соответствии со стандартными методами и тщательно контролировать температуру выращивания 47.
- Создание трансгенных линий С. Элеганс выражения прионов, как белок, маркированный мономерного красного флуоресцентного белка (MRFP). Смотреть это видео, которое демонстрирует, как использовать микроинъекции 48. Для получения более подробной информации и методов, описывающих, как интегрировать эти внехромосомных линии, см 49.
- Подготовка синхронизированных популяций путем укладки яиц или отбеливания в соответствии со стандартными методами 50.
- Синхронизация с откладки яиц
- Передача 10 - 20 беременные взрослых на тарелку и дайте им откладывают яйца за 1 - 2 часа. Удалить взрослых от пластины, и пусть потомство не растут до желаемого возраста.
- Синхронизация с помощью отбеливания
- Сбор несинхронизированный население беременных взрослых и отбелить их с щелочным раствором гипохлорита (250 мм NaOH и 1: 4 (V / V) разбавления коммерческой отбеливателя в H 2 O). Вымойте яйца в два раза (218 мкг в течение 1 мин) с M9 буфера 47 (21 mMNa 2 HPO 4 · 7H 2 O, 22 mMKH 2 PO 4, 86 mMNaCl, 1 mMMgSO 4 · 7H 2 O, добавьте дН 2 O до 1 л).
- Позвольте им люк в M9 буфера при осторожном перемешивании O / N на 20 ° C. Развитие червь задержать на стадии L1 в отсутствие источника пищи, в результате чего синхронизированный население. Трансфер L1S на свежий нематоды питательной среды, (NGM) Плиты, посеянных с OP50 Е. бактерии кишечной палочки, и пусть потомки не развиться до требуемого возраста 47.
- Синхронизация с откладки яиц
- Подготовка 2% агарозном колодки (в H 2 O) на предметном стекле микроскопа, как описано 50.
- Приготовьте два миcroscope слайды с маркировки ленты размещены по всей их длине, чтобы использовать в качестве прокладок. Поместите третий микроскопа между ними.
- Растворите 2% агарозы в H 2 O и пипетки одну каплю на чистую слайда.
- Поместите четвертый слайд перпендикулярно к трем другим скользит по верхней части агара капли. Аккуратно надавите на него, чтобы сгладить площадку к тому же толщины, как маркировочной лентой.
- Дайте высохнуть в течение 1 мин перед удалением прокладок и осторожно потянув слайды друг от друга. Агар панель будет придерживаться одного из них.
- Внесите ~ 10 мкл анестетика (2 мМ левамизол в M9 буфера) на площадку и передачи ~ 10 животных с использованием платиновой проволоки выбор. Крышка с покровным (~ 22 х 22 мм) и получать изображения в течение 1 часа.
- В качестве альтернативы, чтобы получить фильмы в течение более длительного периода времени, или для дальнейшего снижения вероятности любого движения животных, используют комбинацию анестетика и борта иммобилизации 51.
- Подготовка 10% агавырос колодки (в M9 буфера), как описано 51 и добавить червей до 3 мкл раствора стандартов размеров наносфера (полистирольные шарики, 100 нм) плюс 3 мкл анестезии (4 мМ левамизол в M9 буфера). Обложка осторожно покровным. Чтобы избежать высыхания, печать покровное с VALAP (смесь равных количеств вазелин, ланолин, и парафина).
- Изображение иммобилизованных червей с помощью конфокальной микроскопии.
ПРИМЕЧАНИЕ: Результаты получены с использованием вращающегося диска AF конфокальной микроскопии, оснащенный EM-CCD камеры и микроскопия Автоматизация и анализ изображений программное обеспечение, такое как Метаморф и наметить особенности ниже, но и другие системы, сравнимые конфокальной микроскопии также могут быть использованы.- Используйте масло цели 63x или 100X / 1.4NA и поместите стекло микроскопа, содержащий червей в держатель стекло микроскопа.
- Откройте программное обеспечение. Отрегулируйте мощность лазера и фильтров для работы с изображениями MRFP. Используйте лазер на 561 нм при 10% мощности и выбросов Filter> 600 нм. Открыть "Многомерные Приобретение". На вкладке "Главная", установите флажки для "ИНТЕРВАЛ" и "Run Журналы» (Hardware Auto Focus: OFF).
- На вкладке "Сохранение" выберите или создайте папку директории, где будут сохраняться файлы. Назначьте имя файла.
- На вкладке "длина волны" выберите соответствующий освещение и настройки экспозиции и усиления. Используйте "YokoQuad Red" (или эквивалент установку освещения для изображений MRFP) с экспозицией между 100 и 300 мс и коэффициентом усиления камеры между 100 и 300, в зависимости от конкретного образца (оценивается с помощью живой образ).
- На вкладке "Интервальная" выберите "Кол-во пунктов Time" = 301, "Продолжительность" = 5 мин и "Time / Интервал" = 1 сек.
- Под "Журналы" выберите закладку журнала: "АФК SET Z HOLD" и "АФК Вернуться к Z HOLD", Тип: &# 8220; Специальный "(дважды), начальной точки:" Начало момент времени "и" Конец момент времени ". Этот вариант автофокусом важно, чтобы изображение той же самой секции в течение более длительного периода времени.
- Когда настройка закончена, нажмите "Приобрести". Интервальная видео приберег в виде отдельных файлов в формате TIFF.
- Откройте все .tiff файлов данного временного ряда в ImageJ. Перейти к "Image" → "Стеки" → "Изображения для складирования". По желанию, настроить яркость и контрастность, добавлять размера бар и т.д. Экспорт фильма в разделе "Файл" → "Сохранить как" → "AVI ..." (для примера см Видео 1 и 2, соответствующий рисунку 1).
2. Использование Складные Датчики и стресс Репортеры по расследованию Cell автономный и без клеток автономный влияет на Proteostasis и токсичность
- Создание трансгенных линий, которые coexpress датчик складной или стресс reporteг вместе с прион-подобный белок. Для методов о том, как установить кресты или создания трансгенных линий, см 48,49,52. В таблице 1 приведен список С. штаммы Элеганс, которые могут быть использованы.
- Подготовка синхронизированных популяций трансгенных животных и не растут их до желаемого возраста, как описано выше (раздел 1.2) 50.
- Использование стереомикроскопа, изучить соответствующую фенотип датчика складной или стресс репортера.
- Для датчика складывающиеся, определить количество животных, являющихся носителями агрегатов на каждый день после синхронизации (для примера, рис 2Е и F).
- Для стресс-репортера, проверить, если коэкспрессия прионных, как белка приводит к увеличению флуоресценции репортера (для примера см рисунок 3).
3. Генома экрана по пресечению прионному-индуцированной токсичности в C. Элеганс
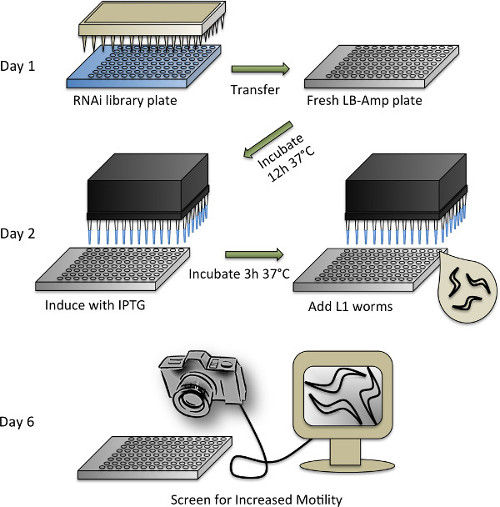
Рисунок 4. Схематическое изображение протокол скрининга RNAi, см. Раздел 3 протокола для подробного описания отдельных этапов.
- Синхронизация С Элеганс червей и дублирование библиотеки РНК-интерференции
- Для экрана РНК-интерференции, использовать библиотеку Ahringer RNAi (или библиотеку Vidal RNAi) 53,54. Rearray библиотеку RNAi из исходного формата 384 а в 96-луночных планшетах при заполнении пластины 100 мкл LB-амп сред (50 мкг / мл ампициллина, в LB) с добавлением 10% глицерина и инокуляции с использованием 96-контактный репликатор. Выращивают при температуре 37 ° CO / N при перемешивании и хранят при -80 ° С.
- Поддержание C. Элеганс WT и трансгенных линий при 20 ° C на НГО пластин затравку OP50 Е. палочки бактерии в соответствии со стандартными методами 47.
- Синхронизация трансгенных домена прионов и WT (контроль) нематод с помощью отбеливания (см раздел 1.2).
- В тот же день, что черви беленой, подготовить LB среде с добавлением 50 мкг / мл ампициллина. Использование автоматизированной реагента дозатор для дозирования (или пипетки вручную) 65 мкл сред LB-Amp в каждую лунку 96-луночного планшета.
- Удалить 96 а библиотечные пластины Ahringer RNAi от -80 ° C и привести их в стерильную капот выстроились с бумажными полотенцами. Немедленно снять уплотнительную-ленту, держа планшет вверх дном, а пластины еще заморожены, будьте осторожны, чтобы избежать загрязнения от льда на внешней стороне пластин. Переворачивания тарелки и пусть таять в течение 30 мин.
- Опустите один стерильный 96-контактный репликатор в одну библиотеку РНК-интерференции пластины, а затем в один свежий LB-усилителя пластины. Использование свежей стерильной репликатор для каждой пластины. Закройте все таблички с клейкой фольги ленты и вернуть библиотечные пластин до -80 ° C. Репликаторы может быть насквозь пропитанной известью, ополаскивают,и выдерживают в автоклаве, чтобы использовать снова.
- Разрешить дублированные RNAi пластины расти O / N в инкубатор до 37 ° С и 300 оборотах в минуту. Для использования HT115 Е. палочка бактерии, несущие пустой вектор (L4440) в качестве контроля, вырастить его отдельно в пробирку, а затем пипеткой 65 мкл культуры с помощью многоканальной пипетки в одну четверть двух 96-луночных планшетах.
- Индукция бактериального дцРНК производства и добавлением червей
- Развести изопропил-β-D-thiogalactopyranosid (IPTG) до концентрации 5 мМ в DDH 2 O. Использование автоматизированное рабочее место с помощью многоканальной головкой для выдачи (или пипетки вручную) 10 мкл разбавленного IPTG в каждую лунку бактерий RNAi и контрольных плит. Плотно закройте и поместите пластины обратно в инкубатор. Пусть встряхивают в течение 3 ч при 37 ° С.
- В то время как бактерии трясутся, подготовить червей. Смешайте M9 / червей, подвеска хорошо, и пипетки небольшой образец (~ 5 - 10 мкл) в предметное стекло микроскопа. Считатьколичество червей под стереомикроскопом и рассчитать количество червей на мкл.
- Использование метода стерилизации, приготовить раствор с добавлением M9 (M9 +) со следующими конечных концентрациях: 0,20 мг / мл IPTG, 8,0 мкг / мл холестерина, 50 мкг / мл ампициллина, 9,6 мкг / мл тетрациклина, 0,0835 мкг / мл Fungizone, и 15 червей в 50 мкл.
- Сделайте отдельные решения для трансгенных домена прионов и WT червей. Конечный объем М9 + червячного раствора, необходимого будет зависеть от количества пластин RNAi скопированных (смотри ниже), а также ~ 30 мл мертвого объема, который будет оставаться в резервуаре, при использовании автоматизированной диспенсер.
- После 3 ч индукции бактериальных дсРНК, возьмите пластины из инкубатора и дайте им остыть до комнатной температуры (~ 30 мин), чтобы избежать тепла подчеркивая животных.
- Разлить по 50 мкл М9 + домена прион трансгенной червь раствора в каждую лунку планшетов RNAi и один из пустых пластин векторного управления. Сделатьобязательно смешать червь раствора перед каждым шагом, как животные, как правило, оседают на дно резервуара.
- Не включать WT червей во второй контрольной пластине. Оставьте пластин незапечатанных, чтобы аэрацию. Чтобы сохранить культуральной жидкости от испарения, стек 4 - 5 пластин вместе и оберните влажным полотенцем бумаги и алюминиевой фольги. Инкубируют при 200 оборотах в минуту при 20 ° С в течение 4 дней.
- Счет
ПРИМЕЧАНИЕ: После 4 дней в инкубаторе, черви будут на второй день совершеннолетия и готовы к экрану. Дай животным приспособиться к некурящих сотрясении в течение 30 мин до проверки, чтобы гарантировать бесперебойную взбучку.- Используя камеру Сокол 4M60, подключенный к компьютеру с помощью монитора, экран визуально для увеличения обмолота по сравнению с контрольными лечение доменных прионов трансгенных животных.
- Составьте список предварительных просмотров, чтобы подтвердить с помощью wrMTrck (смотрите следующий раздел).
4. Подтверждение предварительногоЭкран Просмотров
- Подвижность анализ на твердых плит
- Подготовка пластин с NGM с добавкой 100 мкг / мл ампициллина, 12,5 мкг / мл тетрациклина и 1 мМ IPTG, в соответствии со стандартными методами 47. Если возможно, используйте пластины-заливки машину, чтобы обеспечить все пластины имеют одинаковую высоту СМИ, что позволит более упрощенной процедуре приобретения видео.
- Выращивают различные клоны RNAi в ~ 1 мл LB + 50 мкг / мл ампициллина, O / N при 37 ° С и 250 оборотах в минуту.
- На следующий день, индуцируют экспрессию дцРНК 1 мМ IPTG в течение 3 часов. Семенной пластин с 150 мкл каждой бактериальной клона РНК-интерференции, распространение в тонком слое. Пусть бактерии сухие в течение 2 дней при комнатной температуре в темноте. Подготовьте 3 пластин в РНК-интерференции клона.
- Синхронизация население червя при отбеливании в соответствии со стандартными методами 50 (см раздел 1.2), и пусть яйца люк O / N в М9.
- Возьмем образец червячного суспензии и определения количества NEMatodes в мкл на стереомикроскопом. Затем пипеткой надлежащего объема М9 плюс червей в каждой экспериментальной пластины таким образом, что она содержит 25 - 30 L1 червей. Расти нематод при 20 ° С в течение 4 дней, пока черви не достигнете день 2 взрослости.
- Количественный анализ червя моторики с помощью плагина wrMTrck для ImageJ
ПРИМЕЧАНИЕ: видео были записаны с использованием стереомикроскопа с 10Х с Хамамацу Orca-R2 цифровой камеры C10600-10B и программного обеспечения Простой изображений PCI Хамамацу.- Включите камеру и простое программное обеспечение визуализации PCI. Нажмите на кнопку "Live", чтобы обеспечить изменения условий формирования изображения.
- Настройка видео соблюдении следующих условий: усиление = 0; Light Mode = High; Скорость Index = 1; Биннинг = 2. Щелкните "Auto Expose", а затем настроить условия освещения, перемещения микроскопа зеркала и яркость и контрастность диски.
ПРИМЕЧАНИЕ: видео необходимо иметь высокий контраст, не будучи ПЕРЕЭКСПosed, так что животные появляются в виде черных фигур на светлом фоне. - Нажмите на кнопку "время сканирования" и выберите папку и имя файла. Установите "Поле задержка" на 20 мс и "Остановка на время" 30 сек. Нажмите "Live Обзор", чтобы выбрать область пластины для записи (где большинство червей). Нажмите пластина 3 или 4 раза на сцене, быстро подтвердить свою позицию в поле зрения и нажать кнопку "Старт".
- После фильма завершения записи, щелкните правой кнопкой мыши на изображение и выберите "Экспорт Montage последовательность", чтобы экспортировать фильм из .cxd формата в формате .avi.
- Анализируя моторики видео
- Откройте программное обеспечение ImageJ, перейдите на вкладку "Плагины", затем "wrmtrck" и выберите "wrMTrck партии". Выберите каталог, содержащий все файлы, которые будут проанализированы.
- В главном окне ввода wrMTrck_Batch, загрузите входные значения, как описано в Figurе 5C. Объяснение для каждого из параметров можно найти в инструкции, которые сопровождают плагин. Нажмите "OK", и пусть анализа движения перспективе.
- Курировать результаты и убедиться, что все обнаруженные следы от фактических С Элеганс и ликвидации артефакты, откройте каждый из .txt файлов, созданных для каждого фильма и копировать информацию в файл программного обеспечения для анализа данных. Откройте "* _labels.zip" файлы, созданные и запустить полученный "* _labels.tif", чтобы вручную проверить и устранить ложные червь треков.
Результаты
Мониторинг межклеточные распространения прионных-подобных белков по в естественных условиях покадровой съемки
Трансгенные С. Элеганс линии, экспрессирующие домен прионов, особенно хорошо подходит для анализа некоторых аспектов прионов-подобных бе...
Обсуждение
Способы, описанные здесь помогают проиллюстрировать распространения и клеточное автономным и не клеточно-автономными токсичность прионов-подобных белков. Недавно мы обнаружили, что цитозольный домена прионов агрегации склонны поглощают в мембраносвязанных везикул в процессе аутоф...
Раскрытие информации
The authors declare no competing financial interests.
Благодарности
We thank Cindy Voisine and Yoko Shibata for helpful discussion and critical comments on the manuscript. We acknowledge the High Throughput Analysis Laboratory (HTAL) and the Biological Imaging Facility (BIF) at Northwestern University for their assistance. This work was funded by grants from the National Institutes of Health (NIGMS, NIA, NINDS), the Ellison Medical Foundation, and the Daniel F. and Ada L. Rice Foundation (to R.I.M.). C.I.N.-K. was supported by the Deutsche Forschungsgemeinschaft (KR 3726/1-1).
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Nanosphere size standards 100 nm | ThermoScientific | 3100A | |
| Levamisole | Sigma | L-9756 | |
| IPTG | Sigma | 15502-10G | |
| Ahringer RNAi library | Source BioScience LifeSciences | http://www.lifesciences.sourcebioscience .com/clone-products/non-mammalian/c-elegans/c-elegans-rnai-library/ | |
| Equipment | |||
| Sorvall Legend XTR Refrigerated Centrifuge, 120VAC | ThermoScientific | 75004521 | http://www.coleparmer.com/Product/Thermo_Scientific_Sorvall_Legend_ XTR_Refrigerated_Centrifuge_120 VAC/EW-17707-60 |
| 96 pin replicator | Scionomix | http://www.scinomix.com/all-products/96-pin-replicator/ | |
| HiGro high-capacity, incubating shaker | Digilab | http://www.digilabglobal.com/higro | |
| Multidrop Combi Reagent Dispenser | Titertrek | http://groups.molbiosci.northwestern.edu/hta/titertek.htm | |
| Biomek FX AP96 Automated Workstation | Beckman Coulter | http://groups.molbiosci.northwestern.edu/hta/biomek_multi.htm | |
| Innova44 shaker | New Brunswick | http://www.eppendorf.com/int///index.php?sitemap=2.3&pb=d78efbc05310ec 04&action=products&contentid=1& catalognode=83389 | |
| M205 FA | Leica | http://www.leica-microsystems.com/de/produkte/stereomikroskope-makroskope/fluoreszenz/details/product/leica-m205-fa/ | |
| ORCA-R2 C10600-10BDigital CCD camera | Hamamatsu | http://www.hamamatsu.com/jp/en/community/life_science_camera/product/search/C10600-10B/index.html | |
| Spinning Disc AF Confocal Microscope | Leica | http://www.leica-microsystems.com/products/light-microscopes/life-science-research/fluorescence-microscopes/details/product/leica-sd-af/ | |
| Falcon 4M60 camera | Teledyne Dalsa | http://www.teledynedalsa.com/imaging/products/cameras/area-scan/falcon/PT-41-04M60/ | |
| Software | |||
| MetaMorph Microscopy Automation & Image Analysis Software | Molecular Devices | http://www.moleculardevices.com/products/software/meta-imaging-series/metamorph.html | |
| Hamamatsu SimplePCI Image Analysis Software | Meyer Instruments | http://meyerinst.com/imaging-software/hamamatsu/index.htm | |
| ImageJ | NIH | http://rsbweb.nih.gov/ij/download.html | |
| wrMTrck plugin for ImageJ | http://www.phage.dk/plugins/wrmtrck.html | ||
| C. elegans strains | |||
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | http://www.cgc.cbs.umn.edu/strain.php?id=10570 | |
| AM815 rmIs323[myo-3p::sup35(r2e2)::rfp] | Morimoto lab | available from our laboratory | |
| See table 1 for a source for folding sensor and stress reporter strains |
Ссылки
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Jarrett, J. T., Lansbury, P. T. Seeding 'one-dimensional crystallization' of amyloid: a pathogenic mechanism in Alzheimer's disease and scrapie. Cell. 73 (6), 1055-1058 (1993).
- Caughey, B., Kocisko, D. A., Raymond, G. J., Lansbury, P. T. Aggregates of scrapie-associated prion protein induce the cell-free conversion of protease-sensitive prion protein to the protease-resistant state. Chem Biol. 2 (12), 807-817 (1995).
- Wickner, R. B. [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae. Science. 264 (5158), 566-569 (1994).
- Chien, P., Weissman, J. S., DePace, A. H. Emerging principles of conformation-based prion inheritance. Annu Rev Biochem. 73, 617-656 (2004).
- Kimberlin, R. H., Walker, C. A. Pathogenesis of mouse scrapie: patterns of agent replication in different parts of the CNS following intraperitoneal infection. J R Soc Med. 75 (8), 618-624 (1982).
- Beekes, M., McBride, P. A., Baldauf, E. Cerebral targeting indicates vagal spread of infection in hamsters fed with scrapie. J Gen Virol. 79 (3), 601-607 (1998).
- Jucker, M., Walker, L. C. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 501 (7465), 45-51 (2013).
- Aguzzi, A. Cell biology: Beyond the prion principle. Nature. 459 (7249), 924-925 (2009).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proc Natl Acad Sci U S A. 96 (8), 4604-4609 (1999).
- Wood, S. J., et al. alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease. J Biol Chem. 274 (28), 19509-19512 (1999).
- Wang, Y. Q., et al. Relationship between prion propensity and the rates of individual molecular steps of fibril assembly. J Biol Chem. 286 (14), 12101-12107 (2011).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 123 (8), 1191-1201 (2010).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Winkler, J., Tyedmers, J., Bukau, B., Mogk, A. Chaperone networks in protein disaggregation and prion propagation. J Struct Biol. 179 (2), 152-160 (2012).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Nussbaum-Krammer, C. I., Morimoto, R. I. Caenorhabditis elegans as a model system for studying non-cell-autonomous mechanisms in protein-misfolding diseases. Dis Model Mech. 7 (1), 31-39 (2014).
- Lino, M. M., Schneider, C., Caroni, P. Accumulation of SOD1 mutants in postnatal motoneurons does not cause motoneuron pathology or motoneuron disease. J Neurosci. 22 (12), 4825-4832 (2002).
- Li, J. Y., et al. Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagation. Nat Med. 14 (5), 501-503 (2008).
- Desplats, P., et al. Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein. Proc Natl Acad Sci U S A. 106 (31), 13010-13015 (2009).
- Clement, A. M., et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice. Science. 302 (5642), 113-117 (2003).
- Gu, X., et al. Pathological cell-cell interactions elicited by a neuropathogenic form of mutant Huntingtin contribute to cortical pathogenesis in HD mice. Neuron. 46 (3), 433-444 (2005).
- Yamanaka, K., et al. Mutant SOD1 in cell types other than motor neurons and oligodendrocytes accelerates onset of disease in ALS mice. Proc Natl Acad Sci U S A. 105 (21), 7594-7599 (2008).
- Garden, G. A., et al. Polyglutamine-expanded ataxin-7 promotes non-cell-autonomous purkinje cell degeneration and displays proteolytic cleavage in ataxic transgenic mice. J Neurosci. 22 (12), 4897-4905 (2002).
- Raeber, A. J., et al. Astrocyte-specific expression of hamster prion protein (PrP) renders PrP knockout mice susceptible to hamster scrapie. EMBO J. 16 (20), 6057-6065 (1997).
- Yazawa, I., et al. Mouse model of multiple system atrophy alpha-synuclein expression in oligodendrocytes causes glial and neuronal degeneration. Neuron. 45 (6), 847-859 (2005).
- Lobsiger, C. S., Cleveland, D. W. Glial cells as intrinsic components of non-cell-autonomous neurodegenerative disease. Nat Neurosci. 10 (11), 1355-1360 (2007).
- Sambataro, F., Pennuto, M. Cell-autonomous and non-cell-autonomous toxicity in polyglutamine diseases. Prog Neurobiol. 97 (2), 152-172 (2012).
- Polymenidou, M., Cleveland, D. W. Prion-like spread of protein aggregates in neurodegeneration. J Exp Med. 209 (5), 889-893 (2012).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 11 (4), 301-307 (2010).
- Braak, H., Braak, E., Bohl, J. Staging of Alzheimer-related cortical destruction. Eur Neurol. 33 (6), 403-408 (1993).
- Meyer-Luehmann, M., et al. Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host. Science. 313 (5794), 1781-1784 (2006).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Clavaguera, F., et al. Transmission and spreading of tauopathy in transgenic mouse brain. Nat Cell Biol. 11 (7), 909-913 (2009).
- Nonaka, T., et al. Prion-like Properties of Pathological TDP-43 Aggregates from Diseased Brains. Cell Rep. 4 (1), 124-134 (2013).
- Lundmark, K., et al. Transmissibility of systemic amyloidosis by a prion-like mechanism. Proc Natl Acad Sci U S A. 99 (10), 6979-6984 (2002).
- Lai, C. H., Chou, C. Y., Ch'ang, L. Y., Liu, C. S., Lin, W. Identification of novel human genes evolutionarily conserved in Caenorhabditis elegans by comparative proteomics. Genome Res. 10 (5), 703-713 (2000).
- Xu, X., Kim, S. K. The early bird catches the worm: new technologies for the Caenorhabditis elegans toolkit. Nat Rev Genet. 12 (11), 793-801 (2011).
- Boulin, T., Hobert, O. From genes to function: the C. elegans genetic toolbox. Wiley Interdiscip Rev Dev Biol. 1 (1), 114-137 (2012).
- Nussbaum-Krammer, C. I., Park, K. W., Li, L., Melki, R., Morimoto, R. I. Spreading of a prion domain from cell-to-cell by vesicular transport in Caenorhabditis elegans. PLoS Genet. 9 (3), e1003351 (2013).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi. Science. 268 (5212), 880-884 (1995).
- Liu, J. J., Lindquist, S. Oligopeptide-repeat expansions modulate 'protein-only' inheritance in yeast. Nature. 400 (6744), 573-576 (1999).
- Halfmann, R., et al. Prions are a common mechanism for phenotypic inheritance in wild yeasts. Nature. 482 (7385), 363-368 (2012).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6 (11), e294 (2008).
- Krammer, C., et al. The yeast Sup35NM domain propagates as a prion in mammalian cells. Proc Natl Acad Sci U S A. 106 (2), 462-467 (2009).
- Hofmann, J. P., et al. Cell-to-cell propagation of infectious cytosolic protein aggregates. Proc Natl Acad Sci U S A. 110 (15), 5951-5956 (2013).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833 (2008).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Shaham, S. Methods in cell biology. Wormbooks. , (2006).
- Kim, E., Sun, L., Gabel, C. V., Fang-Yen, C. Long-term imaging of Caenorhabditis elegans using nanoparticle-mediated immobilization). PLoS One. 8 (1), e53419 (2013).
- Fay, D. Genetic mapping and manipulation: Chapter 1-Introduction and basics. WormBook. , (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Rual, J. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- Kern, A., Ackermann, B., Clement, A. M., Duerk, H., Behl, C. HSF1-controlled and age-associated chaperone capacity in neurons and muscle cells of C. elegans. PLoS One. 5 (1), e8568 (2010).
- Becker, J., Walter, W., Yan, W., Craig, E. A. Functional interaction of cytosolic hsp70 and a DnaJ-related protein, Ydj1p, in protein translocation in vivo. Mol Cell Biol. 16 (8), 4378-4386 (1996).
- Salvaterra, P. M., McCaman, R. E. Choline acetyltransferase and acetylcholine levels in Drosophila melanogaster: a study using two temperature-sensitive mutants. J Neurosci. 5 (4), 903-910 (1985).
- Goloubinoff, P., Mogk, A., Zvi, A. P., Tomoyasu, T., Bukau, B. Sequential mechanism of solubilization and refolding of stable protein aggregates by a bichaperone network. Proc Natl Acad Sci U S A. 96 (24), 13732-13737 (1999).
- Schroder, H., Langer, T., Hartl, F. U., Bukau, B. D. n. a. K. DnaJ and GrpE form a cellular chaperone machinery capable of repairing heat-induced protein damage. EMBO J. 12 (11), 4137-4144 (1993).
- Rampelt, H., et al. Metazoan Hsp70 machines use Hsp110 to power protein disaggregation. EMBO J. 31 (21), 4221-4235 (2012).
- Gupta, R., et al. Firefly luciferase mutants as sensors of proteome stress. Nat Methods. 8 (10), 879-884 (2011).
- Gidalevitz, T., Ben-Zvi, A., Ho, K. H., Brignull, H. R., Morimoto, R. I. Progressive disruption of cellular protein folding in models of polyglutamine diseases. Science. 311 (5766), 1471-1474 (2006).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proc Natl Acad Sci U S A. 106 (35), 14914-14919 (2009).
- Karady, I., et al. Using Caenorhabditis elegans as a model system to study protein homeostasis in a multicellular organism. J Vis Exp. (82), e50840 (2013).
- Gidalevitz, T., Krupinski, T., Garcia, S., Morimoto, R. I. Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity. PLoS Genet. 5 (3), e1000399 (2009).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. J Neurosci. 26 (29), 7597-7606 (2006).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. J Biol Chem. 283 (1), 194-201 (2008).
- Libina, N., Berman, J. R., Kenyon, C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell. 115 (4), 489-502 (2003).
- Schatzl, H. M., et al. A hypothalamic neuronal cell line persistently infected with scrapie prions exhibits apoptosis. J Virol. 71 (11), 8821-8831 (1997).
- Keith, S. A., Amrit, F. R., Ratnappan, R., Ghazi, A. The C. elegans healthspan and stress-resistance assay toolkit. Methods. , (2014).
- Pierce-Shimomura, J. T., et al. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc Natl Acad Sci U S A. 105 (52), 20982-20987 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены