Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Metazoan Model Organizma kullanma Serim ve toksisitesi prion-benzeri Proteinler incelenmesi
Bu Makalede
Özet
Prion-like propagation of protein aggregates has recently emerged as being implicated in many neurodegenerative diseases. The goal of this protocol is to describe, how to use the nematode C. elegans as a model system to monitor protein spreading and to investigate prion-like phenomena.
Özet
Prions are unconventional self-propagating proteinaceous particles, devoid of any coding nucleic acid. These proteinaceous seeds serve as templates for the conversion and replication of their benign cellular isoform. Accumulating evidence suggests that many protein aggregates can act as self-propagating templates and corrupt the folding of cognate proteins. Although aggregates can be functional under certain circumstances, this process often leads to the disruption of the cellular protein homeostasis (proteostasis), eventually leading to devastating diseases such as Alzheimer’s disease (AD), Parkinson’s disease (PD), Amyotrophic lateral sclerosis (ALS), or transmissible spongiform encephalopathies (TSEs). The exact mechanisms of prion propagation and cell-to-cell spreading of protein aggregates are still subjects of intense investigation. To further this knowledge, recently a new metazoan model in Caenorhabditis elegans, for expression of the prion domain of the cytosolic yeast prion protein Sup35 has been established. This prion model offers several advantages, as it allows direct monitoring of the fluorescently tagged prion domain in living animals and ease of genetic approaches. Described here are methods to study prion-like behavior of protein aggregates and to identify modifiers of prion-induced toxicity using C. elegans.
Giriş
Alzheimer hastalığı (AD), Parkinson hastalığı (PD), Amyotrofik lateral skleroz (ALS) ve bulaşıcı sünger tipi ansefalopatiler (TSEler) dahil olmak üzere birçok nörodejeneratif hastalıklar, agregasyon eğilimli proteinler ile ilişkili ve dolayısıyla birlikte, protein yanlış katlanması bozuklukları (pmds şekilde bilinmektedir ). Her ikisi de insanlarda ve hayvanlarda 1 enfeksiyona sebep olabilir ki TSEler veya prion hastalıkları pmds benzersiz bir sınıfını teşkil ederler. Moleküler düzeyde, prion alımı ve patolojik β-tabaka zengin PrPSc konformasyonunda 2,3 içine monomerik α-sarmal zengin konak-kodlanmış hücresel PRP (PrP C) dönüştürerek çoğaltmak. Kendi kendine ilerleyen Protein topakları ayrıca memeli prion 4,5 ile önemli özellikleri paylaşan mantarlar içinde tanımlanmıştır. Buna ek olarak, bir memeli, prionlar hücreden hücreye hareket edebilen ve naif hücreleri 6,7 enfekte etmektedir.
Pmds OTH daer TSE'ler bulaşıcı değildir, daha onlar prion hastalıkları 8,9 ile ortak bir patojenik ilke paylaşıyoruz. Pmds her birine bağlı proteinler yapı veya fonksiyonunda ilgili olmasa da, bir kristalleşme gibi süreci ile tüm form agrega çekirdekli denir ya polimerizasyonu numaralı seribaşı; üstelik proteinli tohumlar onların çözünür izoformlarını 2,10,11 işe alarak büyür. öz-yayılmasına verimliliği birlikte, moleküler chaperones gibi ek hücresel faktörlerle sonuçta toplam çekirdeklenme, tohumlama, parçalanma ve 12-15 yayılma oranlarını belirlemek protein içsel özelliklerine bağlı olarak, in vivo değişir. Bu nedenle, protein agregasyonu verimli yayılmasını izin veren bu faktörler arasında ince bir denge bulunmalıdır. Sadece bazı Amiloidojenik agrega bir prion özelliklerini barındıran ve böylece tüm pmds bulaşıcı Bu yüzden de açıklayabilir. Prionlar 'üst-sanatçıların o temsil görünüyorOnlara pmds 8,13 incelemek için güçlü bir araç yapar kendini kopyalayan proteinli agrega fa geniş spektrumlu,.
Ilginç bir hastalıkla ilişkili agrega ile ilişkili toksisite genellikle olmayan bir hücre özerk bileşeni 16,17 sahiptir. Bu durum, sadece hücreler, gen sergilediğini belirli bir fenotip ifade ima katı bir hücre otonom etkisi, aksine, ilgili geni ifade etmeyen komşu hücreleri üzerinde etki anlamına gelir. Bu zorlayıcı dokuya özel ekspresyon gösterdiği veya nörodejeneratif hastalıklar 18-26 çok sayıda model ilgili proteinlerin yıkmak edildi. Çeşitli mekanizmalar azalmış besin kaynağı, nöronal sinyalleşme dengesizlik, glutamat eksitotoksisitesi ve nöro 16,27,28 içeren pmds bu sigara hücrenin otonom toksisite için bir temel olarak önerilmiştir. Buna ek olarak, hücreler arasında hastalığa bağlı agregalar prion-benzeri hareket might Bu açıdan 29,30 katkıda bulunur. Giderek artan kanıtlar, prionlar dışındaki protein inklüzyonlar özelliği de pmds 30-36 gözlenen patolojinin yayılma açıklayabilir, hücreden hücreye iletmek düşündürmektedir. Ancak, henüz hastalık proteinlerin hücreler arası hareket ve komşu hücreler üzerinde toksik etkisi arasında net bir nedensel bağlantı olup olmadığı belirlenecek olan. Bu nedenle, hücre-hücre iletim ve olmayan hücre özerk toksisite altında yatan hücresel yolların daha iyi anlaşılması yeni tedavilerin geliştirilmesi için gerekli ve önemlidir. Bununla birlikte, Metazoan'da olarak yanlış katlanmış proteinler, hücre-hücre iletim etkileyen yayılması ve hücresel faktörlerin prion-benzeri birçok yönü de organizma seviyesinde, özellikle anlaşılamamıştır.
Caenorhabditis elegans nematod potansiyeli sağlamak çeşitli avantajları vardır prion-benzeri SPREADI yeni yüzleri keşfedeceksinizMetazoan'da 17 ng. Bu, in vivo canlı bir organizmada floresan etiketli proteinleri izleme sağlayan saydamdır. Ayrıca, hastalıktan etkilenen birçok hücresel ve fizyolojik süreçler insana solucanlar korunmuş, ve C edilir C. elegans, genetik manipülasyon ve moleküler ve biyokimyasal analizler 37-39 çeşitli elverişlidir. Tam 959 somatik hücreler hala kas, nöronlar ve bağırsak dahil olmak üzere birçok farklı doku tipleri vardır basit bir vücut planına sahip yetişkin hermafrodit makyaj.
C. yeni bir prion modeli kurmak için elegans, biz solucanlar 4,40 bilinen hiçbir endojen prion proteinleri vardır çünkü dışsal olarak, iyi karakterize glutamin / asparagin (Q / N) sitozolik maya prion proteini Sup35 olan bakımından zengin prion alanı NM ifade seçti. Maya prionların prion çoğaltma 41-44 temel mekanizmaların tanıtılması çok değerli olmuştur. Ayrıca, NM FIRmemeli hücre kültüründe 45,46 bir prion tam yaşam döngüsü özetlemek gösterilmiştir st sitosolik prion-benzeri protein. Benzer şekilde, C olarak ifade edildiğinde elegans, mitokondriyal bütünlüğü ve görünüm bozulması dahil 40. NM toplama derin toksik fenotip ile ilişkili maya hücreleri ve prion biyoloji sergilenen temel özellikleri karşılaştırıldığında metazoan hücrelerde yayılması için farklı ihtiyaçlarına oldukça iyi kabul Sup35 prion alanı Hücresel düzeyde çeşitli otofaji ilgili kesecikler, yanı sıra embriyonik ve larva tutuklama, gelişimsel gecikme ve organizma düzeyinde protein katlanması ortamının yaygın bir rahatsızlık. Çarpıcı, prion etki transgen ifade değildi hangi komşu dokuları etkileyen, hücre özerk olmayan hücre özerk toksisite sergiler. Ayrıca, hücreler içinde ve arasında prion etki vesiküler taşıma gerçek zamanlı olarak izlenir in vivo 40.
Burada C prion-benzeri yayılmasını incelemek için nasıl açıklamak elegans. Biz time-lapse floresan mikroskobu kullanarak prion alanı içeren veziküllerin içi ve hücreler arası ulaşım izlemek için nasıl açıklayacağız. Biz doku-spesifik katlama sensörleri kullanımını vurgulamak ve her yerde bulunan hücresel fitness hücre özerk olmayan hücre özerk etkilerini değerlendirmek için stres gazetecilere dile olacaktır. Son olarak, biz prion kaynaklı toksisite yeni değiştiricileri belirlemek için bir süre önce gerçekleştirilen genom RNA enterferans (RNAi) Ekranın prosedürü anlatacağız. Kombinasyon halinde, bu yöntemler, protein arası hareketi ve olmayan hücre otonom toksisite yer genetik yolları ayrı takılmak için yardımcı olabilir.
Protokol
1. İzleme transselüler İn Vivo Time-lapse Görüntüleme By prion-benzeri Proteinlerin Yayılma
NOT: C büyütün standart yöntemlere ve dikkatli bir şekilde kültür sıcaklığı 47 kontrol göre elegans vahşi tip (WT) (N2) ve transgenik çizgiler.
- C transjenik çizgileri oluşturmak elegans monomerik kırmızı floresan proteini (MRFP) ile etiketlenmiş prion proteini gibi, ifade. Mikroenjeksiyon 48 nasıl kullanılacağını gösterir bu videoyu izleyin. Bu ekstrakromozomal satırları nasıl entegre açıklayan Daha detaylı bilgi ve yöntemleri için, 49 bkz.
- Yumurta standart yöntemlere göre 50 döşeme veya ağartıcı senkronize popülasyonlar hazırlayın.
- Yumurtlayarak Senkronizasyon
- Transferi 10-20 gebe bir plaka üzerinde yetişkin ve onları 1 yumurtalarını izin - 2 saat. Plaka yetişkin çıkarın ve döl istenen yaşına kadar büyümesine izin.
Senkronizasyon - Gebe yetişkin eşleşmemiş olan bir popülasyon toplamak ve alkalin hipoklorit çözeltisi (250 mM NaOH ve 1: 2 konumundaki H O ticari ağartıcı 4 (h / h) seyreltme) ile, peroksijen ağartıcıdır. 2 O 7H, 22 mMKH 2 PO 4, 86 mMNaCl, 1 mMMgSO 4 · 7H 2 O, 1 dH 2 O toplayın M9 tampon 47 (21 MMNA 2 HPO 4 · iki kez (218 xg az 1 için) yumurta yıkayın L) sokuldu.
- Bunları 20 ° C / nazik ajitasyon O ile M9 tampon N yumurtadan izin verin. Solucan geliştirme senkronize nüfusu bırakarak, bir besin kaynağı yokluğunda L1 aşamasında tutuklama olacaktır. OP50 E. ile seribaşı taze Nematodu Büyüme Medya (NGM) plakalar üzerine L1S Transferi E. coli bakteri ve döl istenen yaş 47 kadar geliştirmek verelim.
- Yumurtlayarak Senkronizasyon
- 50 tarif edildiği gibi, bir mikroskop lamı üzerine (H2O)% 2 agaroz pedleri hazırlayın.
- İki mil hazırlayınbunların tüm uzunluğu boyunca yerleştirilmiş etiketleme bant ile mikroskop slayt ayırıcılar olarak kullanılır. Aralarında üçüncü bir mikroskop lamı yerleştirin.
- Temiz slayt üzerine H 2 O 2% agaroz ve pipet bir damla eritin.
- Agar damla üstüne diğer üç slaytlar dik dördüncü slayt yerleştirin. Yavaşça etiketleme bant aynı kalınlıkta pedi düzleştirmek için bastırın.
- Aralayıcıları kaldırılması ve hafifçe birbirinden slaytlar çekerek önce 1 dakika kurumaya bırakın. Agar ped bunlardan birine sopa olacak.
- Pipet ~ 10 ul anestezik pedi ve transfer (2 mM levamizol M9 tampon) ~ bir platin tel çekme kullanarak 10 hayvan. Bir kapak kayma (~ 22 x 22 mm) ile kaplayın ve 1 saat içinde görüntüleri almak.
- Seçenek olarak ise, daha uzun bir süre boyunca film elde etmek için ya da daha fazla, hayvanların herhangi bir hareket olasılığını azaltmak anestezi ve boncuk hareketsizleştirme 51 bir arada kullanımı.
- 10% aga hazırlayın(M9 tampon) 51 tarif ve 3 ul Nanokürecikli boyutu standartları çözüm solucanlar (polistiren boncuklar, 100 nm) artı 3 ul anestezik (M9 tampon 4mM Levamizol) ekleyin yastıkları yükseldi. Bir kapak kayma hafifçe örtün. Kuruma önlemek için, valap (vazelin, lanolin ve parafin mumu eşit miktarda karışımı) ile kapak kayma mühür.
- Görüntü konfokal mikroskop kullanılarak solucanlar hareketsiz.
NOT: Sonuçlar bir EM-CCD kamera ve MetaMorph gibi bir Mikroskopi Otomasyon ve Görüntü Analiz Yazılımı ile donatılmış bir İplik Disk AF Konfokal Mikroskobu kullanılarak elde edilen ve aşağıda özelliklerini ana hatlarıyla, ancak diğer karşılaştırılabilir konfokal görüntüleme sistemleri de tercih edilebilir.- 63X veya 100X / 1.4NA yağı hedefi kullanın ve mikroskop lamı tutucuya yerleştirin solucanları içeren mikroskop lamı yerleştirin.
- Yazılımını açın. MRFP görüntüleme için lazer gücü ve filtreleri ayarlayın. % 10 güç ve emisyon filtresi> 600 nm 561 nm lazer kullanın.
- Aç "Çok Boyutlu Toplama". "Ana" sekmesinde, "Timelapse" ve "Run Dergiler" (: kapalı Donanım Otomatik Odaklama) için onay kutularını.
- "Tasarruf" sekmesinde seçmek veya dosyaların kaydedilmesi gereken dizin klasör oluşturun. Dosyaya bir ad atayın.
- "Dalga Boyu" sekmesi altında uygun aydınlatma seçmek ve pozlama ve kazancını ayarlayın. 100 ve 300 ms ve 100 ile 300 arasında bir kamera artışı arasında bir maruz kalma ile "YokoQuad Kırmızı" (ya da MRFP görüntüleme için eşdeğer aydınlatma ayarı) kullanarak, tek tek örnek olarak (canlı görüntü ile değerlendirildi).
- "Timelapse" sekmesi altında "zaman noktalarının sayısı" = 301, "Süre" = 5 dk ve "Zaman / Aralığı" = 1 sn seçin.
- "AFC SET Z TUT" ve "Z TUT için AFC dön", Türü: "Dergiler" sekmesi seçin Journal altında &# 8220; Özel "(iki kez), Başlangıç Noktası:" Başlat zaman noktası "ve" zaman noktası Sonu ". Bu otofokus seçenek görüntünün daha uzun bir süre boyunca aynı bölümü için önemlidir.
- Kurulum tamamlandığında, basın "Acquire". timelapse Video ayrı TIFF dosyaları olarak safed edilir.
- ImageJ belirli bir zaman serisinin tüm .tiff dosyaları açın. "Image" → "Yığınlar" → "Yığınlarına Görüntüler" gidin. İsteğe bağlı olarak, → "File" altında film İhracat, vb boyut çubuğu eklemek, parlaklık ve kontrast ayarı → "AVI ..." "olarak Kaydet" (bir örnek için, Video 1 ve 2 Şekil 1'e tekabül bakın).
2. Özerk ve Non hücre Özerk Proteostasis ve Toksisite Etkileri Hücre Araştırma Katlanır Sensörleri ve Stres Gazeteciler kullanma
- Bir katlama sensörü veya stres önce bildirilmiştir birlikte açığa transgenik hatları oluşturunBirlikte prion-benzeri protein r. Çarpılar kurmak veya transgenik çizgiler oluşturmak için nasıl yöntemler için, 48,49,52 bkz. C listesi için bakınız Tablo 1 kullanılabilir elegans suşu.
- Transgenik hayvanların senkronize popülasyonları hazırlayın ve (bölüm 1.2) 50 yukarıda anlatıldığı gibi istenilen yaşına kadar onları büyümek.
- Bir Stereomikroskopta kullanarak, katlama sensörü veya stres muhabiri ilgili fenotip incelemek.
- Katlama sensörü için, senkronizasyon sonra her gün agrega barındıran hayvanların sayısını belirlemek (bir örnek için, Şekil 2E ve F).
- Stres haberci için, deney habercisinin artmış floresan prion-benzeri protein sonuçları birlikte ekspresyonu (örnek için, bakınız Şekil 3) gösterir.
C. prion kaynaklı zehirlilik Önlenmesi 3. genom Ekran elegans
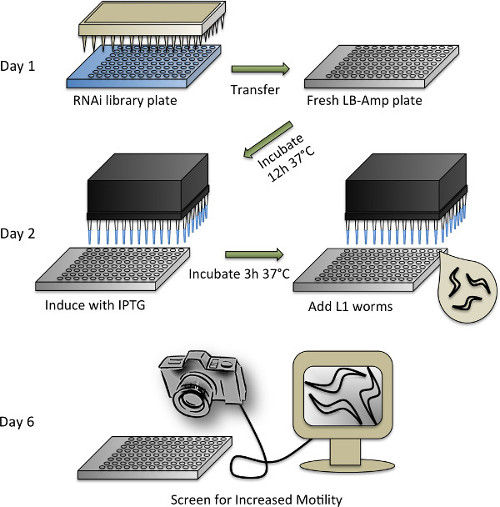
RNAi tarama protokolü 4. şematik gösterimi Şekil. Bireysel adımların ayrıntılı bir açıklama için protokol bölümüne 3 Bkz.
- C. Senkronizasyon elegans solucanlar ve RNAi kütüphane çoğaltılması
- RNAi ekran için, Ahringer RNAi kütüphane (veya Vidal RNAi kütüphanesi) 53,54 kullanın. % 10 gliserol ile takviye edilmiş 100 ul LB-amp ortamı ile plakaları (LB içinde 50 ug / ml ampisilin) doldurarak 96 gözlü levhalar içine, orijinal 384 gözlü formattan RNAi kütüphane Rearray ve 96 pimli çoğaltıcı kullanarak inoküle. -80 ° C'de ajitasyon ve mağaza ile 37 ° CO / N büyür.
- C koruyun elegans WT ve 20 ° C NGM üzerinde plakaları transgenik hatları OP50 E. ile seribaşı standart yöntemlere göre 47 E. coli bakterisi.
- Ağartma tarafından prion etki transgenik ve WT (kontrol) nematod senkronize (bölüm 1.2).
- Solucanlar ağartılmış aynı gün, 50 ug / ml ampisilin ile desteklenmiş LB ortam hazırlar. Dağıtmak için otomatik bir reaktif dağıtıcı kullanma (veya pipet el ile), 96 gözlü bir plakanın her oyuğuna LB-amp ortamının 65 ul.
- -80 ° C den 96 de Ahringer RNAi kütüphane plakaları çıkarın ve kağıt havlu ile kaplı steril bir kaput getirmek. Hemen plakaları hala donmuş ise plakaların dış buz kirlenmesini önlemek için dikkatli olmak, baş aşağı plaka tutarak mühür-bandı çıkarın. Plakaları Reinvert ve bunları yaklaşık 30 dakika çözülme sağlar.
- Bir taze LB-amp plaka içine sonra bir RNAi kütüphane plaka içine bir steril 96 pimli çoğaltıcı batırın ve. Her plaka için taze steril çoğaltıcısının kullanın. Yapışkanlı folyo bant ile tüm plakaları Seal ve -80 ° C kütüphane plakaları dönün. çoğaltıcılar, çamaşır suyu ile ıslatılmış çalkalanabilir,ve tekrar kullanılmak üzere otoklavlanmıştır.
- Çoğaltılmış RNAi plakalar 37 ° C ve 300 rpm'de ayarlanmış bir kuluçka makinesi içinde O / N büyümeye izin verin. HT115 E. kullanmak için E. coli, bir kontrol olarak boş bir vektör (L4440) barındıran bakteri, bir kültür tübü içinde ayrı olarak büyür ve daha sonra iki 96 gözlü levhalar dörtte biri bir çok kanallı pipet ile kültür 65 ul pipetle.
- Bakteriyel dsRNA'nın üretim ve solucanların ilavesinden indüksiyonu
- Ile kombine edilmiştir 2 O içinde bir 5 mM konsantrasyona kadar izopropil-β-D-thiogalactopyranosid (IPTG) seyreltin Dağıtmak için çok kanallı bir kafa ile otomatik bir iş istasyonu kullanarak (veya pipeti el ile) RNAi bakteri ve kontrol plakalarının her bir oyuğuna seyreltildi IPTG 10 ul. Yeniden mühürlemek ve geri kuvöz içine plakaları yerleştirin. Bunların 37 ° C'de 3 saat boyunca sallamak olsun.
- Bakteriler sallayarak iken, solucanlar hazırlamak. Bir cam mikroskop lamı - (10 ul ~ 5) küçük bir örnek de M9 / solucan süspansiyon karıştırın ve pipetle. Saymaksteromikroskopla solucanlar sayısı ve ul başına solucanlar sayısını hesaplamak.
- , 0.20 mg / ml IPTG, 8.0 ug / ml kolesterol 50 ug / ml ampisilin, 9.6 ug / ml tetrasiklin, 0,0835 ug / ml Fungizone, ve: Steril teknik kullanılarak, aşağıdaki nihai konsantrasyonları ile desteklenmiş M9 (M9 +) ihtiva eden bir çözelti hazırlamak 50 ul başına 15 solucanlar.
- Prion etki transgenik ve WT solucanlar için ayrı çözümler olun. Nihai (aşağıya bakınız), kopyalanan RNAi plakalarının sayısına bağlıdır gerekli M9 + solucan çözeltisinin hacmi artı ~ otomatik dağıtıcı kullanılırsa, rezervuar içinde kalır ölü hacim 30 mi.
- Bakteriyel dsRNA'nın üretimi 3 saat indüksiyon sonrası, inkübatör dışına plakaları almak ve onları hayvanlar vurgulayarak ısı önlemek için RT (~ 30 dk) soğumasını bekleyin.
- Her RNAi plakaları kuyu ve boş vektör kontrol plakaları birine 50 ul M9 + prion alanı transgenik solucan çözümü dağıtın. Yapmakhayvanlar rezervuar altına birikme eğiliminde her adımdan önce solucan çözüm karıştırmak için emin olun.
- İkinci kontrol plakasına WT solucanlar dağıtın. Havalandırma sağlamak için mühürsüz plakaları bırakın. 5 tabak ve birlikte nemli bir kağıt havlu ve alüminyum folyo ile sarın - buharlaşan sıvı kültürü korumak için, 4 yığını. 4 gün boyunca 20 ° C'de 200 rpm'de inkübe edin.
- Puanlama
NOT: inkübatör 4 gün sonra, solucanlar yetişkinliğe ikinci gününde olması ve ekran hazır olacaktır. Hayvanlar rahatsız dayak sağlamak için tarama önce 30 dakika süreyle olmayan sallayarak koşullarına uyum edelim.- Kontrol tedavi prion alanı transgenik hayvanlara kıyasla artmış dayak için görsel bir monitör, ekran bir bilgisayara bağlı bir Falcon 4M60 kameranın kullanılması.
- WrMTrck kullanarak onaylamak için ön hit bir listesini derlemek (bir sonraki bölüme bakınız).
Preliminary 4. OnayEkran Hits
- Katı plakalar üzerinde Motilite deneyi
- Standart yöntemlere 47 göre 100 ug / ml ampisilin, 12.5 ug / ml tetrasiklin ve 1 mM IPTG ile takviye NGM ile tabak hazırlayın. Mümkünse, tüm plakalar daha akıcı bir video toplama işlemi için izin verecektir medya aynı yüksekliğe sahip sağlamak için bir plaka dökme makinesi kullanın.
- 37 ° C'de ve 250 rpm'de ~ 1 ml LB + 50 ug / ml ampisilin, O / N farklı RNAi klonlar büyütün.
- Bir sonraki gün, 3 saat süre ile, 1 mM IPTG ile dsRNA'nın ifadesini teşvik eder. Ince bir tabaka halinde yayılır, her RNAi bakteriyel klon 150 ul, plak Tohum. Karanlıkta ve oda sıcaklığında 2 gün boyunca kuru bakteri olsun. RNAi klon başına 3 tabak hazırlayın.
- Standart yöntemler 50 (bölüm 1.2) göre ağartıcı solucan nüfus senkronize ve yumurta ambar O / N M9 medyayı izin.
- Sonsuz bir süspansiyon örneği alın ve NEM miktarını belirlemekstereomikroskopta ul başına atodes. 30 L1 solucanlar - 25 içerecek şekilde Ardından, her deneysel plaka içine M9 artı solucanlar uygun hacmi pipetle. Solucanlar yetişkinliğe gün 2 ulaşana kadar 4 gün boyunca 20 ° C'de nematod büyütün.
- ImageJ için wrMTrck eklentisi ile solucan hareketlilik kantitatif analizi
NOT: Video Hamamatsu Orca-R2, dijital kamera C10600-10B ve Hamamatsu Basit PCI görüntüleme yazılımı ile 10X büyütmede bir skala kullanılarak kaydedildi.- Kamera ve Basit PCI görüntüleme yazılımı açın. Görüntüleme koşulları ayarlanması için izin vermek için "Canlı" üzerine tıklayın.
- Aşağıdaki gibi video koşullarını ayarlayın: Kazanç = 0; Işık Modu = Yüksek; Hız Endeksi = 1; Binning = 2. "Otomatik Açığa" ve ardından mikroskop aynalar ve parlaklık ve kontrast kadranları hareketli, aydınlatma koşulları ayarlayın.
NOT: Video overexp olmadan yüksek kontrast olması gerekirhayvanlar parlak arka plan üzerine siyah şekiller görünür, böylece bırakılmıştı. - "Zaman Scan" seçeneğini tıklayın ve bir klasör ve dosya adını seçin. 20 msn "Alan Gecikmesi" Set ve 30 sn "Zamanda Dur". (Çoğu solucanlar nerede) kaydetmek için plakanın alanı seçmek için basın "Live İnceleme". Görünümü ve basın "Başlat" alanındaki konumunu teyit hızlı, sahnede plaka 3 veya 4 kez dokunun.
- Film kayıt tamamlandıktan sonra, resmin üzerine sağ tıklayın ve bir avi bir .cxd formatta filmi ihracat "İhracat Montaj Sırası" seçin.
- Motilite videoları analiz
- , ImageJ yazılımı açın "Eklentiler" sekmesine gidin, ardından "wrmtrck" ve "wrMTrck Toplu" seçeneğini seçin. Tüm dosyaları içeren dizini seçin analiz edilecek.
- Figür detaylı olarak wrMTrck_Batch ana giriş penceresinde, giriş değerleri yüklemekE 5C. Parametrelerin her biri için açıklama eklentisi eşlik kılavuzunda bulunabilir. "Tamam" ı tıklayın ve hareket analizi çalışmasına izin.
- Sonuçları küratörlüğünü ve algılanan tüm parçaları gerçek C'den onaylamak için elegans ve ortadan kaldırmak eserler, her film için oluşturulan .txt dosyaları her açmak ve bir veri analiz yazılımı dosya bilgileri kopyalayın. Oluşturulan "* _labels.zip" dosyaları açın ve elle kontrol etmek ve yanlış solucan parçaları ortadan kaldırmak için ortaya çıkan "* _labels.tif" çalıştırın.
Sonuçlar
In vivo time-lapse görüntüleme ile prion-benzeri proteinler yayılması hücrelerarası İzleme
Transgenik C. Prion domainini ifade eden C. elegans hatları prion-benzeri proteinler, örneğin, hücreden hücreye intikal olmayan hücre otonom toksisite bazı yönlerinin analizi için özel olarak uygundur. sağlayan floresan izleme hayvanların şeffaflık hayatın her aşamasında canlı organizma içinde proteinlerin etiketledi. Bu ya...
Tartışmalar
Burada tarif edilen yöntemler yayılan göstermek için yardımcı ve prion-benzeri proteinler kompleks hücre otonom olmayan hücre otonom toksisitesi. Son zamanlarda, bir agregasyon eğilimli sitosolik prion alan bir Otofaji ilgili süreç içinde membran-sınırlayıcı kabarcıklar içine alınmış olduğunu keşfettik. Bu vesikül spesifik bir alt kümesi içindeki hücre ve doku 40 ile prion etki taşır. canlı bir hayvanda hareketlerini izlemek için anahtar proteinin, sadece MRFP-etiketli proteinle...
Açıklamalar
The authors declare no competing financial interests.
Teşekkürler
We thank Cindy Voisine and Yoko Shibata for helpful discussion and critical comments on the manuscript. We acknowledge the High Throughput Analysis Laboratory (HTAL) and the Biological Imaging Facility (BIF) at Northwestern University for their assistance. This work was funded by grants from the National Institutes of Health (NIGMS, NIA, NINDS), the Ellison Medical Foundation, and the Daniel F. and Ada L. Rice Foundation (to R.I.M.). C.I.N.-K. was supported by the Deutsche Forschungsgemeinschaft (KR 3726/1-1).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Nanosphere size standards 100 nm | ThermoScientific | 3100A | |
| Levamisole | Sigma | L-9756 | |
| IPTG | Sigma | 15502-10G | |
| Ahringer RNAi library | Source BioScience LifeSciences | http://www.lifesciences.sourcebioscience .com/clone-products/non-mammalian/c-elegans/c-elegans-rnai-library/ | |
| Equipment | |||
| Sorvall Legend XTR Refrigerated Centrifuge, 120VAC | ThermoScientific | 75004521 | http://www.coleparmer.com/Product/Thermo_Scientific_Sorvall_Legend_ XTR_Refrigerated_Centrifuge_120 VAC/EW-17707-60 |
| 96 pin replicator | Scionomix | http://www.scinomix.com/all-products/96-pin-replicator/ | |
| HiGro high-capacity, incubating shaker | Digilab | http://www.digilabglobal.com/higro | |
| Multidrop Combi Reagent Dispenser | Titertrek | http://groups.molbiosci.northwestern.edu/hta/titertek.htm | |
| Biomek FX AP96 Automated Workstation | Beckman Coulter | http://groups.molbiosci.northwestern.edu/hta/biomek_multi.htm | |
| Innova44 shaker | New Brunswick | http://www.eppendorf.com/int///index.php?sitemap=2.3&pb=d78efbc05310ec 04&action=products&contentid=1& catalognode=83389 | |
| M205 FA | Leica | http://www.leica-microsystems.com/de/produkte/stereomikroskope-makroskope/fluoreszenz/details/product/leica-m205-fa/ | |
| ORCA-R2 C10600-10BDigital CCD camera | Hamamatsu | http://www.hamamatsu.com/jp/en/community/life_science_camera/product/search/C10600-10B/index.html | |
| Spinning Disc AF Confocal Microscope | Leica | http://www.leica-microsystems.com/products/light-microscopes/life-science-research/fluorescence-microscopes/details/product/leica-sd-af/ | |
| Falcon 4M60 camera | Teledyne Dalsa | http://www.teledynedalsa.com/imaging/products/cameras/area-scan/falcon/PT-41-04M60/ | |
| Software | |||
| MetaMorph Microscopy Automation & Image Analysis Software | Molecular Devices | http://www.moleculardevices.com/products/software/meta-imaging-series/metamorph.html | |
| Hamamatsu SimplePCI Image Analysis Software | Meyer Instruments | http://meyerinst.com/imaging-software/hamamatsu/index.htm | |
| ImageJ | NIH | http://rsbweb.nih.gov/ij/download.html | |
| wrMTrck plugin for ImageJ | http://www.phage.dk/plugins/wrmtrck.html | ||
| C. elegans strains | |||
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | http://www.cgc.cbs.umn.edu/strain.php?id=10570 | |
| AM815 rmIs323[myo-3p::sup35(r2e2)::rfp] | Morimoto lab | available from our laboratory | |
| See table 1 for a source for folding sensor and stress reporter strains |
Referanslar
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Jarrett, J. T., Lansbury, P. T. Seeding 'one-dimensional crystallization' of amyloid: a pathogenic mechanism in Alzheimer's disease and scrapie. Cell. 73 (6), 1055-1058 (1993).
- Caughey, B., Kocisko, D. A., Raymond, G. J., Lansbury, P. T. Aggregates of scrapie-associated prion protein induce the cell-free conversion of protease-sensitive prion protein to the protease-resistant state. Chem Biol. 2 (12), 807-817 (1995).
- Wickner, R. B. [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae. Science. 264 (5158), 566-569 (1994).
- Chien, P., Weissman, J. S., DePace, A. H. Emerging principles of conformation-based prion inheritance. Annu Rev Biochem. 73, 617-656 (2004).
- Kimberlin, R. H., Walker, C. A. Pathogenesis of mouse scrapie: patterns of agent replication in different parts of the CNS following intraperitoneal infection. J R Soc Med. 75 (8), 618-624 (1982).
- Beekes, M., McBride, P. A., Baldauf, E. Cerebral targeting indicates vagal spread of infection in hamsters fed with scrapie. J Gen Virol. 79 (3), 601-607 (1998).
- Jucker, M., Walker, L. C. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 501 (7465), 45-51 (2013).
- Aguzzi, A. Cell biology: Beyond the prion principle. Nature. 459 (7249), 924-925 (2009).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proc Natl Acad Sci U S A. 96 (8), 4604-4609 (1999).
- Wood, S. J., et al. alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease. J Biol Chem. 274 (28), 19509-19512 (1999).
- Wang, Y. Q., et al. Relationship between prion propensity and the rates of individual molecular steps of fibril assembly. J Biol Chem. 286 (14), 12101-12107 (2011).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 123 (8), 1191-1201 (2010).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Winkler, J., Tyedmers, J., Bukau, B., Mogk, A. Chaperone networks in protein disaggregation and prion propagation. J Struct Biol. 179 (2), 152-160 (2012).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Nussbaum-Krammer, C. I., Morimoto, R. I. Caenorhabditis elegans as a model system for studying non-cell-autonomous mechanisms in protein-misfolding diseases. Dis Model Mech. 7 (1), 31-39 (2014).
- Lino, M. M., Schneider, C., Caroni, P. Accumulation of SOD1 mutants in postnatal motoneurons does not cause motoneuron pathology or motoneuron disease. J Neurosci. 22 (12), 4825-4832 (2002).
- Li, J. Y., et al. Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagation. Nat Med. 14 (5), 501-503 (2008).
- Desplats, P., et al. Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein. Proc Natl Acad Sci U S A. 106 (31), 13010-13015 (2009).
- Clement, A. M., et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice. Science. 302 (5642), 113-117 (2003).
- Gu, X., et al. Pathological cell-cell interactions elicited by a neuropathogenic form of mutant Huntingtin contribute to cortical pathogenesis in HD mice. Neuron. 46 (3), 433-444 (2005).
- Yamanaka, K., et al. Mutant SOD1 in cell types other than motor neurons and oligodendrocytes accelerates onset of disease in ALS mice. Proc Natl Acad Sci U S A. 105 (21), 7594-7599 (2008).
- Garden, G. A., et al. Polyglutamine-expanded ataxin-7 promotes non-cell-autonomous purkinje cell degeneration and displays proteolytic cleavage in ataxic transgenic mice. J Neurosci. 22 (12), 4897-4905 (2002).
- Raeber, A. J., et al. Astrocyte-specific expression of hamster prion protein (PrP) renders PrP knockout mice susceptible to hamster scrapie. EMBO J. 16 (20), 6057-6065 (1997).
- Yazawa, I., et al. Mouse model of multiple system atrophy alpha-synuclein expression in oligodendrocytes causes glial and neuronal degeneration. Neuron. 45 (6), 847-859 (2005).
- Lobsiger, C. S., Cleveland, D. W. Glial cells as intrinsic components of non-cell-autonomous neurodegenerative disease. Nat Neurosci. 10 (11), 1355-1360 (2007).
- Sambataro, F., Pennuto, M. Cell-autonomous and non-cell-autonomous toxicity in polyglutamine diseases. Prog Neurobiol. 97 (2), 152-172 (2012).
- Polymenidou, M., Cleveland, D. W. Prion-like spread of protein aggregates in neurodegeneration. J Exp Med. 209 (5), 889-893 (2012).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 11 (4), 301-307 (2010).
- Braak, H., Braak, E., Bohl, J. Staging of Alzheimer-related cortical destruction. Eur Neurol. 33 (6), 403-408 (1993).
- Meyer-Luehmann, M., et al. Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host. Science. 313 (5794), 1781-1784 (2006).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Clavaguera, F., et al. Transmission and spreading of tauopathy in transgenic mouse brain. Nat Cell Biol. 11 (7), 909-913 (2009).
- Nonaka, T., et al. Prion-like Properties of Pathological TDP-43 Aggregates from Diseased Brains. Cell Rep. 4 (1), 124-134 (2013).
- Lundmark, K., et al. Transmissibility of systemic amyloidosis by a prion-like mechanism. Proc Natl Acad Sci U S A. 99 (10), 6979-6984 (2002).
- Lai, C. H., Chou, C. Y., Ch'ang, L. Y., Liu, C. S., Lin, W. Identification of novel human genes evolutionarily conserved in Caenorhabditis elegans by comparative proteomics. Genome Res. 10 (5), 703-713 (2000).
- Xu, X., Kim, S. K. The early bird catches the worm: new technologies for the Caenorhabditis elegans toolkit. Nat Rev Genet. 12 (11), 793-801 (2011).
- Boulin, T., Hobert, O. From genes to function: the C. elegans genetic toolbox. Wiley Interdiscip Rev Dev Biol. 1 (1), 114-137 (2012).
- Nussbaum-Krammer, C. I., Park, K. W., Li, L., Melki, R., Morimoto, R. I. Spreading of a prion domain from cell-to-cell by vesicular transport in Caenorhabditis elegans. PLoS Genet. 9 (3), e1003351 (2013).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi. Science. 268 (5212), 880-884 (1995).
- Liu, J. J., Lindquist, S. Oligopeptide-repeat expansions modulate 'protein-only' inheritance in yeast. Nature. 400 (6744), 573-576 (1999).
- Halfmann, R., et al. Prions are a common mechanism for phenotypic inheritance in wild yeasts. Nature. 482 (7385), 363-368 (2012).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6 (11), e294 (2008).
- Krammer, C., et al. The yeast Sup35NM domain propagates as a prion in mammalian cells. Proc Natl Acad Sci U S A. 106 (2), 462-467 (2009).
- Hofmann, J. P., et al. Cell-to-cell propagation of infectious cytosolic protein aggregates. Proc Natl Acad Sci U S A. 110 (15), 5951-5956 (2013).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833 (2008).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Shaham, S. Methods in cell biology. Wormbooks. , (2006).
- Kim, E., Sun, L., Gabel, C. V., Fang-Yen, C. Long-term imaging of Caenorhabditis elegans using nanoparticle-mediated immobilization). PLoS One. 8 (1), e53419 (2013).
- Fay, D. Genetic mapping and manipulation: Chapter 1-Introduction and basics. WormBook. , (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Rual, J. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- Kern, A., Ackermann, B., Clement, A. M., Duerk, H., Behl, C. HSF1-controlled and age-associated chaperone capacity in neurons and muscle cells of C. elegans. PLoS One. 5 (1), e8568 (2010).
- Becker, J., Walter, W., Yan, W., Craig, E. A. Functional interaction of cytosolic hsp70 and a DnaJ-related protein, Ydj1p, in protein translocation in vivo. Mol Cell Biol. 16 (8), 4378-4386 (1996).
- Salvaterra, P. M., McCaman, R. E. Choline acetyltransferase and acetylcholine levels in Drosophila melanogaster: a study using two temperature-sensitive mutants. J Neurosci. 5 (4), 903-910 (1985).
- Goloubinoff, P., Mogk, A., Zvi, A. P., Tomoyasu, T., Bukau, B. Sequential mechanism of solubilization and refolding of stable protein aggregates by a bichaperone network. Proc Natl Acad Sci U S A. 96 (24), 13732-13737 (1999).
- Schroder, H., Langer, T., Hartl, F. U., Bukau, B. D. n. a. K. DnaJ and GrpE form a cellular chaperone machinery capable of repairing heat-induced protein damage. EMBO J. 12 (11), 4137-4144 (1993).
- Rampelt, H., et al. Metazoan Hsp70 machines use Hsp110 to power protein disaggregation. EMBO J. 31 (21), 4221-4235 (2012).
- Gupta, R., et al. Firefly luciferase mutants as sensors of proteome stress. Nat Methods. 8 (10), 879-884 (2011).
- Gidalevitz, T., Ben-Zvi, A., Ho, K. H., Brignull, H. R., Morimoto, R. I. Progressive disruption of cellular protein folding in models of polyglutamine diseases. Science. 311 (5766), 1471-1474 (2006).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proc Natl Acad Sci U S A. 106 (35), 14914-14919 (2009).
- Karady, I., et al. Using Caenorhabditis elegans as a model system to study protein homeostasis in a multicellular organism. J Vis Exp. (82), e50840 (2013).
- Gidalevitz, T., Krupinski, T., Garcia, S., Morimoto, R. I. Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity. PLoS Genet. 5 (3), e1000399 (2009).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. J Neurosci. 26 (29), 7597-7606 (2006).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. J Biol Chem. 283 (1), 194-201 (2008).
- Libina, N., Berman, J. R., Kenyon, C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell. 115 (4), 489-502 (2003).
- Schatzl, H. M., et al. A hypothalamic neuronal cell line persistently infected with scrapie prions exhibits apoptosis. J Virol. 71 (11), 8821-8831 (1997).
- Keith, S. A., Amrit, F. R., Ratnappan, R., Ghazi, A. The C. elegans healthspan and stress-resistance assay toolkit. Methods. , (2014).
- Pierce-Shimomura, J. T., et al. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc Natl Acad Sci U S A. 105 (52), 20982-20987 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır