JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
후생 동물 모델 생물을 사용하여 확산 및 독성 프리온 같은 단백질을 조사
요약
Prion-like propagation of protein aggregates has recently emerged as being implicated in many neurodegenerative diseases. The goal of this protocol is to describe, how to use the nematode C. elegans as a model system to monitor protein spreading and to investigate prion-like phenomena.
초록
Prions are unconventional self-propagating proteinaceous particles, devoid of any coding nucleic acid. These proteinaceous seeds serve as templates for the conversion and replication of their benign cellular isoform. Accumulating evidence suggests that many protein aggregates can act as self-propagating templates and corrupt the folding of cognate proteins. Although aggregates can be functional under certain circumstances, this process often leads to the disruption of the cellular protein homeostasis (proteostasis), eventually leading to devastating diseases such as Alzheimer’s disease (AD), Parkinson’s disease (PD), Amyotrophic lateral sclerosis (ALS), or transmissible spongiform encephalopathies (TSEs). The exact mechanisms of prion propagation and cell-to-cell spreading of protein aggregates are still subjects of intense investigation. To further this knowledge, recently a new metazoan model in Caenorhabditis elegans, for expression of the prion domain of the cytosolic yeast prion protein Sup35 has been established. This prion model offers several advantages, as it allows direct monitoring of the fluorescently tagged prion domain in living animals and ease of genetic approaches. Described here are methods to study prion-like behavior of protein aggregates and to identify modifiers of prion-induced toxicity using C. elegans.
서문
알츠하이머 병 (AD), 파킨슨 병 (PD), 근 위축성 측삭 경화증 (ALS) 및 전염성 해면상 뇌증 (TSEs)를 포함한 많은 신경 변성 질환, 응집하기 쉬운 단백질과 연관되어 있고, 따라서 집합 적 단백질 미스 폴딩 장애 (즉 PMD라고도 ). 그들은 모두 인간과 동물 (1)에 감염 될 수 있다는 점에서 TSEs 또는 프리온 질병은 PMD를 독특한 클래스를 구성한다. 분자 수준에서, 프리온은 모집 및 병리학 적 β-시트 풍부한 PRP 사우스 캐롤라이나 형태 2,3에 단량체 α 나선이 풍부한 호스트 인코딩 세포 PRP (PRP C)를 변환하여 복제합니다. 자체 전파 단백질 응집체는 포유 동물의 프리온 4,5으로 중요한 특성을 공유 곰팡이에서 확인되었다. 또한 프리온은 포유류 세포 간에서 이동할 수 있으며 6,7 나이브 세포를 감염.
즉 PMD의 OTH 동안어 TSEs는 전염성이없는 것보다, 그들은 프리온 질환 8,9와 공통 병원성 원칙을 공유 할 수 있습니다. PMD를 각각에 연결된 단백질 구조 또는 기능에 관련되지는 않지만, 그들은 결정화와 같은 과정을 통해 모든 형태의 집계는 핵이라고 또는 중합 시드; 또한 단백질 씨는 수용성 이소 2,10,11 모집에 의해 성장한다. 자기 전파 효율이 함께 같은 분자 샤페론 같은 추가적인 요인 궁극적으로 세포 집합체 핵 시딩 단편화 및 12-15의 확산 속도를 결정하는 단백질의 고유 특성에 따라, 생체 내에서 변화한다. 따라서, 단백질 응집을 효율적으로 전파 할 수 있습니다 이러한 요인들 사이에서 좋은 균형이 존재해야한다. 일부 아밀로이드 응집체가 프리온의 특성을 항구, 따라서 모든 PMD가이 전염성이있는 이유도 설명 할 수 있습니다. 프리온은 '최고의 공연'O를 대표하는 것그들에게 PMD가 8, 13을 연구 할 수있는 강력한 도구를 만드는 자기 복제 단백질 집합체의 FA 다양한 스펙트럼.
흥미롭게도, 질병 관련 집계와 관련된 독성은 종종 비 셀 자율적 인 구성 요소 (16, 17)이있다. 이것은 그들이 단지 세포 유전자 전시에게 특정 표현형을 발현하는 것을 의미 엄격 셀 자율적 효과와는 달리, 해당 유전자를 발현하지 않는 인접 셀에 영향을 미치는 것을 의미한다. 이것은 강력하게 조직 - 특이 적 발현에 의해 증명 또는 신경 퇴행성 질환 18 ~ 26의 다양한 모델의 각 단백질의 노크했다. 다양한 메커니즘 점감 영양 공급, 신경 신호 불균형, 글루타메이트 흥분 독성 (excitotoxicity), 및 신경 염증 16,27,28 포함 PMD가이 비 - 자율적 인 세포 독성의 기초로 제안되어왔다. 또한, 질환 세포 간의 결합 된 응집체의 프리온 같은 운동 might이면 (29, 30)에 기여한다. 증가 증거는 프리온이 아닌 다른 단백질 흠이 특성은 여러 가지 PMD 30-36에서 관찰되는 병리의 확산을 설명 할 수있는 세포 간에서 송신 할 수 있음을 시사한다. 그러나, 아직 질환 단백질의 세포 내 이동 및 이웃 셀에 대한 독성 효과 사이의 명확한 인과 관계가 있는지를 판정해야한다. 따라서, 셀 간 전송 및 비 자율 세포 독성의 기초 세포질 통로의 더 나은 이해는 신규 치료법의 개발이 필요하고 필수적이다. 그러나, 후생 동물에 잘못 접힌 단백질의 세포 간 전송에 영향을 미칠 확산 및 세포 인자 프리온 등의 여러 측면이 아니라 생명체의 수준에서, 특히 이해되지 않습니다.
예쁜 꼬마 선충 선충은 잠재력을 제공하는 몇 가지 장점이 있습니다 프리온 같은 spreadi의 새로운면을 발견후생 동물 17 ng를. 이는 생체가 생체에서의 형광 태그로 단백질을 추적 가능 투명하다. 또한, 질병에 의해 영향을받는 많은 세포 및 생리 학적 과정은 인간에 웜으로부터, 그리고 C.된다 엘레 또한 유전자 조작 및 분자 생화학 적 분석 37 ~ 39의 다양한 의무입니다. 정확히 959 체세포는 여전히 근육, 신경 및 대장 등 여러 가지 별개의 조직 유형을 가지고 간단한 몸 계획을 가지고있는 성인 자웅 동체를 구성합니다.
C. 새로운 프리온 모델을 설정하려면 엘레, 우리는 벌레 4,40에는 알려진 내생 프리온 단백질이 없기 때문에 외생 적, 잘 특징 글루타민 / 아스파라긴 (Q / N) 세포질 효모 프리온 단백질 Sup35의이 풍부한 프리온 도메인 NM을 표현하기로 결정했습니다. 효모 프리온은 프리온 복제 41 ~ 44의 기본 메커니즘을 밝히는데 귀중한왔다. 또한, NM은 전나무이다포유 동물 세포 배양 물 45, 46에서 프리온의 전체 라이프 사이클 요점을 되풀이하는 것으로 나타났다 세포질 성 단백질 프리온 등. 마찬가지로, C로 표시 할 때 엘레, 미토콘드리아 무결성 및 외관의 중단을 포함하여 40. NM 집계가 깊은 독성 표현형와 관련이 효모 세포 프리온 생물학의 전시 주요 기능에 비해 후생 동물 세포에서의 전파에 대한 다양한 요구 사항에 매우 잘 채택 Sup35 프리온 도메인 세포 수준과 관련된 다양한 자식 작용 소체뿐만 아니라 배아와 유충 마비, 발달 지연과 유기체 레벨에 단백질 접힘 환경 교란 광범위. 놀랍게도, 프리온 도메인 유전자가 발현되지 않은 인접 조직에 영향을 미치는 세포 자율 및 비 자율 세포 독성을 나타낸다. 또한, 내부 및 셀간 프리온 도메인 소낭 수송 실시간 모니터링된다 생체 (40).
여기에서 우리는 C.에서 프리온 등의 보급을 검사하는 방법에 대해 설명합니다 엘레. 우리는 시간 경과 형광 현미경을 이용하여 프리온 도메인을 함유 소포 인트라 및 세포 간 수송을 모니터링하는 방법을 설명 할 것이다. 우리는 조직 - 특이 폴딩 센서의 사용을 강조 편재 셀룰러 니스에 셀 자율 및 비 자율 셀에 미치는 효과를 평가하기 위하여, 응력 기자를 표현한다. 마지막으로, 우리는 프리온 - 유도 독성의 새로운 개질제를 식별하기 위해 최근에 수행 넓은 게놈 RNA 간섭 (RNAi의) 화면의 순서를 설명한다. 조합, 이러한 방법은 단백질의 세포 간 이동 및 그 이외의 세포 자율 독성에 관여하는 유전 적 경로를 떨어져 애타게하는 데 도움이 될 수 있습니다.
프로토콜
1. 모니터링 세포 횡단는 생체 시간 경과 영상으로 프리온 같은 단백질의 확산
참고 : C. 성장 표준 방법에 조심스럽게 재배 온도 (47)를 제어에 따라 elegans의 야생형 (WT) (N2)와 유전자 변형 라인.
- C.의 유전자 변형 라인을 생성 엘레 단량체 적색 형광 단백질 (MRFP) 태그 프리온 같은 단백질을 표현. 미세 주입 (48)를 사용하는 방법을 보여줍니다 비디오를 시청. 이러한 염색체 외 라인을 통합하는 방법에 대한 자세한 내용과 방법에 대해서는 49을 참조하십시오.
- 계란은 표준 방법 (50)에 따라 누워 또는 표백에 의해 동기화 인구를 준비합니다.
- 달걀 누워에 의해 동기화
- 전송 10-20 임신하는 접시에 성인들이 1 알을 낳는하자 - 2 시간. 접시에서 어른을 제거하고 자손이 원하는 나이까지 성장 할 수 있습니다.
<표백에 의한 리> 동기화 - 임신하는 성인의 동기화 인구를 수집 및 알칼리 차아 염소산 용액 (250 mM의 NaOH를 1 : H 2 O 상업 표백제의 4 (v / v)로 희석)로 표백. 2 O 7H, 22 mMKH 2 PO 4, 86 mMNaCl, 1 mMMgSO 4 ·가 7H 2 O, 1 dH보다 2 O를 추가 M9 버퍼 (47) (21 mMNa 2 HPO 4 · 회 (218 XG 분 1) 계란을 세척 L).
- 그들이 20 ° C에서 / 부드러운 교반 O와 M9 버퍼에 N을 부화 할 수 있습니다. 웜 개발 동기화 모집단을 떠나고, 음식 공급원의 부재하에 L1 단계에서 정지한다. OP50 E. 시드 신선한 선충 성장 미디어 (NGM) 접시에 L1s로 이동 대장균 박테리아와는 자손이 원하는 나이 47까지 발전 할 수 있습니다.
- 달걀 누워에 의해 동기화
- 50 바와 같이 현미경 슬라이드에 (H 2 O) 2 % 아가로 오스 패드를 준비한다.
- 두 마일 준비그들의 전체 길이에 걸쳐 배치 된 테이프와 라벨 croscope 슬라이드 스페이서로서 이용된다. 그들 사이의 제 3 현미경 슬라이드를 놓습니다.
- 깨끗한 슬라이드에 H 2 O 2 % 아가로 오스와 피펫 한 방울을 녹여.
- 한천 드롭의 상단에있는 세 개의 다른 슬라이드에 수직 네 번째 슬라이드를 놓습니다. 조심스럽게 라벨 테이프와 같은 두께로 패드를 평평를 누르십시오.
- 스페이서를 제거하고 부드럽게 떨어져 슬라이드를 당겨 전에 1 분 동안 말리면. 한천 패드는 그 중 하나에 충실합니다.
- 피펫 ~ 10 μL 마취 패드 및 전송 (2 밀리미터의 levamisole M9 버퍼) ~ 백금 와이어 픽업을 사용하여 10 동물. 커버 슬립 (~ 22 X 22mm)로 덮고 1 시간 내에서 이미지를 가져 가라.
- 대안 적으로, 더 긴 시간 동안 영화를 취득하거나, 또한 동물의 움직임의 가능성을 감소 및 마취제 고정화 비드 (51)의 조합을 사용한다.
- 10 % AGA 준비(M9 버퍼) (51)을 설명하고 3 μL 나노 구체의 크기 표준 솔루션 웜 (폴리스티렌 비즈, 100 ㎚) 플러스 3 μL 마취제 (M9 버퍼에 4 밀리미터의 levamisole)를 추가로 패드를했다. 커버 슬립으로 가볍게 커버. 탈수를 방지하기 위해, VALAP (바셀린, 라놀린, 파라핀 왁스 같은 양의 혼합물)와 커버 슬립을 봉인.
- 이미지는 공 초점 현미경을 사용하여 웜을 고정.
주 : 결과 EM-CCD 카메라와 MetaMorph로부터 같은 현미경 자동화 및 이미지 분석 소프트웨어를 구비 한 스피닝 디스크 AF 공 촛점 현미경을 사용하여 획득하고 아래 구체적인 개요이지만, 다른 유사한 공 초점 영상 시스템도 사용될 수있다.- 63X 또는 100X / 1.4NA 오일 목표를 사용하여 현미경 슬라이드 홀더에 웜을 포함하는 현미경 슬라이드를 놓습니다.
- 소프트웨어를 엽니 다. MRFP 이미징을위한 레이저 파워 및 필터를 조정합니다. 10 %의 전력 및 배출 필터> 600 nm에서 561 nm의 레이저를 사용합니다.
- 열기 "다차원 취득". "메인"탭에서, "어 Timelapse"과 "실행 저널"(: 오프 하드웨어 자동 초점)의 확인란을 선택합니다.
- "저장"탭에서 선택하거나 파일을 저장할 디렉토리 폴더를 만듭니다. 파일에 이름을 지정합니다.
- "파장 길이"탭에서 적절한 조명을 선택하고 노출과 이득을 조정합니다. 100 ~ 300 밀리 초 100과 300 사이의 카메라 이득 사이의 노출 "YokoQuad 레드"(또는 MRFP 이미징 동등한 조명 설정)을 사용하여, 각각의 샘플에 따라 (라이브 이미지를 사용하여 평가).
- "어 Timelapse"탭에서 "시점의 수"= 301, "시간"= 5 분 "시간 / 간격"= 1 초를 선택합니다.
- "AFC SET의 Z의 HOLD"와 "Z의 HOLD에 AFC 반환"유형 : "저널"탭을 선택 저널에서 &# 8220; 특수 "(2 회), 초기 점 :"시작 시간의 점 "과"시점의 끝 ". 이 옵션은 자동 초점 화상 장기간에 걸쳐 동일한 부분에 중요하다.
- 설정을 완료 한 후 "취득". 인터벌 동영상은 별도의 TIFF 파일로 세이프가 걸려있다.
- ImageJ에 주어진 시계열의 모든 .TIFF 파일을 엽니 다. "이미지"→ "스택"→ "스택에 이미지"로 이동합니다. 선택적으로, → "파일"의 영화를 내보내기 등, 크기, 줄을 추가, 밝기 및 대비를 조정 → "AVI ..." "다른 이름으로 저장"(예를 들어, 비디오 1과 2는 그림 1에 해당하는 참조).
2. 자율 및 비 세포 자치가 Proteostasis 및 독성에 미치는 영향 세포를 조사하기 위해 접는 센서 및 스트레스 기자 사용
- 접이식 센서 또는 스트레스 reporte을 같이 발현 형질 전환 라인을 생성함께 프리온 같은 단백질과 R. 십자가를 설정하거나 유전자 변형 라인을 생성하는 방법에 대한 방법에 대해서는, 48,49,52를 참조하십시오. C.의 목록은 표 1을 참조하십시오 사용할 수있는 엘레 균주.
- 형질 전환 동물의 동기 인구를 준비하고 (1.2 절) (50) 전술 한 바와 같이 원하는 세 때까지 성장합니다.
- 실체 현미경을 사용하여 접는 센서 또는 스트레스 기자의 각각의 표현형을 확인합니다.
- 폴딩 센서, 동기 후의 각 날 응집체 은닉 동물의 수를 결정 (예컨대,도 2e 및 F 참조).
- 스트레스 기자를 들어, 테스트 기자의 증가 형광 프리온 같은 단백질 결과의 동시 발현은 (예를 들어, 그림 3 참조)합니다.
C.에서 프리온에 의한 독성의 억제를위한 3 게놈 전체 화면 엘레
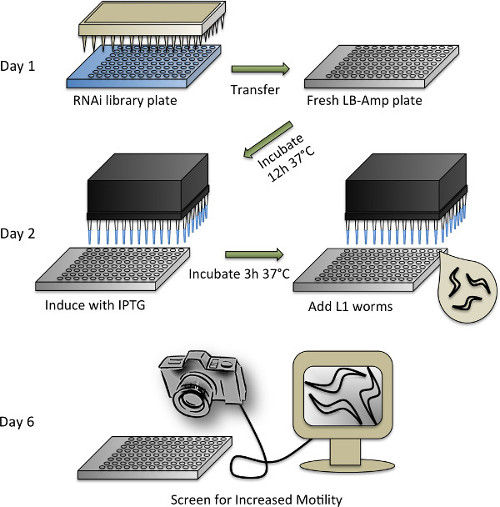
RNAi의 심사 프로토콜의 4 도식 표현 그림. 각 단계에 대한 자세한 설명 프로토콜 (3)을 참조하십시오.
- C.의 동기화 엘레 웜과의 RNAi 라이브러리의 중복
- RNAi의 화면의 경우, Ahringer의 RNAi 라이브러리 (또는 비달의 RNAi 라이브러리) 53, 54을 사용합니다. 10 % 글리세롤 보충 100 μl의 LB-A 미디어와 플레이트 (LB 50 ㎍ / ml의 암피실린)를 작성하여 96 웰 플레이트에 원래 384 웰 형식에서의 RNAi 라이브러리를 Rearray 및 96 핀 복제기를 사용하여 접종. -80 ° C에서 교반 및 저장 37 ° CO / N에서 성장.
- C. 유지 엘레 WT 20 ° C NGM에 플레이트에서 형질 전환 라인은 OP50 E. 시드 표준 방법 (47)에 따라 대장균 박테리아.
- 표백에 의해 프리온 도메인 형질 전환 및 WT (제어) 선충을 동기화 (1.2 절 참조).
- 웜이 표백되는 당일에, 50 ㎍ / ㎖의 앰피 실린이 보충 된 LB 매체를 준비한다. 분배하도록 자동 지급기 시약을 사용하여 (또는 수동 피펫)을 96 웰 플레이트의 각 웰에 LB-A 매체 65 μL.
- -80 ° C에서 96 웰 Ahringer의 RNAi 라이브러리 플레이트를 제거하고 종이 타월로 줄 지어 멸균 후드에 가져. 즉시 플레이트가 계속 동결하는 동안 판의 외부에 얼음에서 오염되지 않도록주의하면서, 거꾸로 접시를 들고하여 밀봉 테이프를 제거합니다. 판을 Reinvert하고 약 30 분 동안 해동 수 있습니다.
- 하나의 신선한 LB-A 플레이트에 다음 하나의 RNAi 라이브러리 플레이트에 한 멸균 96 핀 복제기를 찍어합니다. 각각의 판에 대한 신선한 무균 복제를 사용합니다. 접착 호일 테이프 모든 판을 밀봉 및 -80 ° C에 라이브러리 번호판을 반환합니다. 벌레는 표백제에 담가 세척 할 수있다,다시 사용할 수 있도록 멸균.
- 중복 된 RNAi의 플레이트가 37 ° C, 300 rpm으로 설정 인큐베이터에서 O / N을 성장하도록 허용합니다. HT115 E.을 사용하려면 대장균 컨트롤로 빈 벡터 (L4440)를 숨겨 박테리아, 문화 관에 별도로 성장하고 두 개의 96 웰 플레이트의 1/4에 멀티 채널 피펫 문화의 65 μl를 피펫.
- 박테리아 dsRNA를 생산 및 웜의 첨가 유도
- DDH 2 O.에 5 mM의 농도로 이소 프로필-β-D-thiogalactopyranosid (IPTG)를 희석 분배하도록 멀티 헤드를 사용하여 자동화 된 워크 스테이션 (또는 수동 피펫)의 RNAi 박테리아와 제어 플레이트의 각 웰에 희석 IPTG 10 μL. 다시 봉인 및 인큐베이터에 접시를 배치합니다. 이를 37 ℃에서 3 시간 동안 흔들어 보자.
- 박테리아가 떨고있다 동안, 벌레를 준비합니다. 유리 현미경 슬라이드에 - (10 μL ~ 5) 작은 샘플을 잘 M9 / 웜 현탁액을 혼합하고, 피펫. 계산실체 현미경 벌레의 수와는 μL 당 벌레의 수를 계산한다.
- 0.20 ㎎ / ㎖ IPTG, 8.0 ㎍ / ㎖의 콜레스테롤 50 ㎍ / ml의 암피실린, 9.6 ㎍ / ㎖의 테트라 사이클린 0.0835 ㎍ / ml의 Fungizone을하며 : 무균 기술을 사용하여, 다음의 최종 농도로 보충 M9 (M9 +)의 용액을 제조 50 μL 당 15 벌레.
- 프리온 도메인 형질 전환 및 WT 웜에 대한 별도의 솔루션을합니다. 최종 (아래 참조)의 RNAi 복사 플레이트의 수에 의존 할 필요 M9 + 웜 용액의 부피, 플러스 ~ 자동 디스펜서가 사용되는 경우, 저장소 내에 남아 불감 부피의 30 ㎖.
- 박테리아 dsRNA를 생산의 3 시간 유도 한 후, 인큐베이터에서 접시를 타고 그들이 동물을 강조 열을 피하기 위해 RT (~ 30 분)으로 냉각 할 수 있습니다.
- 각각의 RNAi 판 웰과 빈 벡터 제어 플레이트의 일 50 μL + M9 프리온 유전자 도메인 웜 용액을 분주한다. 확인동물 저장조의 바닥으로 침강하는 경향이 각 공정 전에 웜 용액을 혼합하여주십시오.
- 제 2 제어 플레이트에 WT 웜을 분배. 포기를 할 수 있도록 봉인 판을 둡니다. 5 접시를 함께 젖은 종이 타월 및 알루미늄 호일로 포장 - 증발에서 액체 문화를 유지하기 위해, 4 스택. 4 일 동안 20 ° C에서 200 rpm으로 품어.
- 점수
참고 : 인큐베이터 4 일 후, 웜은 성인의 두 번째 날에하고 화면 준비가됩니다. 동물이 방해받지 래싱을 보장하기 위해 심사 전에 30 분 동안 비 흔들어 조건을 조정할 수 있습니다.- 제어 처리 프리온 도메인 형질 전환 동물에 비해 증가 탈곡 육안 모니터 화면 컴퓨터에 접속 된 콘 4M60 카메라를 사용.
- wrMTrck를 사용하여 확인하는 예비 히트 곡의 목록을 컴파일 (다음 절 참조).
예비 4. 확인화면 조회수
- 고체 접시에 운동성 분석
- 표준 방법 (47)에 따르면, 100 ㎍ / ㎖의 앰피 실린, 12.5 ㎍ / ㎖의 테트라 사이클린 및 1 mM의 IPTG로 보충 NGM와 접시를 준비합니다. 가능하다면, 모든 플레이트가 유선형 영상 획득 과정을 허용 할 미디어의 동일한 높이를 가질 보장 플레이트 주출 기계를 사용한다.
- 37 ° C, 250 rpm에서 ~ 1 ML의 LB + 50 ㎍ / ㎖의 앰피 실린, O / N의 다른 RNAi의 클론 성장.
- 다음날, 3 시간 동안 1 mM의 IPTG로하는 dsRNA의 발현을 유도한다. 얇은 층으로 확산 각각의 RNAi 세균성 클론의 150 μL와 접시를 시드. 어둠 속에서 실온에서 2 일간 건조 박테리아를 보자. RNAi의 클론 당 3 판을 준비합니다.
- 표준 방법 (50) (1.2 절 참조)에 따라 표백하여 웜 인구를 동기화하고, 알이 부화의 O / N M9 미디어를 할 수 있습니다.
- 웜 현탁액을 샘플 및 NEM의 양을 결정실체 현미경에서 μL 당 atodes. 30 L1 웜 -가 (25)가 포함되도록 그런 다음, 각 실험 플레이트에 M9 플러스 웜의 적절한 볼륨을 피펫. 벌레가 성년의 날 2에 도달 할 때까지 4 일 동안 20 ° C에서 선충 성장.
- ImageJ에 대한 wrMTrck 플러그인과 웜 운동의 정량 분석
참고 : 비디오는 하마 오카-R2 디지털 카메라 C10600-10B와 하마 마츠 간단한 PCI 이미징 소프트웨어의 10 배 배율로 실체 현미경을 사용하여 기록 하였다.- 카메라와 간단한 PCI 이미징 소프트웨어를 켭니다. 이미징 조건의 조정을 허용하기 위해 "라이브"를 클릭합니다.
- 다음 영상 조건을 설정 : 게인 = 0; 라이트 모드 = 높은; 속도 지수 = 1; 비닝 = 2. "자동 노출"다음 현미경 거울과 밝기 및 대비 다이얼을 이동, 조명 조건을 조정합니다.
참고 : 비디오는 overexp없이 높은 대비가 필요동물 밝은 배경으로 검은 모양을 나타나도록, osed. - "시간 스캔"을 클릭하고 폴더와 파일 이름을 선택합니다. 20 밀리 초에 "필드 지연"을 설정하고 30 초에 "시간에 정지". (대부분의 웜이 어디에) 기록하는 판의 영역을 선택하기 위하여 눌러 "라이브 리뷰". 보기 "시작"을 누릅니다 분야에서의 위치를 확인 빨리 무대에있는 플레이트에 3 ~ 4 번을 누릅니다.
- 동영상 촬영을 마친 후, 오른쪽 이미지를 클릭 .AVI에 .cxd 형식에서 동영상을 내보낼 "수출 몽타주 시퀀스"를 선택합니다.
- 운동성 비디오를 분석한다
- , ImageJ에 소프트웨어를 열고 "플러그인"탭으로 이동 한 다음 "wrmtrck을"과 "wrMTrck 배치"를 선택합니다. 모든 파일이 들어있는 디렉토리를 선택 분석합니다.
- Figur에 자세히 wrMTrck_Batch의 기본 입력 창에 입력 된 값을로드전자 5C. 각 매개 변수에 대한 설명은 플러그인을 동반 지침에서 찾아 볼 수있다. "OK"를 클릭하고 이동 분석을 실행 할 수 있습니다.
- 결과를 보좌 신부와 감지 된 모든 트랙이 실제 C.에서하는 것을 확인하기 위해 엘레 및 아티팩트 제거, 각각의 동영상에 대해 생성 .txt 파일들 각각을 열고 데이터 분석 소프트웨어 파일에 정보를 복사한다. 만든 "* _labels.zip"파일을 열고 수동으로 확인하고 거짓 웜 트랙을 제거하는 결과 "*의 _labels.tif"를 실행합니다.
결과
생체 시간 경과 영상에 의해 프리온 같은 단백질의 확산 세포 간 모니터링
형질 전환 C. 프리온 도메인을 발현 간스 라인 형상의 프리온 단백질, 예를 들면 세포 간 전송 및 비 자율 세포 독성의 특정 양상의 분석에 특히 적합하다. 수의 형광 추적 동물의 투명성은 삶의 모든 단계에서 생체 내에서 단백질을 태그. 이것의 활용, 세포 형광...
토론
여기에 설명 된 방법은 확산 예시 도와 같은 프리온 단백질의 조립 전지 자율 및 비 독성 세포 자율. 우리는 최근에 집계가 발생하기 쉬운 세포질 프리온 도메인이 자식 작용과 관련된 과정에 막 결합 소포로 흡수되는 것을 발견했다. 이러한 소체의 특정 서브 세트 내에서 세포 및 조직과 40 사이 프리온 도메인을 수송한다. 살아있는 동물에서의 움직임을 모니터링하는 키는 단백질 만 MRFP ...
공개
The authors declare no competing financial interests.
감사의 말
We thank Cindy Voisine and Yoko Shibata for helpful discussion and critical comments on the manuscript. We acknowledge the High Throughput Analysis Laboratory (HTAL) and the Biological Imaging Facility (BIF) at Northwestern University for their assistance. This work was funded by grants from the National Institutes of Health (NIGMS, NIA, NINDS), the Ellison Medical Foundation, and the Daniel F. and Ada L. Rice Foundation (to R.I.M.). C.I.N.-K. was supported by the Deutsche Forschungsgemeinschaft (KR 3726/1-1).
자료
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Nanosphere size standards 100 nm | ThermoScientific | 3100A | |
| Levamisole | Sigma | L-9756 | |
| IPTG | Sigma | 15502-10G | |
| Ahringer RNAi library | Source BioScience LifeSciences | http://www.lifesciences.sourcebioscience .com/clone-products/non-mammalian/c-elegans/c-elegans-rnai-library/ | |
| Equipment | |||
| Sorvall Legend XTR Refrigerated Centrifuge, 120VAC | ThermoScientific | 75004521 | http://www.coleparmer.com/Product/Thermo_Scientific_Sorvall_Legend_ XTR_Refrigerated_Centrifuge_120 VAC/EW-17707-60 |
| 96 pin replicator | Scionomix | http://www.scinomix.com/all-products/96-pin-replicator/ | |
| HiGro high-capacity, incubating shaker | Digilab | http://www.digilabglobal.com/higro | |
| Multidrop Combi Reagent Dispenser | Titertrek | http://groups.molbiosci.northwestern.edu/hta/titertek.htm | |
| Biomek FX AP96 Automated Workstation | Beckman Coulter | http://groups.molbiosci.northwestern.edu/hta/biomek_multi.htm | |
| Innova44 shaker | New Brunswick | http://www.eppendorf.com/int///index.php?sitemap=2.3&pb=d78efbc05310ec 04&action=products&contentid=1& catalognode=83389 | |
| M205 FA | Leica | http://www.leica-microsystems.com/de/produkte/stereomikroskope-makroskope/fluoreszenz/details/product/leica-m205-fa/ | |
| ORCA-R2 C10600-10BDigital CCD camera | Hamamatsu | http://www.hamamatsu.com/jp/en/community/life_science_camera/product/search/C10600-10B/index.html | |
| Spinning Disc AF Confocal Microscope | Leica | http://www.leica-microsystems.com/products/light-microscopes/life-science-research/fluorescence-microscopes/details/product/leica-sd-af/ | |
| Falcon 4M60 camera | Teledyne Dalsa | http://www.teledynedalsa.com/imaging/products/cameras/area-scan/falcon/PT-41-04M60/ | |
| Software | |||
| MetaMorph Microscopy Automation & Image Analysis Software | Molecular Devices | http://www.moleculardevices.com/products/software/meta-imaging-series/metamorph.html | |
| Hamamatsu SimplePCI Image Analysis Software | Meyer Instruments | http://meyerinst.com/imaging-software/hamamatsu/index.htm | |
| ImageJ | NIH | http://rsbweb.nih.gov/ij/download.html | |
| wrMTrck plugin for ImageJ | http://www.phage.dk/plugins/wrmtrck.html | ||
| C. elegans strains | |||
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | http://www.cgc.cbs.umn.edu/strain.php?id=10570 | |
| AM815 rmIs323[myo-3p::sup35(r2e2)::rfp] | Morimoto lab | available from our laboratory | |
| See table 1 for a source for folding sensor and stress reporter strains |
참고문헌
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Jarrett, J. T., Lansbury, P. T. Seeding 'one-dimensional crystallization' of amyloid: a pathogenic mechanism in Alzheimer's disease and scrapie. Cell. 73 (6), 1055-1058 (1993).
- Caughey, B., Kocisko, D. A., Raymond, G. J., Lansbury, P. T. Aggregates of scrapie-associated prion protein induce the cell-free conversion of protease-sensitive prion protein to the protease-resistant state. Chem Biol. 2 (12), 807-817 (1995).
- Wickner, R. B. [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae. Science. 264 (5158), 566-569 (1994).
- Chien, P., Weissman, J. S., DePace, A. H. Emerging principles of conformation-based prion inheritance. Annu Rev Biochem. 73, 617-656 (2004).
- Kimberlin, R. H., Walker, C. A. Pathogenesis of mouse scrapie: patterns of agent replication in different parts of the CNS following intraperitoneal infection. J R Soc Med. 75 (8), 618-624 (1982).
- Beekes, M., McBride, P. A., Baldauf, E. Cerebral targeting indicates vagal spread of infection in hamsters fed with scrapie. J Gen Virol. 79 (3), 601-607 (1998).
- Jucker, M., Walker, L. C. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 501 (7465), 45-51 (2013).
- Aguzzi, A. Cell biology: Beyond the prion principle. Nature. 459 (7249), 924-925 (2009).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proc Natl Acad Sci U S A. 96 (8), 4604-4609 (1999).
- Wood, S. J., et al. alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease. J Biol Chem. 274 (28), 19509-19512 (1999).
- Wang, Y. Q., et al. Relationship between prion propensity and the rates of individual molecular steps of fibril assembly. J Biol Chem. 286 (14), 12101-12107 (2011).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 123 (8), 1191-1201 (2010).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Winkler, J., Tyedmers, J., Bukau, B., Mogk, A. Chaperone networks in protein disaggregation and prion propagation. J Struct Biol. 179 (2), 152-160 (2012).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Nussbaum-Krammer, C. I., Morimoto, R. I. Caenorhabditis elegans as a model system for studying non-cell-autonomous mechanisms in protein-misfolding diseases. Dis Model Mech. 7 (1), 31-39 (2014).
- Lino, M. M., Schneider, C., Caroni, P. Accumulation of SOD1 mutants in postnatal motoneurons does not cause motoneuron pathology or motoneuron disease. J Neurosci. 22 (12), 4825-4832 (2002).
- Li, J. Y., et al. Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagation. Nat Med. 14 (5), 501-503 (2008).
- Desplats, P., et al. Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein. Proc Natl Acad Sci U S A. 106 (31), 13010-13015 (2009).
- Clement, A. M., et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice. Science. 302 (5642), 113-117 (2003).
- Gu, X., et al. Pathological cell-cell interactions elicited by a neuropathogenic form of mutant Huntingtin contribute to cortical pathogenesis in HD mice. Neuron. 46 (3), 433-444 (2005).
- Yamanaka, K., et al. Mutant SOD1 in cell types other than motor neurons and oligodendrocytes accelerates onset of disease in ALS mice. Proc Natl Acad Sci U S A. 105 (21), 7594-7599 (2008).
- Garden, G. A., et al. Polyglutamine-expanded ataxin-7 promotes non-cell-autonomous purkinje cell degeneration and displays proteolytic cleavage in ataxic transgenic mice. J Neurosci. 22 (12), 4897-4905 (2002).
- Raeber, A. J., et al. Astrocyte-specific expression of hamster prion protein (PrP) renders PrP knockout mice susceptible to hamster scrapie. EMBO J. 16 (20), 6057-6065 (1997).
- Yazawa, I., et al. Mouse model of multiple system atrophy alpha-synuclein expression in oligodendrocytes causes glial and neuronal degeneration. Neuron. 45 (6), 847-859 (2005).
- Lobsiger, C. S., Cleveland, D. W. Glial cells as intrinsic components of non-cell-autonomous neurodegenerative disease. Nat Neurosci. 10 (11), 1355-1360 (2007).
- Sambataro, F., Pennuto, M. Cell-autonomous and non-cell-autonomous toxicity in polyglutamine diseases. Prog Neurobiol. 97 (2), 152-172 (2012).
- Polymenidou, M., Cleveland, D. W. Prion-like spread of protein aggregates in neurodegeneration. J Exp Med. 209 (5), 889-893 (2012).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 11 (4), 301-307 (2010).
- Braak, H., Braak, E., Bohl, J. Staging of Alzheimer-related cortical destruction. Eur Neurol. 33 (6), 403-408 (1993).
- Meyer-Luehmann, M., et al. Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host. Science. 313 (5794), 1781-1784 (2006).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Clavaguera, F., et al. Transmission and spreading of tauopathy in transgenic mouse brain. Nat Cell Biol. 11 (7), 909-913 (2009).
- Nonaka, T., et al. Prion-like Properties of Pathological TDP-43 Aggregates from Diseased Brains. Cell Rep. 4 (1), 124-134 (2013).
- Lundmark, K., et al. Transmissibility of systemic amyloidosis by a prion-like mechanism. Proc Natl Acad Sci U S A. 99 (10), 6979-6984 (2002).
- Lai, C. H., Chou, C. Y., Ch'ang, L. Y., Liu, C. S., Lin, W. Identification of novel human genes evolutionarily conserved in Caenorhabditis elegans by comparative proteomics. Genome Res. 10 (5), 703-713 (2000).
- Xu, X., Kim, S. K. The early bird catches the worm: new technologies for the Caenorhabditis elegans toolkit. Nat Rev Genet. 12 (11), 793-801 (2011).
- Boulin, T., Hobert, O. From genes to function: the C. elegans genetic toolbox. Wiley Interdiscip Rev Dev Biol. 1 (1), 114-137 (2012).
- Nussbaum-Krammer, C. I., Park, K. W., Li, L., Melki, R., Morimoto, R. I. Spreading of a prion domain from cell-to-cell by vesicular transport in Caenorhabditis elegans. PLoS Genet. 9 (3), e1003351 (2013).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi. Science. 268 (5212), 880-884 (1995).
- Liu, J. J., Lindquist, S. Oligopeptide-repeat expansions modulate 'protein-only' inheritance in yeast. Nature. 400 (6744), 573-576 (1999).
- Halfmann, R., et al. Prions are a common mechanism for phenotypic inheritance in wild yeasts. Nature. 482 (7385), 363-368 (2012).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6 (11), e294 (2008).
- Krammer, C., et al. The yeast Sup35NM domain propagates as a prion in mammalian cells. Proc Natl Acad Sci U S A. 106 (2), 462-467 (2009).
- Hofmann, J. P., et al. Cell-to-cell propagation of infectious cytosolic protein aggregates. Proc Natl Acad Sci U S A. 110 (15), 5951-5956 (2013).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833 (2008).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Shaham, S. Methods in cell biology. Wormbooks. , (2006).
- Kim, E., Sun, L., Gabel, C. V., Fang-Yen, C. Long-term imaging of Caenorhabditis elegans using nanoparticle-mediated immobilization). PLoS One. 8 (1), e53419 (2013).
- Fay, D. Genetic mapping and manipulation: Chapter 1-Introduction and basics. WormBook. , (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Rual, J. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- Kern, A., Ackermann, B., Clement, A. M., Duerk, H., Behl, C. HSF1-controlled and age-associated chaperone capacity in neurons and muscle cells of C. elegans. PLoS One. 5 (1), e8568 (2010).
- Becker, J., Walter, W., Yan, W., Craig, E. A. Functional interaction of cytosolic hsp70 and a DnaJ-related protein, Ydj1p, in protein translocation in vivo. Mol Cell Biol. 16 (8), 4378-4386 (1996).
- Salvaterra, P. M., McCaman, R. E. Choline acetyltransferase and acetylcholine levels in Drosophila melanogaster: a study using two temperature-sensitive mutants. J Neurosci. 5 (4), 903-910 (1985).
- Goloubinoff, P., Mogk, A., Zvi, A. P., Tomoyasu, T., Bukau, B. Sequential mechanism of solubilization and refolding of stable protein aggregates by a bichaperone network. Proc Natl Acad Sci U S A. 96 (24), 13732-13737 (1999).
- Schroder, H., Langer, T., Hartl, F. U., Bukau, B. D. n. a. K. DnaJ and GrpE form a cellular chaperone machinery capable of repairing heat-induced protein damage. EMBO J. 12 (11), 4137-4144 (1993).
- Rampelt, H., et al. Metazoan Hsp70 machines use Hsp110 to power protein disaggregation. EMBO J. 31 (21), 4221-4235 (2012).
- Gupta, R., et al. Firefly luciferase mutants as sensors of proteome stress. Nat Methods. 8 (10), 879-884 (2011).
- Gidalevitz, T., Ben-Zvi, A., Ho, K. H., Brignull, H. R., Morimoto, R. I. Progressive disruption of cellular protein folding in models of polyglutamine diseases. Science. 311 (5766), 1471-1474 (2006).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proc Natl Acad Sci U S A. 106 (35), 14914-14919 (2009).
- Karady, I., et al. Using Caenorhabditis elegans as a model system to study protein homeostasis in a multicellular organism. J Vis Exp. (82), e50840 (2013).
- Gidalevitz, T., Krupinski, T., Garcia, S., Morimoto, R. I. Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity. PLoS Genet. 5 (3), e1000399 (2009).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. J Neurosci. 26 (29), 7597-7606 (2006).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. J Biol Chem. 283 (1), 194-201 (2008).
- Libina, N., Berman, J. R., Kenyon, C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell. 115 (4), 489-502 (2003).
- Schatzl, H. M., et al. A hypothalamic neuronal cell line persistently infected with scrapie prions exhibits apoptosis. J Virol. 71 (11), 8821-8831 (1997).
- Keith, S. A., Amrit, F. R., Ratnappan, R., Ghazi, A. The C. elegans healthspan and stress-resistance assay toolkit. Methods. , (2014).
- Pierce-Shimomura, J. T., et al. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc Natl Acad Sci U S A. 105 (52), 20982-20987 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유