A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Electrochemically وBioelectrochemically المستحث استعادة الأمونيوم
In This Article
Summary
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Abstract
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Introduction
استرداد قيمة من منتجات مياه الصرف الصحي مكاسب أهمية عندما تصبح الموارد القيمة النادرة والعلاج دون الانتعاش لا يمثل سوى تكلفة. يحتوي كل من مياه الصرف الصحي الطاقة والمواد الغذائية التي يمكن استردادها، واستعادة المواد الغذائية يمكن أن يساعد على إغلاق حلقة إنتاج 1. استعادة الطاقة من خلال الهضم اللاهوائي هو عملية راسخة، في حين استعادة مغذيات التربة أقل شيوعا. وقد تم التحقيق استرداد المغذيات من مجاري النفايات السائلة مثل البول والروث على نطاق واسع، على سبيل المثال، من خلال إنتاج ستروفايت وتجريد مباشر من الأمونيا 2،3. ومع ذلك، فإن الحاجة إلى إضافة الكيميائية هو الجانب السلبي من هذه العمليات 4. هنا نقدم تقنية لاستعادة العناصر الغذائية الموجبة من مجاري النفايات، بما في ذلك كل من البوتاسيوم والأمونيوم. شكل الموجبة من هذه المواد الغذائية يسمح الانتعاش باستخدام غشاء انتقائي أيون في نظام الكهروكيميائية. في هذه الحالة، electrochemicويتكون نظام آل من غرفة الأنود (حيث يأخذ مكان الأكسدة)، وغرفة الكاثود (حيث يأخذ تخفيض مكان) وأيون غشاء انتقائي للفصل بين المقصورات. يتم تطبيق الجهد عبر الخلية لإنتاج تدفق التيار من القطب الموجب إلى القطب السالب. يمكن إنشاء هذا الجهد من مصدر طاقة خارجي لدفع الأكسدة المائية وردود الفعل التخفيض. بدلا من ذلك أكسدة انوديك، على سبيل المثال، المواد العضوية، ويمكن أن يحفزه البكتيريا electroactive، والتي تتطلب طاقة أقل. ليغلق الدائرة والحفاظ على التوازن تهمة، يجب على الأنواع اتهم تهاجر بين الأقطاب لكل إلكترون ولدت. وبالتالي يمكن نقل الأمونيوم من غرفة إلى غرفة الأنود الكاثود عبر غشاء تبادل الأيونات الموجبة (CEM) تعويض تدفق الإلكترونات 4،5.
تقنية المعروضة هنا ليس فقط يزيل الأمونيوم من مجاري النفايات، ولكن يمكن أيضا انتعاشها. مجموع نيتروجين الأمونيا (TAN) موجود في توازن كلا عمونالبوتاسيوم (NH 4 +) والأمونيا (NH 3)، ويعتمد على درجة الحموضة ودرجة الحرارة 6. NH 4 + غير متوفرة بكثرة نظرا لارتفاع تركيز TAN وبالقرب الرقم الهيدروجيني محايدة في غرفة الأنود وهذا النوع موجبة الشحنة وبالتالي يمكن أن تكون مدفوعة من قبل التيار عبر CEM في غرفة الكاثود. التيار يدفع الحد من الماء عند الكاثود، مما يؤدي إلى إنتاج أيونات الهيدروكسيد وغاز الهيدروجين. التحولات التوازن TAN إلى ما يقرب من 100٪ NH 3 نظرا لارتفاع درجة الحموضة في غرفة الكاثود (> 10.0). NH 3 هو الغاز الذي يمكن نقله بسهولة عن طريق دوران الهواء من وحدة تجريد لعمود الامتصاص حيث المحاصرين عليه وتتركز في محلول حامض.
هذه التكنولوجيا لديه القدرة على تقليل سمية الأمونيوم أثناء الهضم اللاهوائي للتيارات-N الغنية مثل السماد، وبالتالي زيادة استعادة الطاقة من مجاري النفايات تلك، بينما في وقت واحدالمواد الغذائية يتعافى 4. ويمكن أيضا استخراج الكهروكيميائية وbioelectrochemical الامونيوم تطبيقها كما تقنية الانتعاش المغذيات على مجاري النفايات ذات المحتوى العالي TAN مثل البول وبالتالي تجنب تكاليف إزالة المغذيات في محطات معالجة مياه الصرف 7.
بروتوكول المعروضة هنا يمكن أن تكون بمثابة أساس لكثير من التجارب الكهروكيميائية وbioelectrochemical مختلفة، ونحن استخدام مفاعل وحدات. تختلف أنواع القطب، والأغشية وسمك إطار يمكن الجمع كما هو موضح في بروتوكول أدناه. والهدف الرئيسي من البروتوكول هو توفير وسيلة للمقارنة من الانتعاش الأمونيوم الكهروكيميائية والانتعاش الأمونيوم الحيوية الكهروكيميائية باستخدام خلية التحليل الكهربائي. يتم تقييم النظم من حيث كفاءة الاستخراج، ومدخلات الطاقة والتكاثر.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. تجميع مفاعل وتوصيل وحدات تجريد والاستيعاب
- جمع كل المواد اللازمة لبناء المفاعل: الأقطاب الكهربائية، وإطارات والمطاط (انظر قائمة المواد). قطع بعناية جميع اجزاء لنفس الأبعاد لتجنب التسريبات في حين تجميع المفاعل.
- الحفر في المقصورات مفاعل لتناسب الذكور إلى موصل الذكور. حفر حفرة إضافي واحد في منتصف الجانب واحدة من المقصورات مفاعل لتناسب القطب المرجعية.
- إعداد مخزون من 1 MH 2 SO 4 للعمود الامتصاص. زيادة هذا التركيز عند الضرورة لاستيعاب حمولات أعلى من الأمونيا.
- تأكد من أن الغشاء سابقة التجهيز وفقا لتعليمات الشركة الصانعة. يمهد للمعالجة شعر الكربون القطب عن طريق نقع عليه في 2 ملي CTAB (المنظفات) لمدة 3 دقائق. شطف الكربون شعرت بالماء المنزوع المعادن 8. الأنود مستقر للتجارب الكهروكيميائية لا تتطلب العلاقات العامةetreatment.
- كومة من اجزاء مختلفة من أجل مفاعل وفقا لنوع المفاعل. لمفاعل حيوي: البرسبيكس endplate والمطاط والفولاذ المقاوم للصدأ جامع الحالي، ورأى الجرافيت سابقة التجهيز، البرسبيكس حجرة المفاعل، والمطاط، وتبادل الأيونات الموجبة الغشاء، والمطاط، والمواد الفاصل، غير القابل للصدأ شبكة من الصلب الكهربائي، والمطاط، والبرسبيكس مفاعل مقصورة، والمطاط، البرسبيكس endplate
- كومة من أجزاء المفاعل لخلية كهروكيميائية على النحو التالي: البرسبيكس endplate، والمطاط، IROX الأنود من خلال endplate، البرسبيكس مفاعل مقصورة، والمطاط، هل، والمطاط، وتبادل الأيونات الموجبة الغشاء، والمطاط، والمواد الفاصل، غير القابل للصدأ شبكة من الصلب الكهربائي، والمطاط، ومفاعل البرسبيكس مقصورة، والمطاط، البرسبيكس endplate.
- استخدام تفلون لاغلاق منافذ اتصال من المفاعل. وضع القطب المرجعية في نفس المكان الذي فيه القطب العمل: الأنود في حالة وجود خلية bioelectrochemical، القطب السالب أو الموجب في حالة وجود خلية كهروكيميائية.
- استخدام المكسرات ومسامير لإغلاق المفاعل. تشديد البراغي على طرفي نقيض لمعادلة الضغط. لا تستخدم أدوات لإغلاق هذا المفاعل على أصابع ضيق يكفي لضمان وجود مفاعل مغلقة تماما.
- ملء مفاعل بالماء لاختبار إذا المفاعل هو مجانا للتسرب. إذا ظهرت تسريبات، معرفة ما اذا كان يتم شد البراغي بما فيه الكفاية أو إذا كان أحد أجزاء المفاعل انتقل حين تجميع المفاعل. إذا تم الكشف عن أي تسرب، تفريغ المياه من المفاعل.
- إضافة حلقات Raschig في كل من قطاع غزة وامتصاص عمود لملء الأعمدة في منتصف الطريق.
- معايرة معدل تدفق جميع المضخات. توصيل الأعلاف وإعادة تدوير مضخات للمفاعل ومضخة الهواء إلى وحدات تجريد وامتصاص (الشكل 1). تقليل طول أنابيب قدر الإمكان.
- ملء العمود امتصاص مع 250 مل من 1 MH 2 SO 4، ينبغي أن تغطية حلقات Raschig. تأكد من أن مجرى الهواء يختلط الحامض بشكل جيد عندما يتم تشغيل المضخة على. زيادة أو تقليل حجم حامض على أساس تصميم العمود ومضخة الهواء قدرة تجريد.

الشكل 1. الإعداد مفاعل لنظام bioelectrochemical تمكين استخراج الأمونيوم. ويعمل النظام المعروضة هنا في الوضع المستمر. خطوط الصلبة تمثل تدفق السائل، والخطوط المنقطة تمثل تدفق الغاز. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
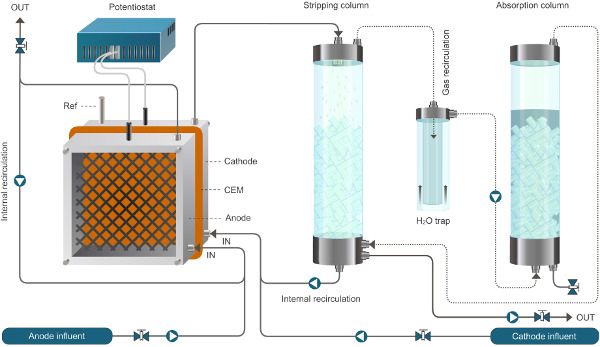
الشكل 2. الإعداد مفاعل لنظام bioelectrochemical تمكين استخراج الأمونيوم. ويعمل النظام المعروضة هنا في الوضع المستمر. خطوط الصلبة تمثل تدفق السائل، والخطوط المنقطة تمثل تدفق الغاز.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
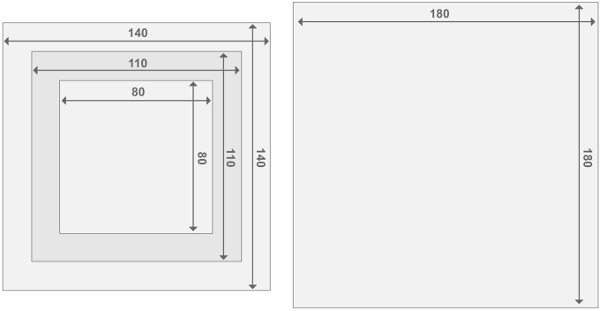
الشكل 3. تصميم الأطر مفاعل البرسبيكس. ويتألف كل مفاعل مفاعلين endplate و 2 حجرات المفاعل. جميع أجزاء لها سماكة 2 سم. تفاصيل بشأن حجم المواد الأخرى يمكن العثور عليها في قائمة المواد. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
2. Bioanode استخراج مدفوعة
- إعداد وسائل الإعلام.
- إعداد anolyte للمفاعل حيوي كما هو موضح في الجدول رقم 1 9. زيادة تركيز الأمونيوم في المتوسط إلى تقليد تيار النفايات النيتروجين الغنية.
- لتخزين ميديأم قبل استخدامها، الأوتوكلاف المتوسطة لضمان عدم استنزاف مصدر الكربون من خلال التلوث. إعداد الفيتامينات والعناصر النزرة، وفقا للجدول (1) وإضافة بعد التعقيم والتبريد المتوسط.
- تدفق المتوسطة من خلال تطهير مع غاز النيتروجين لمدة 30 دقيقة على الأقل لإزالة الأكسجين. للقيام بذلك، اضافة الى وجود أنبوب أو الإبرة في المتوسط وبدوره على تيار غاز النيتروجين.
- يعد حل موصل كما كهرل مهبطي. في هذه الحالة، استخدم 0.1 M كلوريد الصوديوم للسماح إنتاج الكاوية.
| عنصر | كمية | ||
| نا 2 هبو 4 | 6 ز / L | ||
| KH 2 PO 4 | 3 ز / L | ||
| كلوريد الصوديوم | 0.5 غرام / L | ||
| NH 4 الكلورين | 0.5 غرام / L | ||
| MgSO 4 · 7H 2 O | 0.1 غرام / L | ||
| CaCl 2 · 2H 2 O الحل (14.6 غرام / L) | 1 مل | ||
| خلات الصوديوم | 2 ز / L (لبدء التشغيل) | ||
| العناصر النزرة | 1 مل | ||
| حل فيتامين | 1 مل | ||
| العناصر النزرة (1،000x) | ز / L | الفيتامينات (1،000x) | ز / L |
| كوكلي 2 | 0.1 | البيوتين | 0.004 |
| نا 2 وزارة النفط 4 .2H 2 O | 0.01 | حمض الفوليك | 0.004 |
| H 3 BO 3 | 0.01 | البيريدوكسين هيدروكلوريد | 0.02 |
| 2 ملغ كلور 2 .6H 2 O | 3 | الريبوفلافين | 0.01 |
| ZnCl 2 | 0.1 | هيدروكلوريد الثيامين | 0.01 |
| CaCl 2 .2H 2 O | 0.1 | حمض النيكوتينيك | 0.01 |
| كلوريد الصوديوم | 1 | بانتوثينات DL-الكالسيوم | 0.01 |
| nitrilotriacetic الحمضيه | 1.5 | فيتامين B12 | 0.0002 |
| AlCl 3 .6H 2 O | 0.01 | ص حمض -aminobenzoic | 0.01 |
| CuCl 2 | 0.01 | يبويك (thioctic) حمض | 0.01 |
| FeCl 2 | 0.1 | ميو -inositol | 0.01 |
| MnCl 2 .2H 2 O | 0.5 | كلوريد الكولين | 0.01 |
| ضبط درجة الحموضة إلى 6.5 باستخدام KOH | نياسيتاميد | 0.01 | |
| هيدروكلوريد بيريدكسال | 0.01 | ||
| أسكوربات الصوديوم | 0.01 |
الجدول 1. Anolyte تكوين لاستخراج الأمونيوم الحيوي الأنود مدفوعة.
- تلقيح من مفاعل حيوي
ملاحظة: العمل في ظروف معقمة ليس من الضروري لهذه مفاعل حيوي، كما يستخدم ثقافة اللقاح المختلط والظروف المفاعل سوف نختار الكائنات electroactive محددة.- تحضير اللقاح. لهذا مفاعل حيوي، وإعداد 30 مل خليط من النفايات السائلة من المفاعلات الحيوية اللاهوائية النشطة بما في ذلك تخميروbioanode، وهو هاضم اللاهوائية و / أو مياه الصرف الصحي الخام. جمع الخليط في حقنة.
- توصيل الغاز حقيبة مليئة N 2 إلى زجاجة anolyte من اجل الحفاظ على الضغط مستقرة مع عدم السماح للأكسجين للدخول. مزيج مصدر اللقاح مع حجم anolyte (هنا، و 100 مل من anolyte لمدة 30 مل من مصدر اللقاح) عن طريق إفراغ الحقنة مع اللقاح في زجاجة المتوسطة. تأكد من الحصول على حجم اللازمة لملء الأنود.
- باستخدام حقنة، وملء الأنود والكاثود مقصورة في وقت واحد مع حلول كل منهما. توصيل الغاز حقيبة مليئة N 2 إلى زجاجة anolyte بحيث يمكن إزالة الحل anolyte من خلال منفذ أخذ العينات دون إدخال الأوكسجين. إغلاق المنفذ عينة مع الصنبور بين التحويلات.
ملاحظة: إجراء هذه الخطوة مع زميل له للتأكد من أن تمتلئ كل من المقصورات المفاعل في وقت واحد. - عندما تمتلئ كل من المقصورات المفاعل، بدوره علىمضخة تدوير بمعدل إعادة تدوير ما يقرب من 6 L / ساعة.
- قم بتوصيل كابل potentiostat مع الأقطاب الثلاثة، وذلك باستخدام الأنود كما القطب العمل. ضع القطب المرجعية في الأنود.
- التبديل على potentiostat في وضع chronoamperometry باستخدام برنامج potentiostat. تحديد إمكانية الأنود ثابت من -200 بالسيارات مقابل حج / أجكل.
- تشغيل مفاعل المستمر لاستخراج الأمونيوم
ملاحظة: مع تطور بيوفيلم، سيتم إنتاجها الحالي مع استهلاك خلات. ونتيجة لنضوب خلات، سوف ينخفض التيار (انظر القسم النتائج، الشكل 3).- للتغيير إلى تغذية مستمرة، والتبديل على مضخة تغذية للالأنود والكاثود. وسرعة مضخة تحديد وقت الإقامة الهيدروليكي (HRT). هنا وتشغيل المفاعل في HRT من 6 ساعات.
- تشغيل مضخة الهواء من الشريط وامتصاص الوحدة. إعادة توزيع الهواء في حلقة مغلقة، أو تداول فيحلقة مفتوحة باستخدام الهواء المحيط. تدفق التكوين الهواء يمكن أن تؤثر على كفاءة الامتصاص.
- تحديث متوسطة ثلاث مرات في الأسبوع. إعداد anolyte الطازجة وكهرل مهبطي كما هو موضح في الخطوات 2.1.1-2.1.4.
- بعد هذه الخطوات، ونعلق على حقيبة مليئة الغاز N 2 إلى زجاجة تغذية مغلقة، ووقف مضخة تغذية، ووضع المشبك على خط مؤثر، تبديل زجاجات القديمة والجديدة، وأخيرا إزالة المشابك وإعادة تشغيل المضخة.
- في كل مرة يتم تحديث تغذية، تأخذ 5 مل العينات السائلة من النفايات السائلة ومؤثر من anolyte وكهرل مهبطي لقياس الموصلية، ودرجة الحموضة ومحتوى خلات وتركيز الأمونيوم.
- عند تغيير الأعلاف، وأيضا أخذ عينة 3 مل من عمود امتصاص لمراقبة درجة الحموضة وللتحليل TAN. عندما يقترب الأس الهيدروجيني 4، استبدال ماصة مع الطازجة 1 M حل حامض الكبريتيك لضمان كفاءة امتصاص عالية.
- لان التيار ستزيد أولا ثم تصل إلى الهضبة، وقياس الآسلا تسبب المحتوى تيت في anolyte مؤثر والنفايات السائلة لضمان ذلك عن طريق الحد الكربون: تركيزات خلات في النفايات السائلة anolyte أقل من 100 ملغ / L تشير الحد الكربون. زيادة تركيز خلات في الأعلاف في هذه الحالة (الجدول 2).
- وإذا لم يحدث استقرار الحالي بنسبة القيود خلات، زيادة تدريجية في تركيز الأمونيوم في الأعلاف، والانتظار لتحقيق الاستقرار للتيار من أجل تقييم كفاءة الاستخراج (الجدول 3).
ملاحظة: كما يتم زيادة تركيز الأمونيوم، وسمية الأمونيا والموصلية عالية الطعن في بيوفيلم وسوف تيار إسقاط في نهاية المطاف نتيجة لذلك.
| مرة | كمية من خلات الصوديوم تضاف إلى علف الأنود (ز / L) |
| اليوم 0 - 35 يوم | 2 |
| 3 | |
| يوم 37 - 51 يوم | 4 |
| يوم 51 - 61 يوم | 5 |
الجدول 2. تركيز خلات الصوديوم في anolyte لاستخراج الأمونيوم bioanode مدفوعة.
| مرة | كمية NH 4 HCO 3 تضاف إلى علف الأنود (ز / L) | مرحلة |
| اليوم 0 - 16 يوم | 2.26 | أنا |
| يوم 16 - 26 يوم | 4.5 | II |
| يوم 26 - 33 يوم | 9 | III |
| يوم 33 - 40 يوم | 14.1 | IV |
| يوم 40 - 47 يوم | 20 | V |
| يوم 47 - 54 يوم | 25.4 | VI |
| يوم 54 - 63 يوم | 31 | VII |
الجدول 3. تركيز الأمونيوم في anolyte لاستخراج الأمونيوم bioanode مدفوعة. وأشار مراحل على الرسم البياني الكثافة الحالية (الشكل 2).
3. الكهروكيميائية استخراج
- إعداد وسائل الإعلام
- إعداد تيار مياه الصرف الصناعي كما anolyte وفقا للجدول 4 4 إضافة كبريتات الأمونيوم للوصول إلى تركيز النهائي من 1، 3، أو 5 ز N / L.
- إعداد 0.1 M كلوريد الصوديوم حل للكهرل مهبطي.
| عنصر | كمية |
| نا 2 هبو 4 .2H 2 O | 1.03 غرام / L |
| KH 2 PO 4 | 0.58 غرام / L |
| MgSO 4 · 7H 2 O | 0.1 غرام / L |
| CaCl 2 .2H 2 O | 0.02 غرام / L |
| (NH 4) 2 SO 4 | اعتمادا على التجربة، للحصول على 1/3/5 ز N / L التركيز النهائي |
الجدول 4. Anolyte تكوين لاستخراج الأمونيوم الكهروكيميائية 4.
- تشغيل مفاعل المستمر لاستخراج الأمونيوم
- التبديل على مضخة تغذية لملء مقصورات المفاعل. لتسريع عملية زيادة معدل ضخ مؤقتا.
- تقليل سرعة المضخة للحصول على HRT من 6 ساعات مرة واحدة يتم تعبئة المفاعل. التبديل على مضخة تدوير بمعدل 6 لتر / ساعة. أخذ عينة من مؤثر (5 مل).
ملاحظة: قياس معدل التدفق بشكل دوري في كافة مراحل التجربةلضمان أنها لا تختلف. - بدء الشريط وامتصاص الوحدة. تشغيل هذه الوحدة هي نفسها بالنسبة للمفاعل حيوي.
- التبديل على potentiostat في وضع chronopotentiometry باستخدام برنامج potentiostat. أول تطبيق الكثافة الحالية منخفضة في حدود 0.5 A / متر مربع لاستقطاب الغشاء وتحديد تدفق النيتروجين بسبب انتشار وحدها.
- عندما تم الاستقطاب النظام لمدة 24 ساعة، وتطبيق كثافة التيار اللازمة للتجربة. اختبار الكثافة الحالية مختلفة، وعادة ما تتراوح بين 10 A / متر مربع إلى 50 A / متر مربع. أخذ عينات من الأنود والكاثود النفايات السائلة، والعمود امتصاص قبل زيادة الكثافة الحالية.
ملاحظة: بعد 3 دورات HRT، ينبغي للمفاعل يقترب حالة مستقرة. - مرة واحدة وصلت الى مفاعل حالة مستقرة، يستغرق 3 عينات على الأقل خلال دورة الوقت. أخذ عينات من الأنود والكاثود النفايات السائلة، وعمود الامتصاص (5 مل لكل منهما). أكتب حجم أخذ العينات، والتاريخ والوقت.
- اعتمادا على استقرار مؤثر الأنود، أخذ عينة الأنود مؤثر جديدة إذا لزم الأمر. وهذا أمر ضروري عند استخدام مياه الصرف الحقيقي.
- تغيير ظروف الاختبار، مثل تطبيق الكثافة الحالية والتركيز TAN. بعد كل تغيير، والسماح للمفاعل استقرار لا يقل عن 3 HRTs قبل أخذ عينات.
- عندما يكون الرقم الهيدروجيني للعمود امتصاص نهج 4، استبدال ماصة مع الطازجة 1 M محلول حمض الكبريتيك.
4. تحليل عينة
- قياس درجة الحموضة والموصلية من العينات في نفس اليوم الذي أخذ العينات للحد من عدم الدقة بسبب فقدان الأمونيا متقلبة. قياس درجة الحموضة والموصلية باستخدام معايرة بشكل كاف درجة الحموضة والموصلية تحقيقات.
- إذا لم يتم قياس العينة على الفور، وتخزين عينات للتحليل TAN (سواء المفاعلات)، وتحليل الأحماض الدهنية (مفاعل حيوي) في 4 درجات مئوية. مرشح عينات من النفايات السائلة مفاعل حيوي الأنود ومؤثر من خلال 0.45 ميكرون مرشحات لإعادةتحرك الكتلة الحيوية وتساعد على الحفاظ على الأحماض الدهنية. ملء جميع أنابيب العينات إلى حافة من أجل تقليل الخسائر NH 3.
- قياس النيتروجين كما TAN من قبل القياسية طريقة التقطير بالبخار أو أي طريقة أخرى يمكن الاعتماد عليها لقياس TAN 10.
- قياس الأحماض الدهنية كما خلات بأي طريقة موثوق بها، مثل اللوني أيون أو اللوني للغاز 11.
5. تحليل البيانات والحسابات
- تصدير ملف البيانات potentiostat من البرمجيات واستيراده إلى برنامج جداول البيانات. حساب المتوسطات في الساعة للمتغيرات الكهروكيميائية لتقليل عدد نقاط البيانات وسلس منحنيات عندما يخططون لها.
- جمع كل البيانات المقاسة (درجة الحموضة، الأمونيوم، VFA) في ملف بيانات واحدة لإجراء العمليات الحسابية. وتناقش الحسابات في قسم النتائج.
- حساب الإنتاج الحالي من مفاعل حيوي. هو أفضل ممثلة هذا النحو الكثافة الحالية، والذي يحسب على النحو التالي (المعادلة 1،12):
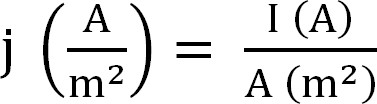 المعادلة 1
المعادلة 1
مع ي لأن كثافة الحالية، I التيار المطلق، ومنطقة سطح المتوقعة من القطب. في برامج معينة فمن الممكن أن يكون هذا يحسب تلقائيا عن طريق إدخال مساحة سطح القطب الموجب قبل بدء التجربة. - حساب المعلمات المتعلقة باستخراج الأمونيوم
- حساب تدفق النيتروجين. تطبيع تدفق النيتروجين (N ز / م / د) إلى منطقة سطح الغشاء ثم كنسبة كثافة التيار (I N). استخدم هذه القيمة لحساب CE (المعادلة 2 و 3 و 4):
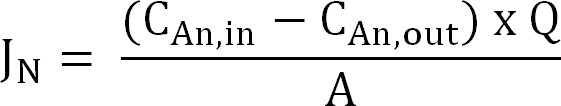 المعادلة 2
المعادلة 2
حيث C آن، في (ز N / L) وC آن، من أصل (ز N / L) وتركيزات الأمونيا قياس القادمة داخل وخارج المقصورة الأنود،على التوالي. Q (L / د) هو معدل تدفق الأنود و A (م 2) هو مساحة سطح الغشاء (متساوية إلى القطب الموجب المتوقع ومساحة سطح الكاثود). - عرض تدفق النيتروجين كما كثافة التيار (I N، A / متر مربع):
 المعادلة 3
المعادلة 3
حيث ض NH4 + (-) هو المسؤول عن NH 4 +، F ثابت فاراداي (96485 C / مول) وM الوزن الجزيئي من النيتروجين (14 جم / مول). - حساب الكفاءة الحالية (CE،٪) على النحو التالي:
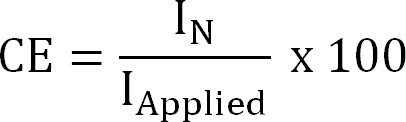 المعادلة 4
المعادلة 4
حيث كنت التطبيقية (A / متر مربع) هو تطبيق (استخراج الكهروكيميائية) أو قياسها (استخراج bioelectrochemical) الكثافة الحالية. - حساب تدفق النيتروجين النظري. حساب الحد الأقصى للالنيتروجين النظريتدفق (J N، ماكس، ز N / م / د) لإعطاء تطبيقها المساحة السطحية الحالية وغشاء (المعادلة 5) على النحو التالي:
 المعادلة 5
المعادلة 5 - حساب كفاءة إزالة النيتروجين (RE،٪). الرجوع إلى نسبة الأمونيوم التي يتم إزالتها من anolyte كما كفاءة الإزالة. احسب من مؤثر الأنود وتركيزات TAN النفايات السائلة (المعادلة 6).
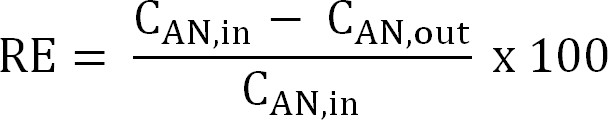 المعادلة 6
المعادلة 6 - حساب القصوى النظرية كفاءة إزالة النيتروجين (RE كحد أقصى،٪) لمؤثر معين الحمل TAN والتطبيقية الحالية (المعادلة 7):
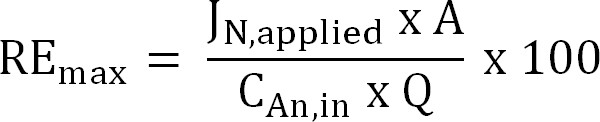 المعادلة 7
المعادلة 7
حيث J N، تطبيق (ز N م -2 د - 1) هو الكثافة الحالية المطبقة كنسبة تدفق النيتروجين.
- حساب تدفق النيتروجين. تطبيع تدفق النيتروجين (N ز / م / د) إلى منطقة سطح الغشاء ثم كنسبة كثافة التيار (I N). استخدم هذه القيمة لحساب CE (المعادلة 2 و 3 و 4):
- حساب الغاز / نسبة السائل كما (المعادلة 8):
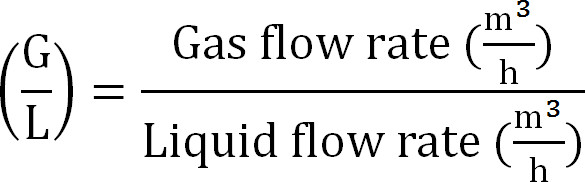 المعادلة 8
المعادلة 8 - حساب القدرة القصوى للعمود الامتصاص. حساب الحد الأقصى N تحميل النظري إلى العمود الامتصاص من الحد الأقصى لتدفق النيتروجين النظري J Nmax، وتركيز TAN في مؤثر (مول / لتر)، وقت ر العملية، ومساحة سطح غشاء A، وحجم V ماصة ( المعادلة 9):
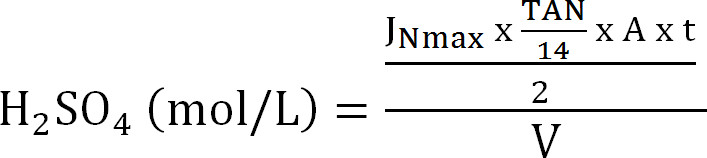 المعادلة 9
المعادلة 9 - حساب الكفاءة SE (٪) (المعادلة 10) تجريد:
 60. المعادلة 10
60. المعادلة 10 - حساب مدخلات الطاقة لاستخراج الأمونيوم من خلال غشاء تبادل الأيونات الموجبة (E N، معبرا عنه كنسبة كيلووات / كغ N) (المعادلة 11):
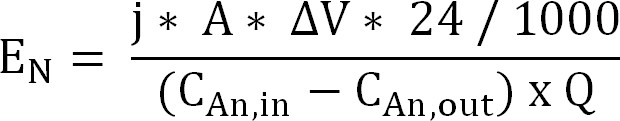 المعادلة 11
المعادلة 11
مع ΔV فرق الجهد يقاس بين الأنود والكاثود. في حالة مفاعل حيوي تم حساب ΔV كمتوسط للفترة أخذ العينات، لمفاعل الكهروكيميائية يتم أخذ متوسط المدى بأكمله.
Access restricted. Please log in or start a trial to view this content.
النتائج
ينتج Chronoamperometry من مفاعل حيوي
نتائج chronoamperometry، وتحسب وفقا لمعادلة 1، تظهر رسم بياني نموذجي لمفاعل مستمر (الشكل 4). في بداية التجربة، كانت تعمل الأنود والكاثود في وضع إعادة تدوير. وهذا يسمح بيوفيلم لتطوير وبداية ال?...
Access restricted. Please log in or start a trial to view this content.
Discussion
توفر هذه المخطوطة الأدوات اللازمة لانشاء bioelectrochemical وخلية كهروكيميائية لاسترداد الأمونيوم. الحسابات المقدمة في قسم النتائج وتوفر معايير لتقييم أداء النظام. النظم البيولوجية والكهروكيميائية متشابهة في الإعداد وظيفة. والفرق الرئيسي بين النظامين هو الخيار تيار ثابت ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
References
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Standard Methods For The Examination Of Water And Wastewater. Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. , American Public Health Association. (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. Elements of Physical Chemistry. , Oxford University Press. Oxford, UK. (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800(2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved