JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
전기 및 Bioelectrochemically 유도 암모늄 복구
요약
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
초록
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
서문
폐수 이익의 중요성에서 가치있는 제품의 복구 귀중한 자원이 회복없이 부족과 치료가로는 비용을 나타냅니다. 폐수는 생산 루프 1을 닫으하는 데 도움이 될 수 있습니다 에너지 및 복구 할 수 있습니다 영양소, 영양 복구를 모두 포함되어 있습니다. 영양소의 회복이 덜 일반적인 상태에서 혐기성 소화를 통해 에너지의 복구, 잘 설립 과정이다. 뇨 및 배설물과 같은 액상 폐기물 스트림으로부터 영양소의 복구 널리 트루 바이트 및 암모니아 스트리핑 2,3- 직접 제조함으로써, 예를 들면, 연구되어왔다. 그러나, 화학적 첨가의 필요성은 이러한 프로세스 (4)의 단점이다. 여기서 우리는 칼륨 및 암모늄 모두 포함한 폐수로부터 양이온 영양소 복구하는 기술을 제시한다. 이러한 영양소의 양이온 형태는 전기 시스템에서 이온 선택성 막을 사용하여 복구 할 수 있습니다. 이 경우, electrochemic알 시스템 (산화가 일어나는) 양극 실의 구성 (환원이 일어나는)과 음극 실 구획을 분리하는 이온 선택성 막. 전압은 애노드로부터 캐소드로의 전류 흐름을 생성하기 위해 셀에인가된다. 이 전압을 물 산화 및 환원 반응을 구동하기 위해 외부 전원에 의해 생성 될 수있다. 선택적 양극 산화, 예를 들면, 유기물, 더 적은 전력을 필요로하는 전기 활성 박테리아에 의해 촉진 될 수있다. 충전 균형을 회로를 폐쇄하고 유지하기 위해, 충전 된 종은 생성 된 각 전자의 전극 사이에 마이그레이션해야합니다. 양이온 교환막 (CEM)에 걸쳐 음극 실에 양극 실에서 암모늄 따라서 트랜스 4,5 전자의 플럭스를 보상 할 수있다.
여기에 제시된 기술뿐만 아니라 폐기물에서 암모늄을 제거하지만 또한 복구 할 수 있습니다. 총 암모니아 성 질소 (TAN)은 모두 암몬의 평형에 존재IUM (NH + 4) 및 암모니아 (NH 3), 및 6의 pH 및 온도에 의존한다. NH 4 + 인해 따라서 음극 실에 걸쳐 CEM 전류에 의해 구동 될 수있는 높은 TAN 농도 및 양극 실의 pH가 중성이 양전하 종 근처 풍부하게된다. 전류는 수산화 이온 및 수소 가스의 생산에 이르는, 음극에서 물의 감소를 구동한다. TAN 평형으로 인해 음극 실 (> 10.0)의 높은 pH로 거의 100 % NH 3으로 이동한다. NH 3는 쉽게 산성 용액에서 포획하고 농축 포집 탑에 스트리핑 부에서 공기 순환을 통해 전송 될 수있는 가스이다.
이 기술은 분뇨와 같은 N - 농후 스트림의 혐기성 소화 동안 암모늄 독성을 감소시키는 잠재력을 보유하고, 따라서, 이들 폐기물 스트림에서의 에너지 회수를 증가하면서 동시에복구 영양소 4. 암모늄의 전기 및 추출 bioelectrochemical 또한 뇨함으로써 WWTP 7에 영양소 제거 비용을 회피 같이 높은 TAN 함량 폐기물에 영양소 회수 기술로서 적용 할 수있다.
우리가 사용하는 모듈 형 반응기로 여기에 제시된 프로토콜은, 다양한 전기 화학적 및 bioelectrochemical 실험 기반이 될 수있다. 아래에 설명 된 것처럼 프로토콜 전극 유형 막 두께와 프레임은 서로 다른 결합 될 수있다. 프로토콜의 주요 목적은 전기 분해 셀을 이용하여 전기 화학적 암모늄 복구 및 전기 화학적 바이오 암모늄 회복의 비교를위한 수단을 제공하는 것이다. 시스템은 추출 효율, 전원 입력과 재현성 측면에서 평가됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 스트립과 흡수 단위 반응기 조립 및 연결
- 원자로를 건설하기 위해 모든 필요한 자료를 수집 : 전극, 프레임 및 고무는 (재료의 목록을 참조하십시오). 조심 반응기를 조립하는 동안 누수를 방지하기 위해 동일한 크기로 모든 부품을 잘랐다.
- 원자로 구획에 드릴 구멍은 남성 커넥터에 남성에 맞게. 기준 전극 맞게 반응기 구획의 일 측면의 중간에 하나의 부가적인 구멍을 뚫는다.
- 흡수 칼럼 1 MH 2 SO 4의 재고를 준비합니다. 암모니아의 높은 부하를 수용하기 위해 필요한이 농도를 높입니다.
- 멤브레인 제조업체의 지침에 따라 전처리되어 있는지 확인합니다. 탄소가 3 분 동안 2 mM의 CTAB (세제)에 담가 전극을 느꼈다 전처리. 탈염수 8 느꼈다 탄소를 씻어. 홍보가 필요하지 않습니다 전기 실험에 대한 안정적인 양극etreatment.
- 반응기 형태에 따라 상이한 순서로 반응기 부품 스택. 생물 반응기의 경우 : 스펙스 종판, 고무, 스테인레스 스틸 집전 전처리 흑연, 방풍 반응기 구획, 고무, 양이온 교환막, 고무, 스페이서 재료, 스테인레스 스틸 메쉬 전극, 고무, 방풍 반응기 구획 고무 스펙스 종판 펠트
- 스펙스 종판, 고무, 종판을 통해 한 IrOx 애노드 스펙스 반응기 구획, 고무, 스페이서, 고무, 양이온 교환막, 고무, 스페이서 재료, 스테인레스 스틸 메쉬 전극, 고무, 방풍 유리 반응기를 다음과 같이 전기 화학 셀을위한 반응기의 부품을 스택 실, 고무, 방풍 엔드 플레이트.
- 반응기의 연결 포트를 밀봉하는 테플론을 사용한다. bioelectrochemical 셀, 전기 화학 셀의 경우 양극 또는 음극의 경우 양극의 작동 전극과 같은 구획에 기준 전극을 배치.
- 너트를 사용하여볼트는 반응기를 닫습니다. 압력을 균등하게 양쪽에 볼트를 조입니다. 손으로 조인 상태로 원자로를 닫습니다 도구를 사용하지 마십시오 완전히 밀폐 된 원자로를 보장하기에 충분하다.
- 반응기 누출이없는 경우 테스트하기 위해 물을 원자로를 입력합니다. 누수가 나타나면 볼트가 충분히 조여 있는지 확인하거나 원자로를 조립하는 동안 원자로 부품 중 하나가 이동 한 경우. 누출이 검출되지 않은 경우, 반응기로부터 물을 비우.
- 중간에 열을 채우기 위해 스트립 흡수 열 모두에서 래쉬 반지를 추가합니다.
- 모든 펌프의 유량 보정. 반응기 스트립 흡수 장치에 공기 펌프 (그림 1)에 대한 공급 및 재순환 펌프를 연결합니다. 가급적 튜빙의 길이를 최소화한다.
- 한 MH 2 SO 4 250ml를 흡수 컬럼을 채우고 그 라씽 링을 포함한다. 펌프를 켜면 공기 흐름이 잘 산을 혼합 있는지 확인합니다. 늘리거나 스트리핑 컬럼 디자인 및 에어 펌프 용량에 따라, 산의 양을 감소시킨다.

암모늄 추출을 가능하게 bioelectrochemical 시스템에 대한 그림 1. 원자로 설치가. 여기에 제시된 시스템은 연속 모드에서 작동합니다. 실선은 액체의 흐름을 나타내고, 점선은 가스의 흐름을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
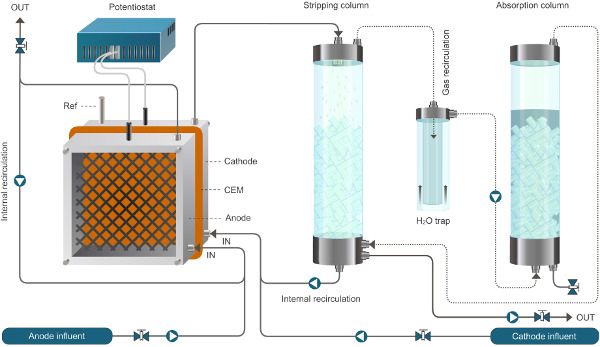
암모늄 추출을 가능하게 bioelectrochemical 시스템에 대한 그림 2. 원자로 설치가. 여기에 제시된 시스템은 연속 모드에서 작동합니다. 실선은 액체의 흐름을 나타내고, 점선은 가스의 흐름을 나타낸다.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
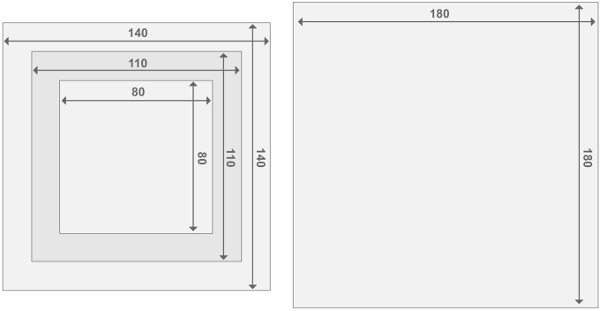
방풍 반응기 프레임의 그림 3. 디자인은. 각각의 반응기는 두 개의 엔드 플레이트 원자로 2 원자로 구획으로 구성되어 있습니다. 모든 부품은 2cm의 두께를 갖는다. 다른 재료의 크기에 관한 자세한 사항은 재료의 목록에서 찾을 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. Bioanode 기반 추출
- 미디어를 준비합니다.
- 표 1 내지 9에 기재된 바와 같이. 바이오 리액터에 대한 양극 액을 준비 폐 질소 - 농후 스트림을 모방하는 배지 중의 암모늄 농도를 증가시킨다.
- 메디을 저장하려면음 이전에 탄소 소스가 오염을 통해 고갈되지 않도록하기 위해 매체를 압력솥, 사용할 수 있습니다. 표 1에 따라 비타민과 미량 요소를 준비하고 오토 클레이브 매체를 냉각 한 후 추가합니다.
- 산소를 제거하기 위해 적어도 30 분 동안 질소로 정화하여 플러싱 매체. 이를 위해 배지 내로 바늘 또는 튜브를 삽입하고 질소 기류를 켜.
- 음극으로 도전 솔루션을 준비합니다. 이 경우에는, 가성 생산을 허용하는 0.1 M의 NaCl을 사용한다.
| 구성 요소 | 양 | ||
| 나 2 HPO 4 | 6g / L | ||
| KH 2 PO 4 | 3g / L | ||
| 염화나트륨 | 0.5 g / L | ||
| NH 4 CL | 0.5 g / L | ||
| 황산 · 7H 2 O | 0.1 g / L | ||
| 염화칼슘 2 · 2H 2 O 용액 (14.6 g / L) | 1 ml의 | ||
| 아세트산 나트륨 | 2g (시동 용) / L | ||
| 미량 원소 | 1 ml의 | ||
| 비타민 솔루션 | 1 ml의 | ||
| (1,000 배)를 미량 원소 | g / L | 비타민 (1,000 배) | g / L |
| 의 CoCl2 | 0.1 | 비오틴 | 0.004 |
| 나 2을 MoO 4 · 2H 2 O | 0.01 | 엽산 | 0.004 |
| H 3 BO 3 | 0.01 | 피리독신 염산염 | 0.02 |
| 마그네슘이 CL 2 · 6H 2 O | 3 | 리보플라빈 | 0.01 |
| ZnCl 2 | 0.1 | 티아민 염산염 | 0.01 |
| 염화칼슘 2 · 2H 2 O | 0.1 | 니코틴산 | 0.01 |
| 염화나트륨 | (1) | DL-판토텐산 칼슘 | 0.01 |
| 니트릴 로트리 아세트산 | 1.5 | 의 비타민 B12 | 0.0002 |
| 의 AlCl 3 · 6H 2 O | 0.01 | P -aminobenzoic 산 | 0.01 |
| 의 CuCl 2 | 0.01 | 리포 (치옥) 산 | 0.01 |
| 50ml을 2 | 0.1 | 미오 -inositol | 0.01 |
| MnCl 2 · 2H 2 O | 0.5 | 염화 콜린 | 0.01 |
| KOH를 사용하여 pH를 6.5로 조정 | 나이아신 아마이드 | 0.01 | |
| 피리 독살 염산염 | 0.01 | ||
| 아스 코르 빈산 나트륨 | 0.01 |
바이오 양극 구동 암모늄 추출 표 1. 양극 액 조성.
- 생물 반응기의 접종
참고 : 혼합 배양 접종을 사용하는 원자로 조건이 특정 전기 생물에 대한 선택하므로 무균 조건에서 작업하는,이 생물 반응기 필요하지 않습니다.- 접종을 준비합니다. 본 생물 반응기를 들어 혐기 발효조를 포함하여 활성 생물 반응기로부터의 유출 물 30㎖의 혼합물을 제조, bioanode, 혐기성 소화조 및 / 또는 원수. 주사기에 혼합를 수집합니다.
- 산소를 입력 할 수 있도록하지 않으면 서 안정된 압력을 유지하기 위해 양극 액 병에 N이 가득 가스 백을 연결합니다. 양극 액의 용적 접종 소스 믹스 (여기서, 접종 소스에 대한 양극 액 30 ㎖를 100 ㎖) 배지 병에 접종과 주사기를 비워서. 양극 구획을 채우기 위해 필요한 볼륨을 획득해야합니다.
- 주사기를 사용하여, 각각의 용액을 동시에 애노드와 캐소드 구획을 채운다. 양극 액 용액은 산소를 도입하지 않고 샘플링 포트를 통해 제거 될 수 있도록 양극 액 병에 N 2 가스로 채워진 백을 연결한다. 전송 사이의 탭으로 샘플 포트를 닫습니다.
참고 : 두 원자로 구획을 동시에 충전되어 있는지 확인하기 위해 동료와 함께이 단계를 수행합니다. - 모두 원자로 구획가 작성되는 경우, 켭니다약 6 L / hr의 순환량 순환 펌프.
- 작업 전극과 양극을 사용하여 세 개의 전극으로 텐쇼 케이블을 연결합니다. 양극 구획 기준 전극을 배치합니다.
- 텐쇼 소프트웨어를 사용하여 chronoamperometry 모드에서 전 위기에 전환합니다. -200 MV 대 자세 / AgCl을 고정 양극 전위를 선택합니다.
- 암모늄 추출을위한 지속적인 반응을 실행
참고 : 바이오 필름 개발로, 현재는 아세테이트의 소비와 생산 될 것이다. 아세테이트 고갈의 결과, 현재는 (도 3을 결과 섹션 참조) 떨어질 것이다.- 연속 급지로 변경하려면, 양극과 음극의 공급 펌프에 전환합니다. 펌프 속도는 유압 체류 시간 (HRT)을 결정합니다. 여기서, 6 시간의 HRT에서 반응기를 작동.
- 스트립 흡수 장치의 공기 펌프에 전환합니다. 폐 루프 공기 재순환 또는 순환에주위 공기를 사용하여 개방 루프. 공기 흐름 구성 형태는 흡착 효율에 영향을 미칠 수있다.
- 주당 중간 세 번을 새로 고칩니다. 단계에 설명 된대로 신선한 양극 액 및 음극 액을 준비 2.1.1-2.1.4.
- 이 단계 후, 유입 라인에 클램프를 넣어, 공급 펌프를 중지, 폐쇄 공급 병에 N이 가득 가스 주머니를 부착 이전 및 새 병을 전환하고 마지막으로 클램프를 제거하고 펌프를 다시 시작합니다.
- 피드를 새로 고칠 때마다, 5 ml의에게 전도도, pH를, 아세테이트 내용과 암모늄 농도 측정 용 양극 액과 음극 액의 유출과 유입의 액체 샘플을 채취.
- 피드를 변경할 때, 또한, pH 및 TAN 분석을 모니터링하는 포집 탑의 3 ml의 샘플을 채취. pH가 4에 도달 할 때, 높은 흡수 효율을 보장하기 위해 신선한 1 M 황산 용액으로 흡수성을 대체.
- 전류가 증가하고 제 정체기에 도달하는 바와 같이, 에이스 측정이를 보장하는 양극 액의 유입과 유출에 탓에 내용이 탄소 제한으로 인한되지 않은 : 100 ㎎ / L 이하 양극 액 유출의 아세테이트 농도는 탄소 제한을 나타냅니다. 이 경우 (표 2)의 공급에 초산 농도를 높입니다.
- 전류 안정화 아세테이트 제한에 의해 야기되지 않으면 서서히 피드 암모늄 농도를 증가시키고, 추출 효율 (표 3) 평가하기 위해 현재의 안정화 기다린다.
주 : 암모늄 농도가 증가함에 따라, 암모니아 독성과 높은 도전성 생물막 도전 것이며 결국 현재 결과로 떨어질 것이다.
| 시간 | 아세트산 나트륨의 양이 애노드 공급 물 (g / L)에 첨가 |
| 0 일 - 35 일 | 이 |
| 35 일 - 데이 (37) | 3 |
| 일 37 - 데이 (51) | 4 |
| 일 51 - 데이 (61) | (5) |
bioanode 종동 암모늄 추출 양극 액에 아세트산 나트륨의 농도를 표 2.
| 시간 | NH 4 HCO 3의 금액 양극 공급 (g / L)에 추가 | 상 |
| 0 일 - 데이 (16) | 2.26 | 나는 |
| 일 16 - 데이 (26) | 4.5 | II |
| 일 26 - 데이 (33) | 9 | III |
| 일 33 - 데이 (40) | 14.1 | IV |
| 일 - 40 일 (47) | (20) | V |
| 일 47 - 데이 (54) | 25.4 | VI |
| 일 54 - 데이 (63) | (31) | VII |
표 bioanode 종동 암모늄 추출 양극 액에서의 암모늄 농도 3.. 위상이 전류 밀도의 그래프에 표시되어있다 (도 2).
3. 전기 추출
- 미디어를 준비
- . (4) 표 4에 따른 양극 액으로 합성 폐수 스트림을 준비 1, 3 또는 5g의 N / L의 최종 농도에 도달하기 위해 황산 암모늄을 추가한다.
- 음극에 대해 0.1 M NaCl 용액을 준비합니다.
| 구성 요소 | 양 |
| 2 HPO 4 · 2H 2 O 나 | 1.03 g / L |
| KH 2 PO 4 | 0.58 g / L |
| 황산 · 7H 2 O | 0.1 g / L |
| 염화칼슘 2 · 2H 2 O | 0.02 g / L |
| (NH 4) 2 SO 4 | 실험에 따라 1/3/5 g의 N / L의 최종 농도를 얻었다 |
전기 암모늄 추출 4 표 4. 양극 액 조성.
- 암모늄 추출을위한 지속적인 반응을 실행
- 원자로 구획을 채우기 위해 공급 펌프에 전환합니다. 프로세스 속도를 일시적으로 펌프 속도를 증가시킨다.
- 반응기가 작성되면 6 시간의 HRT를 얻기 위해 펌프 속도를 줄인다. 6 L / hr의 속도로 순환 펌프의 스위치를 켜. 유입 (5 ㎖)의 샘플을 가져 가라.
주 : 실험을하는 동안 주기적으로 유량을 측정이 변화하지 않도록합니다. - 스트립 흡수 장치를 시작합니다. 본 기기의 작동은 생물 반응기와 동일합니다.
- 텐쇼 소프트웨어를 사용하여 chronopotentiometry 모드에서 전 위기에 전환합니다. 먼저 멤브레인을 극화하고 단독으로 인해 확산 질소 유량을 결정하기 위해 약 0.5 A / 평방 미터의 낮은 전류 밀도를 적용합니다.
- 시스템은 24 시간 동안 편광 된 경우, 실험에 필요한 전류 밀도를 적용. 보통 10 A / 평방 미터에서 50 A / 평방 미터에 이르기까지 서로 다른 전류 밀도를 테스트합니다. 전류 밀도를 증가시키기 전에 애노드 및 캐소드 유출 물, 및 포집 탑의 샘플을 채취.
주 : 3 HRT 사이클 후, 반응기가 정상 상태에 접근한다. - 반응기가 정상 상태에 도달하면, 시간 경과에 걸쳐 적어도 3 샘플을 채취. 양극과 음극 폐수 및 흡수 칼럼 (5 mL 씩)으로부터 시료를 채취. 샘플링 볼륨, 날짜와 시간을 기록합니다.
- 필요한 경우 애노드 유입수의 안정성에 따라, 새로운 양극 유입수 샘플을 채취. 실제 폐수가 사용되는 경우에 필요하다.
- 이러한 적용 전류 밀도와 TAN 농도로 시험 조건을 변경할 수 있습니다. 각 변경 후, 반응기가 샘플을 채취하기 전에 적어도 3 HRTs에 대한 안정화 할 수 있습니다.
- 흡수 칼럼의 pH가 4에 도달 할 때, 새로운 1 M 황산 용액으로 흡수성을 대체.
4. 샘플 분석
- pH 및 샘플의 전도도 휘발성 암모니아의 부정확성으로 인한 손실을 줄일 수 샘플링과 같은 일을 측정한다. 적절하게 보정 된 pH와 전도도 프로브를 사용하여 pH와 전도도를 측정한다.
- 샘플을 바로 측정하지 않을 경우, TAN 분석 (모두 반응기) 및 39 ° C에서 지방산 분석 (바이오 리액터)에 대한 샘플을 저장. 0.45 μm의 필터를 통해 생물 반응기 양극 유출과 유입의 필터 샘플은 다시지방산을 보존 바이오 매스를 이동하고 도움이됩니다. NH 3의 손실을 최소화하기 위해 림 모든 샘플 튜브를 채운다.
- 표준 증기 증류법 또는 10 TAN을 측정하는 임의의 다른 신뢰성있는 방법에 의해 질소 TAN을 측정한다.
- 이온 크로마토 그래피, 가스 크로마토 그래피 (11)와 같은 신뢰성있는 방법에 의해, 아세트산 등의 지방산 류를 측정.
5. 데이터 분석 및 계산
- 소프트웨어에서 텐쇼 데이터 파일을 내보내고 스프레드 시트 프로그램에 가져옵니다. 전기 변수 데이터 포인트의 수를 감소시키고이를 플로팅 때 곡선을 매끄럽게 시간당 평균을 계산한다.
- 계산을 위해 하나의 데이터 파일 내의 모든 측정 데이터 (PH, 암모늄, VFA)를 수집한다. 계산 결과 섹션에서 설명합니다.
- 생물 반응기에 의해 현재의 생산을 계산합니다. 이것은 최선의, 식 1 (다음과 같이 계산된다 전류 밀도로 표현된다12)
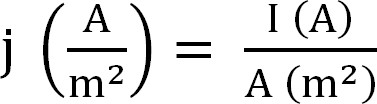 식 (1)
식 (1)
전류 밀도 I 절대 전류 및 전극의 투영 면적과 같은 J. 특정 소프트웨어에서 이것이 실험 시작 전에 양극 표면 영역을 입력함으로써 자동으로 계산하는 것이 가능하다. - 암모늄 추출에 관한 파라미터를 계산
- 질소 유량을 계산합니다. 다음, 전류 밀도 (I N)으로 표현 멤브레인 표면적에 대한 질소 유량 (g에 N / ㎡ 크기 / D)를 정규화한다. CE 계산이 값을 사용하여 (식 2, 3, 4) :
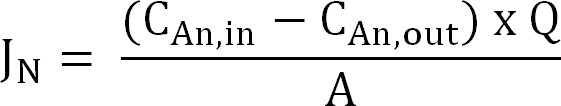 식 (2)
식 (2)
여기서 C (g의 N / L)와 C, 출력 (g의 N / L)을 측정 암모늄 농도 및 양극 실에서 나오는 아르에,각각. Q (L / d)는 양극 유량이고, A (m 2) (양극과 음극 투영 면적과 동일) 막 표면적이다. - 전류 밀도 (I N, A / 평방 미터)과 질소 플럭스를 제시 :
 식 (3)
식 (3)
여기서 Z NH4 + (- 1) NH 4 +의 전하이며, F 패러데이 상수 (96,485 C / mol) 및 M 질소의 분자량 (14g / 몰). - 전류 효율 (CE, %) 등을 계산합니다 :
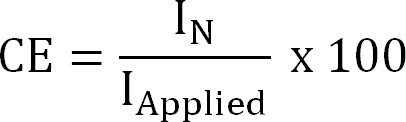 수학 식 4
수학 식 4
나는 응용 (A / 평방 미터)를 적용 (전기 화학적 추출) 또는 측정 (bioelectrochemical 추출) 전류 밀도이다. - 이론적 인 질소 유량을 계산합니다. 최대 이론 질소를 계산주어진에 대한 플럭스 (J N, 최대, g의 N / ㎡ 크기 / d)는 같은 현재와 막 표면적 (식 5)를 적용 :
 식 (5)
식 (5) - 질소 제거 효율 (RE, %)을 계산한다. 제거 효율로서 양극 액에서 제거 된 암모니아의 비율을 참조. 양극의 유입과 유출 TAN 농도 (식 6)에서 계산합니다.
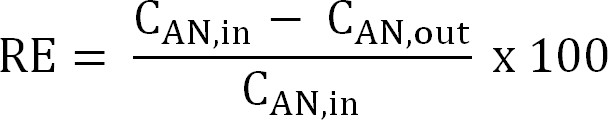 식 (6)
식 (6) - 유입수 TAN 주어진 부하에 대한 이론적 최대 질소 제거 효율 (RE 맥스, %)를 계산하고 현재의 (수학 식 7)을 도포 :
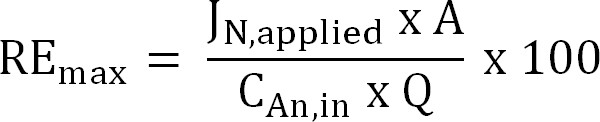 식 (7)
식 (7)
여기서 J N, 적용 (g의 N의 m -이 D - 1) 질소 플럭스로서 표현인가 전류 밀도이다.
- 질소 유량을 계산합니다. 다음, 전류 밀도 (I N)으로 표현 멤브레인 표면적에 대한 질소 유량 (g에 N / ㎡ 크기 / D)를 정규화한다. CE 계산이 값을 사용하여 (식 2, 3, 4) :
- (식 8)와 같은 기체 / 액체 비율을 계산한다
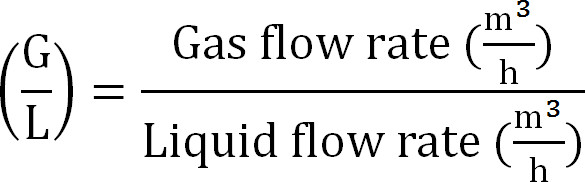 식 (8)
식 (8) - 흡수 칼럼의 최대 용량을 계산합니다. (최대 이론 질소 플럭스 J Nmax에, 유입수 TAN 농도 (몰 / L), 조작 t, 막 표면적의 시간 및 흡수성 V의 볼륨에서 포집 탑에 최대 이론 N의 하중을 계산 식 9)
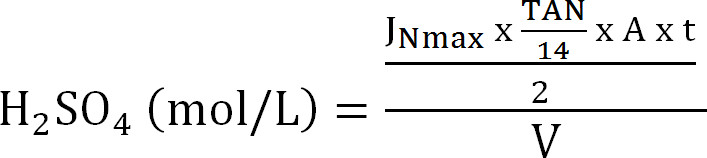 식 (9)
식 (9) - SE 스트리핑 효율 (%) (식 10)를 계산한다 :
 (60); 식 (10)
(60); 식 (10) - 양이온 교환 막을 통해 암모늄 추출을위한 에너지 입력을 계산 (식 11) (E는 N, 킬로와트 / kg으로 표현 N) :
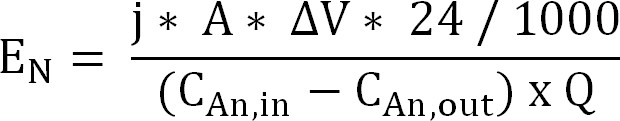 식 (11)
식 (11)
양극과 음극 사이의 ΔV를 측정 전위차. 생물 반응기의 경우, ΔV는 전체 실행에 대해 평균이 취해진 다 전기 화학적 반응기에 대한 샘플링 기간에 대한 평균으로서 계산되었다.
Access restricted. Please log in or start a trial to view this content.
결과
Chronoamperometry는 생물 반응기의 결과
chronoamperometry 결과, 수학 식 1에 따라 계산 (그림 4) 연속 반응에 대한 전형적인 그래프를 보여줍니다. 실험 시작시의 양극과 음극은 재순환 모드로 작동시켰다. 이것은 개발 생물막과 현재의 생산의 개시를 허용한다. 수술 5 일 후에, 전류 밀도는 현재의 생산의 감소에 이어 최대에 도달. 이 바이오 필름은 현재 생?...
Access restricted. Please log in or start a trial to view this content.
토론
이 원고는 bioelectrochemical 암모늄 복구를위한 전기 화학 셀을 설정하는 데 필요한 도구를 제공합니다. 결과 섹션에 제시된 계산은 시스템 성능의 평가를 위해 파라미터를 제공한다. 생물학적 및 전기 시스템 설치 및 기능에서 유사하다. 두 시스템 사이의 주요 차이점은 bioelectrochemical 셋업 고정 양극 전위 대 전기 화학 셀의 현재의 고정 된 선택이다. 비 생물 적 설정을위한 고정 전류는 전극 반응을...
Access restricted. Please log in or start a trial to view this content.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
참고문헌
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Standard Methods For The Examination Of Water And Wastewater. Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. , American Public Health Association. (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. Elements of Physical Chemistry. , Oxford University Press. Oxford, UK. (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800(2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유