需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
电化学和Bioelectrochemically诱导铵恢复
摘要
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
摘要
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
引言
回收的废水收益的重要性有价值的产品作为宝贵的资源变得稀缺和治疗没有恢复只占成本。废水中含有既节能又可以恢复营养物,和营养恢复可以帮助以关闭生产循环1。恢复通过厌氧消化的能量是一个成熟的过程中,而营养物的回收是不常见的。回收从液体废物流如尿液和粪便的营养物质已被广泛地研究, 例如 ,通过生产鸟粪石和氨2,3的直接汽提的。但是,需要进行化学加成是这些过程4的缺点。这里,我们提出了一种用于阳离子营养素从废物流,包括钾和铵的回收。这些营养成分的阳离子形式允许恢复使用离子选择性膜在电化学系统中。在这种情况下,electrochemic人系统由一个阳极室(其中,氧化发生)的,一个阴极室(其中,减少发生)和离子选择性膜分离的隔室中。一电压跨细胞施加以产生电流从阳极到阴极。该电压可以通过外部电源来驱动水氧化和还原反应来产生。可选择地,阳极氧化, 例如 ,有机物,可以通过电细菌,需要较少的功率催化。以闭合电路并保持电荷平衡,带电物质,必须在电极之间迁移产生的每个电子。从阳极室到跨阳离子交换膜(CEM)阴极室铵传输因此可补偿电子4,5的通量。
这里提出的技术不仅能消除从废物流铵,而且还可以复苏。总氨氮(TAN)中都存在,阿蒙的平衡鎓(NH + 4)和氨(NH 3),并且是依赖于pH和温度6。 NH 4 +是丰富地,由于高TAN浓度及近中性的pH值,在阳极室与该带正电荷的物质可以因此通过在CEM当前被驱入阴极室提供。电流驱动的水在阴极处还原,导致生产氢氧离子和氢气。的TAN平衡转移至接近100%的NH 3,由于高PH值,在阴极室(> 10.0)。 NH 3是可以经由空气流通很容易地传送从汽提单元到吸收塔那里被捕获并集中在酸溶液中的气体。
这种技术具有的N-富状粪便流厌氧消化过程中减少铵毒性的潜力,从而增加从这些废物流能量回收,同时恢复营养素4。铵电化学和生物电化学提取,也可作为具有高TAN含量废物流的营养恢复技术应用,如尿液,从而避免对营养物的去除费用在污水处理厂7。
这里介绍的协议可以作为许多不同的电化学和生物电化学实验的基础,因为我们使用了模块化反应器中。不同类型的电极,膜和框架的厚度可以组合为在下面的协议说明。该协议的主要目的是提供一种用于电化学铵回收和生物电化学铵回收使用的电解池比较的装置。该系统中的提取效率,电源输入和再现性方面进行了评价。
研究方案
1.装配反应堆和连接剥离和吸收单位
- 收集所有必要的材料打造的电抗器:电极,框架和橡胶(见材料清单)。精心切割的所有部分相同的尺寸,以避免泄漏,而装配反应器。
- 在反应堆舱钻孔,以适应公对公连接器。钻一个附加孔中的反应器隔室中的一个的一侧的中部,以适应参考电极。
- 准备1 MH 2 SO 4一只股票的吸收塔。增加必要该浓度以适应氨高负荷。
- 确保该膜是根据制造商的说明进行预处理。预处理碳毡电极由3分钟浸泡在2毫米CTAB(清洁剂)。冲洗毡用软化水8中的碳。稳定的阳极电化学实验不需要公关etreatment。
- 根据反应器类型堆叠,以便在不同的反应器中的部分。对于生物反应器:有机玻璃终板,橡胶,不锈钢集流器,预处理石墨毡,有机玻璃反应器室中,橡胶,阳离子交换膜,橡胶垫片材料,不锈钢网电极,橡胶,有机玻璃反应器室中,橡胶,有机玻璃端板
- 堆反应堆部件的电化学电池如下:有机玻璃终板,橡胶,通过终板IROX阳极,有机玻璃反应堆舱,橡胶垫片,橡胶,阳离子交换膜,橡胶垫片材料,不锈钢网状电极,橡胶,有机玻璃反应器隔间,橡胶,有机玻璃终板。
- 使用特氟隆密封的反应器中的连接端口。放置在同一隔室作为工作电极的参考电极:在生物电化学电池中,在电化学电池的情况下的阴极或阳极的情况下的阳极。
- 用坚果和螺栓,关闭反应器。拧紧在相对侧上的螺栓,以均衡的压力。不要使用工具来关闭反应器手指拧紧就足以保证一个完全密封反应堆。
- 填在反应器的水,以测试如果反应器是无泄漏。如果出现渗漏,检查螺栓是否拧紧不足或者反应器的部分之一,而移动的装配器。如果没有检测到泄漏,从反应器排空水。
- 添加拉西环同时在带材和吸收柱到中途填充列。
- 校准所有的泵的流速。连接的进料和再循环泵至反应器和空气泵向所述汽提和吸收单元( 图1)。最小化管道尽可能的长度。
- 用250ml的1 MH 2 SO 4的填充吸收塔,它应覆盖拉西环。确保空气流以及混合的酸当泵被接通。增加或降低酸的基础上,汽提塔设计和空气泵容量的体积。

图1.反应堆设置了生物电化学系统,使铵提取。这里介绍的系统工作在连续模式。实线表示液体流动,虚线代表气流。 请点击此处查看该图的放大版本。
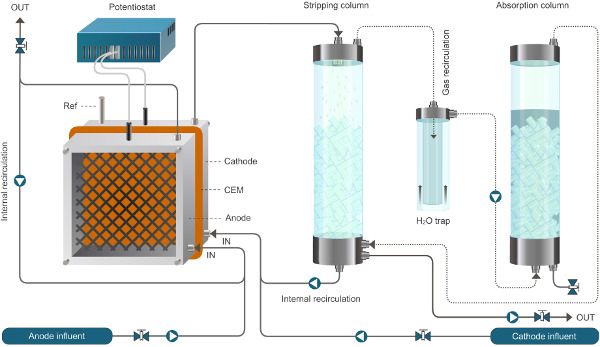
图2.反应器设置的生物电化学系统,使铵提取。这里介绍的系统工作在连续模式。实线表示液流,虚线表示气体的流动。ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg"目标="_空白">点击此处查看该图的放大版本。
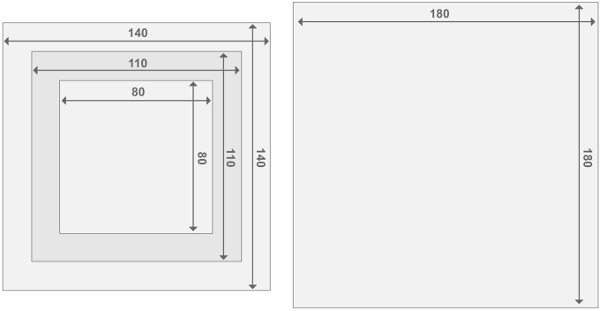
的有机玻璃反应堆帧图3.设计。每个反应器由两个端板的反应器和2的反应器室中。所有部件的厚度为2厘米。关于其他材料的大小细节,可以在材料列表中找到。 请点击此处查看该图的放大版本。
2.生物阳极驱动提取
- 准备媒体。
- 如表1 9中描述制备的阳极液用于生物反应器,增加铵浓度在培养基中以模仿的富氮废气流。
- 要存储MEDI嗯在使用前,高压灭菌的培养基,以确保碳源不通过污染耗尽。根据表1制备的维生素和痕量元素和高压灭菌和冷却介质后添加。
- 通过用氮气吹扫至少30分钟以除去氧气冲洗介质。要做到这一点,插入一个管子或针入培养基并打开氮气流。
- 制备导电溶液作为阴极电解液。在这种情况下,使用0.1 M氯化钠,以允许苛性生产。
| 部件 | 量 | ||
| 的Na 2 HPO 4 | 6克/升 | ||
| KH 2 PO 4 | 3g / L的 | ||
| 氯化钠 | 0.5克/ L的 | ||
| 氯化铵 | 0.5克/ L的 | ||
| 硫酸镁4·7H 2 O | 0.1克/ L的 | ||
| 氯化钙2·2H 2 O解决方案(14.6克/ L) | 1毫升 | ||
| 醋酸钠 | 为2g / L(用于起动) | ||
| 微量元素 | 1毫升 | ||
| 维生素解决方案 | 1毫升 | ||
| 微量元素(1000倍) | 克/升 | 维生素(1000倍) | 克/升 |
| 氯化钴 | 0.1 | 生物素 | 0.004 |
| 娜2的MoO 4·2H 2 O | 0.01 | 叶酸 | 0。004 |
| H 3 BO 3 | 0.01 | 盐酸吡哆醇 | 0.02 |
| 2毫克氯2·6H 2 O | 3 | 核黄素 | 0.01 |
| 氯化锌 | 0.1 | 盐酸硫胺素 | 0.01 |
| 氯化钙2·2H 2 O | 0.1 | 烟酸 | 0.01 |
| 氯化钠 | 1 | DL泛酸钙 | 0.01 |
| 三乙酸 | 1.5 | 维生素B12 | 0.0002 |
| 氯化铝3·6H 2 O | 0.01 | 对氨基苯甲酸 | 0.01 |
| 氯化铜 | 0.01 | 硫辛酸(硫辛酸)酸 | 0.01 |
| 三氯化铁2 | 0.1 | 肌醇 | 0.01 |
| 氯化锰2·2H 2 O | 0.5 | 氯化胆碱 | 0.01 |
| 调整用KOH pH值6.5 | 烟酰胺 | 0.01 | |
| 盐酸吡哆醛 | 0.01 | ||
| 抗坏血酸钠 | 0.01 |
用于生物阳极驱动铵提取表1阳极电解液组合物。
- 生物反应器的接种
注:工作在无菌条件下没有必要为这种生物反应器,作为混合培养接种体使用,反应器中的条件将选择的特定电活性生物。- 准备接种。对于这种生物反应器,从积极的生物反应器厌氧包括发酵罐准备废水30ml的混合液,生物阳极,厌氧消化和/或原废水。收集在注射器中混合。
- 连接填充有N 2的阳极液瓶的气体袋,以保持该压力,同时不允许氧气进入稳定。与阳极电解液的体积混合的接种物源(这里,将100ml的阳极液30毫升接种源的)由排空与接种注射器到培养基瓶中。一定要得到填补了阳极室所必需的量。
- 使用注射器,同时填充在阳极和阴极隔室各自的解决方案。连接填充有N 2的阳极液瓶的气体袋,以使阳极液溶液可以通过取样口,而不会引入氧气被除去。关闭样品端口传输之间的水龙头。
注:与同事一起执行此步骤,以确保这两个反应堆舱同时填补。 - 当两个反应堆舱都装满,开启再循环泵以大约6升/小时的再循环率。
- 与三个电极连接的恒电位线,使用阳极作为工作电极。定位在所述阳极室中的参比电极。
- 开关上使用恒电位软件的电位在计时模式。选择-200毫伏相对于Ag / AgCl电极的一个固定的阳极电位。
- 运行的连续反应器中进行氨提取
注意:作为生物膜的发展,目前将与乙酸盐的消耗产生的。乙耗尽的结果,电流将下降(参见结果部分, 图3)。- 改变到连续进料,打开进料泵用于阳极和阴极。泵的转速决定了水力停留时间(HRT)。这里,操作的反应器中,在6小时的停留时间。
- 开关上的带材和吸收单元的空气泵。再循环的空气在一个封闭的循环中,或循环中的开环使用的环境空气中。空气流动的配置会影响吸收效率。
- 刷新每周介质三次。准备中的步骤描述新鲜的阳极和阴极2.1.1-2.1.4。
- 在这些步骤之后,附加填充有N 2到闭合进料瓶的气体包,停止供给泵,把一个夹具上进水线路,开关新旧瓶和最后去除夹具和重新启动泵。
- 每次进给刷新,取5毫升的阳极电解液和阴极电解液电导率,pH值,酯含量和铵浓度的测量的流出物和进水的液体样品。
- 当改变进料,也取3mL的样品吸收塔监测pH值,并为TAN分析。当pH接近4,用新鲜的1M硫酸溶液代替吸收性,以确保高的吸收效率。
- 由于目前会先增加,然后达到一个平台,测量王牌在阳极液流入和流出泰特内容,以确保此不会引起碳的限制:乙酸盐浓度低于100毫克/升的阳极电解液流出物表明碳的限制。增加的醋酸浓度的进料在这种情况下( 表2)中。
- 如果当前的稳定不是由醋酸引起的限制,逐渐增加氨的浓度在饲料中,并等待当前的稳定化,以便评估萃取效率( 见表3)。
注:由于铵浓度增加,氨的毒性和高的导电性将挑战生物膜和电流最终将下降作为结果。
| 时间 | 乙酸钠的量添加到阳极进料(克/升) |
| 日0 - 35天 | 2 |
| 35日 - 37日 | 3 |
| 37日 - 51日 | 4 |
| 51日 - 61日 | 五 |
乙酸钠中的阳极液用于生物阳极从动铵提取表2浓度的影响。
| 时间 | 的NH 4 HCO 3的量添加到阳极进料(克/升) | 相 |
| 日0 - 16天 | 2.26 | 我 |
| 16日 - 26日 | 4.5 | II |
| 26日 - 33日 | 9 | III |
| 33日 - 40日 | 14.1 | IV |
| 40日 - 47日 | 20 | V |
| 47日 - 54日 | 25.4 | VI |
| 54日 - 63日 | 31 | 七 |
表铵在阳极电解液为生物阳极从动铵提取3浓度的影响。各相上指示的电流密度曲线图( 图2)。
3.电化学提取
- 准备媒体
- 根据表4 4制备合成废水流作为阳极液。添加硫酸铵,以达到1,3或5克N- / L的终浓度。
- 制备用于阴极电解液的0.1M NaCl溶液。
| 部件 | 量 |
| 娜2 HPO 4·2H 2 O | 1.03克/ L的 |
| KH 2 PO 4 | 0.58克/ L的 |
| 硫酸镁4·7H 2 O | 0.1克/ L的 |
| 氯化钙2·2H 2 O | 0.02克/ L的 |
| (NH 4)2 SO 4的 | 根据不同的实验,得到1/3/5克N / L终浓度 |
电化学铵提取4表4.阳极液组成。
- 运行的连续反应器中进行氨提取
- 在进给泵切换到填充在反应器隔室。为了加快该过程暂时增加泵速率。
- 降低泵的转速,以获得6小时的停留时间,一旦该反应器被充满。开关上的再循环泵以6L / hr的速度。取进水(5毫升)中的样品。
注:周期性地测量的流量在整个实验以确保它不会发生变化。 - 启动带和吸收单元。这个单元的操作是一样的生物反应器。
- 接通使用电位软件恒电位在计时电位模式。首先应用大约为0.5 A /平方米的较低的电流密度,以极化膜和测定氮通量由于扩散独自。
- 当系统已被极化为24小时,应用所必需的实验的电流密度。测试不同的电流密度,一般可达10 A /平方米至50 A /平方米。采取在阳极和阴极流出物,和吸收塔样品增加电流密度之前。
注:经过3次HRT,反应器应该接近稳定状态。 - 一旦反应器已达到稳定状态时,至少需要3个样品上的时间过程。取从阳极和阴极流出物,以及吸收塔(每次5毫升)中的样品。写下取样量,日期和时间。
- 取决于阳极进水的稳定性,取一个新的阳极流入样品如果必要的。这是必要的,当实际废水被使用。
- 改变测试条件,如施加的电流密度和TAN的浓度。每次更改后,让反应器取样之前稳定至少3 HRTS。
- 当吸收塔的pH接近4,用新鲜的1M硫酸溶液代替吸收性。
4.样品分析
- 测量pH值和样品的电导率的同一天,采样,以减少由于挥发性氨的损失的不准确。利用适当校准的pH值和电导率的探针测量pH值和电导率。
- 如果样品不立即测量,存储样本TAN分析(两个反应器)和脂肪酸分析(生物反应器),在4℃。从生物反应器阳极污水和进水通过0.45微米的过滤器过滤样本重新移动量,并帮助保护脂肪酸。填充所有样品管在轮圈,以便最小化的NH 3的损失。
- 通过标准的水蒸气蒸馏法或用于测量TAN 10的任何其他可靠的方法测量氮气作为TAN。
- 测量脂肪酸如乙酸通过任何可靠的方法,例如离子色谱法或气相色谱11。
5.数据分析和计算
- 从软件出口的恒电位仪的数据文件,并将其导入到电子表格程序。计算每小时平均值电化学变量以减小的数据点的数量,并绘制它们时平滑曲线。
- 收集在一个数据文件中的所有测量数据(pH值,铵,VFA)进行计算。该计算结果部分讨论。
- 由生物反应器计算当前的生产。这是最好的表示为电流密度,其计算方法如下(式1,12):
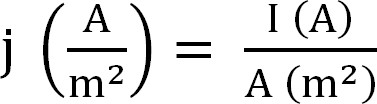 式(1)
式(1)
其中j为电流密度,我的绝对电流,电极的投影表面积。在某些软件,它能够具有这种由实验开始前进入阳极表面积自动计算。 - 计算与铵提取参数
- 计算氮通量。正常化氮气通量(克N /平方米/天),以在膜表面面积,然后表示为电流密度(I N)。使用此值来计算的CE(式2,3和4):
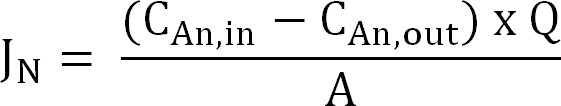 公式2
公式2
其中C 的,在 (克N / L)和C 的,输出 (克N / L)的所测量的铵浓度进出阳极室,分别。 Q(L / D)是所述阳极的流量及A(米2)是膜表面面积(等于投射阳极和阴极表面积)。 - 目前氮通量电流密度(I N,A /平方米):
 公式3
公式3
其中,z NH +( - )为NH 4 +的电荷,F是法拉第常数(96485℃/摩尔)和M氮的分子量(14克/摩尔)。 - 计算出电流效率(CE,%),为:
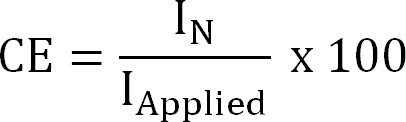 公式4
公式4
在我的应用 (A /平方米)是应用(电化学提取)或测量(生物电化学提取)的电流密度。 - 计算理论的氮通量。计算最大理论氮通量(J·N,最大,克N /平方米/天)对于给定的施加电流和膜表面积(式5)为:
 公式5
公式5 - 计算脱氮效率(RE,%)。参阅铵是从阳极电解液作为去除效率去除的百分比。从阳极进水和出水TAN浓度(式6)计算。
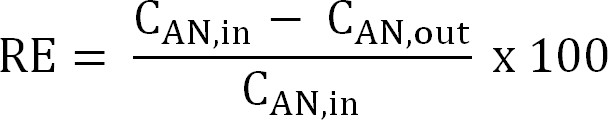 方程6
方程6 - 计算出最大理论脱氮效率(RE 最大 ,%),用于一个给定的进水TAN负荷和施加的电流(等式7):
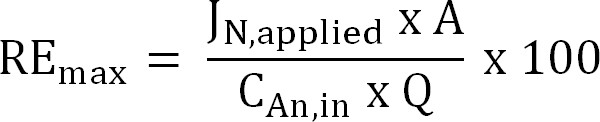 公式7
公式7
其中J N,应用 (克的N-米-2 D - 1)是所施加的电流密度表示为氮气通量。
- 计算氮通量。正常化氮气通量(克N /平方米/天),以在膜表面面积,然后表示为电流密度(I N)。使用此值来计算的CE(式2,3和4):
- 计算气/液比为(式8):
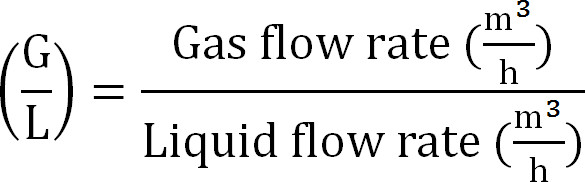 方程8
方程8 - 计算吸收塔的最大容量。从理论上的最大氮通量ĴNmax时 ,在进水的TAN浓度(摩尔/升),操作吨,膜表面区域A内的时间,和吸收Ⅴ的体积计算的最大理论N加载到吸收塔(方程9):
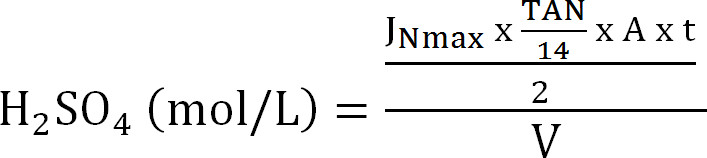 公式9
公式9 - 计算汽提效率SE(%)(方程10):
 60; 10式
60; 10式 - 计算能量输入为铵提取通过阳离子交换膜(E N,表示为千瓦时/千克氮)(式11):
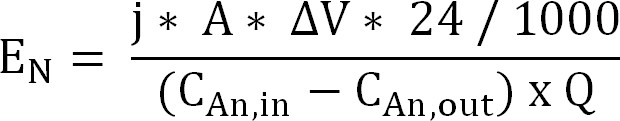 11式
11式
与阳极和阴极之间的ΔV所测量的电位差。在生物反应器的情况下,ΔV计算为平均为采样周期,对电化学反应器取出的平均值在整个运行。
结果
计时从生物反应器的效果
的计时结果,根据公式1计算出的,显示出一个典型的曲线图,用于连续反应器( 图4)。在实验开始时,阳极和阴极在再循环模式进行操作。这允许生物膜发展和目前生产的发作。经过5天的运行中,电流密度达到最大值,然后在当前生产的降低。这是一个指示,该生物膜缺少一个碳/电子源( 例如 ,乙酸酯),以产?...
讨论
这份手稿提供了必要的工具,以建立一个生物电化学和回收硫酸铵电化学电池。在结果部分提出了计算系统性能的评价提供参数。生物和电化学系统在设置和功能相似。两个系统之间的主要区别是一个固定的电流,电化学电池相对于一个固定的阳极电势的生物电化学设置的选择。固定电流对非生物的设置是必要的,以驱动电极反应,并允许还允许在本体阶段的处理的调节,从而导致稳态条件。为?...
披露声明
The authors have nothing to disclose.
致谢
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
材料
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
参考文献
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. . Standard Methods For The Examination Of Water And Wastewater. , (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. . Elements of Physical Chemistry. , (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800 (2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。