Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Elektrokimyasal ve Bioelectrochemically Kaynaklı Amonyum Kurtarma
Bu Makalede
Özet
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Özet
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Giriş
Atıksu önem kazanmaktadır değerli ürünlerin Kurtarma değerli kaynaklar kurtarma olmadan kıt ve tedavi olmak gibi sadece bir maliyet oluşturmaktadır. Atıksu üretimi döngü 1 kapatmak için yardımcı olabilir enerji ve telafi edilebilir besin ve besin kurtarma hem de içeriyor. Besin kurtarma az yaygın iken anaerobik sindirim yoluyla enerji geri kazanımı, köklü bir süreçtir. Idrar ve gübre gibi sıvı atık derelerden besin Kurtarma yaygın strüvit ve amonyak 2,3 doğrudan sıyrılması üretimi yoluyla, örneğin, araştırılmıştır. Ancak, kimyasal ek ihtiyacı bu süreçlerin 4 bir dezavantajı olduğunu. Burada potasyum ve amonyum hem de dahil olmak üzere, atık akımlarının, katyonik besin geri kazanımı için bir yöntem sunulmaktadır. Bu besinlerin katyonik formu bir elektrokimyasal sistemde bir iyon seçici zar kullanılarak kurtarma sağlar. Bu durumda, electrochemicarkadaşları sistemi (oksidasyon gerçekleşir), bir anot odasının oluşur, (redüksiyon gerçekleşir), bir katot odası ve bölmeleri ayırmak için bir iyon seçici membran. Bir voltaj anottan katoda bir akımı üretmeye hücresinde tatbik edilir. Bu gerilim, su oksidasyon ve redüksiyon reaksiyonları sürücü harici bir güç kaynağı ile oluşturulabilir. Alternatif olarak anodik oksidasyonu, örneğin, organik maddelerden daha az güç gerektiren elektro-bakteriler tarafından katalize edilebilir. Yük dengesini devresini kapatmak ve korumak için, bir ücret türler üretilen her elektron için elektrotlar arasında geçirmek gerekir. Bir katyon değişim zarı (CEM) boyunca katot odasında anot odasından Amonyum taşıma, böylece elektron 4,5 akışını telafi edebilir.
Burada sunulan teknik değil, sadece atık derelerden amonyum kaldırır, ama aynı zamanda kurtarma sağlar. Toplam amonyak azotu (TAN) hem Ammon denge varamonyum (NH4 +) ve amonyak (NH3) ve pH ve sıcaklık 6 bağlıdır. NH4 + nedeniyle bu nedenle katot bölmesine CEM üzerinden akım tarafından tahrik edilebilir yüksek bir tan konsantrasyonuna ve anot odası içinde nötr pH değerinde ve pozitif yüklü türler yakınında bol miktarda mevcuttur. Mevcut hidroksit iyonları ve hidrojen gazı üretimine yol açan, katodda su azaltma tahrik eder. TAN denge nedeniyle katot odasının (> 10.0) yüksek pH yaklaşık% 100 NH 3 geçer. NH3 kolaylıkla bir asit çözeltisi içinde kalan konsantre edilir emme sütununa sıyırma biriminden hava yoluyla aktarılabilir bir gazdır.
Bu teknoloji gübre gibi N-zengin akarsu anaerobik sindirim sırasında amonyum toksisitesini azaltmak için bir potansiyele sahiptir, böylece, bu atık derelerden enerji geri kazanımı artırarak aynı anda isekurtarma besinler 4. Amonyum elektrokimyasal ve bioelectrochemical çıkarma ayrıca idrar ve böylece bir AAT 7 de besin kaldırılması için maliyetleri kaçınarak gibi yüksek TAN içerikli atık akışları üzerindeki besin kurtarma tekniği olarak uygulanabilir.
modüler bir reaktör kullanımı burada sunulan protokol, birçok farklı elektrokimyasal ve bioelectrochemical deney için bir temel olarak hizmet edebilir. Aşağıdaki protokol açıklandığı gibi elektrod tipi, membranlar ve çerçeve kalınlıkları farklı birleştirilebilir. protokolünün amacı, bir elektroliz hücresi kullanılarak elektrokimyasal amonyum geri kazanım ve biyo-elektrokimyasal amonyum kurtarma ile karşılaştırılması için bir araç sağlamaktır. sistemleri çıkarma verimliliği, güç girişi ve tekrarlanabilirlik açısından değerlendirilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Ayıklama ve Soğurma Birimleri reaktör Montaj ve Bağlantı
- Reaktör inşa etmek için gerekli tüm malzemeyi toplayın: elektrotlar, çerçeveleri ve kauçuklar (Malzeme Listesi). Dikkatle reaktörü montaj sırasında sızıntı olmaması için aynı boyutlara tüm parçaları kesti.
- Reaktör bölümlerinde delikler erkek konnektörüne bir erkek sığdırmak için. Referans elektrot uygun reaktör bölmeleri birinin tarafında ortasında bir ek delik delin.
- Emme kolon için 1 MH 2 SO 4 bir stok hazırlayın. Amonyak yüksek yükleri karşılamak için gerekli bu konsantrasyon artırın.
- Membran, üreticinin talimatlarına göre ön işleme tabi olduğundan emin olun. C, 3 dakika süre ile 2 mM CTAB (deterjan) içinde ıslatılmasıyla keçe elektrodun ön işleme tabi. Demineralize su 8 ile keçe karbon durulayın. Bir PR gerektirmez elektrokimyasal deneyler için kararlı anotetreatment.
- Reaktör tipine göre sırayla farklı reaktör parçaları yığını. Biyoreaktör için: Perspex plak, kauçuk, paslanmaz çelik akım toplayıcı, ön işlem grafit, Perspex reaktör bölmesi, kauçuk, katyon değişim membranı, kauçuk, ayırıcı malzeme, paslanmaz çelik hasır elektrot, kauçuk, pleksiglas reaktör bölmesi, kauçuk, pleksiglas uç plakası hissettim
- Perspex uç plakası, kauçuk, son plak ile IROX anot, Perspex reaktör bölmesi, kauçuk, ayırıcı, kauçuk, katyon değişim membranı, kauçuk, ayırıcı malzeme, paslanmaz çelik hasır elektrot, kauçuk, pleksiglas reaktör aşağıdaki gibidir: elektrokimyasal hücre için reaktör parçaları Stack bölmesi, kauçuk, pleksiglas plak.
- Reaktörün bağlantı noktalarını kapatmak için teflon kullanın. Bir bioelectrochemical hücresi, bir elektrokimyasal hücre olması halinde, katot veya anotlu durumda anot: çalışma elektrodu ile aynı referans elektrot yerleştirin.
- Fındık kullanın vecıvataları reaktörü kapatmak için. Basıncın dengelenmesi için ters tarafta sıkın. Parmak sıkı olarak reaktörü kapatmak için araçlarını kullanın etmeyin tamamen kapalı reaktör sağlamak için yeterli değildir.
- Reaktör sızdırmaz olup olmadığını test etmek için su ile reaktörü doldurun. Sızıntı görünüyorsa cıvataları yeterince sıkılır ise, çek veya reaktör montaj sırasında reaktör parçalarından biri taşındı eğer. Sızıntı tespit edilirse, reaktörden su boşaltın.
- Yarım sütunlar doldurmak için şerit ve emme sütununda hem de Raschig halkaları ekleyin.
- Tüm pompalar akış hızını ayarlayın. Reaktör ve sıyırma ve emme birimlerine hava pompası (Şekil 1) besleme ve sirkülasyon pompaları bağlayın. Mümkün olduğunca boru uzunluğunu en aza indirmek.
- 1, MH 2 SO 4, 250 ml ile emme sütunu doldurun, bu Raschig halkaları kapsamalıdır. Pompa açıldığında hava akımı iyi asit karışımları emin olun. Artırın veya arındırma kolonunun tasarımı ve hava pompası kapasitesine göre asit düşürür.

Amonyum çıkarma sağlayan bioelectrochemical sistemi için Şekil 1. Reaktör kurulumu. Burada sunulan sistem sürekli modda çalışır. Katı çizgiler sıvı akışını temsil, noktalı çizgiler gaz akışını temsil eder. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
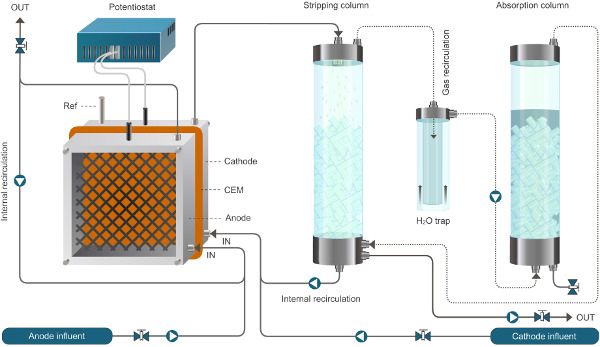
Amonyum çıkarma sağlayan bioelectrochemical sistemi için Şekil 2. Reaktör kurulumu. Burada sunulan sistem sürekli modda çalışır. Katı çizgiler sıvı akışını temsil, noktalı çizgiler gaz akışını temsil eder.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
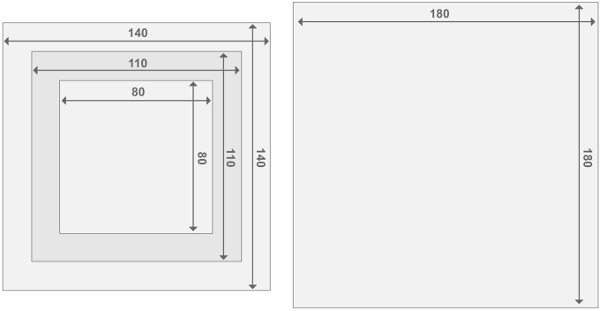
Perspex reaktör çerçevelerinin Şekil 3. tasarımı. Her reaktörün özelliği, iki uç plakası reaktörler ve 2 reaktörü bölmeden oluşmaktadır. Tüm parçalar 2 cm arasında bir kalınlığa sahiptir. Diğer malzemelerin boyutunu ilgili detaylar Malzeme Listesi'nde bulunabilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
2. Bioanode Driven Ekstraksiyon
- Ortamının hazırlanması.
- Tablo 1 9'da tarif edildiği gibi. Bioreaktör olarak bir anolit Hazırlama nitrojen açısından zengin olan atık akımının taklit etmek için ortam içinde amonyum konsantrasyonunu artırır.
- Medi saklamak içinum öncesi karbon kaynağı kontaminasyonu ile bitmediği sağlamak için orta otoklav, kullanmak için. Tablo 1'e göre vitamin ve eser elementlerin hazırlayın ve otoklav ve orta soğuduktan sonra ekleyin.
- Oksijenin ayrılması için en az 30 dakika için azot gazı ile tasfiye ederek orta yıkayın. Bunu yapmak için, ortam içine bir boru veya iğne yerleştirin ve azot gazı akımı açın.
- Katolit olarak iletken bir çözelti hazırlayın. Bu durumda, kostik üretimine izin vermek için 0.1 M NaCl kullanın.
| Bileşen | Miktar | ||
| Na 2 HPO 4 | 6 g / l | ||
| KH 2 PO 4 | 3 g / L, | ||
| NaCl | 0.5 g / l | ||
| NH4CI | 0.5 g / l | ||
| MgSO 4 · 7H 2 O | 0.1 g / l | ||
| CaCl2 · 2H 2 O çözeltisi (14.6 g / L) | 1 mi | ||
| Sodyum Asetat | 2 gr (start-up için) / L | ||
| İz Elementler | 1 mi | ||
| Vitamin çözeltisi | 1 mi | ||
| (1,000x) Elements Trace | g / l | Vitaminler (1,000x) | g / l |
| CoCl2 | 0.1 | biyotin | 0.004 |
| Na 2 MoO 4 .2H 2 O | 0.01 | folik asit | 0.004 |
| H 3 BO 3 | 0.01 | piridoksin hidroklorür | 0.02 |
| 2 mg Cı 2 .6H 2 O | 3 | b 2 vitamini | 0.01 |
| ZnCl2 | 0.1 | tiamin hidroklorür | 0.01 |
| CaCl2 .2H 2 O | 0.1 | nikotinik asit | 0.01 |
| NaCl | 1 | DL-kalsiyum pantotenat | 0.01 |
| nitrilotriasetik asit | 1.5 | Vit B12 | 0.0002 |
| AICI3 .6H 2 O | 0.01 | s -aminobenzoik asit | 0.01 |
| CuCI 2 | 0.01 | lipoik (tioktik asit) | 0.01 |
| FeCI 2 | 0.1 | miyo -inositol | 0.01 |
| MnCl2 .2H 2 O | 0.5 | Kolin klorür | 0.01 |
| KOH kullanılarak pH 6.5'e ayarlayın | niasinamid | 0.01 | |
| piridoksal hidroklorür | 0.01 | ||
| sodyum askorbat | 0.01 |
Biyo-anot tahrik amonyum ekstre Tablo 1. Anolit terkip.
- Biyoreaktör aşılama
NOT: Bir karışık kültür inokulum kullanılır ve reaktör koşulları, belirli elektro-organizmalar için seçmek gibi steril koşullar altında çalışarak, bu biyoreaktör için gerekli değildir.- Inokulum hazırlayın. Bu biyoreaktör, bir fermentasyon dahil olmak üzere aktif anaerobik biyoreaktörlerin atıklarının 30 mi karışımı hazırlamakBir bioanode, bir anaerobik çürütücü ve / veya ham atıksu. Bir şırıngaya karışımı toplamak.
- Oksijen girmek için izin vermiyor ise kararlı basınç tutmak için anolit şişe N2 ile dolu bir gaz torbasını bağlayın. Anolitin hacmi ile aşılama kaynağı karıştırın (burada aşılama kaynağı 30 ml anolitin 100 mi) ortamı şişeye inokulum ile şırınga boşaltılmasıyla elde edilebilecektir. Anot bölmesini doldurmak için gerekli hacim elde etmek için emin olun.
- Bir şırınga kullanılarak, ayrı ayrı çözeltiler ile eş zamanlı olarak anot ve katot bölmesi doldurun. Anolit çözeltisi oksijenin olmayan bir örnekleme noktası üzerinden çıkartılabilir şekilde anolit şişeye N2 ile doldurulmuş bir gaz torbası bağlayın. Transferler arasında bir musluk ile örnek noktasını kapatın.
NOT: Her iki reaktör bölmeleri aynı anda doldurulur emin olmak için bir meslektaşı ile birlikte bu adımı gerçekleştirin. - Her iki reaktör bölmeleri dolu olduğunda, açmakyaklaşık 6 L / saat arasında bir devridaim oranında sirkülasyon pompası.
- Elektrot çalışma gibi anot kullanarak, üç elektrotlu potansiyostat kablosunu bağlayın. Anot bölmesine referans elektrodu yerleştirin.
- Potansiyostat yazılımını kullanarak kronoamperometri modunda potansiyostatla açın. -200 MV vs Ag / AgCl sabit anot potansiyeli seçin.
- Amonyum çıkarılması için sürekli bir reaktör çalıştırma
Not: biyofilm geliştikçe, mevcut asetat tüketimi ile üretilecektir. Asetat tükenmesi bir sonucu olarak, akım (Şekil 3 Sonuçlar bölümüne bakınız) düşecektir.- Sürekli besleme değiştirmek için, anot ve katot besleme pompası açın. Pompa hızı hidrolik kalma süresini (HRT) belirleyecektir. Burada, 6 saat bir HRT reaktörünü çalıştırmak.
- Şerit ve emme ünitesinin hava pompası açın. Kapalı bir döngü içinde havanın tekrar sirkülasyonunu veya dolaşımdaortam havasını kullanarak açık döngü. Hava akış yapılandırma emme verimliliği etkileyebilir.
- Haftada üç kez orta yenileyin. Adımlarda açıklandığı gibi taze anolit ve katolitin hazırlayın 2.1.1-2.1.4.
- Bu adımlardan sonra, akın hattı üzerinde bir kelepçe koymak, yem pompayı durdurun, kapalı besleme şişe N2 ile dolu bir gaz çanta takmak eski ve yeni şişe geçiş ve nihayet kelepçeleri çıkartın ve pompayı yeniden başlatın.
- Yem yenilenir her zaman, 5 ml iletkenlik, pH, asetat içeriği ve amonyum konsantrasyonunun ölçülmesi için anolitin ve katolitin atık ve akan sıvı örnekleri alır.
- Besleme değiştirirken, pH değerinin ve TAN analizi izlemek için emme sütununun 3 ml numunenin alır. PH değeri 4 yaklaştığında, yüksek emme verimi sağlamak için taze 1 M sülfürik asit solüsyonu ile emici değiştirin.
- Günümüzdeki ilk artırmak ve daha sonra bir platoya ulaşır gibi, as ölçmekBunu sağlamak için anolit akan ve içinde prostat içerik karbon sınırlama neden değildir: 100 mg / L'nin altına anolit atık asetat konsantrasyonları karbon sınırlama gösterir. Bu durumda, (Tablo 2) besleme maddesi içinde asetat konsantrasyonunun artırılması.
- Mevcut sabitleme asetat sınırlamalar nedeniyle değilse, yavaş yavaş besleme amonyum konsantrasyonunu artırdığı ve ekstraksiyon verimi (Tablo 3) değerlendirmek için mevcut stabilizasyonu bekleyin.
NOT: amonyum konsantrasyonu arttıkça, amonyak toksisitesi ve yüksek iletkenlik biyofilm meydan okuyacak ve akım sonunda bir sonucu olarak düşecek.
| Zaman | Sodyum asetat miktarı, anot besleme (g / l) eklendi |
| Gün 0 - Gün 35 | 2 |
| Gün 35 - Gün 37 | 3 |
| Gün 37 - Gün 51 | 4 |
| Gün 51 - Gün 61 | 5 |
Bioanode tahrik amonyum çıkarılması için anolit sodyum asetat Tablo 2. konsantre.
| Zaman | NH4 HCO 3 miktarı anot besleme (g / l) eklendi | Faz |
| Gün 0 - Gün 16 | 2.26 | Ben |
| Gün 16 - Gün 26 | 4,5 | II |
| Gün 26 - Gün 33 | 9 | III |
| Gün 33 - Gün 40 | 14.1 | IV |
| Gün 40 - Gün 47 | 20 | V |
| Gün 47 - Gün 54 | 25.4 | VI |
| Gün 54 - Gün 63 | 31 | VII |
Tablo bioanode tahrik amonyum çıkarılması için anolitin içinde amonyum 3. Konsantrasyon. Fazlar akım yoğunluğu grafikte gösterilmiştir (Şekil 2).
3. Elektrokimyasal Ekstraksiyon
- Ortamının hazırlanması
- . Tablo 4 4'e göre anolit olarak sentetik bir atık su akımının hazırlanması 1, 3, ya da 5 g kadar N / L'lik bir son konsantrasyon elde etmek üzere, amonyum sülfat ekleyin.
- Katolit için 0.1 M NaCl çözeltisi hazırlayın.
| Bileşen | Miktar |
| 2 HPO 4 .2H 2 O Na | 1.03 g / l |
| KH 2 PO 4 | 0.58 g / l |
| MgSO 4 · 7H 2 O | 0.1 g / l |
| CaCl2 .2H 2 O | 0.02 g / l |
| (NH4) 2 SO4 | deneye bağlı olarak, 1/3/5 g kadar N / l nihai konsantrasyon elde etmek üzere |
Elektrokimyasal amonyum çıkarma 4 Tablo 4. Anolit kompozisyon.
- Amonyum çıkarılması için sürekli bir reaktör çalıştırma
- Reaktör bölmeleri doldurmak için besleme pompası açın. Sürecini hızlandırmak için geçici pompa oranını artırmak.
- Reaktör dolu bir kere 6 saat bir HRT elde etmek için pompa hızını azaltın. 6 L / st bir oranda yeniden dolaşım pompası ile çalıştırın. Içeriye akan (5 mi) içindeki bir örnek al.
NOT: deney boyunca periyodik olarak akış oranını ölçmekbu farklılık yok sağlamak. - Şerit ve emme ünitesi başlatın. Bu birimin çalışması biyoreaktör aynıdır.
- Potansiyostat yazılımını kullanarak kronopotansiyometri modunda potansiyostatla açın. İlk zarı polarize ve yalnız nedeniyle difüzyon nitrojen akı belirlemek için yaklaşık 0,5 A / m² düşük akım yoğunluğu uygulayın.
- Sistem 24 saat süre ile polarize edildiği zaman, bir deney için gerekli akım yoğunluğu uygulanır. Genellikle 10 A / m² 50 A / m² arasında değişen, farklı akım yoğunluğu test edin. Akım yoğunluğu artırmadan önce anot ve katot atık ve emme sütunun örnekleri alın.
NOT: 3 HRT döngüsünden sonra, reaktör kararlı duruma yaklaşım gerekir. - Reaktör kararlı duruma ulaştığında, bir zaman boyunca en az 3 numune almak. Anot ve katot atık ve emme sütunu (her biri 5 mi) ile ilgili örnekler alın. Örnekleme hacmi, tarih ve saati yazın.
- Gerekirse anot akan istikrar bağlı olarak, yeni bir anot giren örnek almak. Gerçek atıksu kullanıldığında bu gereklidir.
- Böyle uygulanan akım yoğunluğu ve TAN konsantrasyon olarak test koşulları, değiştirin. Her değişiklikten sonra, reaktör örnekleri alarak önce en az 3 HRTs için stabilize edelim.
- Emme sütununun pH 4 yaklaştığında, taze 1 M sülfürik asit solüsyonu ile emici değiştirin.
4. Numune Analizi
- PH ve örneklerin iletkenliği uçucu amonyak kaybı nedeniyle yanlışlıklar azaltmak için numune ile aynı gün ölçülür. Yeterince kalibre pH ve iletkenlik problar kullanılarak pH ve iletkenlik ölçün.
- Numune hemen ölçülür değilse TAN analizi (iki reaktör) ve 4 ° C 'de yağlı asit analizi (biyoreaktör) mağaza örnekleri. 0.45 mikron filtreler aracılığıyla biyoreaktör anot mahsulünden ve akan filtre örnekleri yenidenyağ asitleri korumak biyokütle taşımak ve yardım. NH3 kaybını en aza indirmek için, ağız, tüm numune tüpleri doldurun.
- Standart buhar damıtma yöntemi veya TAN 10 ölçmek için herhangi bir diğer güvenilir yöntemle TAN olarak azot ölçün.
- Iyon kromatografisi ve gaz kromatografisi 11 ile güvenilir bir yöntem ile asetat gibi yağ asitleri, ölçün.
5. Veri Analizi ve Hesaplamalar
- Yazılım potansiyostat veri dosyasını İhracat ve bir elektronik tablo programı ithal. Elektrokimyasal değişkenler veri noktalarının sayısını azaltmak ve çizdirmek zaman eğrileri düzeltmek için saat başına ortalamaları hesaplayın.
- Hesaplamalar için bir veri dosyasındaki tüm ölçülen verileri (pH, amonyum, VFA) toplayın. hesaplamalar sonuç bölümünde tartışılmıştır.
- Biyoreaktör tarafından mevcut üretim hesaplayın. Bu en iyi, Denklem 1 aşağıdaki gibi hesaplanabilir (akım yoğunluğu olarak ifade edilir12):
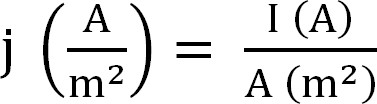 Denklem 1
Denklem 1
akım yoğunluğu, mutlak akım ve elektrot bir tahmin yüzey alanı olarak j ile. Bazı yazılımında bu deney başlamadan önce, anot yüzey alanına girerek otomatik olarak hesaplanır olması mümkündür. - Amonyum çıkarma ile ilgili parametreleri hesaplamak
- Azot akışı hesaplayın. Daha sonra, bir akım yoğunluğunun (I H) olarak ifade edilen zar yüzey alanına, azot akışı (g kadar N / m / gün) normalize edilir. CE hesaplamak için bu değeri kullanın (Denklem 2, 3, ve 4):
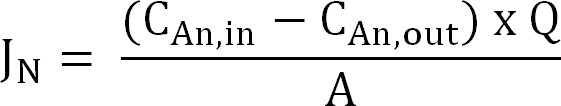 Denklem 2
Denklem 2
burada C An, (g N / L) ve C An, dışarı (g N / L) ölçülen amonyum konsantrasyonları ve anot bölmesine dışarı geliyor de,sırasıyla. S (L / D) anot akış oranı olmaktadır ve A (m, 2) (öngörülen anot ve katot yüzey alanına eşittir) membran yüzey alanıdır. - Akım yoğunluğu (burada N, A / m) olarak azot akışı sunun:
 Denklem 3
Denklem 3
Z NH4 burada (-) NH4 + ve ücret, F, bir Faraday sabiti (96.485 ° C / Mol) ve M, bir nitrojen moleküler ağırlık (14 g / mol) eklendi. - Mevcut verimliliği (CE,%) olarak hesaplanır:
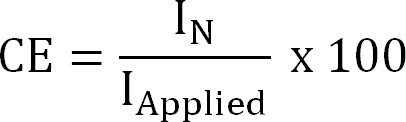 Denklem 4
Denklem 4
Ben Uygulamalı (A / m²) uygulanan (elektrokimyasal ekstraksiyon) veya ölçülen (bioelectrochemical çıkarma) akım yoğunluğu olduğu. - Teorik azot akı hesaplayın. Maksimum teorik azot hesaplayınBelirli bir için akı (J, N, Max, g N / m² / d) Mevcut ve membran yüzey alanı (Denklem 5) uygulanan:
 Denklem 5
Denklem 5 - Azot giderimi verimliliği (RE,%) hesaplayın. Kaldırma verimliliği gibi anolitin kaldırılır amonyum yüzdesine bakın. Anot akan ve çıkış TAN konsantrasyonları (Denklem 6) den hesaplayın.
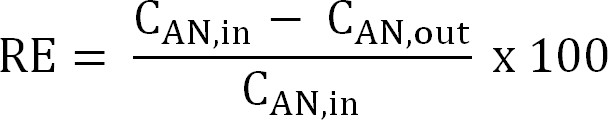 Denklem 6
Denklem 6 - Belirli bir akın TAN yük için maksimum teorik azot giderimi verimi (RE max,%) hesaplayın ve akım (Denklem 7) uygulanan:
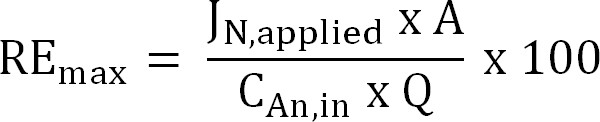 Denklem 7
Denklem 7
buradaki J, N, uygulanan (g K m, -2 d - 1), bir nitrojen akışı olarak ifade uygulanan akım yoğunluğudur.
- Azot akışı hesaplayın. Daha sonra, bir akım yoğunluğunun (I H) olarak ifade edilen zar yüzey alanına, azot akışı (g kadar N / m / gün) normalize edilir. CE hesaplamak için bu değeri kullanın (Denklem 2, 3, ve 4):
- (Denklem 8) olarak gaz / sıvı oranını hesaplayın:
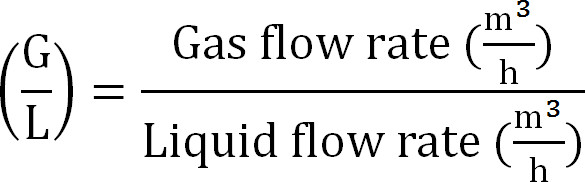 Denklem 8
Denklem 8 - Emme sütununun maksimum kapasitesini hesaplayın. (Maksimum teorik azot akışı J nmax, akma TAN konsantrasyonu (mol / L), işlem t, membran yüzey alanı A zaman ve emici V hacminden emme sütununa maksimum teorik N yük hesaplayın Denklem 9):
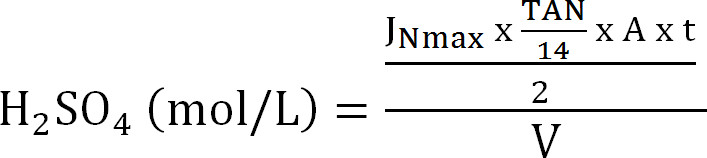 Denklem 9
Denklem 9 - Sıyırma verimliliği SE (%) (Denklem 10) hesaplayın:
 60; Denklem 10
60; Denklem 10 - Katyon değişim zarı boyunca amonyum çıkarılması için enerji girişini hesaplayın (Denklem 11) (E, N, kWh / kg N olarak ifade edilir):
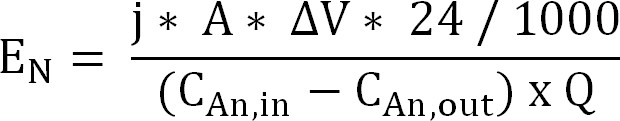 Denklem 11
Denklem 11
Anot ve katot arasında ΔV ölçülen potansiyel farkı ile. Biyoreaktör durumunda, ΔV bütün çalışma için ortalama alınır elektrokimyasal reaktör için, numune alma süresi için ortalama olarak hesaplandı.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Kronoamperometri biyoreaktörden sonuçlanır
kronoamperometri sonuçları, Denklem 1 'e göre hesaplanan, (Şekil 4), sürekli bir reaktör için tipik bir grafiği göstermektedir. Deneyin başlangıcında, anod ve katod devridaim modunda çalıştırılmıştır. Bu geliştirmek için bir biyofilm ve mevcut üretim başlangıcını sağlar. Operasyon 5 gün sonra, akım yoğunluğu üretiminde bir azalma ve ardından maksimum ulaştı. Bu biofilm akı...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu yazının bir bioelectrochemical ve amonyum kurtarma için bir elektrokimyasal hücre kurmak için gerekli araçları sağlar. Sonuçlar bölümünde sunulan hesaplamalar sistem performansının değerlendirilmesi için parametreleri sağlamak. Biyolojik ve elektrokimyasal sistemler kurulum ve fonksiyon benzer. İki sistem arasındaki temel fark bioelectrochemical kurulum için sabit bir anot potansiyeli karşı elektrokimyasal hücre için bir sabit akım seçimdir. abiyotik kurulum için sabit akım elektrot reaksi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
Referanslar
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Standard Methods For The Examination Of Water And Wastewater. Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. , American Public Health Association. (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. Elements of Physical Chemistry. , Oxford University Press. Oxford, UK. (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800(2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır