Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Elektrochemisch und Bioelectrochemically Induzierte Ammonium Erholung
In diesem Artikel
Zusammenfassung
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Zusammenfassung
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Einleitung
Rückgewinnung von Wertstoffen aus Abwasser gewinnt an Bedeutung als wertvolle Ressourcen knapp und die Behandlung ohne Rückgewinnung werden nur einen Preis. Abwasser enthält sowohl Energie und Nährstoffe, die wiederhergestellt werden können, und Nährstoffrückgewinnung kann helfen, den Produktionskreislauf 1 zu schließen. Rückgewinnung von Energie durch anaerobe Vergärung ist ein gut etabliertes Verfahren, während die Rückgewinnung von Nährstoffen ist weniger verbreitet. Verwertung von Nährstoffen aus der flüssigen Abfallströmen, wie Urin und Dung wurde umfassend untersucht, beispielsweise durch die Produktion von Struvit und direkte Ammoniakstrippung 2,3. Die Notwendigkeit einer chemischen Zusatz ist jedoch ein Nachteil dieser Verfahren 4. Hier präsentieren wir eine Technik zur Gewinnung von kationischen Nährstoffen aus Abfallströmen, einschließlich Kalium und Ammonium. Die kationische Form dieser Nährstoffe ermöglicht die Wiederherstellung unter Verwendung einer ionenselektiven Membran, die in einem elektrochemischen System. In diesem Fall wird die electrochemical-System besteht aus einer Anodenkammer (wo Oxidation stattfindet), eine Kathodenkammer (wo die Reduktion stattfindet) und eine ionenselektive Membran, die Räume trennen. Eine Spannung wird an die Zelle angelegt, um einen Stromfluss von der Anode zur Kathode zu erzeugen. Diese Spannung kann durch eine externe Energiequelle, um Wasser Oxidations- und Reduktionsreaktionen fahren erzeugt werden. Alternativ kann die anodische Oxidation, beispielsweise aus organischen Verbindungen, können durch elektro Bakterien, weniger Leistung benötigt, katalysiert werden. Um die Schaltung für den Ladungsausgleich zu schließen und zu halten, muß ein geladener Spezies zwischen den Elektroden für jeden erzeugten Elektronen migrieren. Ammoniumtransport aus der Anodenkammer in die Kathodenkammer durch eine Kationenaustauschmembran (CEM) können so kompensiert den Fluss der Elektronen 4,5.
Die hier vorgestellte Technik entfernt nicht nur Ammonium aus Abfallströmen, sondern ermöglicht auch die Erholung. Gesamtammoniakstickstoff (TAN) im Gleichgewicht sowohl ammon bestehtium (NH 4 +) und Ammoniak (NH 3), und ist abhängig von pH-Wert und Temperatur 6. NH 4 + ist reichlich durch hohe TAN Konzentration und in der Nähe von neutralem pH-Wert in der Anodenkammer und diese positiv geladene Spezies kann daher durch den Strom über die CEM in den Kathodenraum gefahren werden zur Verfügung. Der Strom treibt die Reduktion von Wasser an der Kathode, was zu der Erzeugung von Hydroxidionen und Wasserstoffgas. Die TAN Gleichgewicht verschiebt sich nahezu 100% NH 3 durch den hohen pH-Wert in der Kathodenkammer (> 10,0). NH 3 ist ein Gas, das leicht durch Luftzirkulation von der Destillationseinheit in die Absorptionskolonne, wo er eingeschlossen und in einer Säurelösung konzentriert übertragen werden kann.
Diese Technologie hat das Potenzial, Ammonium Toxizität während der anaeroben Vergärung von N-reichen Strömen wie Gülle zu verringern, wodurch die Energierückgewinnung aus diesen Abfallströmen, während gleichzeitigWiederherstellen Nährstoffe 4. Elektrochemische und bioelektrochemische Extraktion von Ammonium kann auch als Nährstoffrückgewinnungstechnik für Abfallströme mit hoher TAN Inhalte wie beispielsweise Urin, wodurch Kosten für Nährstoffentfernung in einer Kläranlage 7 Vermeidung angewendet werden.
Die hier vorgestellte Protokoll kann als Basis für viele verschiedene elektrochemische und bioelektrochemische Experimenten dienen, wie wir eine modulare Reaktor. Verschiedene Elektrodenarten, Membranen und Rahmenstärken können kombiniert werden, wie in der nachstehenden Protokoll erläutert. Das Ziel des Protokolls ist es, ein Mittel für den Vergleich des elektrochemischen Ammonium Verwertung und bioelektrochemische Ammoniumrückgewinnung unter Verwendung einer Elektrolysezelle bereitzustellen. Die Systeme sind in Bezug auf die Extraktionseffizienz, Stromaufnahme und Reproduzierbarkeit bewertet.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Montage der Reaktor und Anschließen der Stripping und Absorption Units
- Sammeln Sie alle notwendigen Materialien, um den Reaktor zu bauen: Elektroden, Rahmen und Gummi (Siehe Liste der Materialien). Alle Teile, die die gleichen Abmessungen Schneiden Sie vorsichtig, um Lecks zu vermeiden, während der Montage des Reaktors.
- Die Bohrungen in den Reaktorsektionen einen Stecker auf Stecker passen. Bohrgerät ein zusätzliches Loch in der Mitte der Seite von einer der Reaktorsektionen, um die Referenzelektrode zu passen.
- Bereiten Sie einen Bestand von 1 MH 2 SO 4 für die Absorptionskolonne. Erhöhen Sie diese Konzentration als notwendig, um höhere Lasten von Ammoniak unterzubringen.
- Sicherzustellen, daß die Membran nach den Anweisungen des Herstellers vorbehandelt. Vorbehandlung der Kohlenstoff-Filz Elektrode durch Eintauchen in 2 mM CTAB (Reiniger) für 3 min. Spülen Sie die Kohlenstoff-Filz mit demineralisiertem Wasser 8. Die stabile Anode zur elektrochemischen Experimenten keine pr erforderlichetreatment.
- Staple verschieden Reaktorteile, um nach dem Reaktortyp. Aus dem Bioreaktor: Perspex Endplatte, Gummi, Edelstahl Stromkollektor, Filz vorbehandelten Graphit Perspex Reaktorraum, Gummi, Kationenaustauschmembran, Gummi, Abstandsmaterial, Stahlgitterelektrode Edelstahl, Kautschuk Perspex Reaktorraum, Gummi, Perspex Endplatte
- Stack die Reaktorteile für die elektrochemische Zelle wie folgt: Perspex Endplatte, Gummi, IrOx Anode durch die Endplatte, Perspex Reaktorraum, Gummi, Spacer, Gummi, Kationenaustauschmembran, Gummi, Abstandsmaterial, Stahlgitterelektrode Edelstahl, Kautschuk Perspex Reaktor Fach, Gummi, Perspex Endplatte.
- Verwenden Teflon die Anschlussstutzen des Reaktors zu versiegeln. Platzieren der Referenzelektrode im selben Raum wie die Arbeitselektrode: Anode in dem Fall einer bio-elektrochemischen Zelle, die Kathode bzw. Anode in dem Fall einer elektrochemischen Zelle.
- Verwenden Sie Schrauben undSchrauben, um den Reaktor zu schließen. Ziehen Sie die Schrauben an den gegenüberliegenden Seiten, um den Druck auszugleichen. Keine Werkzeuge verwenden, um den Reaktor als handfest schließen ist genug, um einen vollständig abgedichteten Reaktor zu gewährleisten.
- Füllen Sie den Reaktor mit Wasser zu testen, ob der Reaktor leckagefrei ist. Treten Undichtigkeiten auf, zu prüfen, ob die Schrauben fest genug angezogen, oder wenn eine der Reaktorteile bewegt werden, während der Montage des Reaktors. Haben Sie keine Leckagen festgestellt werden, entleeren Sie das Wasser aus dem Reaktor.
- Fügen Raschig-Ringe sowohl in der Band und Absorptionskolonne, um die Spalten in der Mitte zu füllen.
- Kalibrierung der Strömungsrate aller Pumpen. Schließen Sie die Feed und Umwälzpumpen in den Reaktor und die Luftpumpe zu den Strippen und Absorptionseinheiten (Abbildung 1). Minimieren der Länge der Rohrleitung so weit wie möglich.
- Füllen Sie die Absorptionskolonne mit 250 ml 1 MH 2 SO 4, sollte es die Raschig-Ringe zu decken. Sicherzustellen, dass der Luftstrom mischt die Säure auch wenn die Pumpe eingeschaltet ist. Erhöhen oder Verringern der Lautstärke der Säure, bezogen auf die Strippkolonne Design und Luftpumpenleistung.

Abbildung 1. Reactor Setup für die bioelektrochemische System, mit dem Ammonium-Extraktion. Das hier vorgestellte System arbeitet im Dauerbetrieb. Durchgezogene Linien stehen Flüssigkeitsstrom, gestrichelten Linien Gasstrom. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
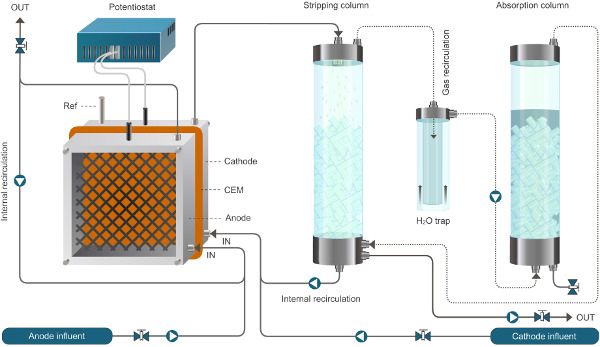
Abbildung 2. Reactor Setup für die bioelektrochemische System, mit dem Ammonium-Extraktion. Das hier vorgestellte System arbeitet im Dauerbetrieb. Durchgezogene Linien stehen Flüssigkeitsstrom, gestrichelten Linien Gasstrom.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
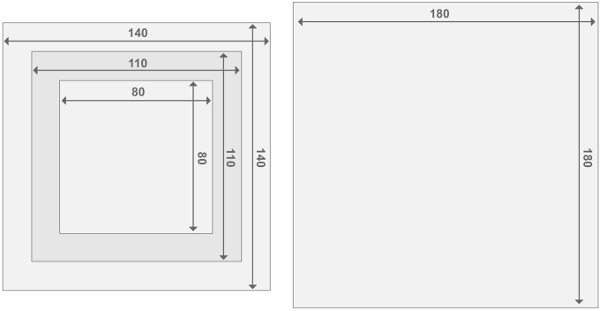
Abbildung 3. Entwurf der Plexiglas Reaktor Frames. Jeder Reaktor besteht aus zwei Endplatten Reaktoren und 2 Reaktorsektionen zusammen. Alle Teile haben eine Dicke von 2 cm. Die Angaben über die Größe der anderen Materialien in der Materialliste zu finden. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
2. Bioanode Driven Extraction
- Vorbereiten der Medien.
- Bereiten Anolyt für den Bioreaktor, wie in Tabelle 1 9 beschrieben. Erhöhung der Ammoniumkonzentration in dem Medium, um einen stickstoffreichen Abfallstrom zu imitieren.
- Um die medi speichernum vor der Verwendung autoklaviert des Mediums, um sicherzustellen, dass die Kohlenstoffquelle nicht durch Verunreinigungen verarmt ist. Bereiten Sie Vitamine und Spurenelemente gemäß Tabelle 1 und fügen Sie nach dem Autoklavieren und Abkühlen des Mediums.
- Spülen Sie das Medium durch Spülen mit Stickstoffgas für mindestens 30 min, um Sauerstoff zu entfernen. Um dies zu tun, legen Sie eine Röhre oder Nadel in das Medium und schalten Sie den Stickstoffgasstrom.
- Bereiten Sie eine leitende Lösung als Katholyt. In diesem Fall verwenden 0,1 M NaCl zu ätzenden Produktion ermöglichen.
| Komponente | Höhe | ||
| Na 2 HPO 4 | 6 g / L | ||
| KH 2 PO 4 | 3 g / L | ||
| NaCl | 0,5 g / L | ||
| NH 4 Cl | 0,5 g / L | ||
| MgSO 4 · 7H 2 O | 0,1 g / L | ||
| CaCl 2 · 2H 2 O-Lösung (14,6 g / L) | 1 ml | ||
| Natriumacetat | 2 g / l (für die Inbetriebnahme) | ||
| Spurenelemente | 1 ml | ||
| Vitamin-Lösung | 1 ml | ||
| Spurenelemente (1,000x) | g / L | Vitamine (1,000x) | g / L |
| CoCl 2 | 0.1 | Biotin | 0,004 |
| Na 2 MoO 4 · 2H 2 O | 0,01 | Folsäure | 0.004 |
| H 3 BO 3 | 0,01 | Pyridoxinhydrochlorid | 0,02 |
| Mg 2 Cl 2 · 6H 2 O | 3 | Riboflavin | 0,01 |
| ZnCl 2 | 0.1 | Thiamin-Hydrochlorid | 0,01 |
| CaCl 2 · 2H 2 O | 0.1 | Nikotinsäure | 0,01 |
| NaCl | 1 | DL-Calciumpantothenat | 0,01 |
| Nitrilotriessigsäure | 1.5 | Vit B12 | 0,0002 |
| AlCl 3 · 6H 2 O | 0,01 | p-Aminobenzoesäure | 0,01 |
| CuCl 2 | 0,01 | Liponsäure (Thioctsäure) Säure | 0,01 |
| FeCl 2 | 0.1 | myo-Inositol- | 0,01 |
| MnCl 2 · 2H 2 O | 0,5 | Cholinchlorid | 0,01 |
| Auf pH 6,5 unter Verwendung von KOH | Niacinamid | 0,01 | |
| Pyridoxalhydrochlorid | 0,01 | ||
| Natriumascorbat | 0,01 |
Tabelle 1 Anolytzusammensetzung für Bio-Anode getrieben Ammonium Extraktion.
- Inokulation des Bioreaktors
HINWEIS: sterile Arbeiten nicht erforderlich ist, diesem Bioreaktor, wie eine Mischkultur Inokulum verwendet wird und die Reaktorbedingungen werden für die spezifische elektro Organismen auszuwählen.- Bereiten Sie den Impfstoff. Aus diesem Bioreaktor, bereiten ein 30 ml Mischung aus Abwässern aus aktiven anaeroben Bioreaktoren mit einem FermenterEin bioanode, eine anaerobe Faul und / oder Rohabwasser. Sammeln des Gemisches in einer Spritze.
- Schließen Sie einen Gassack mit N 2 zum Anolyten Flasche gefüllt, um den Druck stabil, während nicht so Sauerstoff zu geben halten. Mischen das Inokulum Quelle mit einem Volumen von Anolyt (hier 100 ml Anolyt für die 30 ml Inokulum Quelle) durch Entleeren der Spritze, die mit Inokulum in das Medium Flasche. Achten Sie darauf, die Lautstärke erforderlich, den Anodenraum füllen zu erhalten.
- Unter Verwendung einer Spritze füllen die Anoden- und Kathodenkammer gleichzeitig mit ihren entsprechenden Lösungen. Verbinden eines Gassacks mit N 2 zum Anolyten Flasche gefüllt, so daß der Anolyt-Lösung kann durch eine Probenentnahmeöffnung, ohne Einführung von Sauerstoff entfernt werden. Schließen Sie den Probenanschluss mit einem Fingertipp zwischen den Übertragungen.
HINWEIS: Führen Sie diesen Schritt zusammen mit einem Kollegen, um sicherzustellen, dass beide Reaktorsektionen gleichzeitig gefüllt. - Wenn beide Reaktorsektionen gefüllt sind, schalten Sie dieUmwälzpumpe bei einer Rückführungsrate von etwa 6 l / h.
- Verbinden Sie das Kabel mit Potentiostat drei Elektroden, wobei die Anode als Arbeitselektrode. Positionieren Sie die Referenzelektrode im Anodenraum.
- Schalten Sie den Potentiostaten in Chronoamperometrie Modus mit der Potentiostaten-Software. Wählen Sie einen festen Anodenpotential von -200 mV gegen Ag / AgCl.
- Ausführen eines kontinuierlichen Reaktor für Ammonium-Extraktion
Hinweis: Da die Biofilm entsteht, werden die aktuelle mit dem Verzehr von Vinylacetat hergestellt werden. Als Folge der Erschöpfung Acetat, wird die aktuelle fallen (siehe Abschnitt Ergebnisse, Abbildung 3).- Um die kontinuierliche Zuführung zu ändern, schaltet die Speisepumpe für die Anode und Kathode. Die Pumpendrehzahl wird die hydraulische Verweilzeit (HRT) zu bestimmen. Hier arbeiten die Reaktor bei einer HRT von 6 Std.
- Einschalten der Luftpumpe von dem Streifen und Absorptionseinheit. Rezirkulieren der Luft in einer geschlossenen Schleife oder zirkulieren in einemOpen-Loop mit Hilfe der Umgebungsluft. Luftstrom-Konfiguration kann die Absorption Effizienz beeinflussen.
- Aktualisieren Sie die Medium dreimal pro Woche. Bereiten Sie frische Anolyt und Katholyt wie in den Schritten beschrieben 2.1.1-2.1.4.
- Nach diesen Schritten legen einen Gassack mit N 2 in die geschlossene Futterflasche gefüllt, stoppen Sie die Förderpumpe, legte eine Klemme an der Zulaufleitung, wechseln die alten und neuen Flaschen und schließlich entfernen Sie die Klemmen, und starten Sie die Pumpe.
- Jedes Mal, wenn das Futter aufgefrischt wird, nehmen Sie 5 ml flüssige Proben des Abflusses und Zulauf der Anolyt und Katholyt für die Messung von Leitfähigkeit, pH-Wert, Gehalt an Vinylacetat und Ammoniumkonzentration.
- Beim Wechsel der Vorschub, eine 3-ml-Probe der Absorptionssäule, um den pH-Wert und die TAN-Analyse überwacht. Wenn der pH-Wert nähert 4, ersetzen Sie die saugfähige mit frischen 1 M Schwefelsäurelösung auf hohe Absorptionseffizienz zu gewährleisten.
- Wie wird der Strom zunächst zu erhöhen und erreichen dann ein Plateau, messen Sie die Asstate Gehalt im Anolyten Zu- und Ablauf, dies zu gewährleisten, wird nicht durch Kohlenstoff verursachte Einschränkung: Acetatkonzentrationen im Anolyten Abwasser unter 100 mg / L zeigen Kohlenstoff Begrenzung. Erhöhen die Acetat-Konzentration im Zulauf in diesem Fall (Tabelle 2).
- Wenn der Stromstabilisierung nicht durch Acetat Einschränkungen verursacht, schrittweise Erhöhung der Ammoniumkonzentration im Zulauf, und warten auf die Stabilisierung der Strom, um Extraktionseffizienzen (Tabelle 3) zu bewerten.
HINWEIS: Da die Ammoniumkonzentration erhöht wird, wird Ammoniak Toxizität und eine hohe Leitfähigkeit des Biofilms Herausforderung und der Strom wird schließlich als Folge sinken.
| Zeit | Menge an Natriumacetat zu der Anodenzuführung (g / l) zugegeben |
| Tag 0 - Tag 35 | 2 |
| Tag 35 - Tag 37 | 3 |
| Tag 37 - Tag 51 | 4 |
| Tag 51 - Tag 61 | 5 |
Tabelle 2. Konzentration von Natriumacetat im Anolyten zur bioanode angetrieben Ammonium Extraktion.
| Zeit | Menge an NH 4 HCO 3 zur Anode Futter (g / l) zugegeben | Phase |
| Tag 0 - Tag 16 | 2.26 | Ich |
| Tag 16 - Tag 26 | 4.5 | II |
| Tag 26 - Tag 33 | 9 | III |
| Tag 33 - Tag 40 | 14.1 | IV |
| Tag 40 - Tag 47 | 20 | V |
| Tag 47 - Tag 54 | 25,4 | VI |
| Tag 54 - Tag 63 | 31 | VII |
Tabelle 3 Konzentration von Ammonium in der Anolyt zur bioanode angetrieben Ammonium Extraktion. Die Phasen werden von der Stromdichte Graphen angegebenen (Abbildung 2).
3. elektrochemische Extraktion
- Vorbereiten der Medien
- Vorbereiten eines synthetischen Abwasserstrom als Anolyt gemäß Tabelle 4 4. Fügen Ammoniumsulfat bis zu einer Endkonzentration von 1, 3 oder 5 g N / l zu erreichen.
- Bereiten Sie eine 0,1 M NaCl-Lösung für den Katholyten.
| Komponente | Höhe |
| Na 2 HPO 4 · 2H 2 O | 1,03 g / L |
| KH 2 PO 4 | 0,58 g / L |
| MgSO 4 · 7H 2 O | 0,1 g / L |
| CaCl 2 · 2H 2 O | 0,02 g / L |
| (NH 4) 2 SO 4 | je nach Experiment, um 1/3/5 g N / l Endkonzentration zu erhalten |
Tabelle 4. Anolyte Zusammensetzung für elektrochemische Ammonium Extraktion 4.
- Ausführen eines kontinuierlichen Reaktor für Ammonium-Extraktion
- Schalten Sie die Förderpumpe, um die Reaktorsektionen zu füllen. Um den Prozess zu beschleunigen vorübergehend erhöhen die Pumprate.
- Reduzieren Sie die Pumpendrehzahl, eine HRT von 6 h zu erhalten, sobald der Reaktor gefüllt. Einschalten der Umwälzpumpe bei einer Rate von 6 l / Std. Nehmen Sie eine Probe des Zuflusses (5 ml).
HINWEIS: Messen Sie den Durchflussmenge in regelmäßigen Abständen während des gesamten Experimentsum sicherzustellen, dass es sich nicht ändert. - Starten Sie das Band und Absorptionseinheit. Betrieb dieser Einheit ist dieselbe wie für den Bioreaktor.
- Schalten Sie den Potentiostaten in Chronopotentiometrie Modus mit der Potentiostaten-Software. Zuerst eine niedrige Stromdichte von etwa 0,5 A / m², um die Membran zu polarisieren und Stickstofffluss durch Diffusion allein bestimmen.
- Wenn das System für 24 Stunden polarisiert worden ist, gelten die Stromdichte für das Experiment notwendig. Testen Sie verschiedene Stromdichten, in der Regel im Bereich von 10 A / m² bis 50 A / m². Probenahmen aus der Anode und Kathode Abwässer und der Absorptionskolonne vor der Erhöhung der Stromdichte.
HINWEIS: Nach 3 HRT-Zyklen, sollte der Reaktor stabilen Zustand zu nähern. - Nachdem der Reaktor stationären Zustand erreicht hat, nehmen Sie mindestens 3 Proben über einen Zeitverlauf. Proben zu entnehmen, die von der Anode und der Kathode Abwässer und der Absorptionskolonne (je 5 ml). Notieren Sie sich die Probenmenge, Datum und Uhrzeit.
- Je nach Stabilität des Anoden Zulauf, nehmen Sie eine neue Anodenzufluss Probe, wenn nötig. Dies ist notwendig, wenn die Real Abwasser verwendet wird.
- Ändern der Testbedingungen, wie angelegte Stromdichte und TAN-Konzentration. Nach jeder Änderung, lassen Sie den Reaktor Stabilisierung für mindestens 3 HRTs vor der Probenahme.
- Wenn der pH-Wert der Absorptionskolonne nähert 4, ersetzen Sie mit frischen 1 M Schwefelsäurelösung das saugfähige.
4. Probenanalyse
- Der pH und die Leitfähigkeit der Proben am selben Tag wie Abtastung Ungenauigkeiten aufgrund des Verlustes von flüchtigen Ammoniak reduzieren. Messen pH und Leitfähigkeit mit ausreichend kalibriert pH- und Leitfähigkeitssonden.
- Wenn die Probe nicht sofort gemessen, zu speichern Proben für TAN-Analyse (beide Reaktoren) und Fettsäureanalyse (Bioreaktor) bei 4 ° C. Filter Proben aus dem Bioreaktor Anodenabfluss und Zulauf durch 0,45 um-Filter neubewegen Biomasse und zur Erhaltung Fettsäuren. Füllen Sie alle Probenröhrchen bis zum Rand, um NH 3 Verlust zu minimieren.
- Messen Sie Stickstoff als TAN von der Norm Dampfdestillationsverfahren oder andere zuverlässige Methode zur Messung TAN 10.
- Messen Fettsäuren wie Acetat durch eine zuverlässige Methode, wie Ionenchromatographie oder Gaschromatographie 11.
5. Datenanalyse und Berechnungen
- Exportieren Sie die Potentiostat-Datei von der Software und importieren Sie sie in ein Tabellenkalkulationsprogramm. Berechnen Sie Mittelwerte pro Stunde für die elektrochemischen Variablen, um die Anzahl der Datenpunkte zu verringern und glätten die Kurven beim Plotten von ihnen.
- Sammeln Sie alle Messdaten (pH, Ammonium, VFA) in eine Datendatei für die Berechnungen. Die Berechnungen werden im Ergebnisteil diskutiert.
- Berechnen Sie die laufende Förderung des Bioreaktors. Dies ist vor allem als Stromdichte, die wie folgt berechnet wird vertreten (Gleichung 1,12):
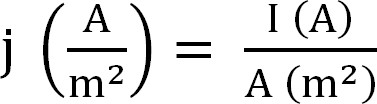 Gleichung 1
Gleichung 1
mit j als die Stromdichte I der absolute Strom und A die projizierte Fläche der Elektrode. In bestimmten Software ist es möglich, dass diese durch Eingabe der Anodenfläche vor dem Beginn des Versuchs automatisch berechnet. - Berechnen Sie die Parameter Ammonium-Extraktion
- Berechnen Sie die Stickstofffluss. Normalisieren Stickstofffluss (g N / m² / d) mit der Membranfläche dann als Stromdichte (I N) ausgedrückt. Verwenden Sie diesen Wert, um die CE berechnen (Gleichung 2, 3 und 4):
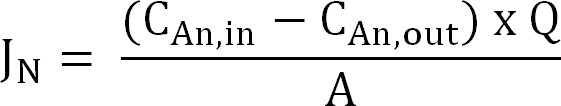 Gleichung 2
Gleichung 2
wobei C ein, in (g N / l) und C ein, aus (g N / l) werden die gemessenen Ammoniumkonzentrationen in und aus dem Anodenraum,jeweils. Q (L / d) ist das Anodenströmungsgeschwindigkeit und A (m 2) ist die Membranfläche (gleich projiziert Anoden- und Kathodenfläche). - Präsentieren Sie die Stickstoffstrom wie der Stromdichte (I N, A / m²):
 Gleichung 3
Gleichung 3
wobei Z NH 4 + (-), ist die Ladung des NH 4 +, F die Faraday-Konstante (96.485 C / Mol) und M das Molekulargewicht von Stickstoff (14 g / mol). - Berechnen Sie die Stromausbeute (CE,%) als:
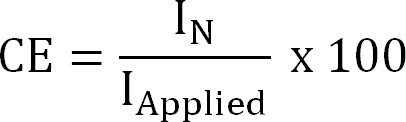 Gleichung 4
Gleichung 4
wo ich Angewandte (A / m²) ist die Anwendung (elektrochemische Extraktion) oder gemessen (bioelektrochemische Extraktion) Stromdichte. - Berechnen Sie den theoretischen Stickstofffluss. Berechnen Sie die maximale theoretische StickstoffFluß (J N, Max, g N / m² / d) bei einer gegebenen zugeführten Strom und der Membranoberfläche (Gleichung 5) als:
 Gleichung 5
Gleichung 5 - Berechnen Sie die Stickstoffentfernung Effizienz (RE,%). Beziehen sich auf den Prozentsatz von Ammonium ist, welches aus der Anolyt als Entfernungseffizienz entfernt wird. Berechnen von der Anode Zu- und Ablauf TAN-Konzentrationen (Gleichung 6).
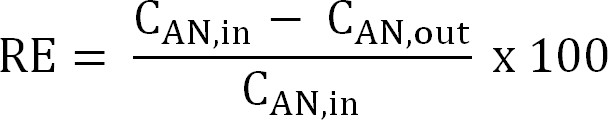 Gleichung 6
Gleichung 6 - Berechnung der maximalen theoretischen Stickstoffentfernungseffizienz (RE max,%) für eine gegebene Zulauf TAN Last und angelegten Strom (Gleichung 7):
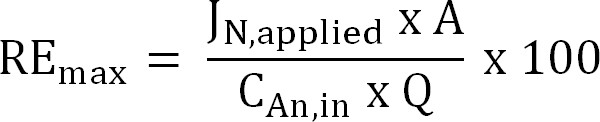 Gleichung 7
Gleichung 7
wobei J N, angewendet (g N m -2 d - 1) ist die angewendete Stromdichte in einem Stickstofffluss ausgedrückt.
- Berechnen Sie die Stickstofffluss. Normalisieren Stickstofffluss (g N / m² / d) mit der Membranfläche dann als Stromdichte (I N) ausgedrückt. Verwenden Sie diesen Wert, um die CE berechnen (Gleichung 2, 3 und 4):
- Berechnen Gas / Flüssig-Verhältnis (Gleichung 8):
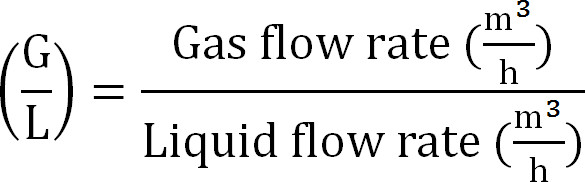 Gleichung 8
Gleichung 8 - Berechnen der maximalen Kapazität der Absorptionskolonne. Berechnung der maximalen theoretischen N Belastung in die Absorptionskolonne aus der maximalen theoretischen Stickstofffluss J Nmax, die TAN-Konzentration im Zulauf (mol / L), die Zeit der Operation t, der Membranfläche A, und dem Volumen des absorbierenden V ( Gleichung 9):
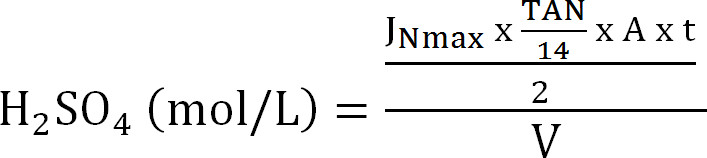 Gleichung 9
Gleichung 9 - Berechnen Sie die Strippeffizienz SE (%) (Gleichung 10):
 60; Gleichung 10
60; Gleichung 10 - Berechnen Sie den Energieaufwand für die Ammonium Extraktion durch die Kationenaustauschmembran (E N, ausgedrückt in kWh / kg N) (Gleichung 11):
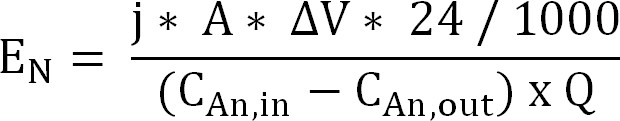 Gleichung 11
Gleichung 11
Mit & Delta; V die gemessene Potentialdifferenz zwischen Anode und Kathode. Im Falle des Bioreaktors, & Dgr; V wurde berechnet als der Mittelwert für die Abtastperiode für den elektrochemischen Reaktor der Durchschnitt für den gesamten Durchlauf genommen wird.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Chronoamperometrie resultiert aus Bioreaktor
Die Chronoamperometrie Ergebnisse nach Gleichung 1 berechnet wird, zeigen eine typische Kurve für einen kontinuierlichen Reaktor (Abbildung 4). Zu Beginn des Experiments wurden die Anode und die Kathode im Umluftbetrieb betrieben. Dies ermöglicht einen Biofilm zu entwickeln und den Beginn der aktuellen Produktion. Nach 5 Tagen Betrieb die Stromdichte ein Maximum erreicht, gefolgt von einer Abnahme in der laufend...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese Handschrift stellt die notwendigen Werkzeuge zur Einrichtung einer bioelektrochemische und eine elektrochemische Zelle für Ammonium Erholung. Die im Abschnitt Ergebnisse vorgestellt Berechnungen liefern die Parameter für die Bewertung der Systemleistung. Die biologischen und elektrochemische Systeme ähneln in Aufbau und Funktion. Der Hauptunterschied zwischen den zwei Systemen ist die Wahl eines festen Strom für die elektrochemische Zelle gegenüber einem festen Anodenpotential für die bio-elektrochemischen E...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
Referenzen
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Standard Methods For The Examination Of Water And Wastewater. Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. , American Public Health Association. (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. Elements of Physical Chemistry. , Oxford University Press. Oxford, UK. (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800(2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten