Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Récupération d'ammonium électrochimique et Bioelectrochemically induite
Dans cet article
Résumé
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Résumé
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Introduction
Récupération des produits précieux provenant des eaux usées prend de l'importance que de précieuses ressources se raréfient et le traitement sans récupération représente seulement un coût. Les eaux usées contiennent à la fois l'énergie et les nutriments qui peuvent être récupérés et la récupération des nutriments peut aider à fermer la boucle de production 1. Récupération de l'énergie par la digestion anaérobie est un processus bien établi, alors que la récupération des nutriments est moins fréquent. Récupération des nutriments provenant des flux de déchets liquides tels que l'urine et du fumier a été largement étudié, par exemple, par la production de struvite et de décapage directe d'ammoniac 2,3. Toutefois, la nécessité pour l'addition chimique est un inconvénient de ces procédés 4. Ici, nous présentons une technique pour la récupération des éléments nutritifs cationiques des flux de déchets, y compris à la fois de potassium et d'ammonium. La forme cationique de ces nutriments permet une récupération à l'aide d'une membrane sélective d'ions dans un système électrochimique. Dans ce cas, le electrochemical système consiste en une chambre d'anode (où l'oxydation a lieu), une chambre de cathode (où la réduction a lieu) et une membrane sélective d'ions pour séparer les compartiments. Une tension est appliquée à travers la cellule pour produire un flux de courant de l'anode à la cathode. Cette tension peut être générée par une source d'alimentation externe pour conduire l'oxydation de l'eau et des réactions de réduction. En variante, l'oxydation anodique, par exemple, des composés organiques, peut être catalysée par des bactéries électroactifs, nécessitant moins de puissance. Pour fermer le circuit et maintenir l'équilibre de charge, une espèce chargée doivent migrer entre les électrodes pour chaque électrons généré. le transport d'ammonium à partir de la chambre anodique à la chambre de cathode à travers une membrane échangeuse de cations (CEM) peut ainsi compenser le flux d'électrons de 4,5.
La technique présentée ici non seulement supprime ammonium des flux de déchets, mais permet également la récupération. Azote ammoniacal total (TAN) existe en équilibre des deux ammonium (NH 4 +) et l'ammoniac (NH 3), et est dépendante du pH et de la température 6. NH 4 + est disponible en abondance en raison de la concentration élevée et à proximité de TAN pH neutre dans la chambre d'anode et cette espèce à charge positive peut donc être entraîné par le courant à travers la CEM dans la chambre de cathode. Le courant entraîne la réduction de l'eau à la cathode, ce qui conduit à la production d'ions hydroxyde et de l'hydrogène gazeux. L'équilibre se déplace TAN à près de 100% de NH 3 en raison du pH élevé dans la chambre de cathode (> 10,0). NH 3 est un gaz qui peut être facilement transféré par circulation d'air de l'unité de stripping à la colonne d'absorption où il est piégé et concentré dans une solution acide.
Cette technologie a le potentiel de diminuer la toxicité d'ammonium lors de la digestion anaérobie des flux de N riches comme le fumier, augmentant ainsi la récupération d'énergie à partir de ces flux de déchets, tandis que simultanémentnutriments récupération 4. Extraction électrochimique et bioélectrochimique de l'ammonium peut également être appliquée comme technique de récupération des nutriments sur les flux de déchets à haute teneur TAN comme l'urine évitant ainsi les coûts pour l'élimination des nutriments à une station d'épuration 7.
Le protocole présenté ici peut servir de base pour de nombreuses expériences électrochimiques différents et bioélectrochimiques, comme on utilise un réacteur modulaire. Différents types d'électrodes, des membranes et des épaisseurs de cadre peuvent être combinés comme expliqué dans le protocole ci-dessous. Le principal objectif du protocole est de fournir un moyen pour la comparaison de récupération électrochimique d'ammonium et d'ammonium récupération bio-électrochimique en utilisant une cellule d'électrolyse. Les systèmes sont évalués en termes d'efficacité d'extraction, entrée de puissance et de reproductibilité.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Assemblage du réacteur et connexion des unités de décapage et d'absorption
- Recueillir tout le matériel nécessaire pour construire le réacteur: électrodes, des cadres et caoutchoucs (voir la liste des matériaux). Découpez soigneusement toutes les parties aux mêmes dimensions pour éviter les fuites lors de l'assemblage du réacteur.
- Percez des trous dans les compartiments de réacteur pour se adapter à un mâle à connecteur mâle. Percer un trou supplémentaire au milieu de la face de l'un des compartiments du réacteur pour se adapter à l'électrode de référence.
- Préparer un stock de 1 MH 2 SO 4 pour la colonne d'absorption. Augmenter cette concentration selon les besoins pour se adapter à des charges plus élevées d'ammoniac.
- Se assurer que la membrane est prétraitée selon les instructions du fabricant. Prétraiter le feutre de carbone électrode par trempage dans mM de CTAB (détergent) 2 à 3 min. Rincer le feutre de carbone avec de l'eau déminéralisée 8. L'anode stable pour des expériences électrochimiques ne nécessite pas de pretreatment.
- Empiler les différentes parties du réacteur dans l'ordre en fonction du type de réacteur. Pour le bioréacteur: plexiglas plaque d'extrémité, le caoutchouc, l'acier inoxydable collecteur de courant, le graphite prétraité feutre, Perspex compartiment du réacteur, le caoutchouc, la membrane échangeuse de cations, le caoutchouc, matériau d'espacement, inoxydable électrode en treillis d'acier, le caoutchouc, Perspex compartiment du réacteur, le caoutchouc, Perspex plaque d'extrémité
- Empiler les pièces de réacteurs pour la cellule électrochimique de la manière suivante: plexiglas plaque d'extrémité, le caoutchouc, IrOx anode à travers la plaque d'extrémité, Perspex compartiment du réacteur, le caoutchouc, l'entretoise, le caoutchouc, la membrane échangeuse de cations, le caoutchouc, matériau d'espacement, inoxydable électrode en treillis d'acier, le caoutchouc, le réacteur Perspex compartiment, le caoutchouc, plexiglas flasque.
- Utilisation Teflon pour sceller les ports du réacteur de connexion. Placer l'électrode de référence dans le même compartiment que l'électrode de travail: l'anode dans le cas d'une cellule bioélectrochimique, la cathode ou l'anode dans le cas d'une cellule électrochimique.
- Utiliser des écrous etboulons pour fermer le réacteur. Serrer des boulons sur les côtés opposés pour équilibrer la pression. Ne utilisez pas d'outils pour fermer le réacteur doigt étanche est suffisant pour assurer un réacteur complètement étanche.
- Remplir le réacteur avec de l'eau pour tester si le réacteur est étanche. Si des fuites apparaissent, vérifier si les boulons sont serrés suffisamment ou si l'une des parties de réacteurs déplacé lors de l'assemblage du réacteur. Si aucune fuite ne est détectée, vider l'eau du réacteur.
- Ajouter anneaux de Raschig à la fois dans la colonne de la bande et l'absorption de remplir les colonnes mi-course.
- Calibrer le taux de toutes les pompes de circulation. Connecter les pompes d'alimentation et de recirculation dans le réacteur et la pompe à air pour le décapage et d'absorption unités (Figure 1). Réduire la longueur du tube le plus possible.
- Remplissez la colonne d'absorption avec 250 ml d'une MH 2 SO 4, il devrait couvrir les anneaux de Raschig. Assurez-vous que le flux d'air se mélange l'acide et lorsque la pompe est activée. Augmenter ou diminuer le volume d'acide sur la base de la capacité nominale de la colonne et la pompe d'extraction d'air.

Figure 1. Configuration du réacteur pour le système bioélectrochimique permettant l'extraction d'ammonium. Le système présenté ici fonctionne en mode continu. Les lignes continues représentent l'écoulement du liquide, lignes pointillées représentent les flux de gaz. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
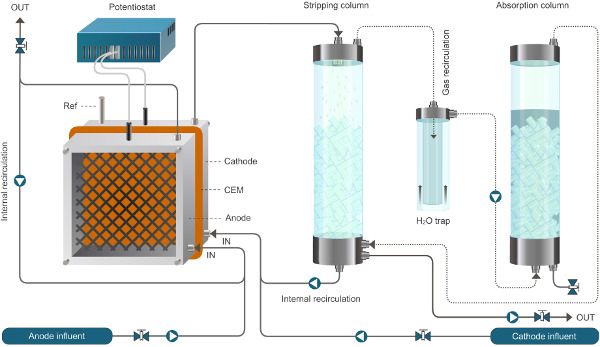
Figure 2. Installation de réacteur nucléaire pour la bioélectrochimique système permettant l'extraction d'ammonium. Le système présenté ici fonctionne en mode continu. Les lignes continues représentent l'écoulement du liquide, lignes pointillées représentent les flux de gaz.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "target =" _ blank "> Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
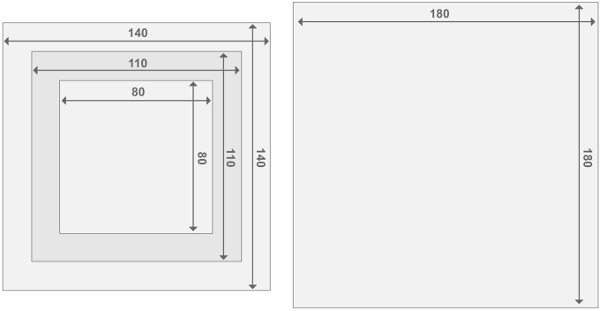
Figure 3. Conception des trames de réacteur Perspex. Chaque réacteur est constitué de deux réacteurs à plateaux vertébraux et les deux compartiments du réacteur. Toutes les pièces ont une épaisseur de 2 cm. Les détails concernant la taille des autres matériaux peuvent être trouvés dans la liste des matériaux. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
2. bioanode Extraction Driven
- Préparer les médias.
- Préparer anolyte pour le bioréacteur comme décrit dans le tableau 1 9. Augmenter la concentration en ammonium dans le milieu pour imiter un flux de déchets riches en azote.
- Pour stocker le medium avant utilisation, dans un autoclave pour assurer le support de la source de carbone ne est pas déchargée par la contamination. Préparer des vitamines et des oligo-éléments, conformément au tableau 1 et ajouter après autoclavage et refroidissement du milieu.
- Rincer le milieu en le purgeant avec de l'azote gazeux pendant au moins 30 minutes pour éliminer l'oxygène. Pour ce faire, insérer un tube ou une aiguille dans le milieu et tourner sur le flux d'azote gazeux.
- Préparer une solution conductrice catholyte. Dans ce cas, utiliser 0,1 M de NaCl pour permettre la production caustique.
| Composant | Montant | ||
| Na 2 HPO 4 | 6 g / L | ||
| KH 2 PO 4 | 3 g / L | ||
| NaCl | 0,5 g / L | ||
| NH 4 Cl | 0,5 g / L | ||
| MgSO 4 · 7H 2 O | 0,1 g / L | ||
| CaCl 2 · 2H 2 O solution (14,6 g / L) | 1 ml | ||
| l'acétate de sodium | 2 g / L (pour le démarrage) | ||
| Oligo-éléments | 1 ml | ||
| solution de vitamines | 1 ml | ||
| Oligo-éléments (1,000x) | g / L | Vitamines (1,000x) | g / L |
| CoCl 2 | 0,1 | biotine | 0,004 |
| Na 2 MoO 4, 2H 2 O | 0,01 | acide folique | 0.004 |
| H 3 BO 3 | 0,01 | chlorhydrate de pyridoxine | 0,02 |
| Mg 2 Cl 2 .6H 2 O | 3 | riboflavine | 0,01 |
| ZnCl 2 | 0,1 | chlorhydrate de thiamine | 0,01 |
| CaCl 2, 2H 2 O | 0,1 | l'acide nicotinique | 0,01 |
| NaCl | 1 | Pantothénate de calcium DL- | 0,01 |
| l'acide nitrilotriacétique | 1,5 | Vit B12 | 0,0002 |
| AlCl 3 .6H 2 O | 0,01 | l'acide p-aminobenzoïque | 0,01 |
| CuCl 2 | 0,01 | lipoïque (thioctique) acide | 0,01 |
| FeCl 2 | 0,1 | myo-inositol | 0,01 |
| MnCl 2, 2H 2 O | 0,5 | chlorure de choline | 0,01 |
| Ajuster le pH à 6,5 en utilisant KOH | niacinamide | 0,01 | |
| chlorhydrate de pyridoxal | 0,01 | ||
| ascorbate de sodium | 0,01 |
Tableau 1. Composition Anolyte pour la bio-anode conduit d'extraction d'ammonium.
- L'inoculation du bioréacteur
NOTE: Travailler dans des conditions stériles ne est pas nécessaire pour ce bioréacteur, comme un inoculum de culture mixte est utilisé et les conditions du réacteur sélectionnera pour les organismes électroactifs spécifiques.- Préparer l'inoculum. Pour ce bioréacteur, préparer un mélange de 30 ml effluents de bioréacteurs anaérobies actifs comprenant un fermenteur, Un bioanode, un digesteur anaérobie et / ou les eaux usées brutes. Recueillir le mélange dans une seringue.
- Connectez un sac rempli de gaz avec N 2 à la bouteille d'anolyte pour maintenir la pression stable tout en ne permettant pas à l'oxygène d'entrer. Mélanger la source d'inoculum avec un volume de l'anolyte (ici, 100 ml d'anolyte de 30 ml de source d'inoculum) par vidange de la seringue avec l'inoculum dans le milieu bouteille. Assurez-vous d'obtenir le volume nécessaire pour remplir le compartiment anodique.
- En utilisant une seringue, remplir le compartiment de l'anode et de la cathode en même temps que leurs solutions respectives. Connecter un sac à gaz remplie de N 2 à la bouteille d'anolyte de sorte que la solution d'anolyte peut être enlevé à travers un orifice d'échantillonnage sans introduction d'oxygène. Fermez le port de l'échantillon avec un robinet entre les transferts.
REMARQUE: Effectuez cette étape avec un collègue pour se assurer que les deux compartiments de réacteurs sont remplis simultanément. - Lorsque les deux compartiments de réacteurs sont remplis, tourner sur lapompe de recirculation à une vitesse d'environ 6 L / h de recirculation.
- Branchez le câble de potentiostat avec les trois électrodes, en utilisant l'anode comme électrode de travail. Positionner l'électrode de référence dans le compartiment anodique.
- Allumez le potentiostat en mode chronoampérométrie l'aide du logiciel de potentiostat. Sélectionner un potentiel d'anode fixe de -200 mV par rapport à Ag / AgCl.
- Exécution d'un réacteur continu pour l'extraction d'ammonium
NOTE: Comme le biofilm se développe, le courant sera produit à la consommation de l'acétate. En conséquence de l'épuisement de l'acétate, le courant va baisser (voir la section Résultats, figure 3).- Pour passer à une alimentation continue, activer la pompe d'alimentation pour l'anode et la cathode. La vitesse de la pompe va déterminer le temps de résidence hydraulique (TRH). Ici, faire fonctionner le réacteur à un HRT de 6 h.
- Mettre en marche la pompe à air de l'unité de bande et l'absorption. Faire recirculer l'air en circuit fermé, ou circuler dans unboucle ouverte en utilisant l'air ambiant. La configuration du flux d'air peut affecter l'efficacité d'absorption.
- Actualiser les trois moyennes fois par semaine. Préparer l'anolyte frais et catholyte comme décrit dans les étapes 2.1.1-2.1.4.
- Après ces étapes, fixer un sac rempli de gaz avec N 2 à la bouteille d'alimentation fermé, arrêter la pompe d'alimentation, mettre un collier sur la ligne de l'influent, basculer les anciennes et les nouvelles bouteilles et enfin retirer les pinces et redémarrer la pompe.
- Chaque fois que l'alimentation est actualisé, prendre 5 ml des échantillons de liquide de l'effluent affluent et de l'anolyte et du catholyte pour la mesure de la conductivité, le pH, la teneur et la concentration de l'acétate d'ammonium.
- Lors du changement de la charge, aussi prendre un échantillon de 3 ml de la colonne d'absorption pour contrôler le pH et pour l'analyse TAN. Lorsque le pH se rapproche de 4, remplacer l'absorbant par une solution fraîche d'acide sulfurique 1 M pour assurer l'efficacité d'absorption élevée.
- Comme le courant va d'abord augmenter, pour ensuite atteindre un plateau, de mesurer l'asTate contenu dans les affluents de l'anolyte et des effluents pour assurer ce ne est pas causée par la limitation de carbone: acétate concentrations dans l'effluent d'anolyte en dessous de 100 mg / L indiquent limitation de carbone. Augmenter la concentration en acétate dans la charge, dans ce cas (tableau 2).
- Si la stabilisation du courant ne est pas causée par des limitations d'acétate, augmenter progressivement la concentration d'ammonium dans l'alimentation, et attendre la stabilisation du courant, afin d'évaluer l'efficacité d'extraction (tableau 3).
NOTE: Comme la concentration d'ammonium est augmentée, la toxicité de l'ammoniac et de haute conductivité vont défier le biofilm et le courant finiront par baisser en conséquence.
| Temps | Montant d'acétate de sodium ajouté à l'alimentation d'anode (g / L) |
| Jour 0 - Jour 35 | 2 |
| Jour 35 - Jour 37 | 3 |
| Jour 37 - Jour 51 | 4 |
| Jour 51 - Jour 61 | 5 |
Tableau 2. Concentration d'acétate de sodium dans l'anolyte pour l'extraction d'ammonium bioanode entraîné.
| Temps | Montant de NH 4 HCO 3 ajouté à l'alimentation d'anode (g / L) | Phase |
| Jour 0 - Jour 16 | 2,26 | Je |
| Jour 16 - Jour 26 | 4.5 | II |
| Jour 26 - Jour 33 | 9 | III |
| Jour 33 - Jour 40 | 14,1 | IV |
| Jour 40 - Jour 47 | 20 | V |
| Jour 47 - Jour 54 | 25,4 | VI |
| Jour 54 - Jour 63 | 31 | VII |
Tableau 3. Concentration de l'ammonium dans l'anolyte pour l'extraction d'ammonium bioanode entraîné. Les phases sont indiquées sur le graphique de la densité de courant (figure 2).
3. Extraction électrochimique
- Préparation du support
- Préparer un courant d'eaux usées comme anolyte synthétique conformément au tableau 4 4. Ajouter du sulfate d'ammonium pour atteindre une concentration finale de 1, 3, ou 5 g N / l.
- Préparer une solution à 0,1 M de NaCl pour le catholyte.
| Composant | Montant |
| Na 2 HPO 4, 2H 2 O | 1,03 g / L |
| KH 2 PO 4 | 0,58 g / L |
| MgSO 4 · 7H 2 O | 0,1 g / L |
| CaCl 2, 2H 2 O | 0,02 g / L |
| (NH 4) 2 SO 4 | en fonction de l'expérience, pour obtenir 1/3/5 g N / l concentration finale |
Tableau 4. Composition Anolyte pour l'extraction d'ammonium électrochimique 4.
- Exécution d'un réacteur continu pour l'extraction d'ammonium
- Mettre en marche la pompe d'alimentation pour remplir les compartiments du réacteur. Pour accélérer le processus d'augmenter temporairement le débit de la pompe.
- Réduire la vitesse de la pompe pour obtenir un HRT de 6 heures une fois que le réacteur est rempli. Mettre en marche la pompe de recirculation à un débit de 6 l / h. Prenez un échantillon de l'influent (5 ml).
NOTE: Mesurer périodiquement le débit pendant toute l'expériencepour se assurer qu'il ne varie pas. - Lancer l'unité de bande et l'absorption. Le fonctionnement de cet appareil est le même que pour le bioréacteur.
- Allumez le potentiostat en mode chronopotentiométrie l'aide du logiciel de potentiostat. Tout d'abord appliquer une faible densité de courant d'environ 0,5 A / m² à polariser la membrane et pour déterminer le flux d'azote due à la diffusion seule.
- Lorsque le système a été polarisée pendant 24 heures, appliquer la densité de courant nécessaire pour l'expérience. Testez différentes densités de courant, généralement allant de 10 A / m² à 50 A / m². Prélever des échantillons de l'anode et de cathode des effluents, et la colonne d'absorption avant d'augmenter la densité de courant.
NOTE: Après trois cycles de THS, le réacteur devrait approcher l'état d'équilibre. - Une fois que le réacteur a atteint l'état d'équilibre, prendre au moins trois échantillons sur un parcours de temps. Prélever des échantillons de l'anode et de cathode des effluents, et la colonne d'absorption (5 ml chacun). Notez le volume d'échantillonnage, la date et l'heure.
- En fonction de la stabilité de l'affluent d'anode, prendre un nouvel échantillon anode d'influent au besoin. Cela est nécessaire lorsque réelle eaux usées est utilisé.
- Modifier les conditions d'essai, tels que la densité de courant appliquée et la concentration TAN. Après chaque changement, laissez le réacteur se stabiliser pendant au moins trois HRT avant de prendre des échantillons.
- Lorsque le pH de la colonne d'absorption 4 se approche de, l'absorbant remplacer par une solution fraîche à 1 M d'acide sulfurique.
4. Analyse de l'échantillon
- Mesurer le pH et la conductivité des échantillons le même jour que pour réduire les erreurs d'échantillonnage dues à la perte de l'ammoniac volatil. Mesurer le pH et la conductivité en utilisant pH et de conductivité sondes calibrées de manière adéquate.
- Si l'échantillon ne sont pas mesurés immédiatement, conserver les échantillons pour l'analyse TAN (deux réacteurs) et l'analyse des acides gras (bioréacteur) à 4 ° C. Filtrer les échantillons de l'effluent bioréacteur d'anode et influent par le biais de 0,45 um filtres de redéplacer la biomasse et aidez à préserver les acides gras. Remplissez tous les tubes échantillons à la jante afin de minimiser les pertes de NH 3.
- Mesurer l'azote comme TAN par la méthode de distillation à la vapeur standard ou toute autre méthode fiable pour mesurer TAN 10.
- Mesurer acides gras que l'acétate par toute méthode fiable, comme la chromatographie ionique ou la chromatographie gazeuse 11.
5. Analyse des données et calculs
- Exportez le fichier de données de potentiostat à partir du logiciel et l'importer dans un tableur. Calculer des moyennes par heure pour les variables électrochimiques pour diminuer le nombre de points de données et de lisser les courbes lors de leur traçage.
- Recueillir toutes les données mesurées (pH, ammonium, VFA) dans un fichier de données pour les calculs. Les calculs sont discutés dans la section des résultats.
- Calculer la production de courant par le bioréacteur. Ceci est mieux représenté par la densité de courant, qui est calculé de la manière suivante (Equation 1,12):
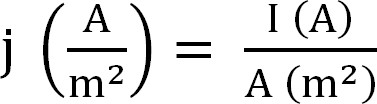 Equation 1
Equation 1
avec j que la densité de courant, je le courant absolue, et A la surface projetée de l'électrode. Dans certains logiciels, il est possible d'avoir cette calculée automatiquement en entrant la zone de surface de l'anode avant le début de l'expérience. - Calculer les paramètres liés à l'extraction d'ammonium
- Calculer le flux d'azote. Normaliser flux d'azote (N g / m² / d) à la zone de surface de la membrane puis exprimée en densité de courant (I N). Utiliser cette valeur pour calculer la CE (équation 2, 3 et 4):
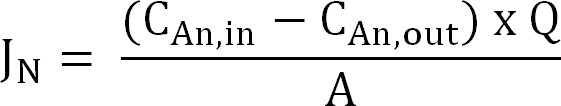 Equation 2
Equation 2
où C An, dans (g N / L) et C An, à (g N / L) sont les concentrations d'ammonium mesurées viennent dans et hors du compartiment d'anode,respectivement. Q (L / D) est le taux d'écoulement d'anode et A (m 2) est l'aire de surface de la membrane (soit projetée anode et la cathode de surface). - Présenter le flux d'azote comme densité de courant (I N, A / m²):
 Équation 3
Équation 3
où z NH4 + (-) est la charge de NH 4 +, F la constante de Faraday (96 485 C / mol), et M la masse moléculaire de l'azote (14 g / mole). - Calculez le rendement en courant (CE,%) que:
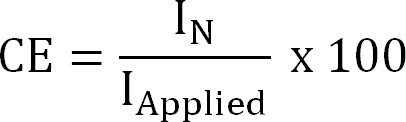 Equation 4
Equation 4
où je ai appliquée (A / m²) est l'application (extraction électrochimique) ou mesuré (extraction bioélectrochimique) densité de courant. - Calculer le flux d'azote théorique. Calculer l'azote théorique maximaleflux (J N, Max, g N / m² / d) pour une application donnée surface actuelle et la membrane (Equation 5) en tant que:
 Equation 5
Equation 5 - Calculer l'efficacité d'élimination d'azote (RE,%). Se référer au pourcentage de l'ammonium qui est ensuite éliminé de l'anolyte comme l'efficacité d'élimination. Calculer à partir de l'affluent de l'anode et les concentrations des effluents (TAN de l'équation 6).
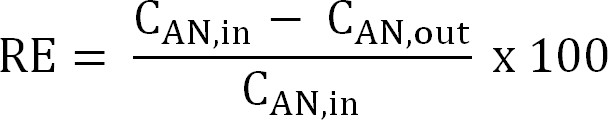 Equation 6
Equation 6 - Calculez le rendement théorique d'élimination de l'azote maximum (RE max,%) pour un affluent donné TAN charge et de courant appliqué (Equation 7):
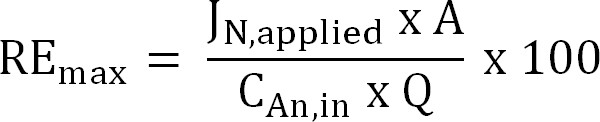 Equation 7
Equation 7
où J N, appliquée (g N m -2 d - 1) est la densité de courant appliquée exprimé en un flux d'azote.
- Calculer le flux d'azote. Normaliser flux d'azote (N g / m² / d) à la zone de surface de la membrane puis exprimée en densité de courant (I N). Utiliser cette valeur pour calculer la CE (équation 2, 3 et 4):
- Calculer gaz / ratio de liquide (équation 8):
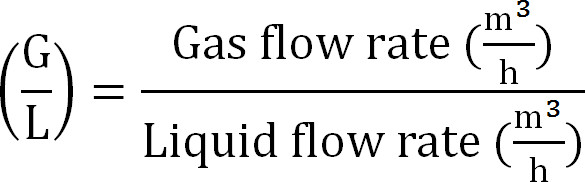 Equation 8
Equation 8 - Calculer la capacité maximale de la colonne d'absorption. Calculer la N charge maximale théorique de la colonne d'absorption de la quantité théorique flux d'azote au maximum J Nmax, la concentration TAN dans l'influent (mol / L), le temps de fonctionnement t, la membrane de surface A, et le volume de V absorbant ( Equation 9):
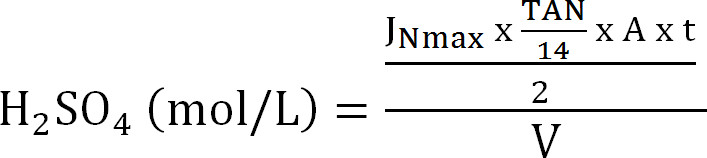 Equation 9
Equation 9 - Calculer l'efficacité de décapage SE (%) (Equation 10):
 60; Equation 10
60; Equation 10 - Calculer l'apport d'énergie pour l'extraction d'ammonium à travers la membrane échangeuse de cations (N E, exprimée en kWh / kg N) (équation 11):
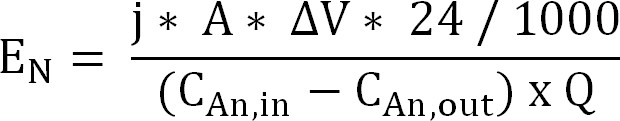 Equation 11
Equation 11
Avec AV la différence de potentiel mesurée entre l'anode et la cathode. Dans le cas du bioréacteur, AV a été calculé comme la moyenne de la période d'échantillonnage, pour le réacteur électrochimique de la moyenne pour l'ensemble du terme est prise.
Access restricted. Please log in or start a trial to view this content.
Résultats
Chronoampérométrie résulte du bioréacteur
Les résultats de la chronoampérométrie, calculé selon l'équation 1, montrent un graphique typique pour un réacteur fonctionnant en continu (figure 4). Au début de l'expérience, l'anode et la cathode ont été exploités en mode de recirculation. Ceci permet de développer un biofilm et le début de la production en cours. Au bout de 5 jours de fonctionnement, la densité de courant atteint un ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce manuscrit fournit les outils nécessaires pour mettre en place un bioélectrochimique et une cellule électrochimique pour la récupération d'ammonium. Les calculs présentés dans la section des résultats fournissent les paramètres pour l'évaluation de la performance du système. Les systèmes biologiques et électrochimiques sont similaires dans la configuration et la fonction. La principale différence entre les deux systèmes est le choix d'un courant fixe de la cellule électrochimique par rappor...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
Références
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Standard Methods For The Examination Of Water And Wastewater. Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. , American Public Health Association. (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. Elements of Physical Chemistry. , Oxford University Press. Oxford, UK. (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800(2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon