É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Recuperação de Amónio Eletroquimicamente e Bioelectrochemically Induzida
Neste Artigo
Resumo
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Resumo
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Introdução
Recuperação de produtos valiosos de águas residuais ganha importância como valiosos recursos se tornam escassos e tratamento sem recuperação representa apenas um custo. Wastewater contém energia e nutrientes que podem ser recuperados, e recuperação de nutrientes pode ajudar a fechar o ciclo de produção 1. A recuperação de energia através de digestão anaeróbia é um processo bem estabelecido, enquanto a recuperação de nutrientes é menos comum. Recuperação de nutrientes dos fluxos de resíduos líquidos como a urina e estrume de animais tem sido amplamente investigada, por exemplo, através da produção de struvite e remoção direta de amônia 2,3. No entanto, a necessidade de adição de produtos químicos é uma desvantagem destes processos 4. Aqui apresentamos uma técnica para a recuperação de nutrientes catiônicos de fluxos de resíduos, incluindo potássio e amônio. A forma catiónica desses nutrientes permite a recuperação usando uma membrana selectiva de iões de um sistema electroquímico. Neste caso, o electrochemical sistema consiste de uma câmara de ânodo (onde tem lugar a oxidação), uma câmara de cátodo (em que a redução tem lugar) e uma membrana selectiva de iões para separar os compartimentos. A tensão é aplicada através da célula para produzir um fluxo de corrente do ânodo para o cátodo. Esta tensão pode ser gerado por uma fonte externa de energia para conduzir a oxidação da água e as reacções de redução. Em alternativa, a oxidação anódica, por exemplo, de produtos orgânicos, pode ser catalisada por bactérias electroactivos, que requerem menos energia. Para fechar o circuito e manter o equilíbrio de carga, uma espécie carregada deve migrar entre os eletrodos para cada elétron gerado. Transporte de amônio da câmara de anodo para o catodo câmara através de uma membrana de troca de cátions (CEM) podem, assim, compensar o fluxo de elétrons 4,5.
A técnica apresentada aqui não só remove amónio de fluxos de resíduos, mas também permite a sua recuperação. Amoníaco Azoto total (TAN) existe em equilíbrio de ambos amónium (NH 4 +) e amoníaco (NH3), e é dependente do pH e da temperatura 6. NH 4 + é abundantemente disponíveis, devido à alta concentração TAN e próximo pH neutro na câmara do ânodo e a espécie com carga positiva pode, por conseguinte, ser conduzido pela corrente através do CEM para a câmara de cátodo. A corrente acciona a redução da água no cátodo, que leva à produção de iões hidróxido e gás hidrogénio. O equilíbrio TAN desloca-se para cerca de 100% de NH 3, devido ao elevado pH na câmara do cátodo (> 10,0). NH 3 é um gás que pode ser facilmente transferida através de circulação de ar a partir da unidade de separação para a coluna de absorção onde é preso e concentrou-se em uma solução de ácido.
Esta tecnologia tem o potencial para reduzir a toxicidade de amónio durante a digestão anaeróbica de fluxos rico-N como estrume, aumentando assim a recuperação de energia a partir destas correntes de resíduos, enquanto simultaneamentenutrientes que recuperam 4. Extração eletroquímica e bioelectrochemical de amônio também pode ser aplicado como técnica de recuperação de nutrientes sobre fluxos de resíduos com alto teor de TAN, como urina, evitando assim os custos para a remoção de nutrientes em uma ETAR 7.
O protocolo aqui apresentado pode servir como uma base para muitas experiências electroquímicas e bioelectrochemical diferentes, como usamos um reactor modular. Diferentes tipos de eléctrodos, as membranas e espessuras de quadros podem ser combinados, tal como explicado no protocolo abaixo. O objectivo principal do protocolo é o de proporcionar um meio para a comparação de recuperação electroquímica de amónio e de amónio recuperação electroquímica bio-se utilizando uma célula de electrólise. Os sistemas são avaliadas em termos de eficiência de extracção, de entrada de alimentação e reprodutibilidade.
Protocolo
1. Montagem do Reactor e Conexão das unidades de extracção e de Absorção
- Recolha todo o material necessário para a construção do reactor: eletrodos, quadros e borrachas (ver lista de materiais). Corte com cuidado todas as partes para as mesmas dimensões para evitar vazamentos durante a montagem do reactor.
- Faça furos nos compartimentos de reatores para caber um macho para conector macho. Perfurar um furo adicional no meio do lado de um dos compartimentos do reactor para ajustar o eléctrodo de referência.
- Prepare um estoque de 1 MH 2 SO 4 para a coluna de absorção. Aumentar esta concentração como necessário para acomodar cargas elevadas de amoníaco.
- Assegure-se que a membrana é pré-tratado de acordo com as instruções do fabricante. O feltro de carbono e pré-tratamento de eléctrodo por imersão em CTAB 2 mM (detergente) durante 3 min. Lavar o feltro de carbono com água desmineralizada 8. O ânodo estável para as experiências electroquímicas não requerem um pretreatment.
- Empilhar as diferentes partes do reactor, a fim de acordo com o tipo de reactor. Para o biorreator: perspex placa motora, borracha, coletor de corrente de aço inoxidável, grafite pré-tratados sentia, compartimento perspex reactor, borracha, membranas de troca catiônica, borracha, material espaçador, eletrodo de malha de aço inoxidável, borracha, compartimento do reator perspex, borracha, perspex placa terminal
- Empilhe as peças do reator para a célula eletroquímica da seguinte forma: perspex placa motora, borracha, Irox ânodo através da placa motora, o compartimento do reator perspex, borracha, espaçador, borracha, membranas de troca catiônica, borracha, material espaçador, eletrodo de malha de aço inoxidável, borracha, perspex reactor compartimento, borracha, perspex placa terminal.
- Use Teflon para selar as aberturas de conexão do reactor. Inserir o eléctrodo de referência no mesmo compartimento que o eléctrodo de trabalho: o ânodo no caso de uma célula bioelectrochemical, cátodo ou ânodo, no caso de uma célula electroquímica.
- Use nozes eparafusos para fechar o reactor. Apertar os parafusos em lados opostos, para equalizar a pressão. Não use ferramentas para fechar o reator como com os dedos é suficiente para garantir um reactor completamente selado.
- Encher o reactor com água para testar se o reactor é livre de fugas. Se os vazamentos aparecer, verifique se os parafusos são apertados o suficiente ou se uma das partes de reatores movido durante a montagem do reactor. Se não se detectarem fugas, esvaziar a água do reactor.
- Adicionar anéis Raschig tanto na coluna tira e absorção para preencher as colunas no meio do caminho.
- Calibre o caudal de todas as bombas. Ligar as bombas de alimentação e de recirculação para o reactor e a bomba de ar para as unidades de decapagem e de absorção (Figura 1). Minimizar o comprimento do tubo, tanto quanto possível.
- Encher a coluna de absorção com 250 ml de 1 MH 2 SO 4, ele deve cobrir os anéis de Raschig. Assegure-se que a corrente de ar mistura-se bem o ácido quando a bomba está ligada. Aumentar ou diminuir o volume de ácido baseado na capacidade de design de coluna e bomba de ar de extracção.

Figura 1. Configuração Reactor para o sistema bioelectrochemical permitindo a extração de amónio. O sistema aqui apresentado opera em modo contínuo. As linhas sólidas representam o fluxo de líquido, linhas pontilhadas representam o fluxo de gás. Por favor, clique aqui para ver uma versão maior desta figura.
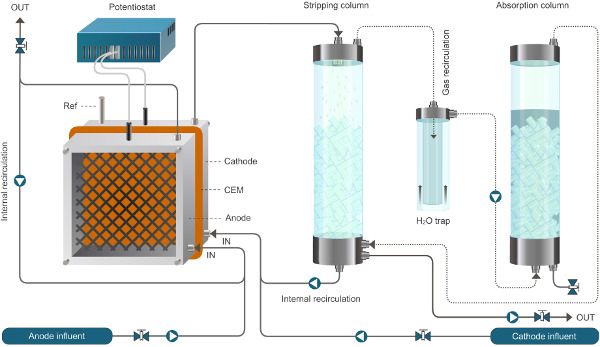
Figura 2. Reactor de configuração para o sistema bioelectrochemical permitindo a extracção de amónio. O sistema aqui apresentado opera em modo contínuo. As linhas sólidas representam o fluxo de líquido, linhas pontilhadas representam o fluxo de gás."target =" _ ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg blank "> Clique aqui para ver uma versão maior desta figura.
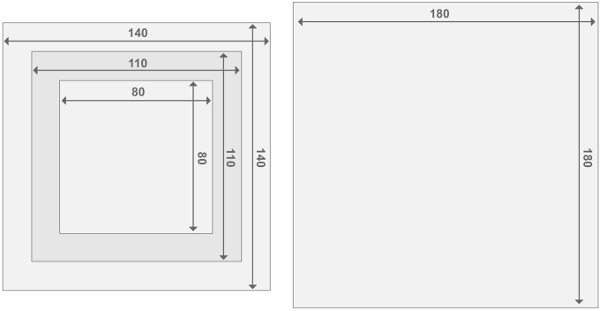
Figura 3. Desenho dos quadros de reactores de Perspex. Cada reactor é constituído por dois reactores de placa terminal e dois compartimentos do reactor. Todas as peças têm uma espessura de 2 cm. Detalhes sobre o tamanho de outros materiais podem ser encontrados na lista de materiais. Por favor, clique aqui para ver uma versão maior desta figura.
2. Bioanode Extraction Impulsionada
- Preparando a mídia.
- Prepare anólito para o bioreactor, como descrito na Tabela 1 9. Aumentar a concentração de amónio na forma de imitar um fluxo de resíduos rico em azoto.
- Para armazenar a medihum antes da utilização, o meio de autoclave para assegurar a fonte de carbono não é esgotada através da contaminação. Prepare vitaminas e oligo-elementos de acordo com a Tabela 1 e adicionar após a autoclavagem e arrefecimento do meio.
- Lave a forma pela purga com azoto gasoso durante pelo menos 30 minutos para remover o oxigénio. Para fazer isso, insira um tubo ou agulha para o meio e ligue o fluxo de gás nitrogênio.
- Prepare uma solução condutora como católita. Neste caso, usar 0,1 M de NaCl para permitir a produção de soda cáustica.
| Componente | Quantidade | ||
| Na 2 HPO 4 | 6 g / L | ||
| KH 2 PO 4 | 3 g / L | ||
| NaCl | 0,5 g / L | ||
| NH4Cl | 0,5 g / L | ||
| MgSO 4 7H 2 O · | 0,1 g / L | ||
| CaCl 2 2H 2 O solução (14,6 g / L) | 1 mL | ||
| Acetato de sódio | 2 g / L (para start-up) | ||
| Trace Elements | 1 mL | ||
| Solução de vitamina | 1 mL | ||
| Oligoelementos (1.000 vezes) | g / L | Vitaminas (1.000 vezes) | g / L |
| CoCl2 | 0,1 | biotina | 0,004 |
| Na 2 MoO 4 .2H 2 O | 0,01 | ácido fólico | 0.004 |
| H 3 BO 3 | 0,01 | cloridrato de piridoxina | 0,02 |
| Mg 2 Cl 2 .6H 2 O | 3 | riboflavina | 0,01 |
| ZnCl2 | 0,1 | cloridrato de tiamina | 0,01 |
| CaCl 2 .2H 2 O | 0,1 | ácido nicotínico | 0,01 |
| NaCl | 1 | Pantotenato de cálcio-DL | 0,01 |
| ácido nitrilotriacético | 1,5 | Vit B12 | 0,0002 |
| AlCl 3 .6H 2 O | 0,01 | p ácido -aminobenzoic | 0,01 |
| CuCl2 | 0,01 | lipóico (thioctic) | 0,01 |
| FeCl2 | 0,1 | mio-inositol | 0,01 |
| MnCl 2 .2H 2 O | 0,5 | cloreto de colina | 0,01 |
| Ajustar para pH 6,5 utilizando KOH | niacinamida | 0,01 | |
| cloridrato de piridoxal | 0,01 | ||
| ascorbato de sódio | 0,01 |
Tabela 1. Composição Anólito para a extração de amônio bio-ânodo conduzido.
- A inoculação do bioreactor
NOTA: O trabalho em condições estéreis não é necessário para este biorreactor, como um inoculo de cultura mista é utilizado e as condições do reactor irá seleccionar para os organismos específicos electroactivos.- Preparar o inoculo. Para este biorreator, prepare uma mistura de efluentes 30 ml de biorreatores anaeróbios ativos, incluindo um fermentador, Um bioanode, um digestor anaeróbico e / ou efluente bruto. Recolhe-se a mistura em uma seringa.
- Conectar um saco de gás preenchido com N 2 para o frasco de anólito a fim de manter a pressão estável, enquanto não permite a entrada do oxigênio. Misture a fonte de inoculo com um volume de anólito (aqui, a 100 ml de anólito por 30 ml de fonte de inoculo) por esvaziar a seringa com inoculo para o meio de garrafa. Certifique-se de obter o volume necessário para encher o compartimento do ânodo.
- Usando uma seringa, encher o compartimento de ânodo e cátodo em simultâneo com as respectivas soluções. Conectar um saco de gás preenchido com N 2 para o frasco do anólito, de modo que a solução de anólito pode ser removido através de uma porta de amostragem, sem a introdução de oxigénio. Feche a porta da amostra com um toque entre as transferências.
NOTA: Execute esta etapa, juntamente com um colega para garantir que ambos os compartimentos de reatores são preenchidos simultaneamente. - Quando ambos os compartimentos de reatores são preenchidos, ligue obomba de recirculação, a uma taxa de recirculação de cerca de 6 L / h.
- Conecte o cabo potencióstato com três eletrodos, utilizando-se o ânodo como eletrodo de trabalho. Posicionar o eléctrodo de referência no compartimento do ânodo.
- Ligue o potenciostato no modo cronoamperometria usando o software potenciostato. Selecione um potencial ânodo fixo de -200 mV vs. Ag / AgCl.
- A execução de um reator contínuo para a extração de amônio
NOTA: Como o biofilme se desenvolve, a corrente irá ser produzida com o consumo de etilo. Como consequência do esgotamento de etilo, a corrente vai cair (ver secção Resultados, Figura 3).- Para mudar para a alimentação contínua, ligar a bomba de alimentação para o anodo eo catodo. A velocidade da bomba irá determinar o tempo de residência hidráulica (TRH). Aqui, operar o reactor a uma HRT de 6 h.
- Ligue a bomba de ar do aparelho tira e absorção. Recircular o ar num circuito fechado, ou circular em umcircuito aberto utilizando o ar ambiente. Configuração do fluxo de ar pode afectar a eficiência de absorção.
- Atualizar as médias de três vezes por semana. Preparar fresco anólito e católito, tal como descrito nos passos 2.1.1-2.1.4.
- Após essas etapas, anexar um saco cheio de gás com N 2 para a garrafa de alimentação fechada, parar a bomba de alimentação, colocar um grampo na linha influente, mudar as velhas e novas garrafas e, finalmente, remover os grampos e reinicie a bomba.
- Cada vez que a alimentação é atualizada, tomar 5 ml amostras líquidas do efluente e afluente do anólito e católito para medição de condutividade, pH, teor de acetato e concentração de amônio.
- Quando se altera a alimentação, também tomar uma amostra de 3 ml da coluna de absorção para monitorizar o pH e para análise do TAN. Quando a aproximação do pH 4, substitua o absorvente com fresca solução de ácido sulfúrico 1 M para garantir alta eficiência de absorção.
- Como o atual primeiro aumentar e, em seguida, chegar a um platô, medir o aceconteúdo tate no afluente e no efluente do anólito para garantir que esta não é causada por uma limitação de carbono: acetato de concentrações no efluente do anólito abaixo de 100 mg / L indicam limitação de carbono. Aumentar a concentração de acetato na alimentação nesse caso (Tabela 2).
- Se a corrente de estabilização não é causado por limitações de etilo, gradualmente, aumentar a concentração de amónio na alimentação, e esperar para a estabilização da corrente a fim de avaliar a eficiência de extracção (Tabela 3).
NOTA: Como a concentração de amônio é aumentada, a toxicidade da amônia e alta condutividade vai desafiar o biofilme ea corrente acabará por cair como uma conseqüência.
| Tempo | Quantidade de acetato de sódio adicionada à ração ânodo (g / L) |
| Dia 0 - Dia 35 | 2 |
| Dia 35 - Dia 37 | 3 |
| Dia 37 - Dia 51 | 4 |
| Dia 51 - Dia 61 | 5 |
Tabela 2. Concentração de acetato de sódio no anólito para a extracção de amónio bioanode accionado.
| Tempo | Montante de NH 4 HCO 3 adicionado ao alimento ânodo (g / L) | Fase |
| Dia 0 - Dia 16 | 2.26 | EU |
| Dia 16 - Dia 26 | 4,5 | II |
| Dia 26 - Dia 33 | 9 | III |
| Dia 33 - Dia 40 | 14.1 | IV |
| Dia 40 - Dia 47 | 20 | V |
| Dia 47 - Dia 54 | 25.4 | VI |
| Dia 54 - Dia 63 | 31 | VII |
Tabela 3. Concentração de amónio no anólito para a extracção de amónio bioanode accionado. As fases são indicados no gráfico de densidade de corrente (Figura 2).
3. Eletroquímica Extração
- Preparar os meios de comunicação
- Prepara-se uma corrente de água residual sintética como anólito de acordo com a Tabela 4 4. Adicionar sulfato de amónio para atingir uma concentração final de 1, 3, ou 5 g N / L.
- Prepara-se uma solução de 0,1 M de NaCl para o católito.
| Componente | Quantidade |
| Na 2 HPO 4 .2H 2 O | 1,03 g / L |
| KH 2 PO 4 | 0,58 g / L |
| MgSO 4 7H 2 O · | 0,1 g / L |
| CaCl 2 .2H 2 O | 0,02 g / L |
| (NH 4) 2 SO 4 | dependendo da experiência, para se obter N 1/3/5 g / L de concentração final |
Tabela 4. Composição anólito para extracção electroquímica de amónio 4.
- A execução de um reator contínuo para a extração de amônio
- Ligue a bomba de alimentação para encher os compartimentos do reactor. Para acelerar o processo de aumentar temporariamente a taxa de bomba.
- Reduzir a velocidade da bomba para obter uma HRT de 6 horas uma vez que o reactor é cheio. Ligar a bomba de recirculação, a uma taxa de 6 l / h. Tomar uma amostra do afluente (5 ml).
NOTA: medir a vazão periodicamente durante todo o experimentopara garantir que ele não varia. - Comece a unidade de fita e absorção. A operação deste aparelho é o mesmo que para o bioreactor.
- Ligue o potenciostato no modo cronopotenciometria usando o software potenciostato. Primeiro aplica uma baixa densidade de corrente de cerca de 0,5 A / m para polarizar a membrana e para determinar o fluxo de azoto, devido à difusão sozinho.
- Quando o sistema foi polarizado, durante 24 h, aplicar a densidade de corrente necessário para a experiência. Teste diferentes densidades de corrente, geralmente variando de 10 A / m e 50 A / m. Tirar amostras de ânodo e cátodo efluentes, e a coluna de absorção antes de aumentar a densidade de corrente.
NOTA: Depois de 3 ciclos HRT, o reator deve abordar o estado estacionário. - Depois do reactor ter atingido o estado estacionário, ter, pelo menos, três amostras ao longo de um curso de tempo. Retirar amostras a partir do ânodo e cátodo efluentes, e a coluna de absorção (5 ml cada). Anote o volume de amostragem, data e hora.
- Dependendo da estabilidade do afluente ânodo, levar uma nova amostra ânodo afluente se necessário. Isto é necessário quando é utilizado águas residuais reais.
- Mudar as condições de teste, tais como a densidade de corrente aplicada e concentração TAN. Após cada alteração, deixe o reactor estabilizar durante pelo menos 3 HRTs antes de tomar amostras.
- Quando o pH da coluna de absorção 4 se aproxima, substituir o absorvente com solução fresca de ácido sulfúrico 1M.
Análise 4. Amostra
- Medir o pH e a condutividade das amostras no mesmo dia que a amostragem para reduzir imprecisões devido à perda de amónia volátil. Medir o pH e condutividade usando sondas de pH e condutividade adequadamente calibrados.
- Se a amostra não são medidos imediatamente, armazenar amostras para análise TAN (ambos os reactores) e análise de ácidos gordos (biorreactor) a 4 ° C. Amostras de filtração do efluente biorreator ânodo e influente através 0,45 filtros para remover biomassa e ajudar a preservar os ácidos graxos. Encha todos os tubos de amostra para o aro, a fim de minimizar a perda de NH3.
- Meça nitrogênio como TAN pelo método de destilação a vapor padrão ou qualquer outro método confiável para medir a TAN 10.
- Meça ácidos graxos como o acetato por qualquer método confiável, tais como cromatografia de íons ou cromatografia gasosa 11.
5. Análise e cálculos de dados
- Exportar o arquivo de dados potencióstato do software e importá-lo para um programa de planilha. Calcular as médias por hora para as variáveis eletroquímicas para diminuir o número de pontos de dados e suavizar as curvas ao plotar-los.
- Colete todos os dados medidos (pH, amónio, VFA) em um arquivo de dados para os cálculos. Os cálculos são discutidos na secção de resultados.
- Calcule a produção atual do biorreator. Isto é melhor representado como densidade de corrente, que é calculada como se segue (Equação 1,12):
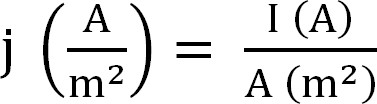 Equação 1
Equação 1
com j como a densidade de corrente, I a corrente absoluta, e uma área de superfície projetada do eletrodo. Em determinado software é possível ter este calculados automaticamente por entrar na área de superfície do ânodo antes do início da experiência. - Calcular os parâmetros relacionados com a extracção de amônio
- Calcula-se o fluxo de azoto. Normalizar o fluxo de azoto (N g / m² / d) para a área de superfície da membrana, em seguida expressa como uma densidade de corrente (I N). Use esse valor para calcular a CE (Equação 2, 3, e 4):
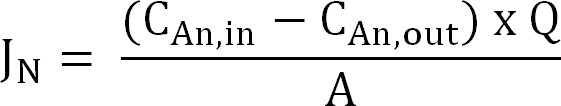 Equação 2
Equação 2
onde C An, em (g N / L) e C An, out (g N / L) são as concentrações de amônio medidos entrando e saindo do compartimento do ânodo,respectivamente. Q (L / d) representa a taxa de fluxo do ânodo e A (m 2) é a área de superfície da membrana (igual ao ânodo projectada e a área de superfície do cátodo). - Apresentar o fluxo de nitrogênio como densidade de corrente (I N, A / m²):
 Equação 3
Equação 3
onde z NH4 + (-) é a carga de NH 4 +, F a constante de Faraday (96,485 C / mol) e M o peso molecular de azoto (14 g / mol). - Calcula-se a eficiência de corrente (CE,%) como:
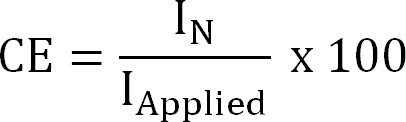 Equação 4
Equação 4
onde eu Aplicada (A / m²) é a aplicada (extração eletroquímica) ou medidos (extração bioelectrochemical) densidade de corrente. - Calcula-se o fluxo de azoto teórico. Calcula-se o azoto teórico máximofluxo (J N, Max, g N / m² / d) de uma determinada área de superfície aplicada atual e de membrana (Equação 5), como:
 Equação 5
Equação 5 - Calcule a eficiência de remoção de nitrogênio (RE,%). Referem-se a percentagem de amónio que é removido do anólito como a eficiência de remoção. Calcule do influente ânodo e concentrações TAN de efluentes (Equação 6).
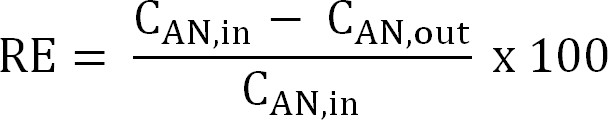 Equação 6
Equação 6 - Calcule o máximo teórico de eficiência de remoção de nitrogênio (RE max,%) para uma determinada carga afluente TAN e corrente aplicada (Equação 7):
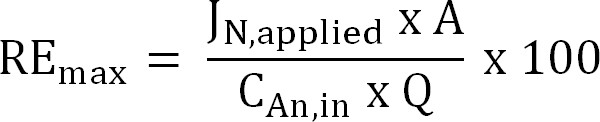 Equação 7
Equação 7
onde J N, aplicado (g N m -2 d - 1) é a densidade de corrente aplicada expressa como um fluxo de azoto.
- Calcula-se o fluxo de azoto. Normalizar o fluxo de azoto (N g / m² / d) para a área de superfície da membrana, em seguida expressa como uma densidade de corrente (I N). Use esse valor para calcular a CE (Equação 2, 3, e 4):
- Calcular a relação gás / líquido como (Equação 8):
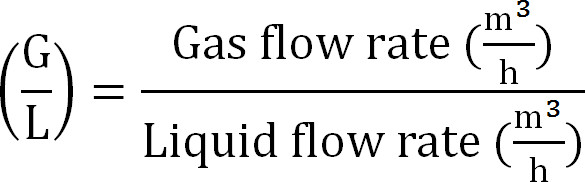 Equação 8
Equação 8 - Calcula-se a capacidade máxima da coluna de absorção. Calcula-se a carga de N máxima teórica para a coluna de absorção a partir do fluxo máximo teórico de azoto J Nmax, a concentração TAN no afluente (mol / L), o tempo de funcionamento t, a área de superfície da membrana A, e o volume de V absorvente ( Equação 9):
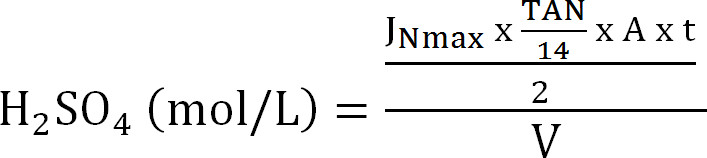 Equação 9
Equação 9 - Calcula-se a eficiência de extracção SE (%) (Equação 10):
 60; Equação 10
60; Equação 10 - Calcula-se a entrada de energia para a extracção de amónio através da membrana de permuta catiónica (E N, expressa em kWh / kg de N) (Equação 11):
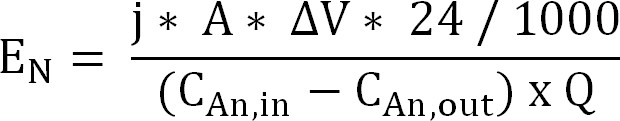 Equação 11
Equação 11
Com AV a diferença de potencial medida entre ânodo e cátodo. No caso de o bioreactor, AV foi calculada como a média durante o período de amostragem, para o reactor electroquímico a média de toda a execução é feita.
Resultados
Cronoamperometria resulta do bioreactor
Os resultados cronoamperometria, calculado de acordo com a Equação 1, mostra um gráfico típico para um reactor contínuo (Figura 4). No início da experiência, o ânodo e cátodo foram operados em modo de recirculação. Isto permite um biofilme para desenvolver e o início da produção corrente. Após 5 dias de operação, a densidade de corrente atinge um máximo, seguido de uma diminuição na produção corre...
Discussão
Este manuscrito fornece as ferramentas necessárias para criar uma bioelectrochemical e uma célula eletroquímica para a recuperação de amónio. Os cálculos apresentados na seção de resultados fornecem os parâmetros para a avaliação do desempenho do sistema. Os sistemas biológicos e eletroquímicas são semelhantes na configuração e função. A principal diferença entre os dois sistemas, é a escolha de uma corrente fixa para a célula electroquímica contra uma potencial ânodo fixo para a configuração b...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0,5mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
Referências
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. . Standard Methods For The Examination Of Water And Wastewater. , (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. . Elements of Physical Chemistry. , (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800 (2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados