A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحريض الفئران المعوية التهاب عن طريق نقل بالتبني من المستجيب CD4
In This Article
Summary
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
Abstract
هناك العديد من النماذج الحيوانية المختلفة المتاحة لدراسة المرضية للأمراض البشرية التهابات الأمعاء (IBD)، ولكل منها مزاياه وعيوبه. وصفنا هنا نموذج التهاب القولون التجريبية التي بدأها نقل بالتبني من خلايا الطحال مسانج CD4 + T CD45RB عالية إلى T والخلايا B الفئران المتلقي ناقصة. السكان خلية عالية T CD4 + CD45RB التي تتكون في معظمها من خلايا المستجيب ساذجة غير قادرة على إحداث التهاب الأمعاء المزمن، تشبه عن كثب الجوانب الرئيسية لIBD البشري. هذه الطريقة يمكن التلاعب بها لدراسة جوانب من بداية ظهور أعراض المرض والتقدم. بالإضافة إلى ذلك فإنه يمكن استخدامها لدراسة وظيفة الفطري، على التكيف، والسكان الخلايا المناعية التنظيمي، ودور التعرض للعوامل البيئية، أي الجراثيم، في التهاب الأمعاء. في هذه المادة ونحن توضيح المنهجية لإحداث التهاب القولون مع بروتوكول خطوة بخطوة. هذا المؤتمر الوطني العراقيLUDES مظاهرة الفيديو من الجوانب التقنية الأساسية اللازمة لتطوير هذا نموذج الفئران من التهاب القولون التجريبي لأغراض البحث بنجاح.
Introduction
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: التأكد من أن جميع البروتوكولات الحيوانات معتمدة من وامتثالا المؤسسي رعاية الحيوان واللجنة الاستخدام (IACUC) اللوائح ودليل المجلس القومي للبحوث لرعاية واستخدام الحيوانات المختبرية. قد تكون الفئران المانحة سواء الذكور أو الإناث، ولكن ينبغي أن تكون الفئران المتلقي الذكور. إذا المستفيدات هم لاستخدامها، يجب أن تكون الفئران المانحة الإناث 5. الحفاظ على المستعمرات باستخدام منتظم، والفراش غير معقمة والمياه غير المحمضة، وهذه قد تؤثر على الجراثيم المعوية، وبالتالي، النمط الظاهري التهاب القولون من الفئران 5،6.
1. إعداد التجريبية
- استخدام وسائل الإعلام الجليد الباردة ومخازن. حفاظ على الخلايا على الجليد في كافة مراحل التجربة.
- إجراء التجربة في معقم واقية غطاء محرك السيارة باستخدام تقنية معقمة.
2. عزل خلايا الطحال T
- الموت ببطء الماوس المانحة / الفئران في CO 2 غرفة تليها خلع عنق الرحمن. رش البطن مع الايثانول 70٪.
- إجراء شق أفقي في البطن وقشر الجلد بعيدا لفضح البريتوني. عقد البريتوني بعيدا عن الأعضاء الداخلية مع ملقط وجعل شق في الغشاء البريتوني في البطن الأيسر لفضح واستئصال الطحال.
- وضع الطحال في 10 مل من وسائل الإعلام كاملة في طبق بتري. إزالة والتخلص من الأنسجة الزائدة من الطحال.
- استخدام 2 الشرائح الزجاجية تعقيمها لسحق وندف بصرف النظر الطحال في تعليق وحيد الخلية. تعليق خلية مرشح من خلال مصفاة 70 ميكرومتر إلى 50 مل أنبوب مخروطي الشكل وشطف مصفاة مع 5 مل من وسائل الإعلام كاملة. وضع ما يصل إلى 5 الطحال في أنبوب واحد 50 مل مخروطي.
- خلايا الطرد المركزي في 450 x ج لمدة 7 دقائق. تجاهل طاف بصب خارج أو عن طريق شفط فراغ في حاوية النفايات.
- بلطف الخلايا resuspend في 5 مل لكل الطحال من الاحتياطي تحلل إلى ليز خلايا الدم الحمراء لمدة 10 دقيقة في درجة حرارة الغرفة. إضافة حجم مساو من وسائل الإعلام كاملة (5 مل لكل الطحال) إلى الأنبوب. خلايا الطرد المركزي في 450 x ج لمدة 7 دقائق. تجاهل طاف بصب خارج أو عن طريق شفط فراغ في حاوية النفايات.
- و resuspend بلطف الخلايا في 10 مل من وصفها العازلة.
- عدد الخلايا عن طريق استبعاد التريبان الأزرق.
- إزالة 20 ميكرولتر من تعليق خلية وإضافة إلى 180 ميكرولتر التريبان الأزرق إلى أنبوب microfuge وتخلط جيدا. بعد 5 دقائق، إضافة 10 ميكرولتر الخلايا لعدادة الكريات وعدد الخلايا غير زرقاء تحت المجهر المسمى. تحديد العدد الكلي للخلايا قابلة للحياة. تجاهل الخلايا / التريبان مزيج الأزرق.
- خلايا الطرد المركزي في 10 مل من وصفها العازلة في 450 x ج لمدة 7 دقائق. تجاهل طاف بصب خارج أو عن طريق شفط فراغ في حاوية النفايات.
3. إثراء خلايا CD4 + T
ملاحظة: اتبع تعليمات الشركة الصانعة للمنتجات المحددة المستخدمة في هذا القسم.
- بلطف الخلايا resuspend على تعليق خلية واحدة من 20 × 10 6 خلية / مل في تسمية الباردةجي العازلة.
- إضافة 5 ميكرولتر لكل 1 × 10 6 خلايا CD4 T الأجسام المضادة تخصيب الخلايا المعقدة البيروكسيديز. احتضان الخلايا على الجليد لمدة 15 دقيقة.
- إضافة 10X حجم وصفها العازلة. خلايا الطرد المركزي في 450 × ز لمدة 7 دقائق. نضح بعناية كل طاف باستخدام شفط فراغ في حاوية النفايات.
- دوامة بدقة الجزيئات المغناطيسية-streptavidin مترافق. إضافة 5 ميكرولتر من الجسيمات في 1 × 10 6 خلايا.
- تخلط جيدا ولكن بلطف. حافظ على مزيج في 6-12 درجة مئوية لمدة 30 دقيقة.
- إضافة صفها العازلة إلى تركيز 20-80 × 10 6 خلية / مل. نقل ما يصل إلى 1.0 مل المسمى خلايا لكل 12 × 75 مم الجولة القاع أنبوب اختبار (ويشار إليها باسم "أنبوب الإيجابي-جزء").
- ضع كل أنبوب الإيجابي-جزء على المغناطيس لمدة 6-8 دقيقة.
- مع أنابيب إيجابي-جزء لا يزال على المغناطيس، ونقل بعناية طاف من أنبوب الإيجابي-جزء مع الزجاج باستور الماصة إلى العقيمة 50 مل أنبوب مخروطي الشكل الجديد (referreد باسم "جزء المخصب"). هذا الكسر المخصب يحتوي على خلايا CD4 + T. يجب الحرص على عدم تعطيل الخلايا المسمى تنجذب إلى المغناطيس.
- Resuspend الخلايا غادرت في أنابيب إيجابي-الكسر في نفس الحجم من وصفها العازلة كما في الخطوة 3.6 قبل pipetting صعودا وهبوطا بقوة. وضع أنبوب الإيجابي-جزء مرة أخرى على المغناطيس لمدة 6-8 دقيقة.
- مع أنابيب إيجابي-جزء لا يزال على المغناطيس، ونقل بعناية طاف (المخصب جزء، CD4 +) من أنبوب الإيجابي-جزء مع الزجاج باستور الماصة لعقيمة 50 مل أنبوب مخروطي الشكل من الخطوة 3.8 دون تعطيل الخلايا تعلق على المغناطيس.
- كرر الخطوات من 3،9-3،10 لزيادة الغلة من خلايا CD4 + T التي تم الحصول عليها. تواصل البروتوكول باستخدام جزء المخصب (CD4 + الخلايا).
4. وضع العلامات والفرز خلايا 7
- الطرد المركزي التخصيب الخلايا في 450 x ج لمدة 7 دقائق. تجاهل طاف بصب قبالة أو فراغ suctايون في حاوية النفايات.
- Resuspend الخلايا في 1 مل من وصفها العازلة. إزالة قسامة من الخلايا لحساب وتقييم لبقاء الخلية التي الاستبعاد التريبان الأزرق كما في الخطوة 2.9.
- إضافة حجم وصفها العازلة إلى 10 × 10 6 خلية / مل. إذا الخلايا هي بالفعل <10 × 10 6، الطرد المركزي في 450 x ج لمدة 7 دقائق، تجاهل طاف بصب قبالة أو شفط فراغ في حاوية النفايات، وإضافة حجم وصفها العازلة إلى 10 × 10 6 خلية / مل.
- إعداد مأخوذة منفصلة من حوالي 5-10 × 10 5 خلايا لكل من خلايا غير ملوثين، الملطخة نمط إسوي، واحدة الملطخة السيطرة في أنابيب microfuge.
- إضافة 5 ميكروغرام / مل-CD4 FITC و 1 ميكروغرام / مل CD45RB-PE إلى الخلايا. إضافة البقع isotype السيطرة والبقع واحدة في نفس التركيز على المناسبة مأخوذة في أنابيب microfuge. تخلط جيدا ولكن بلطف واحتضان على الجليد محمية من الضوء لمدة 30 دقيقة.
- إضافة 10X حجم وصفها العازلة للخلايا والتحكمالصورة. الطرد المركزي 450 x ج لمدة 7 دقائق. تجاهل طاف بواسطة شفط فراغ في حاوية النفايات.
- resuspend في وصفها العازلة للحجم في الخطوة 4.5. الطرد المركزي 450 x ج لمدة 7 دقائق. تجاهل طاف بواسطة شفط فراغ في حاوية النفايات.
- resuspend في وصفها العازلة إلى 10 × 10 6 خلية / مل. تمر الخلايا من خلال 70 ميكرومتر مصفاة في أنبوب FACS. الحفاظ على الجليد محمية من الضوء لتصبح جاهزة للFACS.
- إعداد وتحديد التعويض المناسب على فارز الخلية مع الخلايا غير ملوثين والضوابط واحدة الملطخة.
- استبعاد الخلايا غير قابل للحياة مع forward- والجانبية مبعثر النابضة (الشكل 1A). إعداد النابضة لCD4 + وCD45RB + الخلايا مع الضوابط الملطخة نمط إسوي. خلايا البوابة على السكان CD4 +.
- نوع CD4 + الخلايا في CD45RB عالية وCD45RB السكان المنخفض باستخدام الرسم البياني بسيط للخلايا ملطخة PE في أنابيب مع 2 مل من وسائل الإعلام كاملة. وCD45RB عالية السكان يمثل أعلى 40٪ من CD4 + CD45RB + الخلايا (CD45RB عالي)، والسكان CD45RB منخفض هو أدنى 20٪ من CD4 + CD45RB + خلايا (منخفض CD45RB، الشكل 1B).
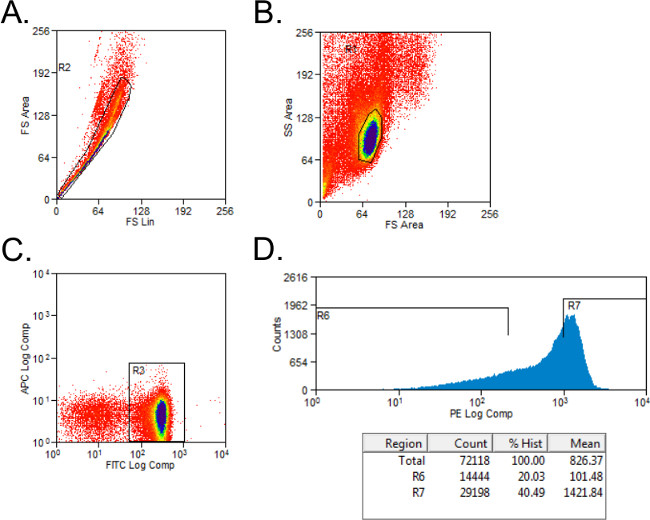
الشكل 1: تدفق الممثل الخلوي قطع CD4 + T CD45RB السكان الخلية خلال تحليل FACS (A - C) FITC CD4- وPE splenocytes CD45RB الملون من الجهات المانحة C57BL / 6 الفئران تم فرزها من قبل FACS CD4 + إلى CD45RB عالية وCD4 +. CD45RB منخفض T السكان الخلية. استبعدت الأحداث (A) دوبليه على مؤامرة مبعثر إلى الأمام. تم بوابات (ب) الخلايا اللمفاوية في الأمام والجانب مبعثر المؤامرة. (C) CD4 + وبوابات خلايا T، وتم التخطيط الخلايا (D) CD4 + T + CD45RB على PE مقابل الأحداث الرسم البياني. واعتبرت خلايا CD4 + CD45RB منخفضة لتكون أدنى 20٪ من CD45RB + الخلايا. وقد تم تحديد خلايا CD4 + عالية CD45RB بوصفها أعلى 40٪ من CD45RB + الخلايا.
- تشغيل قسامة من كل السكان الخلية على الجهاز FACS لتقييم نقاء للسكان.
- الطرد المركزي فرز الخلايا في 450 x ج لمدة 7 دقائق. resuspend في 1 مل PBS. إزالة قسامة من الخلايا لحساب وتقييم لبقاء الخلية التي الاستبعاد التريبان الأزرق كما في الخطوة 2.9.
5. حقن الخلايا إلى المستلمين
- في resuspend فرز الخلايا ل4 × 10 6 خلية / مل (CD45RB عالي) أو 2 × 10 6 خلية / مل (منخفض CD45RB) في برنامج تلفزيوني.
- نقل 100 ميكرولتر من خلايا عالية CD45RB في المتلقي لأنبوب معقم الجديد. إضافة 100 ميكرولتر من برنامج تلفزيوني فيالمتلقي لهذا الأنبوب. وهكذا، السعة الإجمالية حقن للحيوان الواحد هو 200 ميكرولتر، والمبلغ الإجمالي للخلايا في المتلقي هو 4 × 10 5 CD4 + T CD45RB خلايا ساذجة عالية.
- إذا كان المطلوب المجموعة التجريبية تلقي خلايا T التنظيمية، ونقل 100 ميكرولتر من خلايا عالية CD45RB في المتلقي لأنبوب معقم الجديد. إضافة 100 ميكرولتر من CD45RB خلايا منخفضة لكل متلق لنفس الأنبوب. إجمالي حجم حقن للحيوان الواحد هو 200 ميكرولتر. نسبة CD45RB عالية: CD45RB خلايا المنخفضة هي 2: 1.
- ضخ 100 ميكرولتر من CD45RB عالية أو CD45RB عالية / منخفضة CD45RB CD4 + الخلايا داخل الصفاق في الجانب الأيمن والأيسر من البطن (ما مجموعه 200 ميكرولتر) من كل مستلم.
6. مراقبة تقدم المرض في الحيوانات مستلم
- لتقييم الوضع السريري للحيوانات المتلقي، تعيين عشرات السريرية الإجمالية للparamete التاليةRS 8 يوم الحقن، أسبوعيا بعد ذلك، وفي وقت التضحية:
- تحديد إضاعة عن طريق قياس فقدان الوزن: 0 - لا يوجد نقص في الوزن؛ فقدان 0،1 حتي 10٪ من وزن الجسم الأولي - 1؛ 2 - فقدان أكثر من 10٪ من وزن الجسم الأولي (الشكل 2A).

الشكل 2: علامات المرضية السريرية والجسيمة لالتهاب تحدث بعد نقل من نوع CD4 + البرية CD45RB خلايا T عالية في Rag1 - / - والفئران المتلقي NRDKO 11 (A) المتلقين NRDKO فقدت في المتوسط 10٪ من وزن الجسم الأولية بنسبة 5. أسابيع بعد نقل، في حين Rag1- / - لم المتلقين تظهر علامات السريرية للمرض في هذا الوقت. كل نقطة تمثل نسبة متوسط وزن الجسم الأولي للفوج ± SEM. **، ع <0.005. (ب) بعض الفئران طورت التهاب معوي حاد، كما يتبين من وجود هبوط المستقيم. هذه هي صورة تمثيلية للهبوط المستقيم في الماوس المتلقي NRDKO. (C) بشكل صارخ، ونقطتين من كل من Rag1 - / - وسميكة الفئران المتلقي NRDKO وتقصير مقارنة كولون من Rag1 - / - والفئران NRDKO دون T خلية نقل بالتبني. كولون من الفئران المتلقي NRDKO تظهر التهاب شديد وزيادة الأوزان القولون (لا تظهر البيانات). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- تحديد نوعية البراز عن طريق وضع الحيوان في حاوية نظيفة حتى تزولالبراز: 0 - لا شيء؛ 1 - البراز اللين. 2 - البراز المائي و / أو دموي.
- تحديد الصحة العامة للحيوان بواسطة جود العلامات التالية للمرض: 0 - لا التقوس في الجلوس، شعيرات الفراء، أو الآفات الجلدية. 1 - أي واحد من الحاضرين التالية: منحنية الموقف، وشعيرات الفراء، أو الآفات الجلدية.
- تحديد جود هبوط المستقيم: 0 - غائبة. 1 - حتى الآن (الشكل 2B).
- التضحية الحيوانات عن طريق CO 2 استنشاق تليها خلع عنق الرحم عندما أنهم فقدوا 20٪ من وزن الجسم البداية أو في نقطة زمنية المطلوب، أيهما يأتي أولا. المرض السريري هو واضح عادة ابتداء من الساعة 5 الاسبوع بعد تخمة.
- تقييم لشدة المرض كما هو موضح سابقا 5،7.
- تعيين علامات سريرية كما في الخطوة 6.1 8.
- قياس طول القولون والوزن (الشكل 2C).
- لتحليل النسيجي للالتهاب5.
- تحديد عفوية التعبير خلوى في الأمعاء الثقافات يزدرع الأنسجة 9، الليمفاوية المساريقي الليمفاوية 10، و / أو المصل 11.
- لفترة وجيزة، للثقافات يزدرع 9، وإزالة كولون بعد التضحية، وفتح طوليا، ونظيفة مع برنامج تلفزيوني. احتضان كولون على شاكر المداري وضعت في 250 دورة في الدقيقة في وسائل الإعلام كاملة لمدة 30 دقيقة في درجة حرارة الغرفة.
- ختم الأنسجة الى قطع صغيرة وحضنت في 37 درجة مئوية في وسائل الإعلام كاملة لمدة 24 ساعة. جمع طاف واستخدامها لتحديد الكميات من السيتوكينات لكل 100 ملغ من الأنسجة ELISA.
- أداء توصيف المجراة سابقا من T الظواهر الخلية و / أو وظيفة 10.
Access restricted. Please log in or start a trial to view this content.
النتائج
حوالي 10 × 10 6 CD4 + T CD45RB خلايا عالية من 10 الطحال من الكبار C57BL / 6 الفئران المانحة معزولة بشكل موثوق. وهذا العدد تختلف حسب عمر وسلالة من الماوس المانحة والكفاءة للباحث. عندما 4 × 10 5 C57BL / يتم نقل 6 CD4 + T CD45RB خلايا عالية في C57BL / 6 Rag1 - / -
Access restricted. Please log in or start a trial to view this content.
Discussion
نحن هنا وصف بروتوكول خطوة بخطوة إحداث التهاب القولون في الفئران عن طريق نقل بالتبني من خلايا CD4 + T + CD45RB في الفئران العوز المناعي. كنا الطحال C57BL / 6 المانحة وRag1 مسانج - / - الفئران المتلقي، على الرغم من سلالات أخرى (على سبيل المثال، BALB / ج، 129S6...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
وأيد هذا العمل من قبل الجمعية الأمريكية الجهاز الهضمي (AGA) بحوث جائزة العلماء وكرون والتهاب القولون مؤسسة الأمريكية (CCFA) جائزة التطوير المهني (لSZS)، NIH NIDDK F30 DK089692 (لECS)، ومركز جامعة نورث كارولينا للبيولوجيا الجهاز الهضمي ومرض غرانت P30 DK34987 (علم الأنسجة الأساسية). ويدعم مرفق التدفق الخلوي UNC الأساسية في جزء منه من قبل مركز NCI الأساسية دعم جرانت (P30CA016086) إلى مركز UNC Lineberger الشامل للسرطان. ونحن نشكر لوقا B. بورست من ولاية كارولينا الشمالية جامعة كلية للطب البيطري لمساعدته مع تحليل الأنسجة والمناعية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
References
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416(2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437(2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved