Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La inducción de la inflamación intestinal murino por transferencia adoptiva de Efector CD4
En este artículo
Resumen
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
Resumen
Hay muchos modelos diferentes de animales disponibles para el estudio de la patogénesis de las enfermedades humanas inflamatorias del intestino (IBD), cada uno con sus propias ventajas y desventajas. Se describe aquí un modelo de colitis experimental que se inicia por la transferencia adoptiva de células de alta T CD4 + CD45RB singeneicos bazo en ratones receptores deficientes de células T y B. La población de células de alta T CD4 + CD45RB que consiste en gran parte de las células efectoras no tratados previamente es capaz de inducir la inflamación intestinal crónica, muy parecidas a aspectos clave de la EII humana. Este método puede ser manipulado para estudiar aspectos de la aparición de la enfermedad y la progresión. Además, puede ser utilizado para estudiar la función de innato y adaptativo, y las poblaciones de células inmunes reguladoras, y el papel de la exposición ambiental, es decir, la microbiota, en la inflamación intestinal. En este artículo se expone la metodología para la inducción de la colitis con un protocolo paso a paso. Esta incLudes un video de demostración de los aspectos técnicos clave necesarios para desarrollar con éxito este modelo murino de colitis experimental con fines de investigación.
Introducción
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: Asegúrese de que todos los animales protocolos son aprobados por y en cumplimiento con el empleo Comisión (IACUC) regulaciones Institucional Cuidado de Animales y el y el Manual del Consejo Nacional de Investigación para el Cuidado y Uso de Animales de Laboratorio. Los ratones donantes pueden ser ya sea hombre o mujer, pero los ratones receptores deben ser hombres. Si hembras receptoras se van a utilizar, los ratones donantes deben ser mujeres 5. Mantener colonias utilizando, ropa de cama no estéril y agua regulares no acidificado, porque éstos pueden afectar la microbiota intestinal y, por lo tanto, el fenotipo colitis de los ratones 5,6.
1. Preparación Experimental
- Utilice los medios y tampones heladas. Mantener células en hielo durante todo el experimento.
- Lleve a cabo el experimento en campana de bioseguridad estéril utilizando una técnica estéril.
2. Aislamiento de células T esplénica
- La eutanasia de ratón donante / ratones en CO 2 cámara seguidos por dislocatio cervicaln. Pulverizar abdomen con etanol al 70%.
- Haga una incisión horizontal en el abdomen y pelar la piel para exponer peritoneo. Mantenga peritoneo fuera de los órganos internos con los fórceps y hacer una incisión en el peritoneo abdominal izquierda para exponer y extirpar el bazo.
- Coloque el bazo en 10 ml de medios completos en un plato de Petri. Retire y deseche el exceso de tejido de bazo.
- Utilice 2 portaobjetos de vidrio esterilizados para aplastar y desmenuzar el bazo en la suspensión de una sola célula. Suspensión de células Filtrar a través de un colador de 70 micras en un tubo cónico de 50 ml y enjuague filtro con 5 ml de medios completos. Coloque un máximo de 5 bazos en un tubo cónico de 50 ml.
- Centrifugar las células a 450 xg durante 7 minutos. Desechar el sobrenadante vertiendo o por succión al vacío en un contenedor de residuos.
- Resuspender suavemente las células en 5 ml por bazo de tampón de lisis para lisar las células rojas de la sangre durante 10 min a temperatura ambiente. Añadir un volumen igual de completa Media (5 ml por bazo) en el tubo.
- centrifugar las células a 450 xg durante 7 minutos. Desechar el sobrenadante vertiendo o por succión al vacío en un contenedor de residuos.
- Resuspender las células en 10 ml de Etiquetado Buffer.
- Contar las células por exclusión de azul tripán.
- Retire 20 l de suspensión celular y añadir 180 l de azul de tripano a un tubo de microcentrífuga y mezclar bien. Después de 5 min, añadir 10 l de células hemocitómetro y contar las células no azules bajo el microscopio etiquetados. Determinar el número total de células viables. Deseche celular / azul tripán mezcla.
- Centrifugar las células en 10 ml de Etiquetado Buffer a 450 xg durante 7 minutos. Desechar el sobrenadante vertiendo o por succión al vacío en un contenedor de residuos.
3. Enriquecimiento de las células T CD4 +
NOTA: Siga las instrucciones del fabricante para los productos específicos que se utilizan en esta sección.
- Resuspender suavemente las células a una suspensión de una sola célula de 20 x 10 6 células / ml en frío Labeling Buffer.
- Añadir 5 l por 1 x 10 6 células T CD4 anticuerpos enriquecimiento celular con biotina. Se incuban las células en hielo durante 15 min.
- Añadir 10x volumen de Etiquetado Buffer. Centrifugar las células a 450 xg durante 7 minutos. Aspirar con cuidado todo el sobrenadante mediante aspiración al vacío en un contenedor de residuos.
- Completamente vórtice partículas magnéticas conjugadas con estreptavidina. Añadir 5 l de partículas por 1 x 10 6 células.
- Mezclar bien pero con suavidad. Mantener la mezcla a 6-12 ° C durante 30 min.
- Añadir Labeling Buffer a una concentración de 20-80 x 10 6 células / ml. Transferencia de hasta 1,0 ml células marcadas por tubo de ensayo de fondo redondo de 12 x 75 mm (en adelante, el "tubo-fracción positiva").
- Colocar cada tubo de fracción positiva en el imán durante 6-8 min.
- Con los tubos de fracción positiva fijas en el imán, transferir cuidadosamente el sobrenadante de tubo de fracción positiva con pipeta Pasteur de vidrio a un nuevo tubo cónico de 50 ml estériles (referred como la "fracción enriquecida"). Esta fracción enriquecida contiene células T CD4 +. Tenga cuidado de no romper las células marcadas atraídos por el imán.
- Resuspender las células dejan en los tubos de la fracción positiva en el mismo volumen de Etiquetado Buffer como en el paso 3.6 pipeta hacia arriba y hacia abajo con fuerza. Coloque el tubo-fracción positiva de vuelta en el imán de 6-8 min.
- Con tubos de fracción positiva fijas en el imán, transferir cuidadosamente el sobrenadante (fracción enriquecida, CD4 +) de tubo de fracción positiva con vidrio pipeta Pasteur estéril de 50 ml tubo cónico de paso 3.8 sin afectar las células unidas al imán.
- Repetir los pasos 3.9 a 3.10 para aumentar el rendimiento de las células T CD4 + obtenidos. Continuar utilizando protocolo fracción enriquecida (células CD4 +).
4. Etiquetado y ordenar celdas 7
- Centrifugar las células enriquecido a 450 xg durante 7 min. Desechar el sobrenadante vertiendo o SUCT vacíoiones en un contenedor de residuos.
- Resuspender las células en 1 ml de Etiquetado Buffer. Eliminar alícuota de células para contar y para evaluar la viabilidad celular por exclusión con azul de tripano como en el paso 2.9.
- Añadir un volumen de Etiquetado Buffer de 10 x 10 6 células / ml; si las células ya están <10 x 10 6, centrifugar a 450 xg durante 7 min, desechar el sobrenadante vertiendo o succión de vacío en el contenedor de residuos, y aumentar el volumen del etiquetado Buffer de 10 x 10 6 células / ml.
- Establecer alícuotas separadas de aproximadamente 5 a 10 × 10 5 células cada una de las células de control sin teñir, isotipo manchados, y de un solo manchado en tubos de microcentrífuga.
- Añadir 5 g / ml-CD4 FITC y 1 mg / ml CD45RB-PE a las células. Añadir manchas de control de isotipo y las manchas individuales a la misma concentración a partes alícuotas en tubos de microcentrífuga apropiarse. Mezclar bien pero suavemente y se incuba en hielo protegidas de la luz durante 30 min.
- Añadir 10x volumen de Etiquetado Buffer a las células y el controls. Centrífuga 450 xg durante 7 minutos. Desechar el sobrenadante por succión al vacío en un contenedor de residuos.
- Resuspender en Labeling Buffer de volumen en el paso 4.5. Centrífuga 450 xg durante 7 minutos. Desechar el sobrenadante por succión al vacío en un contenedor de residuos.
- Resuspender en Labeling Buffer de 10 x 10 6 células / ml. Pase células a través de 70 micras filtro en el tubo de FACS. Mantener en hielo protegido de la luz hasta el momento de FACS.
- Establecer y determinar la indemnización correspondiente en el clasificador de células con células sin teñir y controles individuales de colores.
- Excluir células no viables con gating a plazo y de dispersión lateral (Figura 1). Configure gating CD4 + y células CD45RB + con controles de isotipo manchados. Células Gate sobre la población CD4 +.
- Ordenar CD4 + CD45RB células en alto y CD45RB poblaciones de bajos utilizando un histograma simple para células PE-manchado en tubos con 2 ml de medios completos. El CD45RB alta población representa el más alto 40% de CD4 + CD45RB + células (CD45RB alta), y la baja población CD45RB es el 20% más bajo de células CD4 + CD45RB + (CD45RB baja; Figura 1B).
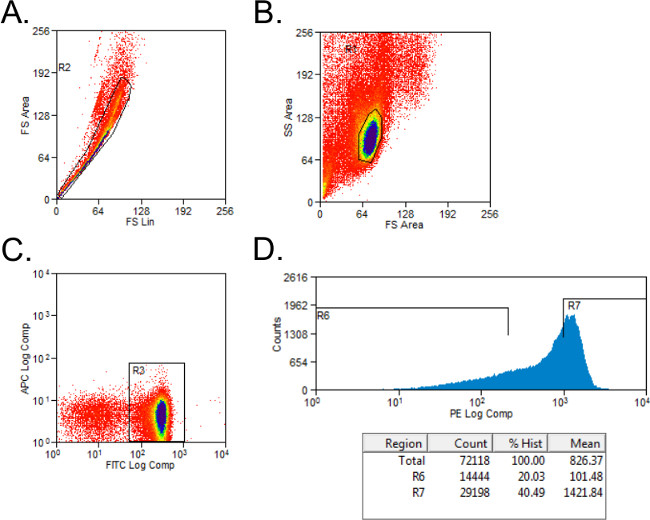
Figura 1: Flujo de Representante citometría de parcelas de poblaciones de células CD4 + CD45RB T durante el análisis FACS (A - C) FITC y CD4 PE esplenocitos CD45RB manchada-de donantes C57BL / 6 ratones fueron ordenados por FACS en CD4 + CD45RB alta y CD4 +. CD45RB poblaciones de células T baja. Eventos (A) Doublet fueron excluidos del gráfico de dispersión hacia adelante. (B) Los linfocitos fueron cerrada en la dispersión frontal y lateral trama. (C) CD4 + células T fueron cerrada, y las células T (D) CD4 + CD45RB + se representaron en un PE frente Eventos histograma. Bajo las células CD4 + CD45RB se consideraron el 20% más bajo de células CD45RB +. Pilas de gran CD4 + CD45RB se definieron como la más alta 40% de las células CD45RB +.
- Ejecutar una alícuota de cada población celular en la máquina de FACS para evaluar la pureza de las poblaciones.
- Centrífuga ordenadas células a 450 xg durante 7 minutos. Resuspender en 1 ml de PBS. Eliminar alícuota de células para contar y para evaluar la viabilidad celular por exclusión con azul de tripano como en el paso 2.9.
5. La inyección de células en Destinatarios
- Resuspender las células ordenadas a 4 x 10 6 células / ml (CD45RB alta) o 2 x 10 6 células / ml (CD45RB baja) en PBS.
- Transfiera 100 l de células de alta CD45RB por destinatario al nuevo tubo estéril. Añadir 100 l de PBS pordestinatario a este tubo. Por lo tanto, el volumen total de inyección por animal es de 200 l, y la cantidad total de células por beneficiario es de 4 altos células T ingenuas x 10 5 células CD4 + CD45RB.
- Si se desea grupo experimental que recibe las células T reguladoras, transferir 100 l de células de alta CD45RB por destinatario al nuevo tubo estéril. Añadir 100 l de células de baja CD45RB por destinatario al mismo tubo. Volumen total de inyección por animal es de 200 l; relación de alta CD45RB: células de baja CD45RB es 2: 1.
- Inyectar 100 l de CD45RB alta o CD45RB células de alta CD45RB bajos CD4 / + por vía intraperitoneal en el lado derecho e izquierdo del abdomen (un total de 200 l) de cada destinatario.
6. Seguimiento de la progresión de la enfermedad en los animales receptores
- Para evaluar el estado clínico de los animales receptores, asignar puntuaciones clínicas agregadas para los siguientes Parameters 8 en el día de la inyección, después semanalmente, y en el momento del sacrificio:
- Determinar perder midiendo la pérdida de peso: 0 - sin pérdida de peso; Pérdida de 0,1 a 10% del peso corporal inicial - 1; 2 - la pérdida de más de 10% del peso corporal inicial (Figura 2A).

Figura 2: signos patológicos y clínicos graves de inflamación se producen después de la transferencia de tipo salvaje células de alta T CD4 + CD45RB en Rag1 - / - y ratones receptores NRDKO 11 (A) los receptores NRDKO perdieron en promedio el 10% de su peso corporal inicial en un 5. semanas después de la transferencia, mientras que Rag1- / - Receptores no mostraron signos clínicos de la enfermedad en este momento. Cada punto representa la media del porcentaje de peso corporal inicial para la cohorte ± SEM. **, P <0,005. (B) algunas ratones desarrollaron inflamación intestinal grave, como se demuestra por la presencia de prolapso rectal. Esta es una imagen representativa de prolapso rectal en un ratón receptor NRDKO. (C) Grueso, dos puntos, tanto de Rag1 - / - y ratones receptores NRDKO se espesan y acortan en comparación con los dos puntos de Rag1 - / - y ratones NRDKO sin transferencia adoptiva de células T. Los dos puntos de los ratones receptores NRDKO muestran inflamación severa y aumento del peso de los dos puntos (datos no mostrados). Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Determinar la calidad de las heces mediante la colocación de los animales en un recipiente limpio hasta que haya pasadotaburete: 0 - ninguno; 1 - heces blandas; 2 - heces acuosas y / o con sangre.
- Determinar la salud general de los animales por la presencia de los siguientes signos de enfermedad: 0 - sin postura encorvada, erizado la piel, o la piel lesiones; 1 - cualquiera de los siguientes presente: encorvado postura, cerdas de piel o lesiones en la piel.
- Determinar la presencia de prolapso rectal: 0 - ausente; 1 - presente (Figura 2B).
- Sacrificar animales por inhalación de CO 2 seguido por dislocación cervical cuando han perdido el 20% de su peso corporal inicial o en el punto de tiempo deseado, lo que ocurra primero. La enfermedad clínica suele ser evidente a partir de las 5 semanas después de la reposición.
- Valorar la gravedad de la enfermedad a lo descrito previamente 5,7.
- Asignar puntuaciones clínicas como en el paso 6.1 8.
- Medir la longitud del colon y el peso (Figura 2C).
- Realizar el análisis histológico de la inflamación5.
- Determinar la expresión de citoquinas espontánea en cultivos de explantes de tejido intestinal 9, nódulos linfáticos mesentéricos 10, y / o suero 11.
- En pocas palabras, para cultivos de explantes 9, quitar dos puntos después del sacrificio, abierta longitudinalmente, y limpia con PBS. Incubar dos puntos en un agitador orbital fijado en 250 rpm en medios completos de 30 min a temperatura ambiente.
- Picar el tejido en trozos pequeños y se incubaron a 37 ° C en medios completos para 24 hr. Recoger el sobrenadante y usar para la cuantificación de citoquinas por 100 mg de tejido por ELISA.
- Realizar ex vivo caracterización de fenotipos de células T y / o la función 10.
Access restricted. Please log in or start a trial to view this content.
Resultados
Aproximadamente 10 x 10 6 células de alta T CD4 + CD45RB de 10 bazos de adultos C57BL / 6 ratones donantes son confiablemente aislado. Este número variará dependiendo de la edad y la cepa del ratón donante y el dominio del investigador. Cuando 4 x 10 5 C57BL / 6 celdas de alta T CD4 + CD45RB se transfieren a C57BL / 6 Rag1 - / - ratones receptores, los signos clínicos de la enfermedad surgen alrededor de la semana 5 después de la...
Access restricted. Please log in or start a trial to view this content.
Discusión
Aquí se describe un protocolo paso a paso la inducción de la inflamación del colon en ratones mediante la transferencia adoptiva de células T CD4 + CD45RB + en ratones inmunodeficientes. Se utilizó bazo C57BL / 6 donantes y Rag1 singénico - / - ratones receptores, aunque otras cepas (por ejemplo, BALB / c, 129S6 / SvEv, diabético no obeso (NOD)) modelos y genéticos de la inmunodeficiencia (por ejemplo, SCID, Rag2 - / -) también se p...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Este trabajo fue apoyado por la Asociación Americana de Gastroenterología (AGA) Investigación estudiosos Premio y la enfermedad de Crohn y Colitis Foundation of America (CCFA) Premio Desarrollo Profesional (a ENS), NIH NIDDK F30 DK089692 (ECS), y la Universidad de Carolina del Norte Centro de Biología Gastrointestinal y Grant Enfermedades P30 DK34987 (Histología Core). El Fondo para el flujo de Citometría de UNC es apoyado en parte por una subvención del NCI Core Support Center (P30CA016086) al Centro Integral del Cáncer de la UNC Lineberger. Damos las gracias a Lucas B. Borst de North Carolina State University College de Medicina Veterinaria por su ayuda con el análisis histopatológico e inmunohistoquímica.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
Referencias
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416(2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437(2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados