Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Efektör CD4 Evlatlık transferi ile Kemirgen Bağırsak Enflamasyon indüksiyonu
Bu Makalede
Özet
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
Özet
İnsan inflamatuar barsak hastalıklarının (IBD), kendi avantajları ve dezavantajları her patogenezi çalışmak için birçok farklı hayvan modelleri vardır. Burada T ve B hücresi eksik alıcı farelere singeneik dalak CD4 + CD45RB yüksek T hücrelerinin adoptif nakli ile başlatılır deneysel kolit modelini açıklar. Büyük ölçüde naif efektör hücrelerin oluşur CD4 + T hücre CD45RB yüksek popülasyonu yakından insan IBD'nin kilit yönlerini benzeyen, kronik bağırsak inflamasyonu uyarma yeteneğine sahiptir. Bu yöntem, hastalığın başlangıcında ve ilerlemesinde yönlerini incelemek için manipüle edilebilir. Ayrıca bağırsak iltihabı yani doğuştan gelen, adaptif fonksiyonlarını ve düzenleyici immün hücre popülasyonları ve çevresel maruziyet rolü, Mikrobiyota, incelemek için kullanılabilir. Bu yazıda, bir adım-adım protokolü ile Kolit için bir metodoloji göstermektedir. Bu incidarecisi başarıyla araştırma amaçlı deneysel kolit bu fare modeli geliştirilmesi için gerekli anahtar teknik yönlerini bir video gösterisi.
Giriş
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Tüm hayvan protokolleri ile ve Laboratuvar Hayvanları Bakım ve Kullanım Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) yönetmelik ve Ulusal Araştırma Konseyi'nin Kılavuz uygun onaylanmış emin olun. Verici fareler erkek veya kadın olabilir, ancak alıcı fareler erkek olmalıdır. Dişi alıcı kullanılacak ise, verici fareler 5 kadın olmalıdır. Böylece, farelerin 5,6 kolit fenotip, bu intestinal mikrobiyota etki edilebilir, düzenli olmayan steril yatak ve asitli-olmayan su kullanılarak koloni bakımı ve.
1. Deneysel hazırlanması
- Buz soğukluğunda ortamı ve tamponlar kullanın. Deney boyunca buz üzerinde hücreleri tutun.
- Steril tekniği kullanarak steril biyolojik tehlike kaput deney yapın.
Dalak T hücrelerinin 2. izolasyonu
- Donör fare / CO fareler servikal dislocatio 2 odacık ardından euthanizen. % 70 etanol ile karın püskürtün.
- Karın yatay bir kesi yapmak ve periton maruz cilt soymaya. Uzak forseps ile iç organlardan periton tutun ve ortaya çıkarmak ve dalağı tüketim sol karın periton bir kesi yapmak.
- Petri kabındaki tam ortam, 10 ml dalak yerleştirin. Çıkarın ve dalak aşırı doku atın.
- Ezmek ve tek hücre süspansiyonu içine dalak ayrı kızdırmak için 2 steril cam slaytlar kullanın. Filtre hücresi 50 ml konik tüp içine 70 mikron süzgeç vasıtasıyla süspansiyon ve tam Medya 5 ml süzgeç durulayın. Bir 50 ml konik tüp içinde 5 dalak kadar yerleştirin.
- 7 dakika için 450 xg'de Santrifüj hücreleri. Kapalı dökerek ya da atık kabına vakum emme ile süpernatant atın.
- Yavaşça, oda sıcaklığında 10 dakika boyunca, kırmızı kan hücrelerinin lize etmek için Lizis Tamponu dalak başına 5 ml süspansiyon hücrelerin. Tüpe tam ortam içinde eşit hacimde (dalak başına 5 mi) eklenir.
- Santrifüj hücreleri 7 dakika için 450 xg'de. Kapalı dökerek ya da atık kabına vakum emme ile süpernatant atın.
- Yavaşça Etiketleme Tampon, 10 ml hücreler tekrar süspansiyon.
- Tripan mavi dışlama hücreleri saymak.
- Hücre süspansiyonu 20 ul çıkarın ve bir mikrofüj tüpüne 180 ul, tripan mavisi ekleyin ve iyice karıştırın. 5 dakika sonra, hemositometrede ve mikroskop altında olmayan mavi hücreleri saymak için hücreleri etiketli 10 ul ekleyin. Canlı hücrelerin toplam sayısını belirleyin. Hücre / tripan mavi karışımı atın.
- 7 dakika boyunca 450 xg'de Etiketleme Tampon, 10 ml santrifüj hücreleri. Kapalı dökerek ya da atık kabına vakum emme ile süpernatant atın.
CD4 + T hücreleri 3. zenginleştirilmesi
NOT: Bu bölümde kullanılan belirli ürünler için üreticinin talimatlarına uyun.
- Yavaşça soğuk etiket 20 x 10 6 hücre / ml 'lik bir tek hücre süspansiyonuna hücreleri tekrar süspansiyoning Tampon.
- Biyotinlenmiş CD4 T hücresi zenginleştirme antikor 1 x 10 6 hücre başına 5 ul ekleyin. 15 dakika boyunca buz üzerinde kuluçkaya bırakılır.
- Etiketleme Tampon 10x hacim ekleyin. 7 dakika 450 × g Santrifüj hücreleri. Dikkatle atık kabına vakum emme kullanarak tüm süpernatant aspire.
- İyice streptavidin-konjuge manyetik parçacıklar girdap. 1 x 10 6 hücre başına parçacıkların 5 ul ekle.
- İyice fakat nazikçe karıştırın. 30 dakika boyunca, 6-12 ° C'de bir karışım tutun.
- 20-80 x 10 6 hücre / ml 'lik bir konsantrasyona kadar Etiketleme Tamponu ekleyin. 12 x 75 mm yuvarlak alt test tüpüne başına hücreleri etiketli 1.0 ml kadar aktarın ("pozitif kesir tüp" olarak anılacaktır).
- 6-8 dakika mıknatıs her olumlu-fraksiyon tüpü yerleştirin.
- Mıknatıs hala pozitif kesir tüpleri ile dikkatlice (yeni steril 50 ml konik tüp cam Pasteur pipet ile pozitif fraksiyon tüpten referre süpernatant aktarmak"zenginleştirilmiş fraksiyon") olarak d. Bu zenginleştirilmiş fraksiyon, CD4 + T hücrelerini içerir. Mıknatıs çekti etiketli hücreleri bozmak için değil dikkatli olun.
- Süspanse edin hücreleri aşağı yukarı şiddetle pipetleme ve adım 3.6 gibi Etiketleme Tampon aynı hacimde pozitif kesir tüplerde bıraktı. 6-8 dakika geri mıknatıs üzerinde pozitif kesir tüpü yerleştirin.
- Mıknatıs hala pozitif kesir tüpleri ile dikkatlice mıknatıs bağlı hücrelerin aksatmadan 50 ml Aşama 3,8 konik tüp, steril cam Pasteur pipet ile pozitif fraksiyon tüp süpernatant (zenginleştirilmiş fraksiyonu, CD4 +) aktarın.
- Tekrar Elde edilen CD4 + T hücrelerinin verimini artırmak için 3,9-3,10 adımları tekrarlayın. Zenginleştirilmiş fraksiyon (CD4 + hücreleri) kullanılarak protokolü devam edin.
4. Etiketleme ve sıralama Hücreler 7
- Santrifüj 7 dakika için 450 xg'de hücreleri zenginleştirilmiş. Veya vakum emilmesini kapalı dökerek süpernatant atınatık kabına iyon.
- Etiketleme, 1 ml tampon içinde süspanse hücreleri. Saymak ve aşama 2.9 olarak tripan mavisi eksklüzyonu ile hücre canlılığı değerlendirmek için hücreler kısım çıkarın.
- 10 x 10 6 hücre / ml Etiketleme getirme tamponunun bir hacminin ilave et; hücrelerin önceden ise <10 x 10 6, 7 dakika boyunca 450 x g'de santrifüj, atık kabı içine dökülen ya da vakum emiş ile süpernatan atılır ve 10 x 10 6 hücre / ml Etiketleme Tamponu hacmi ekleyin.
- Mikrofüj tüplerinde izotip lekeli, boyanmadan ve tek boyanmış kontrol hücreleri için yaklaşık 5-10 x 10 5 hücre, her biri ayrı ayrı alikotları ayarlayın.
- Hücrelere 5 ug / ml CD4-FITC ve 1 ug / ml CD45RB-PE ekleyin. Mikrofüj tüplerinde alikotları mülk aynı konsantrasyonda izotip kontrol lekeleri ve tek lekeler ekleyin. Iyi bir şekilde fakat nazikçe karıştırın ve 30 dakika için ışıktan korunması buz üzerinde inkübe edilir.
- Hücre ve kontrolü Etiketleme Tampon 10x hacmi ekles. 7 dakika Santrifüj 450 xg. Atık kabına vakum emme ile süpernatant atın.
- Adım 4.5 hacme Etiketleme Tampon süspanse. 7 dakika Santrifüj 450 xg. Atık kabına vakum emme ile süpernatant atın.
- 10 x 10 6 hücre / ml Etiketleme Tamponu içinde yeniden süspanse edin. FACS tüpüne 70 mikron süzgeç vasıtasıyla hücrelere geçerler. FACS için hazır olana kadar ışıktan korunan buz üzerinde tutun.
- Set up ve boyanmamış hücreler ve tek lekeli kontrolleri ile hücre sıralayıcı uygun tazminat belirler.
- Ileriye ve yan dağılım yolluk (Şekil 1A) ile cansız hücreleri hariç. Izotip-lekeli kontrolleri ile CD4 + ve CD45RB + hücreleri için yolluk ayarlayın. CD4 + nüfus Kapı hücreleri.
- Tam ortam, 2 ml tüplere PE-boyanmış hücreler için basit bir histogram kullanarak yüksek CD45RB ve CD45RB alt popülasyon kriteri CD4 + hücreleri. Yüksek CD45RB nüfus CD4 + CD45RB + hücreleri (yüksek CD45RB) en yüksek% 40 temsil eder ve CD45RB alt popülasyonu, CD4 + CD45RB + hücrelerinin en% 20 (alt CD45RB, Şekil 1B).
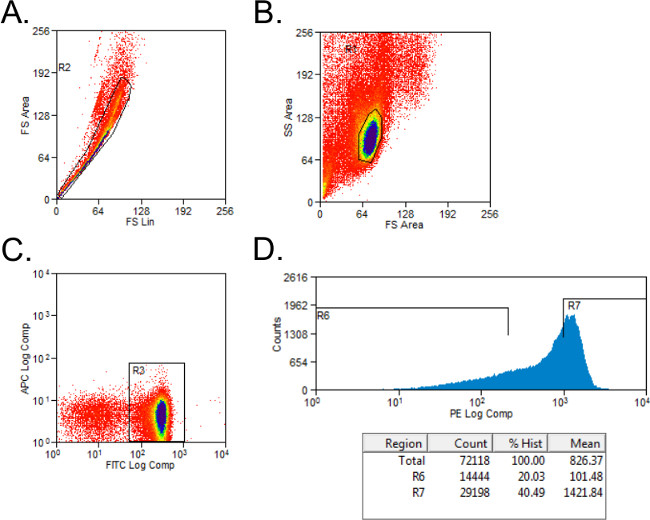
Şekil 1: FACS analizi sırasında, CD4 + CD45RB, T hücre popülasyonlarının sitometrisi lekeleri Örnek akımı (A - C), FITC CD4 ve PE içine FACS ile sınıflandırılmıştır verici, C57BL / 6 farelerinden alınan splenositler CD45RB lekeli CD4 + CD45RB yüksek ve CD4 +. CD45RB alt T hücresi popülasyonu. (A) Doublet olayları ileri dağılım arsa üzerinde dışı bırakıldı. (B) lenfositler ileri ve yan dağılım arsa kapılı edildi. (C), CD4 + T hücreler geçitlendi ve (D) CD4 + CD45RB + T hücreleri, PE karşı etkinlikler histogram çizilmiştir. CD4 + CD45RB alt hücreler, CD45RB + hücrelerinin en% 20 olarak kabul edildi. CD4 + CD45RB, yüksek hücre CD45RB + hücrelerinin en yüksek% 40 olarak tayin edilmiştir.
- Popülasyonlarının saflığı analiz etmek üzere FACS makinede her bir hücre popülasyonunun bir kısım çalıştırın.
- Santrifüj 7 dakika için 450 xg'de hücreleri sıralanır. 1 ml PBS içinde yeniden süspanse. Saymak ve aşama 2.9 olarak tripan mavisi eksklüzyonu ile hücre canlılığı değerlendirmek için hücreler kısım çıkarın.
Alıcılar içine Hücreleri 5. Enjeksiyon
- Süspanse 4 x 10 6 hücre / ml (CD45RB yüksek) veya PBS 2 x 10 6 hücre / ml (düşük CD45RB) hücreleri sıralanır.
- Yeni steril tüpe alıcı başına CD45RB yüksek hücrelerin 100 ul aktarın. PBS Başı 100 ul ekleyinbu tüp alıcısı. Bu nedenle, hayvan başına toplam enjeksiyon hacmi 200 ul ve alıcı için hücrelerin toplam miktarı, 4 x 10 5, CD4 + CD45RB yüksek naiv T hücreleri.
- Regülatör T hücreleri alan deney grubu arzu edildiği takdirde, yeni bir steril tüpe alıcı için CD45RB, yüksek hücre 100 ul aktarın. Aynı tüp alıcı başına CD45RB düşük hücrelerin 100 ul ekleyin. Hayvan başına toplam enjeksiyon hacmi 200 ul; CD45RB yüksek oranı: CD45RB alt hücreler 2: 1 dir.
- Yüksek / düşük CD45RB CD4 + hücreleri intraperitoneal her alıcının karın (200 ul toplam) sağ ve sol tarafına CD45RB yüksek veya CD45RB 100 ul enjekte edilir.
Alıcı Hayvanlarda Hastalık ilerleme 6. İzleme
- Alıcı hayvanların klinik durumunu değerlendirmek aşağıdaki Paramete için toplam klinik skorları atamak içinEnjeksiyon gününde rs 8 haftalık sonra, ve kurban sırasında:
- Kilo kaybı ölçerek israf belirleyin: 0 - hayır kilo kaybı; 1 - İlk vücut ağırlığının% 0.1-10 kaybı; 2 - Başlangıç vücut ağırlığı (Şekil 2A), ve% 10'dan daha fazla zarar.

Şekil 2: inflamasyonun klinik ve toptan patolojik işaretler Rag1 içine yabani tip CD4 + CD45RB yüksek T hücrelerinin transferinden sonra meydana - / - 11 (A) 'NRDKO alıcıları 5 ile başlangıç vücut ağırlıkları 10 ortalama% kayıp NRDKO alıcı fareler. haftalar sonrası transfer, Rag1 ise- / - Alıcıları, şu anda, hastalığın klinik belirtilerini göstermemiştir. Her nokta ± SEM kohort için başlangıç vücut ağırlığının ortalama yüzdesini temsil eder. ** P <0.005. Rektal prolapsus varlığı ile gösterildiği gibi (B) Bazı fareler, şiddetli bağırsak iltihabı geliştirdi. Bu NRDKO alıcı fare rektal prolapsus temsili resim. (C) Büyük oranda, gelen iki nokta üst üste, hem Rag1 - / - ve NRDKO alıcı fareler Rag1 gelen iki nokta üst üste ile karşılaştırıldığında kalınlaşmış ve kısaltılmış - / - ve T hücre evlatlık transferi olmadan NRDKO fareler. NRDKO alıcı farelerin kolonlar şiddetli inflamasyon ve artan kolon ağırlıkları (veriler gösterilmemiştir) gösterir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- O geçene kadar temiz bir kaba hayvan yerleştirerek dışkı kalitesini belirleyinDışkı: 0 - yok; 1 - yumuşak dışkı; 2 - sulu ve / veya kanlı dışkı.
- Hastalığın belirtileri aşağıdaki varlığı ile hayvanın genel sağlık belirleyin: 0 - hayır kambur duruş, kürk, ya da cilt lezyonları kıllı; 1 - Aşağıdaki mevcut herhangi bir: kambur duruş, kürk, deri lezyonları veya kıllı.
- Rektal prolapsus varlığı belirleyin: 0 - devamsızlık; 1 - Mevcut (Şekil 2B).
- Bu, başlangıç vücut ağırlığına göre% 20 kayıp ya da hangisi daha önce arzu edilen bir zaman noktasında, var olduğunda CO, sonra servikal dislokasyon 2 inhalasyon hayvanlar kurban. Klinik hastalık haftada 5 sonrası dolgunluk başlayan tipik açıktır.
- Daha önce açıklandığı gibi 5,7 hastalık şiddeti değerlendirmek.
- Adım 6.1 8 gibi klinik skorları atayın.
- Kolon uzunluğu ve ağırlığı (Şekil 2C) ölçün.
- Inflamasyon histolojik analiz gerçekleştirin5.
- Bağırsak doku eksplant kültürlerinde 9 spontan sitokin ifadesini belirleyin, mezenterik lenf düğümleri 10, ve / veya serum 11.
- Kısaca, eksplant kültürler 9, uzunlamasına açık, kurban sonrası iki nokta üst üste kaldırmak ve PBS ile temiz. Oda sıcaklığında 30 dakika boyunca tam ortam içinde 250 rpm'de bir orbital çalkalayıcı üzerinde iki nokta üst üste inkübe edin.
- Küçük parçalar halinde doku doğranır ve 24 saat süre ile tam ortam içinde, 37 ° C'de inkübe edildi. Süpernatan toplamak ve ELISA ile 100 mg doku başına düşen sitokinlerin miktarının belirlenmesi için kullanılır.
- T hücre fenotipleri ve / veya fonksiyon 10 ex vivo karakterizasyonu gerçekleştirin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Yaklaşık yetişkin, C57BL / 6 verici fareden 10 dalaklarından 10 x 10 6, CD4 + T hücreleri, CD45RB yüksek güvenilir izole edilir. Bu sayı yaşla ve gerginlik verici fare ve araştırmacı yeterliliğine bağlı olarak değişecektir. Ne zaman 4 x 6 CD4 + T hücreleri CD45RB yüksek C57BL / 6 Rag1 aktarılır / 10 5 C57BL - / - alıcı fareler, hastalığın klinik belirtileri hafta 5 sonrası dolgunluk etrafında ortaya veya far...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada bağışıklık yetersizliği olan farelere, CD4 + CD45RB + T hücrelerinin adoptif nakli ile farelerde kolon inflamasyonu yol açan bir adım adım protokol açıklar. Alıcı fareler başka soybaşları rağmen (örneğin, BALB / c, 129S6 / SvEv, obez olmayan diyabetik (NOD)) immün yetmezlik ve genetik modelleri (örneğin, SCID, Rag2 - / - Bu, C57BL / 6 verici dalak ve genetik olarak özdeş Rag1 kullanılan - / -) da 4,14-16...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
Bu çalışma, Amerikan Gastroenteroloji Derneği (AGA) Araştırma Alimler Ödülü ve Crohn ve Amerika (CCFA) (ECS) (SZS için) Kariyer Geliştirme Ödülü NIH NIDDK F30 DK089692 Kolit Vakfı ve Gastrointestinal Biyoloji Kuzey Carolina Merkezi'nin Üniversitesi tarafından desteklenen ve Hastalık Hibe P30 DK34987 (Histoloji Çekirdek). UNC Sitometrisi Çekirdek Tesisi UNC Lineberger Kapsamlı Kanser Merkezi'nde bir NCI Merkezi Çekirdek Desteği Grant (P30CA016086) tarafından kısmen desteklenmektedir. Biz histopatolojik analiz ve immunohistokimyasal ile yaptığı yardım için Veteriner North Carolina State University College Luke B. Borst teşekkür ederim.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
Referanslar
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416(2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437(2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır