Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Induktion von Murine Darmentzündungen durch adoptiven Transfer von Effektor CD4
In diesem Artikel
Zusammenfassung
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
Zusammenfassung
Es gibt viele verschiedene Tiermodelle zum Untersuchen der Pathogenese von menschlichen entzündlichen Darmerkrankungen (IBD), die jeweils ihre eigenen Vor- und Nachteile vorhanden. Wir beschreiben hier eine experimentelle Colitis-Modell, das durch adoptiven Transfer von syngenen Milz CD4 + CD45RB hoch -T-Zellen in T-und B-Zell-defizienten Mäusen Empfänger eingeleitet wird. Die CD4 + CD45RB hoch T-Zellpopulation, die größtenteils aus naiven Effektorzellen induzieren kann chronische Darmentzündung, sehr ähnlich wichtige Aspekte der menschlichen IBD. Dieses Verfahren kann manipuliert werden, um Aspekte der Krankheit Beginn und Fortschreiten zu untersuchen. Zusätzlich kann es für die Funktion der angeborenen, adaptive und regulatorische Immunzellpopulationen, und die Rolle von Umweltfaktoren, das heißt, die Mikroflora im Darmentzündung zu untersuchen. In diesem Artikel erläutern wir die Methode zur Induzierung ulcerosa mit einer Schritt-für-Schritt-Protokoll. Diese includes eine Video-Demonstration der wichtigsten technischen Aspekte erforderlich, um diese Mausmodell der experimentellen Kolitis zu Forschungszwecken erfolgreich zu entwickeln.
Einleitung
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Protokoll
HINWEIS: Stellen Sie sicher, dass alle Tier Protokolle werden von und in Übereinstimmung mit Institutional Animal Care und Verwenden Committee (IACUC) Vorschriften und der National Research Council Handbuch für die Pflege und Verwendung von Labortieren zugelassen. Spendermäusen kann entweder männlich oder weiblich ist, aber Empfängermäuse sollte männlich. Wenn weibliche Empfänger zu verwenden sind, müssen die Spendermäuse female 5 sein. Pflegen Kolonien regelmäßig, unsteril Betten und nicht angesäuerten Wasser mit, da diese die Darmflora auswirken, und damit die Colitis Phänotyp der Mäuse 5,6.
1. Versuchsvorbereitung
- Verwenden eiskalte Medien und Puffer. Halten Zellen auf Eis während des Experimentes.
- Führen Sie das Experiment in sterile Biohazard Haube mit steriler Technik.
2. Isolierung von Milz-T-Zellen
- Einschläfern Spendermaus / Mäuse in CO 2 Kammer durch zervikale Dislocatio gefolgtn. Spray Abdomen mit 70% Ethanol.
- Machen Sie einen horizontalen Schnitt im Bauch und abziehen Haut Bauchfell aus. Halten Bauchfell entfernt von der inneren Organe mit der Zange und einen Einschnitt in der linken Bauchfell zu entlarven und die Milz herausschneiden.
- Legen Sie die Milz in 10 ml Komplett Medien in einer Petrischale. Entfernen und entsorgen Sie überschüssiges Gewebe von Milz.
- Verwenden Sie 2 sterilisiert Glasobjektträger zu zerkleinern und necken neben der Milz in Einzelzellsuspension. Filterzellensuspension durch ein 70 um Sieb in einem 50 ml konischen Röhrchen und spülen Sieb mit 5 ml Vollmedium. Platzieren Sie bis zu 5 Milz in einem 50 ml konischen Röhrchen.
- Zentrifuge Zellen bei 450 g für 7 min. Überstand verwerfen durch Abgießen oder durch Vakuumsauger in Abfallbehälter geben.
- Vorsichtig resuspendieren Zellen in 5 ml pro Milz Lysispuffer an Erythrozyten für 10 Minuten bei Raumtemperatur lysiert. Gleiches Volumen Vollmedium (5 ml pro Milz) zu dem Rohr.
- Centrifuge Zellen bei 450 g für 7 min. Überstand verwerfen durch Abgießen oder durch Vakuumsauger in Abfallbehälter geben.
- Vorsichtig in 10 ml Labeling Buffer resuspendieren Zellen.
- Zählen von Zellen durch Trypanblau-Ausschluss.
- Entfernen Sie 20 ul Zellsuspension und fügen Sie 180 ul Trypanblau auf ein Mikrozentrifugenröhrchen geben und gut mischen. Nach 5 Minuten, fügen Sie 10 ul markierte Zellen zu Hämozytometer und zählen nicht-blauen Zellen unter dem Mikroskop. Ermittlung der Gesamtzahl der lebensfähigen Zellen. Entsorgen Sie Zell / Trypanblau-Mix.
- Zentrifuge Zellen in 10 ml Markierungspuffer bei 450 × g für 7 min. Überstand verwerfen durch Abgießen oder durch Vakuumsauger in Abfallbehälter geben.
3. Anreicherung von CD4 + T-Zellen
Hinweis: Folgen Sie den Anweisungen des Herstellers für bestimmte Produkte in diesem Abschnitt verwendet.
- Vorsichtig resuspendieren Zellen zu einer Einzelzell-Suspension von 20 x 10 6 Zellen / ml in kaltem Etikettening Buffer.
- Mit 5 & mgr; l pro 1 × 10 6 Zellen von biotinyliertem CD4 T-Zell-Anreicherung Antikörper. Inkubieren Zellen auf Eis für 15 min.
- Fügen 10x Volumen Labeling Buffer. Zentrifuge Zellen bei 450 · g für 7 min. Sorgfältig absaugen all des Überstandes mit Vakuumsauger in Abfallbehälter geben.
- Gründlich vortexen Streptavidin-konjugierten magnetischen Partikeln. Mit 5 ul der Teilchen pro 1 x 10 6 Zellen.
- Mischen Sie gründlich, aber vorsichtig. Halten Gemisch bei 6-12 ° C für 30 min.
- Hinzufügen Markierungspuffer auf eine Konzentration von 20-80 x 10 6 Zellen / ml. Übertragung von bis zu 1,0 ml pro 12 x 75 mm Rund Reagenzglas markierten Zellen (als "positive-Bruch Rohr" bezeichnet).
- Platzieren Sie jede positive Fraktion Rohr auf Magneten für 6-8 min.
- Mit den positiven Fraktion Rohre noch auf den Magneten, Überstand vorsichtig Transfer vom positiven Bruchrohr mit Glas Pasteur-Pipette in ein neues steriles 50 ml konischen Röhrchen (referred als "angereicherte Fraktion"). Diese angereicherte Fraktion enthält CD4 + T-Zellen. Achten Sie darauf, um die markierten Zellen mit dem Magneten angezogen zu stören.
- Die Zellen in der positiven Fraktion Rohre in dem gleichen Volumen des Markierungspuffer durch Auf- und Abpipettieren kräftig nach links, wie in Schritt 3.6. Zeigen positive Fraktion Rohr wieder auf Magneten für 6-8 min.
- Mit positiven Bruchrohre noch auf den Magneten, sorgfältig überStand (angereicherte Fraktion, CD4 +) von positiv-Bruchrohr mit Glaspasteurpipette auf 50 ml ohne Unterbrechung Zellen Magneten befestigt sterile konische Röhrchen aus Schritt 3.8.
- Die Schritte 3,9-3,10 um die Ausbeute an CD4 + T-Zellen erhalten erhöhen. Weiter Protokoll mit angereicherten Fraktion (CD4 + Zellen).
4. Beschriften und Sortieren von Zellen 7
- Zentrifuge angereicherten Zellen bei 450 g für 7 min. Überstand verwerfen durch Abgießen oder Vakuum SUCTIonen in die Abfallbehälter.
- Zellen in 1 ml Markierungspuffer. Entfernen Aliquot von Zellen zu zählen und um die Lebensfähigkeit der Zellen durch Trypanblau-Ausschluss, wie in Schritt 2.9 zu beurteilen.
- Hinzufügen eines Volumens von Markierungspuffer bis 10 x 10 6 Zellen / ml; Wenn Zellen bereits <10 x 10 6, Zentrifuge bei 450 · g für 7 min, verwerfen Stand durch Abgießen oder Vakuumansaugung in den Abfallbehälter und fügen Volumen Markierungspuffer bis 10 x 10 6 Zellen / ml.
- Getrennte Teilmengen von etwa 5-10 x 10 5 Zellen je Set für ungefärbte, Isotyp-gefärbt und einzelne befleckten Kontrollzellen in Mikrozentrifugenröhrchen.
- Mit 5 & mgr; g / ml CD4-FITC und 1 ug / ml CD45RB-PE an Zellen. Hinzufügen Isotypkontrolle Flecken und einzelne Flecken in der gleichen Konzentration zu Aliquots in Mikrozentrifugenröhrchen eignen. Gut mischen, aber sanft und Inkubation auf Eis vor Licht für 30 Minuten geschützt.
- Fügen 10x Volumen Labeling Buffer, um Zellen und Steuers. Zentrifuge 450 g für 7 min. Überstand verwerfen durch Vakuumansaugung in Abfallbehälter geben.
- Resuspendieren in Markierungspuffer zu Volumen in Schritt 4.5. Zentrifuge 450 g für 7 min. Überstand verwerfen durch Vakuumansaugung in Abfallbehälter geben.
- Resuspendieren in Markierungspuffer auf 10 x 10 6 Zellen / ml. Pass Zellen durch 70 & mgr; m Sieb in FACS-Röhrchen. Halten Sie auf dem Eis vor Licht geschützt, bis sie zur FACS.
- Einzurichten und zu bestimmen, eine angemessene Entschädigung für die Zellsortierer mit ungefärbten Zellen und Single-gefärbten Kontrollen.
- Ausschließen nonviable Zellen mit Vorwärts- und Seitenstreuung Gating (1A). Up Gating für CD4 + und CD45RB + -Zellen mit Isotyp-gefärbten Bedienelemente ein. Gate-Zellen auf CD4 + -Population.
- Sortieren CD4 + Zellen in CD45RB hoch und niedrig CD45RB Populationen mit einem einfachen Histogramm für PE-gefärbten Zellen in Röhrchen mit 2 ml Komplett Medien. Die CD45RB hoch Bevölkerung stellt die höchsten 40% der CD4 + CD45RB + -Zellen (CD45RB hoch), und die CD45RB niedrig Bevölkerung ist die untersten 20% der CD4 + CD45RB + -Zellen (CD45RB niedrig; 1B).
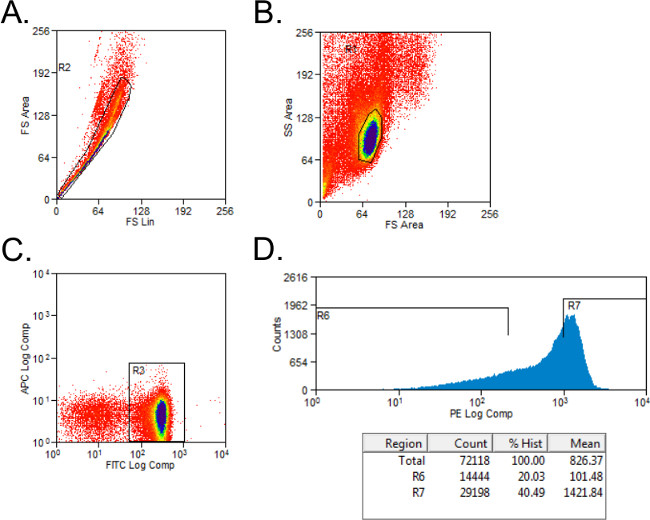
Abbildung 1: Repräsentative Durchflusszytometrie Plots von CD4 + CD45RB T-Zell-Populationen während der FACS-Analyse (A - C) FITC CD4- und PE CD45RB-gefärbten Splenozyten aus Spender C57BL / 6-Mäuse wurden durch FACS sortiert in CD4 + CD45RB hoch und CD4 +. CD45RB geringe T-Zell-Populationen. (A) Doublet Ereignisse auf der vorderen Streudiagramm ausgeschlossen. (B) Lymphozyten wurden in Vorwärts- und Seitenstreudiagramm gated. (C) CD4 + T-Zellen wurden gated, und (D) CD4 + CD45RB + T-Zellen wurden auf einer PE gegen Events Histogramm aufgetragen. CD4 + CD45RB niedrigen Zellen wurden als die niedrigste 20% der CD45RB + Zellen sein. CD4 + CD45RB hoch Zellen wurden als die höchste 40% CD45RB + -Zellen bestimmt.
- Führen Sie ein Aliquot jeder Zellpopulation auf dem FACS-Maschine, um die Reinheit der Bevölkerung zu bewerten.
- Zentrifuge sortierten Zellen bei 450 g für 7 min. Resuspendieren in 1 ml PBS. Entfernen Aliquot von Zellen zu zählen und um die Lebensfähigkeit der Zellen durch Trypanblau-Ausschluss, wie in Schritt 2.9 zu beurteilen.
5. Die Injektion von Zellen in Empfänger
- Resuspendieren sortierten Zellen auf 4 x 10 6 Zellen / ml (CD45RB hoch) oder 2 x 10 6 Zellen / ml (CD45RB niedrig) in PBS.
- Übertragen Sie 100 ul von CD45RB hoch Zellen pro Empfänger zu neuen sterilen Röhrchen. Geben Sie 100 ul PBS proEmpfänger dieser Röhre. So ist die Gesamtinjektionsmenge pro Tier 200 ul und Gesamtbetrag der Zellen pro Empfänger 4 x 10 5 CD4 + CD45RB hoch naiven T-Zellen.
- Wenn Versuchsgruppe, die regulatorischen T-Zellen erwünscht ist, dann 100 ul der CD45RB hoch Zellen pro Empfänger zu neuen sterilen Röhrchen. 100 l CD45RB niedrigen Zellen pro Empfänger auf die gleiche Röhre. Gesamtinjektionsmenge pro Tier ist 200 ul; Verhältnis von CD45RB hoch: CD45RB niedrigen Zellen ist 2: 1.
- Injizieren Sie 100 ul von CD45RB hoch oder CD45RB hoch / niedrig CD45RB CD4 + Zellen intraperitoneal in der rechten und linken Seite des Bauches (insgesamt 200 ul) jedes Empfängers.
6. Überwachung der Krankheitsprogression in Empfängertiere
- Um den klinischen Zustand der Empfängertiere zu bewerten, weisen Gesamt klinischen Scores für das folgende parameters 8 am Tag der Injektion, danach wöchentlich und bei der Opferung:
- Bestimmen Sie verschwenden durch Messung Gewichtsverlust: 0 - keine Gewichtsabnahme; 1 - 0,1 bis 10% Verlust der ursprünglichen Körpergewichts; 2 - mehr als 10% Verlust der ursprünglichen Körpergewichts (Abbildung 2A).

Abbildung 2: Klinische und pathologische Anzeichen einer Entzündung nach der Übertragung von Wildtyp-CD4 + CD45RB hoch -T-Zellen in Rag1 auftreten - / - und NRDKO Empfängermäuse 11 (A) NRDKO Empfänger verloren im Durchschnitt 10% ihres ursprünglichen Körpergewicht um 5. Wochen nach der Übertragung, während Rag1- / - Empfänger nicht klinischen Anzeichen einer Krankheit aufweisen, zu diesem Zeitpunkt. Jeder Punkt stellt den Mittelwert Prozentsatz der anfänglichen Körpergewicht für die Kohorte ± SEM. ** P <0.005. (B) Einige Mäuse entwickelten eine schwere Darmentzündung, wie durch die Anwesenheit von Rektumprolaps demonstriert. Dies ist ein repräsentatives Bild der Darmvorfall in einem NRDKO Empfängermaus. (C) Stark, Doppelpunkte sowohl Rag1 - / - und NRDKO Empfängermäuse sind verdickt und verkürzt im Vergleich zu Doppelpunkte von Rag1 - / - und NRDKO Mäuse ohne T-Zell-adoptiven Transfer. Colons von NRDKO Empfängermäuse zeigen schwere Entzündung und erhöhte Dickgewichte (Daten nicht gezeigt). Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
- Bestimmen Sie die Qualität des Stuhls, indem Tier in sauberen Behälter, bis sie durchlaufen hatHocker: 0 - keine; 1 - weicher Stuhl; 2 - tränende und / oder Blut im Stuhl.
- Bestimmen Sie die allgemeine Gesundheit des Tieres durch die Anwesenheit der folgenden Anzeichen einer Krankheit: 0 - keine gekrümmte Haltung, Borsten Fell oder Hautläsionen; 1 - einem der folgenden vorhanden: gekrümmte Haltung, Borsten Fell oder Hautveränderungen.
- Bestimmen Vorhandensein Rektumprolaps: 0 - nicht vorhanden; 1 - vorhanden ist (2B).
- Opfern Tiere durch CO 2 Inhalation gefolgt durch Genickbruch, wenn sie 20% ihres Ausgangskörpergewicht verloren gehen oder in gewünschten Zeitpunkt, je nachdem was zuerst eintritt. Klinischen Erkrankung ist in der Regel erkennbar ab Woche 5 post Fülle.
- Beurteilen der Schwere der Erkrankung, wie oben beschrieben 5,7.
- Vergeben klinischen Scores, wie in Schritt 6.1 8.
- Messen Kolon Länge und das Gewicht (2C).
- Führen Sie die histologische Analyse der Entzündung5.
- Bestimmen spontane Zytokinexpression in Darmgewebe Explantatkulturen 9, Mesenteriallymphknoten 10 und / oder Serum 11.
- Kurz gesagt, für Explantatkulturen 9, entfernen Sie Doppelpunkte nach der Tötung offenen Längsrichtung, und sauber mit PBS. Doppelpunkte Inkubieren auf einem Orbitalschüttler bei 250 Upm in vollständige Medien für 30 Minuten bei Raumtemperatur eingestellt.
- Hacken Sie Gewebe in kleine Stücke und bei 37 ° C in vollständige Medien für 24 Stunden inkubiert. Die überstehende Flüssigkeit und verwenden Sie für die Quantifizierung von Zytokinen auf 100 mg Gewebe mittels ELISA.
- Führen ex vivo Charakterisierung der T-Zell-Phänotypen und / oder Funktion 10.
Ergebnisse
Ca. 10 x 10 6 CD4 + CD45RB hoch -T-Zellen aus 10 Milz von erwachsenen C57BL / 6 Spendermäusen sind zuverlässig isoliert. Diese Anzahl wird in Abhängigkeit von dem Alter und dem Stamm des Spendermaus und dem Können des Forschers variiert. Beim 4 x 10 5 C57BL / 6 CD4 + CD45RB hoch -T-Zellen in C57BL / 6 Rag1 übertragen - / - Empfängermäuse, klinischen Anzeichen einer Krankheit entstehen rund 5 Wochen nach der Sättigung oder früh...
Diskussion
Hier beschreiben wir eine Schritt-für-Schritt-Protokoll Induzieren Kolonentzündung in Mäusen durch adoptiven Transfer von CD4 + CD45RB + T-Zellen in immundefizienten Mäusen. Wir verwendeten C57BL / 6 Spender Milz und syngenen Rag1 - / - Empfängermäuse, obwohl auch andere Stämme (zB BALB / c, 129S6 / SvEv, nicht-übergewichtigen diabetischen (NOD)) und genetische Modelle der Immunschwäche (zB SCID, Rag2 - / -), können ebenfalls verwe...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Diese Arbeit wurde vom amerikanischen Gesellschaft für Gastroenterologie (AGA) Forschung Wissenschaftler-Preis und Crohn und Colitis Foundation of America (CCFA) Career Development Award (den SZS), NIH NIDDK F30 DK089692 (ECS) und Universität von North Carolina Center for Gastrointestinal Biology unterstützt und Disease Grants P30 DK34987 (Histologie Core). Der UNC-Durchflusszytometrie Core Facility ist teilweise durch eine NCI-Center Core-Unterstützung Grant (P30CA016086) an den UNC Lineberger Comprehensive Cancer Center unterstützt. Wir danken Lukas B. Borst von North Carolina State University College of Veterinary Medicine für seine Hilfe bei histopathologischen Analyse und Immunhistochemie.
Materialien
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
Referenzen
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416 (2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437 (2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten