このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
エフェクターCD4の養子移入によるマウス腸の炎症の誘導
要約
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
要約
ヒト炎症性腸疾患(IBD)、それぞれに長所と短所の病因を研究するために利用可能な多くの異なる動物モデルがある。ここではTおよびB細胞欠損レシピエントマウスに同系の脾臓CD4 + CD45RB high T細胞の養子移入によって開始される実験的大腸炎モデルを記述する。主にナイーブ、エフェクター細胞からなるCD4 + CD45RB 高 T細胞集団は、密接に、ヒトIBDの重要な側面に似た、慢性的腸炎を誘導することができる。この方法は、疾患の発症および進行の側面を研究するために操作することができる。さらに、それは腸の炎症、すなわち 、先天性、適応性の機能、及び調節免疫細胞集団、および環境曝露の役割は、微生物を研究するために使用することができる。この記事では、ステップバイステップのプロトコルで大腸炎を誘発するための方法論を示している。このINCludes成功裏に研究目的のために実験的大腸炎のこのマウスモデルを開発するために必要なキー技術的な側面のデモビデオ。
概要
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
プロトコル
注:すべての動物のプロトコルはによっておよび施設内動物管理使用委員会(IACUC)規制や実験動物の管理と使用に関する米国学術研究会議·ガイドに準拠して承認されていることを確認します。ドナーマウスは、男性または女性のいずれでもよいが、レシピエントマウスは、雄であるべきである。女性の受信者が使用する場合、ドナーマウスは、雌5でなければならない。 、したがって、マウス5,6の大腸炎の表現型を、これらが腸内細菌叢に影響を与える可能性があるように、定期的に、非滅菌寝具と非酸性化した水を使用してコロニーを維持し、。
1。実験の準備
- 氷のように冷たいメディアとバッファを使用。実験を通して氷上で細胞を保管してください。
- 無菌技術を用いた無菌のバイオハザードフード中で実験を行います。
脾臓T細胞の2の分離
- 子宮頸dislocatio続くCO 2チャンバー内でドナーマウス/マウスを安楽死させるN。 70%エタノールで腹部スプレー。
- 腹部の横切開を行い、腹膜を露出するために皮膚をはがし。腹膜離れて鉗子で内臓からのホールドと脾臓を露出し、切除する左腹部腹膜の切開を作る。
- ペトリ皿の中で完全なメディアの10ミリリットルで脾臓を置きます。脾臓から余分な組織を除去し、廃棄する。
- つぶすと単一細胞懸濁液に脾臓を離れていじめる2滅菌ガラススライドを使用してください。 50ミリリットルに70μmのストレーナーを通してフィルタ細胞懸濁液円錐管に完全メディア5mlでストレーナーをすすぐ。 1 50ミリリットルコニカルチューブに5脾臓まで置きます。
- 7分間450×gで遠心分離した細胞。オフ注ぐことによって、または廃棄物容器に真空吸引により上清を捨てる。
- 穏やかに室温で10分間、赤血球を溶解するために溶解緩衝液の脾臓当たり5mlの細胞を再懸濁。チューブへの完全なメディアの等量の(脾臓あたり5ミリリットル)を追加します。 遠心細胞。オフ注ぐことによって、または廃棄物容器に真空吸引により上清を捨てる。
- 静かにラベル緩衝液10mlで細胞を懸濁します。
- トリパンブルー排除により、細胞を数える。
- 細胞懸濁液の20μlのを削除し、マイクロチューブに180μlのトリパンブルーに加え、十分に混合する。 5分後、顕微鏡下で非青色細胞を血球計数器とカウントする10μlの標識細胞を追加します。生存細胞の総数を決定します。セル/パンブルーミックスを破棄します。
- 7分間450×gで標識化緩衝液10mlで遠心細胞。オフ注ぐことによって、または廃棄物容器に真空吸引により上清を捨てる。
CD4 + T細胞の3濃縮
注:このセクションで使用される特定の製品については、製造元の指示に従ってください。
- 穏やかに冷たいラベル20×10 6細胞/ mLの単一細胞懸濁液に細胞を再懸濁INGバッファー。
- ビオチン化CD4 T細胞濃縮抗体の1×10 6細胞あたり5μlを添加する。 15分間氷上で細胞をインキュベート。
- ラベルバッファーの10倍のボリュームを追加します。 7分間450×gで遠心した細胞。慎重に廃棄物容器内に真空吸引を使用してすべての上清を吸引する。
- 徹底的にストレプトアビジン結合磁性粒子をボルテックス。 1×10 6細胞当たりの粒子の5μlを添加する。
- 徹底的になく穏やかに混合。 30分間6-12℃でミックスしてください。
- 20-80×10 6細胞/ mlの濃度に標識バッファーを加える。 12×75ミリメートルの丸底試験管当たりの標識細胞を1.0mlにまで転送する(「ポジティブフラクションチューブ」と称する)。
- 6-8分間磁石上の各ポジティブフラクションチューブを置きます。
- まだ磁石に正のフラクションチューブを、慎重に新しい無菌の50mlの円錐チューブにガラスパスツールピペットでポジティブフラクションチューブから上清を移す(referre「濃縮画分」などからd)。この濃縮画分は、CD4 + T細胞が含まれています。磁石に引きつけ標識細胞を破壊しないように注意してください。
- 精力的に上下にピペッティングすることによって、ステップ3.6のようにラベル表示のバッファの同じ体積でポジティブフラクションチューブに残って細胞を再懸濁し。 6-8分間背面磁石に正のフラクションチューブを置きます。
- まだ磁石に正のフラクションチューブを、慎重に磁石に付着した細胞を破壊することなく、ステップ3.8から50ミリリットルのコニカルチューブを無菌ガラスパスツールピペットでポジティブフラクションチューブから上清(濃縮画分、CD4 +)を転送。
- 繰り返して得られたCD4 + T細胞の収量を増加させるために3.9から3.10までを繰り返す。濃縮画分(CD4 +細胞)を使用してプロトコルを継続します。
4.ラベル付けとソートセル7
- 遠心7分間450×gで細胞を濃縮。または真空suctをオフに傾けて上清を除去廃棄物容器にイオンを打ち込む。
- ラベル緩衝液1mlに細胞を再懸濁。カウントするとステップ2.9のようにトリパンブルー排除により、細胞生存率のために評価するために、細胞のアリコートを削除します。
- 10×10 6細胞/ mlに標識バッファーの容量を追加する。細胞が既にある場合は<10×10 6、7分間450×gで遠心分離は、廃棄物容器に捨てるか、真空吸引により上清を捨て、そして10×10 6細胞/ mlに標識バッファーの容量を追加する。
- マイクロチューブ内アイソタイプ染色し、染色されていない、および単一染色対照細胞のために約5〜10×10 5個の細胞それぞれの個別の分量を設定します。
- 細胞に5μg/ mlのCD4-FITCおよび1μg/ mlのCD45RB-PEを追加します。マイクロチューブ中でアリコートを適切な同じ濃度で、アイソタイプ対照汚れやシングルの汚れを追加します。うまくしかし穏やかに混合し、30分間、光から保護氷上でインキュベートする。
- 細胞とコントロールにラベルバッファーの10倍のボリュームを追加します。S。 7分間遠心450 XG。廃棄物容器に真空吸引により上清を捨てる。
- ステップ4.5でボリュームにラベルバッファーに懸濁します。 7分間遠心450 XG。廃棄物容器に真空吸引により上清を捨てる。
- 10×10 6細胞/ mlに標識化緩衝液に再懸濁する。 FACSチューブに70μmのストレーナーを通して細胞を渡します。 FACSの準備が整うまで、光から保護氷上に保管してください。
- 設定し、非染色細胞と単染色コントロールとセルソーター上の適切な補償を決定する。
- 順方向及び側方散乱ゲーティング( 図1A)と生育不能細胞を除外します。アイソタイプ染色コントロールとCD4 +およびCD45RB +細胞のためのゲーティングを設定します。 CD4 +集団上のゲート細胞。
- 完全なメディアの2ミリリットルにチューブにPE染色細胞のための単純なヒストグラムを用いた高 CD45RBとCD45RB 低集団にソートCD4 +細胞。 高 CD45RB 集団はCD4 + CD45RB +細胞( 高 CD45RB)の最高40%を表し、CD45RB 低集団はCD4 + CD45RB +細胞の最低20%である( 低 CD45RB; 図1B)。
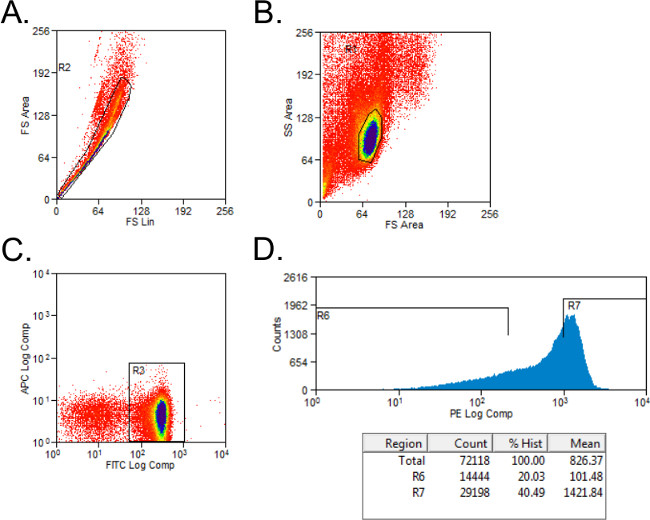
図1:FACS分析中CD4 + CD45RB T細胞集団のプロット代表的なフローサイトメトリー(A - C)FITC CD4-、ドナーからPE CD45RB染色した脾細胞C57BL / 6マウスを、CD4 +高 CD45RBおよびCD4 +にFACSによって選別した。 CD45RB 低い T細胞集団。 (A)ダブレットイベントが前方散乱プロット上除外された。 (B)、リンパ球を前方および側方散乱プロットにゲートした。 (C)CD4 + T細胞をゲートし、および(D)CD4 + CD45RB + T細胞を、PEに対するイベントヒストグラムにプロットした。 CD4 + CD45RB low細胞をCD45RB +細胞の最低20%であると考えられた。 CD4 + CD45RB high細胞をCD45RB +細胞の最大40%と定義した。
- 集団の純度を評価するためにFACSマシン上の各細胞集団のアリコートを実行する。
- 遠心7分間450×gで細胞を選別した。 1mlのPBSで再懸濁します。カウントするとステップ2.9のようにトリパンブルー排除により、細胞生存率のために評価するために、細胞のアリコートを削除します。
受信者への細胞の5インジェクション
- 再懸 濁し、4×10 6細胞/ ml(CD45RB 高 )またはPBS中の2×10 6細胞/ ml( 低 CD45RB)に細胞を選別した。
- 新しい滅菌チューブに受信者ごとCD45RB high細胞の100μlのを転送します。 PBSあたり100μlのを追加します。このチューブに受信者。したがって、動物あたりの総注射容量は200μlであり、受信者ごとの細胞の総量は、4×10 5個のCD4 + CD45RB 高ナイーブT細胞である。
- 制御性T細胞を受けた実験群が必要な場合は、新しい滅菌チューブに受信者ごとCD45RB 高い細胞100μlを移す。同じチューブに受信者ごとCD45RB 低細胞100μlを追加。動物あたりの総注射容量は200μlである。 CD45RB 高の比率:CD45RB low細胞は2:1である。
- ハイ / CD45RB 低 CD4 +細胞の腹腔内各受信者の腹部(200μLの合計)の右側と左側にCD45RB 高またはCD45RB100μlのを注入。
レシピエント動物における疾患進行の6モニタリング
- レシピエント動物の臨床状態を評価するために、以下のparameteの集計臨床スコアを割り当てる注射の日のRS 8、その後毎週、および屠殺時:
- 重量損失を測定することによって無駄に判断します。0 - なし減量を。 1 - 初期体重の0.1〜10%の損失。 2 -最初の体重( 図2A)の10%以上の損失。

図2:炎症の臨床的および肉眼的病理学的徴候は、RAG1に野生型CD4 + CD45RB high T細胞の転写後に起こる- / -およびNRDKOレシピエントマウス11(A)NRDKO受信者5によってその初期体重の平均は10%で失わ週間後転送、RAG1のに対し、- / -レシピエントは、この時点で疾患の臨床徴候を示さなかった。各点は、平均±SEMコホートの初期体重の平均パーセンテージを表す。 **、P <0.005。直腸脱の存在によって示されるように(B)いくつかのマウスは、重篤な腸炎を発症した。これはNRDKOレシピエントマウスにおける直腸脱の代表画像です。 (C)肉眼、からコロン両方RAG1 - / -とNRDKOレシピエントマウスは、RAG1からコロンに比べて厚くなったと短縮されている- / -およびT細胞の養子移入せずにNRDKOマウス。 NRDKOレシピエントマウスからのコロンが重度の炎症と増加したコロンの重み(データは示していない)を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- それが経過するまで、清潔な容器内に動物を置くことによって、糞便の質を決定するスツール:0 - なし。 1 - ソフトスツール。 2 - 水っぽい及び/または血便。
- 病気の以下の徴候の存在によって動物の全般的な健康状態を決定します。0 - なし猫背の姿勢、毛皮、または皮膚病変を毛。 1 - 次の本のいずれか:猫背の姿勢は、毛皮、皮膚病変を剛毛。
- 直腸脱の存在の決定:0 - 不在を。 1 -現在( 図2B)。
- 彼らは彼らの開始体重の20%を失ったか、いずれか早い方所望の時点、でてきたとき頸椎脱臼に続いてCO 2吸入により動物を生け贄に捧げる。臨床疾患は週5ポスト充満から始まる通常は明らかである。
- 以前に5,7を説明するように、疾患の重症度について評価します。
- ステップ6.1 8のように、臨床スコアを割り当てます。
- 結腸の長さと重さ( 図2C)を測定します。
- 炎症の組織学的分析を実行します5。
- 腸組織外培養における自発的なサイトカイン発現9、腸間膜リンパ節10、および/ または血清11を決定します。
- 簡単に言えば、外植片培養9のために、縦方向に開いて、屠殺後のコロンを削除して、PBSで洗浄してください。室温で30分間完全培地中で、250rpmでオービタルシェーカーセットにコロンをインキュベートします。
- 組織を小片にチョップし、24時間完全培地中で37℃でインキュベートした。上清を収集し、ELISAにより100 mgの組織あたりのサイトカインの定量のために使用します。
- T細胞の表現型および/ または機能10のex vivoでの特性評価を行います。
結果
約成体C57BL / 6ドナーマウスから脾臓を10から10×10 6個のCD4 + CD45RB high T細胞を確実に分離されている。この数は、年齢や歪みドナーマウスの研究者の習熟度に応じて変化するであろう。 - / - 4×10 5 C57BL / 6 CD4 + CD45RB high T細胞をC57BL / 6 RAG1に転送されたとき、レシピエントマウスマウスは、より重篤な疾患に遺伝的に感受性である場?...
ディスカッション
ここでは、免疫不全マウスにCD4 + CD45RB + T細胞の養子移入によってマウスでの大腸の炎症を誘導するステップバイステップのプロトコルを記述します。 - / -レシピエントマウス、他の系統であるが( 例えば 、BALB / C、129S6 / SvEv、非肥満糖尿病(NOD))及び免疫不全の遺伝的モデル( 例えば 、SCID、 が、Rag2我々はC57BL / 6ドナー脾臓と同系RAG1を
開示事項
The authors declare that they have no competing financial interests.
謝辞
この作品はアメリカの消化器協会(AGA)研究学者賞とクローン病とアメリカの大腸炎財団(SZSへ)(CCFA)キャリア開発賞、(ECS)は、NIH NIDDK F30 DK089692、胃腸生物学ノースカロライナ大学のセンターによってサポートされていましたと疾病グラントのP30のDK34987(組織学コア)。 UNCフローサイトメトリーコアファシリティは、UNCラインバーガー総合がんセンターのNCIセンターコアサポートグラント(P30CA016086)によって部分的にサポートされています。私たちは、病理組織学的分析および免疫組織化学との彼の助けを獣医のノースカロライナ州立大学からルークB.ボーストに感謝。
資料
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
参考文献
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416 (2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437 (2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved