A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التباين الديناميكي المحسن التصوير بالرنين المغناطيسي لنموذج مثلي سرطان البنكرياس ماوس
In This Article
Summary
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Abstract
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Introduction
ويتمثل الهدف العام من هذه الطريقة هو تطبيق ديناميكي النقيض تعزيز التصوير بالرنين المغناطيسي (DCE-MRI) لمثلي xenografts ورم البنكرياس في الفئران. DCE-MRI هو أسلوب غير الغازية لتقييم الأوعية الدموية الدقيقة في النسيج المستهدف من خلال رصد تغير MR المقابل على مدى فترة معينة من الزمن بعد الحقن. وقد استخدمت DCE-MRI لتشخيص الأورام الخبيثة وتقييم استجابة الورم لمختلف العلاجات 1-4. وقد قدمت الكمي DCE-MRI استنساخ عالية 5. ل quantitate المعلمات الدوائية وكيل النقيض MR في الأنسجة المستهدفة، وجميع الصور DCE-MR المكتسبة في نقاط زمنية مختلفة وخريطة T1 التي تم الحصول عليها قبل الحقن النقيض من ذلك يجب أن coregistered 6. ولكن نظرا لحركات التنفس وتحوي في منطقة البطن، تمت زيارتها الكمي DCE-MRI التطبيق المحدود للأورام الجهاز الهضمي.
وقد استخدمت مثلي نماذج ورم البنكرياس لتقييماستجابة للورم البنكرياس التالية العلاجات البيولوجية والكيميائي 7،8. تعتبر نماذج ورم مثلي متفوقة على نماذج تحت الجلد التقليدية، منذ ينعكس المكروية في موقع الورم الأصلي واستجابة الورم للعلاج وبالتالي الإنسان يمكن التنبؤ بشكل أكثر دقة. ومع ذلك، يقع البنكرياس الماوس في الربع العلوي الأيسر من البطن، الكمي حتى DCE-MRI من مثلي xenografts ورم البنكرياس في الفئران لم ينفذ بسهولة.
لقد وضعنا بروتوكولا للDCE-MRI للأورام البطن في الفئران عن طريق تحديد الأورام باستخدام لوحة من البلاستيك عازمة متعامد لمنع نقل الحركة من منطقة الصدر 9. كان مترجم الضغوط التي مورست من قبل هذا المجلس على منطقة البطن، ولم يؤد إلى صعوبة في التنفس. تم التحقق من صحة تقنية الصورة coregistration الآلي لDCE-MRI من أعضاء البطن في وضع خالية من التنفس، ولكنه يؤدي بفعاليهذ فقط عندما تتحرك المناطق المستهدفة ببطء وبشكل منتظم 10. معدل التنفس من الحيوانات متغيرة أثناء التصوير، وضبط النفس الجسدي وذلك في منطقة البطن تكون ضرورية لاسترداد معلمات الدوائية يمكن الاعتماد عليها في مثلي نماذج ورم البنكرياس الماوس. لقد quantitated بنجاح المعلمات الدوائية وكيل النقيض MR مثلي في xenografts ورم البنكرياس باستخدام لوحة من البلاستيك عازمة متعامد في DCE-MRI 11-13. هنا نقدم الإجراء مفصل لمثلي النمذجة ورم البنكرياس، DCE-MRI من xenografts الورم في الفئران، وتقدير حجم المعلمات الدوائية.
Protocol
تمت الموافقة على جميع الإجراءات من قبل لجنة رعاية واستخدام الحيوان المؤسسية في جامعة ألاباما في برمنغهام.
النمذجة 1. مثلي البنكرياس ورم ماوس
- خطوط الخلايا البنكرياس للسرطان ثقافة القياسية الإنسان في المتوسط تعديل النسر Dulbecco لفي (DMEM) تستكمل مع 10٪ مصل بقري جنيني. الحفاظ على جميع الثقافات في 37 درجة مئوية في جو مرطب مع 5٪ CO 2.
- استخدام 8-10 إناث الفئران شديدة العوز المناعي جنبا إلى جنب أسابيع من العمر. وضع أقفاص الحيوانات في 12 ساعة ضوء ودورة الظلام 12 ساعة على RT (21 ± 2 ° C) و 60٪ الرطوبة.
- تخدير جميع الحيوانات باستخدام التهوية مع 2٪ من الأيزوفلورين مختلطة مع الأكسجين (2 لتر / دقيقة) في جميع أنحاء الجراحة. تأكيد عمق التخدير عن طريق قرصة أخمص قدميه المنعكس. مكان الحيوانات على وسادة التدفئة (37 ° C) للحفاظ على درجة حرارة الجسم. تطبيق مرهم للعين البيطري على العينين لمنع جفاف بينما تحت التخدير. و# 160؛
- إزالة الشعر في الربع العلوي الأيسر من البطن من كل فأر، وإعطاء دواء مسكن (carpofen، 5 ملغم / كغم من وزن الجسم تحت الجلد) في المنطقة. تطبيق حل بتدين على الجلد عرضة للخطر. إعداد الأدوات الجراحية تعقيمها.
- جعل 1 سم شق في الجلد أو الغشاء البريتوني باستخدام مقص القزحية على التوالي. بلطف إزالة البنكرياس من البطن باستخدام الملقط الجراحية.
- إدراج 28 G إبرة حقنة 0.5 مل الأنسولين في ذيل البنكرياس ومن ثم ضخ ببطء حل من 2.5 مليون الخلايا السرطانية في البنكرياس الإنسان في 30 ميكرولتر من DMEM. تأكيد أن فقاعة صغيرة تم إنشاؤه في رأس البنكرياس عن طريق الحل.
- وضع بلطف البنكرياس مرة أخرى في البطن باستخدام الملقط الجراحية. إغلاق الصفاق والجلد في طبقة 1 مع 2 توقف 5-0 الغرز البرولين، ومن ثم إنهاء التخدير. لا يعودون الحيوان الذي خضع لعملية جراحية للشركة من الحيوانات الأخرى حتى تعافى تماما.60؛ إزالة الغرز في 7 ~ 10 أيام بعد الجراحة.
- إعطاء جرعة أخرى من المخدرات مسكن (carpofen، 5 ملغم / كغم من وزن الجسم تحت الجلد) في 24 ساعة بعد الجراحة.
- التحقق من حجم الورم عن طريق تحسس منطقة الجراحة باستخدام إصبعين. الأورام عادة يشعر أكثر كثافة ويشوبه مزيد من الصعوبات من الأنسجة والأعضاء المحيطة بها. وعادة ما يستغرق ~ 1 - 2 أسابيع لتبدأ الشعور الورم.
- مراقبة الحيوانات يوميا لعلامات المرض. عندما تظهر الحيوانات سوء (قلة النظافة الشخصية وتجنب السلوكيات العادية)، ونحن إنهاء لهم باستخدام خلع عنق الرحم في حين تحت التخدير.
2. التصوير بالرنين المغناطيسي
- تطبيق MRI عند حجم الورم حوالي 5 - 7 ملم في القطر على عادة 2 ~ 4 أسابيع بعد زرع الخلايا. استخدام الماسح الضوئي MR مخصصة لتصوير الحيوانات الصغيرة أو الماسح الضوئي MR السريري مجهزة لفائف متخصص للتصوير الحيوانات الصغيرة.
ملاحظة: استخدمنا 9.4T الحيوانات الصغيرة MR الماسح الضوئي مع مزيج من 1 H حجم مرنان/ الارسال والاستقبال لفائف السطحية (30 ملم في القطر) (بروكر BIOSPIN شركة، فالجهاز يبث اشعة تماثل، MA). يوفر فائف سطح نسبة أفضل إشارة إلى الضوضاء (SNR) 14. - إعداد MRI عامل تباين القائم على الجادولينيوم لحقن ~ 0،1-0،2 مليمول / كجم لكل حيوان في ~ 0،1-0،2 مل PBS (الفوسفات مخزنة المالحة).
ملاحظة: استخدمنا gadoteridol، وحقن 0.2 مليمول / كغ في 0.15 مل PBS على مدى فترة من 15 ثانية (0.1 مل / ثانية). - إعداد أنبوب polyethelene الصغير (طول: 7.62 ملم، القطر الداخلي: 0.28 ملم، القطر الخارجي: 0.64 مم). إدراج 30 G إبرة (12.7 ملم طول) في واحدة من نهاية الأنبوب، و 30 G حادة إبرة طرف (9.5 ملم طول) إلى الطرف الآخر. توصيل حقنة 1 مل تحتوي على MR كيل النقيض من الإبرة طرف حادة، ودفع ببطء حقنة لملء أنبوب كامل مع وكيل MR التباين.
- تخدير الحيوانات باستخدام التهوية مع ~ 1 - 2٪ من الأيزوفلورين مختلطة مع الأكسجين (2 لتر / دقيقة) في جميع أنحاء إعداد والتصوير. تأكيد عمق anesthesia بواسطة إصبع قرصة المنعكس. تطبيق مرهم للعين البيطري على العينين لمنع جفاف بينما تحت التخدير. تمدد الذيل الوريد باستخدام مصباح الحرارة قبل الإدراج الإبرة. انتزاع منتصف إبرة 30 G باستخدام ملقط كيلي، وأدخله في الوريد الذيل. الشريط كل من الذيل وأنبوب على قطعة من البلاستيك أو الورق المقوى (10 مم عرض × 100 ملم طول) للحفاظ على التوالي الذيل.
- وضع الحيوان في موقف ضعيف في سرير الحيوانات مجهزة تدوير المياه الدافئة (أو الهواء الدافئ) لتنظيم درجة حرارة الجسم أثناء التصوير. ضبط درجة الحرارة على السرير إلى 37 درجة مئوية. إدراج التحقيق في درجة الحرارة المستقيم لمراقبة درجة حرارة الجسم أثناء التصوير.
- تطبيق لوحة من البلاستيك عازمة متعامد في منطقة البطن. تأكد من يقع الورم وراء نهاية العلوي من لوحة، ومن ثم سحب أسفل اللوحة قليلا (~ 2 مم) لضمان الورم القبض عليهم من قبل مجلس الإدارة. الشريط المجلس إلى الفراش الحيوان بحزم.
- الشريط لوحة التنفس تنبيغص (SA الصك، وشركة، ستوني بروك، NY) على منطقة الصدر لمراقبة التنفس الحيوان أثناء التصوير. وضع لفائف سطح على الجزء العلوي من منطقة الورم، والشريط على السرير الحيوان بحزم. دفع السرير الحيوان في الماسح الضوئي MR لوضع منطقة الورم في وسط لفائف حجم (القطر الداخلي: 72 ملم).
- أداء مطابقة وضبط لكل من الاستقبال والارسال، تليها الملئ.
- بادئ ذي بدء تسلسل MR التشريحية لتحديد موقع الورم. استخدام (T2W) توربو تدور صدى التسلسل المرجحة T2 للحصول على صور المحورية مع المعلمات الاستحواذ التالية. الوقت التكرار (TR) / صدى الزمن (TE) = 3،000 / 34 ميللي ثانية، 128 × 128 مصفوفة، 30 × 30 ملم مجال الرؤية، وعدد من المتوسطات = 1، طول القطار صدى = 4، و 20 متجاورة 1 ملم شرائح سميكة في ووضع المتداخلة لتغطية المنطقة بأسرها الورم (إجمالي وقت المسح: 1.6 دقيقة).
ملاحظة: منذ أورام البنكرياس مثلي أكثر صعوبة أن يكون موجودا من تلك تحت الجلد، locali التقليديةالصور ذر وجود دقة أقل قد لا يكون مفيدا. - الحصول على (T1W) صور المرجحة T1 مع مختلف زوايا الوجه لاسترداد خريطة T1. لهذا الغرض، واستخدام التدرج صدى نهج زاوية multiflip مع المعلمات التالية: الوقت التكرار (TR) / صدى الزمن (TE) = 115/3 ميللي ثانية، 128 × 128 مصفوفة، حقل 30 × 30 ملم للعرض، عدد من المتوسطات = 4، ~ 5-7 متجاورة 1 ملم شرائح سميكة في وضع المتداخلة لتغطية منطقة الورم، وسبعة زوايا الوجه من 10، 20، 30، 40، 50، 60، و 70 (مجموع وقت المسح في زاوية الوجه: 1 دقيقة).
ملاحظة: ومع ذلك، نهج زاوية multiflip فعال فقط عندما تجانس الحقل B1 مرتفع. إن لم يكن، خرائط T1 يمكن الحصول عليها مع نهج TR متعددة بدلا من ذلك 15. - الحصول على صور T1W قبل وبعد الجادولينيوم القائم حقن MR التباين. استخدام نفس المعلمات اقتناء والهندسة لرسم الخرائط T1 ولكن مع زاوية الوجه ثابت من 30. استخدام الترميز الخطي لضمان حالة مستقرة عندما يتم الحصول على مركز ك الفضاء، وإسبانياecially عندما يتم استخدام TR قصيرة وانخفاض درجة زاوية الوجه. الحصول على 5 صور أساسية قبل حقن التباين. ثم الحصول على 40 صور بعد الحقن النقيض (إجمالي وقت المسح: 45 دقيقة). استخدام مضخة الحقن لحقن عامل تباين بمعدل ثابت (0.01 مل / ثانية).
- مراقبة التنفس الحيوان بشكل مستمر، وضبط تركيز الأيزوفلورين للحفاظ على معدل التنفس إلى 50-100 الأنفاس لكل دقيقة. مراقبة درجة حرارة الجسم الحيوانية طوال التصوير.
- بعد الانتهاء من DCE-MRI، خلع الإبرة وتحقيقات أخرى، ووضع الحيوان في قفص فارغ سريرا مع المناشف الورقية. تدليك بهدوء منطقة البطن السفلية. يجب وضع القفص نصف تحت مصباح الحرارة إلى السماح للحيوان للتحرك داخل وخارج التدرج الحراري حيث يتعافى. لا تترك حيوان غير المراقب حتى استعاد وعيه أنه كاف للحفاظ على الاستلقاء القصية.
3. معالجة الصور وتحليل
- ريجي الورم شريحة على الصور في T2W. في الصور T2W، وشدة إشارة في منطقة الورم هو أكثر إشراقا من أن من الأنسجة المحيطة بها، وبالتالي فإن حدود الورم ويمكن تحديد يدويا.
ملاحظة: تقنيات تقسيم شبه آلية مثل العتبة العالمية أو الكنتوري نشط يمكن استخدام 16،17، ولكن ينبغي تصحيح كثافة الخلفية متفاوتة وخصوصا عندما يستخدم لفائف السطح. - خلق T1 وكثافة البروتون الخرائط. في الصور T1W المكتسبة مع التدرج تسلسل صدى، على افتراض أن الوقت الصدى (TE) أقل بكثير من T2 * القيمة، يتم تحديد قيمة بكسل
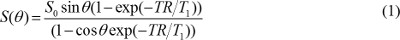
حيث S 0 هو كثافة البروتون، T T 1 1 غير وقت الاسترخاء المستمر، TR حان الوقت التكرار، وθ هو زاوية الوجه. المعادلة (1) ويمكن إعادة كتابة ل
641eq2.jpg "/>
عندما (θ) S / يتم استبدال sinθ مع Y، وS (θ) / يتم استبدال tanθ مع X. المعادلة (2) هو المعادلة الخطية، والمنحدر، واعتراض يمكن استخدامها لاسترداد T1 وS 0 القيم، على التوالي. - حساب MR تركيز التباين في الصور DCE-MR. عندما يتم حقن الجادولينيوم القائم كيل MR النقيض من ذلك، يتم تغيير T الوقت 1 الاسترخاء ثابتة على مر الزمن. لذلك، المعادلة (1) ويمكن إعادة كتابة ل
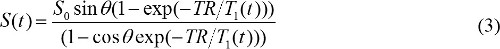
T 1 (ر) يرتبط مع MR تركيز النقيض من ذلك، C (ر)، على النحو التالي،
حيث r 1 هو relaxivity الطولي للMR كيل التباين. لذلك، من خلال الجمع بين المعادلات (3) و (4)، يتم تحديد MR تركيز على النقيض من
- Quantitate المعلمات الدوائية للMR النقيض من وكيل. C ص (ر) يقدم MR تركيز التباين في بلازما الدم في الزمن t بعد بدء حقن التباين. C ص (ر) ويسمى وظيفة الإدخال الشريانية (AIF). إذا AIF هو متاح، ويمكن حساب المعلمات الدوائية للMR كيل النقيض من
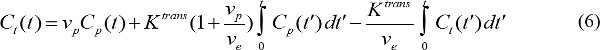
حيث C ر (ر) هو MR تركيز التباين في الأنسجة المستهدفة، والخامس p غير كسور حجم بلازما الدم، والخامس e غير كسور الحجم خارج الخلوي خارج الأوعية، وK غير المشبعة نقل حجم ثابت. تدفق ثابت معدل، ك الجيش الشعبي، ويساوي K ترانق مقسوما ضد ه. إذا AIF غير متوفر، ثم المنطقة النموذج المرجعي يمكن استخدامها بدلا 18،19. ويستند نموذج منطقة إشارة على محدودة تدفق Kety نموذج 20 و يستخدم تركيز التباين في منطقة إشارة إلى إزالة الحاجة إلى AIF على النحو التالي،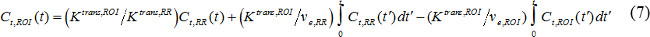
حيث C ر، العائد على الاستثمار (ر)، K العابرة، وعائدات الاستثمار، والخامس الإلكترونية، والعائد على الاستثمار وتركيز المقابل، نقل حجم ثابت، وكسور الحجم خارج الأوعية خارج الخلية، على التوالي، في المنطقة ذات الاهتمام (ROI)، بينما C ر، RR (ر)، K العابرة، RR، والخامس الإلكترونية، RR هي تلك في المنطقة المرجعية. وغالبا ما المختارة العضلات مجاورة للفقرة باسم المنطقة المرجعية، والخامس الإلكترونية، RR في السلطة الفلسطينية الفئرانويفترض العضلات ravertebral أن تكون ثابتة عند 0.08 21. استخدمنا المنطقة النموذج المرجعي.
النتائج
الخلايا السرطانية في البنكرياس الإنسان تنمو بنجاح في الماوس البنكرياس خلق الأورام الصلبة الشكل 1 يظهر صورا ل(A) والبنكرياس العادية حيث يتم حقن محلول الخلايا السرطانية، و (ب) ماوس تمثيلي تحمل على مثلي البنكرياس طعم أجنبي الورم (MIA باكا-2 ). يقع ورم في الربع العلو...
Discussion
وأدخلنا أساليب مفصلة من مثلي النمذجة ورم البنكرياس باستخدام الفئران العوز المناعي، DCE-MRI للأورام البطن في الفئران، وتقدير المعلمات الحركية. في مثلي النمذجة ورم البنكرياس، يجب توخي الحذر عند إدخال إبرة في ذيل البنكرياس. في حال نجاحها، وسيتم نقل الخلايا إلى رأس البنكر...
Disclosures
Authors do not have any conflicts of interest to declare.
Acknowledgements
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
References
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved