Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Dynamic Contrast Verbesserte Spintomographie von einem orthotopen Mausmodell Bauchspeicheldrüsenkrebs
In diesem Artikel
Zusammenfassung
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Zusammenfassung
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Einleitung
Das übergeordnete Ziel dieser Methode ist es, dynamische kontrastverstärkten Magnetresonanztomographie (DCE-MRI) für orthotopen Pankreastumor-Xenografts bei Mäusen anzuwenden. DCE-MRI ist eine nicht-invasive Methode zur Mikrovaskulatur in einem Zielgewebe durch Überwachung der Änderung des MR Kontrast über einen bestimmten Zeitraum nach der Injektion beurteilt. DCE-MRI wurde verwendet, um bösartige Tumore zu diagnostizieren und Tumor-Antwort auf verschiedene Therapien 1-4 zu beurteilen. Quantitative DCE-MRI hat hohe Reproduzierbarkeit 5 vorgestellt. Pharmakokinetischen Parameter eines MR-Kontrastmittels in ein Zielgewebe quantifizieren, müssen alle zu unterschiedlichen Zeitpunkten und T1 Karte vor Kontrastmittelinjektion erhalten erworbenen DCE-MR-Bilder koregistriert 6 werden. Aufgrund der Atemwege und peristaltische Bewegungen im Bauchbereich, quantitative DCE-MRI hat begrenzte Anwendung für Magen-Darm-Tumoren.
Wurden orthotopen Pankreastumormodelle verwendet werden, um zu bewertenPankreas-Tumor-Antwort folgenden biologischen Therapien und Chemotherapien 7,8. Orthotope Tumormodelle werden als überlegen gegenüber herkömmlichen subkutanen Modellen, da die Mikroumgebung in der ursprünglichen Tumorstelle reflektiert wird und dadurch die menschliche Tumor-Antwort auf die Therapie genauer vorhergesagt werden. Jedoch ist die Maus Bauchspeicheldrüse im linken oberen Quadranten des Abdomens angeordnet ist, so quantitative DCE-MRI des orthotopischen Pankreastumor-Xenotransplantaten in Mäusen nicht leicht implementiert.
Wir haben ein Protokoll der DCE-MRI von Bauch Tumoren in Mäusen durch die Festsetzung der Tumoren mit einer orthogonal gebogenen Kunststoffplatte, um Bewegungsübertragung von der Brustbereich 9 zu verhindern etabliert. Die von diesem Platte aufgebracht Druck auf den Bauchbereich lokalisiert und nicht in Atemnot führte. Eine automatisierte Bild Koregistrierung Technik für DCE-MRI der Bauchorgane in einem Freiatemmodus validiert, aber es führt effectively nur dann, wenn die Zielregionen bewegen sich langsam und regelmäßig 10. Die Atemfrequenz von Tieren ist während der Bildvariablen werden so physische Zurückhaltung im Bauchbereich erforderlich sein, zuverlässig pharmakokinetischen Parameter in orthotopen Pankreastumormausmodelle abzurufen. Wir haben erfolgreich quantifiziert die pharmakokinetischen Parameter von einem MR-Kontrastmittel in orthotopen Pankreastumor-Xenotransplantaten mit dem orthogonal gebogenen Kunststoffplatte in DCE-MRI 11-13. Hier präsentieren wir die Einzelheiten des Verfahrens der orthotopen Pankreastumor-Modellierung, DCE-MRI der Tumorfremdtransplantaten in Mäusen, und die Quantifizierung der pharmakokinetischen Parameter.
Protokoll
Alle Verfahren wurden von der Institutional Animal Care und Verwenden Committee an der Universität von Alabama in Birmingham angenommen.
1. orthotopen Pankreastumormausling
- Kultur Standard menschlichen Pankreas-Krebszelllinien in Dulbeccos modifiziertem Eagle-Medium (DMEM) mit 10% fötalem Rinderserum. Behalten Sie alle Kulturen bei 37 ° C in feuchter Atmosphäre mit 5% CO 2.
- Verwenden Sie 8-10 Wochen alte weibliche schwere kombinierte immundefizienten Mäusen. Platzieren Tierkäfigen bei 12 Stunden Licht und 12 Stunden Dunkelheit-Zyklus bei RT (21 ± 2 ° C) und 60% Luftfeuchtigkeit.
- Anesthetize alle Tiere mit Belüftung mit 2% Isofluran mit Sauerstoff (2 l / min) im gesamten Operation gemischt. Bestätigen Sie die Narkosetiefe von toe Prise Reflex. Ort Tiere auf einem Heizkissen (37 ° C), um die Körpertemperatur aufrechtzuerhalten. Bewerben Veterinäraugensalbe auf die Augen bis zur Trockenheit während der Narkose zu verhindern. &# 160;
- Entfernen Sie die Haare in der linken oberen Quadranten des Bauches jeder Maus, und geben einen Analgetikum (carpofen, 5 mg / kg Körpergewicht subkutan) in der Umgebung. Tragen Sie eine Betadin-Lösung auf die freigelegte Haut. Bereiten autoklaviert chirurgische Instrumente.
- Machen Sie eine 1 cm lange Inzision in der Haut und Bauchfell mit Iris gerade Schere. Entfernen Sie vorsichtig die Bauchspeicheldrüse aus dem Bauch mit chirurgischen Pinzette.
- Einsatz 28 G Nadel einer 0,5 ml Insulinspritze in die Schwanzvene von Pankreas und dann langsam zu infundieren eine Lösung von 2,5 Millionen menschlichen Pankreaskarzinom-Zellen in 30 & mgr; l DMEM. Bestätigen Sie, dass eine kleine Luftblase ist in der Spitze der Bauchspeicheldrüse durch die Lösung erstellt.
- Sanft legen Sie die Bauchspeicheldrüse zurück in die Bauchhöhle mit chirurgischen Pinzette. Schließen Sie das Bauchfell und die Haut in 1 Schicht mit 2 unterbrochen 5-0 Prolene Nahtmaterial, und dann beenden Sie die Anästhesie. Sie ein Tier, das der Operation an die Firma von anderen Tieren unterzogen wurde, bis vollständig erholt nicht zurück.60; Nähte entfernen in 7 ~ 10 Tage nach der Operation.
- Geben Sie eine weitere Dosis des Analgetikums (carpofen, 5 mg / kg Körpergewicht subkutan) bei 24 Stunden nach der Operation.
- Überprüfen Tumorgröße durch Abtasten der OP-Bereich mit zwei Fingern. Tumoren in der Regel das Gefühl, dichter und holpriger als die umgebenden Gewebe und Organe. Normalerweise dauert es ca. 1 - 2 Wochen, um zu starten Gefühl ein Tumor.
- Überwachen Tiere täglich auf Anzeichen von Krankheit. Wenn die Tiere krank erscheinen (fehlende normale Pflegen und Vermeidungsverhalten), beendet man sie mit Genickbruch während der Narkose.
2. Magnetic Resonance Imaging
- Anwenden MRI, wenn die Tumorgröße etwa 5-7 mm Durchmesser in der Regel 2 bis 4 Wochen nach der Zellimplantation. Verwenden Sie ein MR-Scanner, um die Kleintierbildgebung oder einem klinischen MR-Scanner mit einem spezialisierten Spule für die Kleintierbildgebung ausgestattet gewidmet.
HINWEIS: Wir haben ein 9,4-T-MR Kleintierscanner mit einer Kombination aus einem 1 H-Volumen-Resonator/ Sender und eine Oberflächenspule Empfänger (30 mm im Durchmesser) (Bruker BioSpin Corp., Billerica, MA). Oberflächenspule eine bessere Signal-Rausch-Verhältnis (SNR) 14. - Vorbereiten einer gadoliniumhaltigen MRI-Kontrastmittel zu ~ 0,1 injizieren - 0,2 mmol / kg an jedes Tier in ~ 0.1 - 0.2 ml PBS (phosphatgepufferte Salzlösung).
HINWEIS: Es wird verwendet, Gadoteridol und injiziert 0,2 mmol / kg in 0,15 ml PBS über einen Zeitraum von 15 sec (0,1 ml / sec). - Bereiten Sie eine Mikro-Polyethylen Rohr (Länge: 7,62 mm, Innendurchmesser: 0,28 mm, Außendurchmesser: 0,64 mm). Legen Sie eine 30 G-Nadel (12,7 mm Länge) in ein Ende des Rohres und einer 30 G stumpfe Spitze Nadel (9,5 mm Länge) in das andere Ende. Schließen Sie eine 1 ml Spritze mit MR-Kontrastmittels in die stumpfe Spitze Nadel und drücken Sie langsam die Spritze zu füllen Sie das gesamte Rohr mit dem MR-Kontrastmittels.
- Anesthetize Tieren unter Belüftung mit ~ 1-2% von Isofluran mit Sauerstoff (2 l / min) gemischt gesamten Zubereitung und Bildgebung. Bestätigen Sie die Tiefe der anesthesia von toe Prise Reflex. Bewerben Veterinäraugensalbe auf die Augen bis zur Trockenheit während der Narkose zu verhindern. Erweitern sich die Schwanzvene mit einer Wärmelampe vor Nadeleinführung. Besorgen Sie sich die Mitte des 30 G-Nadel mit Kelly Zangen, und setzen Sie sie in die Schwanzvene. Band sowohl der Schwanz und Rohr auf ein Stück Kunststoff oder Karton Papier (10 mm Breite x 100 mm Länge), um den Schwanz gerade zu halten.
- Legen Sie das Tier in Rückenlage in einem Tierbett mit zirkulierenden Warmwasser (oder warme Luft), die Körpertemperatur während der Bildgebung zu regulieren ausgestattet. Stellen Sie die Temperatur über dem Bett, um 37 ° C. Legen Sie eine rektale Temperatursonde, die Körpertemperatur während der Bildgebung zu überwachen.
- Tragen Sie eine orthogonal gebogenen Kunststoffplatte in den Bauchbereich. Stellen Sie sicher, der Tumor hinter dem oberen Ende der Platine befindet, und ziehen Sie dann etwas nach unten das Board (~ 2 mm), um den Tumor zu gewährleisten wird vom Vorstand eingeholt. Kleben Sie die Platine zu Tierbett fest.
- Kleben Sie einen Atem Pad Transducer (SA Instrument, Inc., Stony Brook, NY) im Brustbereich zu Tier Atmung während der Bildgebung zu überwachen. Legen Sie eine Oberflächenspule auf der Oberseite der Tumorregion, und kleben Sie sie auf Tierbett fest. Schieben des Tieres Bett in den MR-Scanner, um den Tumorbereich in der Mitte der Volumenspule platzieren (Innendurchmesser: 72 mm).
- Führen Anpassung und Optimierung sowohl für die Sender und Empfänger durch Shimming gefolgt.
- Beginnen Sie mit einer anatomischen MR-Sequenz, um den Tumor zu lokalisieren. Verwenden Sie einen T2-gewichteten (T2W) Turbo-Spin-Echo-Sequenz, um die axiale Bilder mit folgenden Erfassungsparameter zu erhalten. Wiederholungszeit (TR) / Echozeit (TE) = 3000/34 ms, 128 x 128-Matrix, 30 x 30 mm Sichtfeld, Anzahl der Mitte = 1, Echozuglänge = 4 und 20 zusammenhängende 1 mm dicke Scheiben in ein Interlaced-Modus, um die gesamte Tumorregion (1,6 min Gesamtscanzeit) zu decken.
Hinweis: Da orthotopischen Tumoren der Bauchspeicheldrüse sind schwieriger als die subkutane diejenigen befinden, herkömmlichen localizer Bilder mit niedriger Auflösung kann nicht sinnvoll sein. - Erwerben Sie T1-gewichteten (T1W) Bilder mit verschiedenen Kippwinkel bis T1 Karte abzurufen. Zu diesem Zweck verwenden Sie ein Gradientenecho MultiFlip Winkel Ansatz mit den folgenden Parametern: Wiederholungszeit (TR) / Echozeit (TE) = 115/3 ms, 128 x 128-Matrix, eine 30 x 30 mm Sichtfeld, Anzahl der Mittelwerte = 4 ~ 5-7 zusammenhängenden 1 mm dicke Scheiben in einem Zeilensprung-Modus, um den Tumorbereich zu bedecken, und sieben Flipwinkel von 10, 20, 30, 40, 50, 60 und 70 (Gesamtscanzeit pro Flipwinkel: 1 min).
HINWEIS: Es ist jedoch MultiFlip Winkel Ansatz effizient nur, wenn B1 Feldhomogenität ist hoch. Wenn nicht, können T1 Karten mit mehreren TR-Ansatz statt 15 erreicht werden. - Erwerben T1W Bilder vor und nach Gadolinium basiert MR Kontrastmittelinjektion. Verwenden Sie die gleichen Aufnahmeparameter und Geometrie für T1-Mapping, aber mit dem festen Kippwinkel von 30. Verwendung linearer Codierung stabilen Zustand zu gewährleisten, wenn das Zentrum des k-Raums erhalten wird, especially wenn eine kurze TR und ein niedriger Grad Kippwinkel verwendet. Erwerben 5 Basis-Images vor Kontrastmittelinjektion. So erwerben 40 Bilder nach Kontrastmittelinjektion (gesamte Scandauer: 45 min). Verwenden einer Spritzenpumpe Kontrastmittel mit einer konstanten Geschwindigkeit (0,01 ml / sec) zu injizieren.
- Überwachen Tier Atmung kontinuierlich und passen Isofluran-Konzentration, um die Atemfrequenz auf 50 zu halten - 100 Atemzüge pro min. Überwachen Sie Tierkörpertemperatur im gesamten Imaging.
- Nach Abschluss der DCE-MRI, nehmen Sie die Nadel und anderen Sonden, und legen Sie das Tier in einem leeren Käfig mit Papiertüchern gebettet. Massieren Sie sanft den unteren Bauchbereich. Der Käfig sollte die Hälfte unter einer Wärmelampe gelegt werden, dass das Tier in die und aus der Wärmegefälle zu bewegen, wie sie sich erholt. Sie ein Tier nicht unbeaufsichtigt lassen, bis er wieder zu sich kam, um ausreichende Brustlage zu halten.
3. Bildverarbeitung und -analyse
- Segment Tumor regi on in T2W Bilder. In T2W Bildern ist die Signalintensität im Tumorbereich heller als die der umgebenden Gewebe, so dass die Tumorgrenze kann manuell abgegrenzt werden.
HINWEIS: halbautomatische Segmentierungstechniken wie globale Schwellen oder aktive Konturierung verwendet werden 16,17, aber ungleichmäßige Hintergrundintensität korrigiert werden soll vor allem, wenn eine Oberflächenspule verwendet wird. - Neues T1 und Protonendichtekarten. In T1W Bilder mit einer Gradientenecho-Sequenz erfasst, vorausgesetzt, dass die Echozeit (TE) ist viel geringer als T2 * -Wert, der Pixelwert bestimmt wird durch
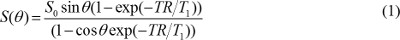
wobei S 0 ist Protonendichte, T 1 T 1 Relaxationszeitkonstante, TR ist Wiederholzeit und θ ein Kippwinkel. Gleichung (1) kann umgeschrieben werden
641eq2.jpg "/>
wenn S (θ) / sin & theta; wird mit Y ersetzt ist, und S (θ) / tan & theta; wird mit X ersetzt. Gleichung (2) ist eine lineare Gleichung, ihre Steigung und kann zum Abrufen von T1 und S & sub0; -Werte betrugen. - Berechnen MR-Kontrastkonzentration im DCE-MR-Bilder. Wenn Gadolinium basierten MR-Kontrastmittel injiziert wird T 1 Relaxationszeitkonstante Laufe der Zeit verändert. So kann die Gleichung (1) neu geschrieben werden
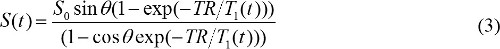
T 1 (t) ist mit MR-Kontrastkonzentration, C (t) bezogen, wie folgt,
wobei r 1 longitudinalen Relaxivität von MR-Kontrastmittel. So kann durch Kombinieren der Gleichungen (3) und (4) wird MR Kontrastmittelkonzentration bestimmt
- Quantifizieren der pharmakokinetischen Parameter der MR-Kontrastmittel. C p (t) stellt MR Kontrastmittelkonzentration im Blutplasma zur Zeit t nach Beginn Kontrastinjektion. C p (t) wird als arteriellen Inputfunktion (AIF). Wenn AIF zur Verfügung steht, können die pharmakokinetischen Parameter von MR-Kontrastmittels berechnet werden
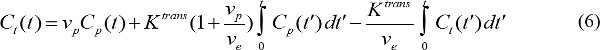
wobei C t (t) MR Kontrastmittelkonzentration in einem Zielgewebe, v p fraktionierten Blutplasmavolumen ist, v e fraktionierte extravasalen Extrazellulärvolumens und K trans Volumenübertragungskonstante. Flux Geschwindigkeitskonstante k ep, gleich K tran ists dividiert durch v e. Wenn AIF nicht verfügbar ist, dann wird der Referenzregion Modell kann statt 18,19 verwendet werden. Der Referenzbereich Modell basiert auf der strömungs beschränkt Kety Modell 20 und basieren nutzt Kontrastmittelkonzentration in einem Referenzbereich, um den Bedarf an AIF wie folgt zu entfernen,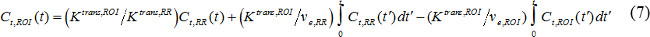
wobei C t, ROI (t), K trans, ROI und v e, sind ROI Kontrastmittelkonzentration, Volumenübertragungskonstante und fraktionierte extravaskulären und extrazellulärer Volumen, bzw. in der Region von Interesse (ROI), wobei C t, RR (t), K trans, RR und v e, RR sind die in der Referenzregion. Paravertebralen Muskeln wird oft als der Referenzbereich ausgewählt ist, und v e, RR in murine paravertebral Muskel wird angenommen bei 0,08 21 konstant zu sein. Wir nutzten die Referenzregion Modell.
Ergebnisse
Menschliche Pankreastumorzellen erfolgreich wachsen in Mauspankreas Schaffung eines soliden Tumors. 1 zeigt Fotografien von (a) einem normalen Pankreas wo Tumorzelllösung eingespritzt wird, und (B) ein Vertreter der Maus trägt eine orthotope Pankreas Tumorxenotransplantates (MIA PaCa-2 ). Tumor im linken oberen Quadranten des Abdomens, neben der Milz. Es dauert normalerweise 2-4 Wochen, die Tumoren zu 5 aufwachsen - 7 mm Durchmesser nach Zellimplantation.
Bewegung orthotop...
Diskussion
Wir haben die detaillierten Methoden der orthotopen Pankreastumor Modellierung mit immundefizienten Mäusen, DCE-MRI von Bauch Tumoren in Mäusen, und die Quantifizierung ihrer kinetischen Parameter eingeführt. Im orthotopen Pankreastumor-Modellierung, müssen Sie beim Einsetzen einer Nadel in den Schwanz der Bauchspeicheldrüse entnommen werden. Wenn dies gelingt, werden Zellen auf den Kopf der Bauchspeicheldrüse Schaffung einer kleinen Blase übertragen werden. Bei der Anwendung eines orthogonal gebogenen Kunststoff...
Offenlegungen
Authors do not have any conflicts of interest to declare.
Danksagungen
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
Referenzen
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten