É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Contraste Dinâmico aprimorada Ressonância Magnética de um Modelo de câncer de pâncreas Orthotopic Rato
Neste Artigo
Resumo
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Resumo
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Introdução
O objetivo geral deste método é a aplicação de contraste dinâmico aprimorado ressonância magnética (DCE-MRI) para ortotópicos xenografts tumor pancreático em camundongos. DCE-MRI é um método não-invasivo de avaliação da microvasculatura num tecido alvo por monitorização da alteração de contraste MR ao longo de um certo período de tempo após a injecção. DCE-MRI tem sido utilizada para diagnóstico de tumores malignos e para avaliar a resposta do tumor a várias terapias 1-4. Quantitative DCE-MRI apresentou alta reprodutibilidade 5. Para quantificar os parâmetros farmacocinéticos de um agente de contraste MR em um tecido alvo, todas as imagens DCE-MR adquiridas em diferentes momentos e mapa T1 obtidos antes da injeção de contraste devem ser georeferenciados 6. No entanto, devido aos movimentos respiratórios e peristálticas na área abdominal, quantitativa DCE-MRI teve aplicação limitada para tumores gastrointestinais.
Modelos ortotópicos de tumor pancreático foram utilizados para avaliarresposta de pâncreas-tumor seguinte terapias biológicas e quimioterapias 7,8. Modelos ortotópicos de tumor são considerados superiores aos modelos subcutâneos convencionais, uma vez que o microambiente no local do tumor original é reflectida e, assim, a resposta do tumor à terapia humana podem ser previstos com mais precisão. No entanto, o pâncreas do mouse está localizado no quadrante superior esquerdo do abdome, de modo quantitativo DCE-MRI de ortotópicos xenotransplantes de tumor do pâncreas em ratos não foi prontamente implementadas.
Nós estabelecemos um protocolo de DCE-MRI de tumores abdominais em camundongos, fixando os tumores usando uma placa de plástico orthogonally dobrado para evitar a transferência de movimento da região do tórax 9. A pressão aplicada por este fórum foi localizada na área abdominal, e não resultou em dificuldade respiratória. Uma técnica automatizada imagem coregistration foi validado para DCE-MRI de órgãos abdominais em um modo livre de respiração, mas ele executa effectively apenas quando as regiões alvo mover-se lentamente e regularmente 10. A freqüência respiratória dos animais é variável durante o exame, moderação, de modo físico na área abdominal será necessário para recuperar os parâmetros farmacocinéticos de confiança em modelos de ratos tumor pancreático ortotópicos. Temos quantificada com sucesso os parâmetros farmacocinéticos de um agente de contraste MR em ortotópicos xenografts tumor pancreático usando a placa de plástico orthogonally dobrado em DCE-MRI 11-13. Aqui apresentamos o procedimento detalhado de modelagem tumor pancreático orthotopic, DCE-MRI dos xenotransplantes de tumor em ratos, e quantificação dos parâmetros farmacocinéticos.
Protocolo
Todos os procedimentos foram aprovados pelo Comitê de Uso e Cuidado Animal Institucional da Universidade do Alabama, em Birmingham.
1. Orthotopic pâncreas Tumor Rato Modeling
- Linhas de padrão de cultura de células humanas do pâncreas-cancro em meio de Eagle modificado por Dulbecco (DMEM) suplementado com 10% de soro fetal bovino. Mantenha todas as culturas a 37 ° C em atmosfera humidificada com 5% de CO 2.
- Use 8-10 semanas de idade, do sexo feminino graves ratos imunodeficientes combinados. Coloque as gaiolas dos animais em 12 horas de luz e escuridão ciclo de 12 horas à temperatura ambiente (21 ± 2 ° C) e 60% de humidade.
- Anestesiar todos os animais utilizando ventilação com 2% de isoflurano misturado com oxigénio (2 L / min) durante toda a cirurgia. Confirme a profundidade da anestesia por toe pitada reflexo. Colocar os animais de uma almofada de aquecimento (37 ° C) para manter a temperatura corporal. Aplicar pomada oftálmica veterinária nos olhos para evitar a secura e sob anestesia. &# 160;
- Remover o cabelo no quadrante superior esquerdo do abdómen de cada rato, e dar um medicamento analgésico (carpofen, 5 mg / kg de peso corporal por via subcutânea) na área. Aplique uma solução de betadine para a pele exposta. Prepare instrumentos cirúrgicos autoclavada.
- Faça uma incisão de 1 cm na pele e peritônio usando iris tesoura reta. Remova cuidadosamente o pâncreas do abdome utilizando pinças cirúrgicas.
- Insira 28 L agulha de uma seringa de 0,5 mL de insulina na cauda do pâncreas e, em seguida, lentamente, uma solução de infusão de 2,5 milhões de células de cancro pancreático humano em 30 ul de DMEM. Confirme se uma pequena bolha é criado na cabeça do pâncreas pela solução.
- Delicadamente, coloque o pâncreas volta para o abdômen utilizando pinças cirúrgicas. Feche o peritônio e da pele em uma camada com 2 interrompido 5-0 Prolene, e, em seguida, terminar a anestesia. Não devolva um animal que passou por uma cirurgia para a companhia de outros animais até que esteja totalmente recuperado.60; Remover suturas em 7 ~ 10 dias após a cirurgia.
- Dê outra dose do medicamento analgésico (carpofen, 5 mg / kg de peso corporal por via subcutânea) a 24 h após a cirurgia.
- Verifique o tamanho do tumor através da palpação da área de cirurgia usando dois dedos. Os tumores normalmente se sentir mais denso e mais instável do que os tecidos e órgãos adjacentes. Normalmente demora ~ 1-2 semanas para começar a sentir um tumor.
- Monitorar os animais diariamente para sinais de doença. Quando os animais aparecem doentes (comportamentos de higiene e de prevenção de falta normais), encerramos-los usando deslocamento cervical sob anestesia.
2. Imagem por Ressonância Magnética
- Aplicar ressonância magnética quando o tamanho do tumor é de cerca de 5-7 mm de diâmetro a normalmente 2 a 4 semanas após a implantação da célula. Use um scanner de ressonância magnética dedicada a pequena imagem de animal ou um scanner MR clínica equipado com uma bobina especializado para pequena imagem animal.
NOTA: Foi utilizado um animal pequeno scanner de ressonância magnética 9.4T com uma combinação de um volume de ressonância 1 H/ Transmissor e um receptor de superfície da bobina (30 mm de diâmetro) (Bruker BioSpin Corporation, Billerica, MA). A bobina de superfície proporciona melhor relação sinal-ruído (SNR) 14. - Prepara-se uma agente de contraste à base de gadolínio para MRI injectar ~ 0,1-0,2 mmol / kg a cada animal em ~ 0,1-0,2 ml de PBS (tampão fosfato salino).
NOTA: Foi utilizado gadoteridol, e injectado 0,2 mmol / kg em 0,15 ml de PBS durante um período de 15 segundos (0,1 ml / seg). - Prepara-se uma micro-tubo de polietileno (comprimento: 7,62 milímetros, o diâmetro interno forma: 0,28 mm, diâmetro externo = 0,64 mm). Inserir uma agulha G 30 (comprimento de 12,7 mm) em uma das extremidades do tubo, e uma agulha 30 G romba ponta (9,5 mm de comprimento) na outra extremidade. Conectar uma seringa de 1 ml, contendo agente de contraste MR à agulha de ponta romba, e empurrar lentamente a seringa para encher todo o tubo com o agente de contraste de MR.
- Anestesiar os animais utilizando ventilação com ~ 1 - 2% de isoflurano misturado com oxigénio (2 L / min) durante toda a preparação e imagiologia. Confirme a profundidade de Anesthesia por toe pitada reflexo. Aplicar pomada oftálmica veterinária nos olhos para evitar a secura e sob anestesia. Dilatar a veia da cauda usando uma lâmpada de calor antes da inserção da agulha. Pegue o meio da agulha de 30 G com a pinça Kelly, e inseri-lo na veia da cauda. Fita ambos a cauda e o tubo sobre uma folha de plástico ou de papel de cartão (10 mm de largura x 100 mm de comprimento) para manter a linha reta cauda.
- Colocar o animal em decúbito dorsal em uma cama de animais equipado com circulação de água quente (ou ar quente) para regular a temperatura corporal durante o exame. Ajuste da temperatura no leito de 37 ° C. Insira uma sonda de temperatura rectal para monitorizar a temperatura do corpo durante o exame.
- Aplicar uma placa de plástico orthogonally dobrada na área abdominal. Verifique se o tumor está localizado atrás da extremidade superior do tabuleiro, e, em seguida, puxe para baixo a placa ligeiramente (~ 2 mm) para garantir o tumor é capturado pela diretoria. Tape o tabuleiro para a cama dos animais com firmeza.
- Tape um transduce pad respiraçãor (SA Instrument, Inc., Stony Brook, NY) na região do peito para monitorar a respiração animal durante o exame. Inserir uma bobina de superfície no topo da região do tumor, e fita-lo para a cama de animais com firmeza. Empurrar a cama dos animais no scanner MR para colocar a região do tumor no centro da bobina de volume (diâmetro interno: 72 milímetros).
- Executar a correspondência e afinação tanto para o receptor e transmissor, seguido por calços.
- Comece com uma sequência MR anatômica para localizar o tumor. Use uma sequência spin-echo (T2W) turbo T2 para obter imagens axiais com os seguintes parâmetros de aquisição. Tempo de repetição (TR) / tempo de eco (TE) = 3.000 / 34 ms, 128 x matriz de 128, 30 x 30 mm campo de visão, número de médias = 1, comprimento do comboio echo = 4 e 20 contíguas de 1 mm de espessura em um modo entrelaçado para cobrir toda a região do tumor (tempo total de digitalização: 1,6 min).
Observação: Uma vez que os tumores pancreáticos ortotópicos são mais difíceis de ser localizado do que as subcutâneas, locali convencionalzer imagens com resolução mais baixa pode não ser útil. - Adquirir imagens ponderadas em T1 (T1W) com vários ângulos de aleta para recuperar T1 mapa. Para esta finalidade, utilizar um gradiente de eco abordagem ângulo multiflip com os seguintes parâmetros: tempo de repetição (TR) / tempo de eco (TE) = 115/3 mseg, de 128 x 128 de matriz, um campo de 30 x 30 mm de vista, o número de médias = 4, ~ 5-7 contíguas de 1 mm de espessura em um modo entrelaçado para cobrir a região do tumor, e sete ângulos de aleta de 10, 20, 30, 40, 50, 60 e 70 (tempo total de digitalização por flip angle: 1 min).
NOTA: No entanto, a abordagem ângulo multiflip é eficiente somente quando o campo B1 homogeneidade é alta. Se não, mapas T1 pode ser obtido com a abordagem TR múltipla, em vez de 15. - Adquira imagens T1W antes e após a injeção de contraste gadolínio baseado MR. Use os mesmos parâmetros de aquisição e da geometria para o mapeamento T1 mas com o ângulo da aleta fixa de 30. Use codificação linear para garantir estado estacionário quando o centro de k-espaço é obtido, especially quando um curto TR e um ângulo de baixo grau de aleta são usados. Adquirir 5 imagens de base antes de injeção de contraste. Em seguida, adquirir 40 imagens após a injeção de contraste (tempo total de digitalização: 45 min). Usar uma bomba de seringa para injectar agente de contraste a uma taxa constante (0,01 ml / seg).
- Controlar a respiração dos animais de forma contínua, e ajustar concentração de isoflurano para manter a freqüência respiratória para 50 - 100 respirações por minuto. Monitore a temperatura do corpo do animal durante exames de imagem.
- Depois de completar DCE-MRI, retirar a agulha e outras sondas, e colocar o animal em uma gaiola vazia camas com toalhas de papel. Massageie suavemente a área abdominal inferior. A gaiola deve ser colocado metade sob uma lâmpada de calor para que os animais possam entrar e sair do gradiente de calor como ele se recupera. Não deixe um animal sem supervisão até que ele recuperou a consciência suficiente para manter decúbito esternal.
3. Processamento de Imagem e Análise
- Regi tumorais Segmento em em imagens em T2. Em imagens em T2, a intensidade do sinal na região do tumor é mais brilhante do que a dos tecidos circundantes, de modo que o limite do tumor pode ser delineada manualmente.
NOTA: técnicas semi-automáticas de segmentação, como limiar global ou contorno ativo pode ser usado 16,17, mas a intensidade de fundo irregular deve ser corrigido especialmente quando uma bobina de superfície é usado. - Criar mapas T1 e densidade de prótons. Em imagens T1W adquiridos com uma sequcia de eco de gradiente, assumindo que o tempo de eco (TE) é muito menor do que em T2 * valor, o valor de pixel é determinada pela
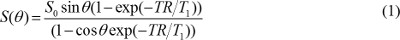
onde S 0 é a densidade de prótons, T 1 T 1 é tempo de relaxamento constante, TR é tempo de repetição, e θ é um ângulo de flip. A equação (1) pode ser reescrito para
641eq2.jpg "/>
quando S (θ) / sinθ é substituído com Y, e S (θ) / tanθ é substituído com X. A equação (2) é uma equação linear, e a sua inclinação e intersecção pode ser utilizado para recuperar e T1 S valores 0, respectivamente. - Calcule concentração contraste MR em imagens DCE-MR. Quando agente de contraste MR base de gadolínio é injetado, T 1 relaxamento constante de tempo é alterada ao longo do tempo. Então, a equação (1) pode ser reescrito para
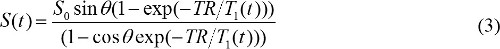
T 1 (t) está relacionada com a concentração de contraste MR, C (t), como se segue,
em que r é 1 a relaxação longitudinal do agente de contraste de MR. Assim, combinando as equações (3) e (4), a concentração de contraste MR é determinada pela - Quantificar os parâmetros farmacocinéticos do MR contraste agente. C p (t) apresenta concentração contraste MR no plasma sanguíneo no tempo t após o início da injeção de contraste. C p (t) é chamada função de entrada arterial (AIF). Se FIA está disponível, os parâmetros farmacocinéticos do agente de contraste MR pode ser calculado
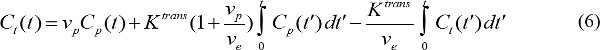
em que C t (t) é a concentração de contraste na RM de um tecido alvo, p v é o volume do plasma sanguíneo fraccionada, e v é o volume extracelular extravascular fraccionada, e K é uma constante trans transferência de volume. Taxa de fluxo constante, k ep é igual a K trans divididos por v e. Se FIA não está disponível, então o modelo da região de referência pode ser utilizado em vez 18,19. O modelo da região de referência é baseado no modelo de fluxo Kety-20 e limitada usa concentração de contraste em uma região de referência para eliminar a necessidade de AIF como se segue,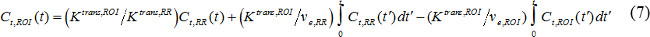
em que C t, ROI (t), K trans, ROI, e v e, ROI são concentração contraste, a transferência de volume constante, e volume extracelular extravascular-fraccionada, respectivamente, na região de interesse (ROI), enquanto a C t, RR (t), K trans, RR, e v e, RR são os da região de referência. Músculo paravertebral é frequentemente seleccionada como a região de referência e v e, em pa murino RRravertebral músculo é assumido ser constante a 0,08 21. Usamos o modelo região de referência.
Resultados
As células tumorais pancreáticas humanas crescer com sucesso em pâncreas de rato criando um tumor sólido. A Figura 1 apresenta fotografias de (A) um pâncreas normal onde a solução da célula de tumor é injectada, e (B) um ratinho representativo tendo um xenoenxerto de tumor pancreático ortotópico (MIA PaCa-2 ). Tumor está localizado no quadrante superior esquerdo do abdómen, ao lado do baço. Ele normalmente leva 2-4 semanas para que os tumores a crescer até 5-7 mm de diâmetro após o impl...
Discussão
Nós introduzimos os métodos detalhados de modelagem de tumor pancreático orthotopic usando ratos imunodeficientes, DCE-MRI de tumores abdominais em ratos, e quantificação de seus parâmetros cinéticos. Na modelagem de tumor pancreático orthotopic, é preciso ter cuidado ao inserir uma agulha na cauda do pâncreas. Se for bem sucedido, as células serão transferidos para a cabeça do pâncreas criando uma pequena bolha. Ao aplicar-se uma placa de plástico orthogonally dobrado, é fundamental para confirmar que o...
Divulgações
Authors do not have any conflicts of interest to declare.
Agradecimentos
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
Referências
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados