Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ortotopik Pankreas Kanseri Fare Modeli Dinamik Kontrast Geliştirilmiş Manyetik Rezonans Görüntüleme
Bu Makalede
Özet
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Özet
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Giriş
Bu yöntemin genel amacı farelerde ortotopik pankreas tümörü xenografts için dinamik kontrastlı manyetik rezonans görüntüleme (DCE-MRI) uygulamaktır. DCE MR enjeksiyonundan sonra belli bir süre boyunca MR kontrast değişiklik izlenerek veya hedeflenen bir dokuda mikrovaskuleterini değerlendirmek için invazif olmayan bir yöntemdir. DCE-MRI habis tümörler teşhis etmek ve çeşitli terapiler 1-4 tümör yanıtı değerlendirmek için kullanılmıştır. Kantitatif DCE-MRG yüksek tekrarlanabilirlik 5 sunmuştur. Bir hedef dokuda bir MR kontrast maddenin farmakokinetik parametrelerini ölçmek için, kontrast madde önce elde edilen farklı zaman noktalarında, T1 haritasına alınan tüm DCE MR görüntüleri 6 coregistered gerekir. Ancak, karın bölgesinde solunum ve peristaltik hareketlere, kantitatif DCE-MRI, gastrointestinal tümörler için sınırlı bir uygulama olmuştur.
Ortotopik pankreatik tümör modelleri değerlendirmek için kullanılmıştırBiyolojik tedaviler ve kemoterapi 7,8 aşağıdaki pankreas-tümör yanıtı. Orijinal tümör sitesinde mikroçevresinin yansır ve tedaviye böylece insan tümör yanıtı daha doğru tahmin edilebilir çünkü Ortotopik tümör modelleri, klasik subkutan modellere üstün kabul edilir. Ancak, fare pankreas karnın sol üst kadranda bulunan, farelerde ortotopik pankreas tümörü ksenograftlarının nedenle nicel DCE-MRI kolayca uygulamaya konmamıştır.
Biz göğüs bölgesi 9 dan hareket transferini engellemek için bir dik bükülmüş plastik tahta kullanarak tümörleri tespit farelerde tümörlerin karın DCE-MRI bir protokol kurduk. Bu kurul tarafından uygulanan basınç karın bölgesinde lokalize edilmiş ve solunum güçlüğü sonuçlandı değil. Otomatik görüntü coregistration tekniği serbest nefes modunda karın içi organların DCE-MRI valide edilmiş, ancak effectivel gerçekleştiriry sadece hedef bölgeleri yavaş yavaş ve düzenli 10 taşıdığınızda. Hayvanların Solunum hızı görüntüleme sırasında değişkendir, karın bölgesinde çok fiziksel kısıtlama ortotopik pankreas tümörü fare modellerinde güvenilir farmakokinetik parametrelerini almak için gerekli olacaktır. Biz başarıyla DCE-MRI 11-13 yılında dik bükülmüş plastik tahta kullanarak ortotopik pankreas tümörü ksenograftlarda bir MR kontrast maddenin farmakokinetik parametreleri quantitated var. Burada ortotopik pankreas tümörü modelleme ayrıntılı prosedürü sunmak, tümör farelerde xenografts ve farmakokinetik parametrelerin ölçümü ve DCE-MRI.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm işlemler Birmingham Alabama Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından kabul edildi.
1. Ortotopik Pankreas Tümör Fare Modelleme
- Dulbecco tadil edilmiş Eagle ortamı (DMEM) içinde kültür standart insan pankreatik kanser hücre çizgileri% 10 cenin sığır serumu ile takviye edilmiştir. % 5 CO2 ile nemli bir atmosferde 37 ° C 'de, tüm kültür muhafaza edin.
- 8-10 haftalık dişi şiddetli kombine immunodefisiyan fareler kullanın. 12 saat ışık ve 12 saat karanlık çevrimi oda sıcaklığında (21 ± 2 ° C) ve% 60 nemde bir hayvan kafesleri yerleştirin.
- Ameliyat boyunca oksijen (/ dk 2 L) ile karıştırılmıştır izofluran% 2 ile havalandırma ile tüm hayvanlar anestezisi. Ayak tutam refleks ile anestezi derinliği onaylayın. Bir ısıtma yastığı (37 ° C) yerleştirin hayvanlar vücut ısısını korumak için. Anestezi altında iken kuruluğu önlemek için göze veteriner oftalmik merhem sürün. &# 160;
- Her fare karnın sol üst kadranda saç çıkarın ve bir analjezik ilaç vermek alana (5 mg / vücut ağırlığı kg subkutan carpofen). Maruz kalan cilde betadin çözümü uygulayın. Otoklava cerrahi aletler hazırlayın.
- Deride 1 cm'lik kesi yapmak ve iris düz makas kullanarak periton. Yavaşça cerrahi cımbız kullanarak karın pankreas kaldırmak.
- Pankreas kuyruğa, 0.5 ml insülin şırınga 28 G iğne takın ve daha sonra yavaş yavaş, DMEM, 30 ul 2.500.000, insan pankreas kanser hücrelerinin bir çözelti aşılamak. Küçük bir kabarcık çözeltisi ile pankreas başında oluşturulan olduğunu doğrulayın.
- Yavaşça geri cerrahi cımbız kullanarak karın içine pankreas yerleştirin. 2 5-0 Prolen sütür kesintiye 1 katmanda periton ve cilt kapatın ve sonra anestezi sonlandırmak. Tamamen iyileşene kadar diğer hayvanların şirkete ameliyat geçirmiş bir hayvan iade etmeyin.60; 7 ~ 10 gün sonrası ameliyat sırasında sütür çıkarın.
- Ameliyattan 24 saat sonra (carpofen 5 mg / vücut ağırlığı deri altından kg) bir ilaç bir doz ver.
- İki parmağınızı kullanarak cerrahi alan palpe tümör boyutunu kontrol edin. Tümörler genellikle çevredeki dokulara ve organlara göre daha yoğun ve bumpier hissediyorum. Bir tümör duygu başlamak için 2 hafta - Genellikle ~ 1 sürer.
- Hastalık belirtileri günlük hayvanları izleyin. Hayvanlar hasta (eksikliği, normal bakım ve kaçınma davranışları) göründüğünde, biz anestezi altında iken servikal dislokasyon kullanarak sonlandırıldı.
2. Manyetik Rezonans Görüntüleme
- Hücre implantasyonu sonrası, genellikle 2 ila 4 hafta sonra, çapı 7 mm - tümör boyutu yaklaşık 5 olduğu zaman MRI uygulanır. Küçük hayvan görüntüleme veya küçük hayvan görüntüleme için özel bir bobin ile donatılmış bir klinik MR tarayıcı adanmış bir MR tarayıcı kullanın.
NOT: 1 lH hacim rezonatörün bir kombinasyonu ile bir 9.4T küçük hayvan MR tarayıcı kullanılır/ Verici ve bir yüzey bobin yuvası (çapı 30 mm) (Bruker BioSpin Corp., Billerica, MA). Bir yüzey bobin daha iyi sinyal-gürültü oranı (SNR) 14 sağlamaktadır. - 0.2 ml PBS (fosfat tamponlu tuzlu su) - 0.1, her bir hayvana, 0.2 mg / kg - 0.1 enjekte etmek için bir gadolinyum göre MRT-kontrast maddesinin hazırlanması.
NOT: gadoteridol kullanılır ve 15 saniyelik bir süre (0,1 ml / sn) üzerinde 0.15 mi, PBS içinde 0.2 mg / kg enjekte edildi. - Bir mikro-polietilen tüp (7.62 mm iç çap: 0.28 mm, dış çap: 0.64 mm uzunluk) hazırlayın. Bir borunun ucuna, diğer ucunu bir 30 G künt ucu iğne (9.5 mm uzunluk) içine 30 G iğne (12.7 mm uzunluk) takın. Künt ucu iğne MR kontrast madde içeren 1 ml şırınga bağlayın ve yavaşça MR kontrast madde ile tüm tüp doldurmak için şırınga itin.
- Hazırlanması ve görüntüleme boyunca oksijen (2 L / dk) ile karışık izofluran% 2 - ~ 1 ile havalandırma kullanarak hayvanları uyutmak. ANEST derinliğini teyitayak tutam refleks ile zi. Anestezi altında iken kuruluğu önlemek için göze veteriner oftalmik merhem sürün. İğne yerleştirilmeden önce bir ısı lambası kullanarak ven kuyruk genişletmek. Kelly forseps kullanarak 30 G iğne ortasında tut, ve kuyruk ven içine yerleştirin. Plastik veya karton kağıt (10 mm genişlik x 100 mm uzunluk) bir parça üzerine bant hem kuyruk ve tüp kuyruğu dik tutmak için.
- Görüntüleme sırasında vücut ısısını düzenlemek için ılık su (ya da sıcak hava) dolaşan ile donatılmış bir hayvan yatakta sırtüstü pozisyonda hayvan yerleştirin. 37 ° C yatakta sıcaklığını ayarlayın. Görüntüleme sırasında vücut sıcaklığını izlemek için bir rektal sıcaklık probu yerleştirin.
- Karın alana bir dik bükülmüş plastik kurulu uygulayın. Tümör kurulu üst ucunun arkasında bulunduğundan emin olun, ve sonra hafifçe tahta aşağı çekin (~ 2 mm) tümörü sağlamak için yönetim kurulu tarafından yakalandı. Sıkıca hayvan yatağına kurulu Teyp.
- Bir solunum ped transduce Teypgöğüs bölgesine r (SA Enstrüman, Inc., Stony Brook, NY) görüntüleme sırasında hayvan solunumu izlemek için. Tümörlü bölgede üst yüzey bobin yerleştirin ve sıkı bir şekilde bir hayvan yatağa bantlayın. (: 72 mm iç çap) hacim bobin merkezine tümör bölgesini yerleştirmek için MR tarayıcı içine hayvan yatak itin.
- Alıcı ve verici hem de eşleştirme ve ayarlama yapın, shimming ile izledi.
- Tümör bulmak için bir anatomik MR dizisi ile başlayın. Aşağıdaki satın alma parametreleri ile eksenel görüntüler elde etmek için bir T2 ağırlıklı (T2A) turbo spin-eko sekansı kullanın. Tekrarlama zamanı (TR) / eko zamanı (TE) = 3,000 / 34 msn, 128 x 128 matris, görüş 30 x 30 mm alan ortalamalar sayısı = 1, eko tren uzunluğu = 4, ve 20 bitişik 1 mm kalınlığında dilimler halinde Bir geçmeli modu tüm tümör bölgesini (: 1.6 dk, toplam tarama süresi) kapsayacak.
Not: ortotopik pankreatik tümörler subkutan olanlardan daha bulunduğu için daha zor olduğu için, geleneksel localiAlt çözünürlüğe sahip zer görüntüleri yararlı olmayabilir. - T1 haritasını almak için çeşitli flip açıları ile T1 ağırlıklı (T1A) görüntüler elde. Ortalamaların tekrar zamanı (TR) / eko zamanı (TE) = 115/3 msn, 128 x 128 matrisi, görüş 30 x 30 mm alanını, sayı: Bu amaçla, aşağıdaki parametrelerin ile multiflip açı yaklaşımı yankı degrade kullanın = 4, ~ 5 - tümör bölgesini kapsayacak bir geçmeli modda 7 bitişik 1 mm kalınlığında dilimler ve 10 yedi çevirme açıları, 20, 30, 40, 50, 60, ve çevirme açısı başına 70 (toplam tarama süresi: 1 dakika).
NOT: Ancak, multiflip açı yaklaşımı B1 alan homojenliği yüksek olduğu zaman etkilidir. Değilse, T1 harita birden TR yaklaşımı yerine, 15 ile elde edilebilir. - Öncesi ve gadolinyum bazlı MR kontrast enjeksiyonundan sonra T1A görüntüler elde. Esp, k-uzay merkezi elde edildiğinde sabit durumu sağlamak için T1 haritalama için ama 30. kullanın doğrusal kodlama sabit kapak açısı ile aynı satın alma parametreleri ve geometri kullanınKısa bir TR ve düşük derece çevirme açısı kullanılır ecially zaman. Kontrast verilmeden önce 5 temel görüntü elde. (: 45 dk, toplam tarama zamanında) Sonra kontrast enjeksiyonu sonrası 40 görüntüler elde. Sabit bir oranda (0.01 mi / saniye) kontrast ajanı enjekte etmek için bir şırınga pompası kullanın.
- Sürekli hayvan nefes Monitör ve 50 solunum hızı tutmak için izofluran konsantrasyonunu ayarlamak - dakika başına 100 nefesten. Görüntüleme boyunca hayvan vücut sıcaklığını izlemek.
- DCE-MRI tamamladıktan sonra, iğne ve diğer sondalar çıkarmak ve kağıt havlu ile tabakalı bir boş kafes içinde hayvan yerleştirin. Usulca alt karın bölgesine masaj. Kafes o kurtarır hayvan ısı degrade ve dışarı taşımak için izin vermek için bir ısı lambası altında yarısı konulmalıdır. Sternal yatma korumak için yeterli bilinci yerine kadar gözetimsiz bir hayvan bırakmayın.
3. Görüntü İşleme ve Analiz
- Segment tümör regi T2A görüntülerde üzerinde. T2A görüntülerde, tümör bölgesinde sinyal yoğunluğu çevre dokulara daha parlak, yani tümör sınır çizilmiştir edilebilir.
NOT: Bu tür küresel eşikleme veya aktif şekillendirme gibi yarı-otomatik segmentasyon teknikleri 16,17 kullanılabilir, ancak düzensiz arka plan yoğunluğu yüzey bobin kullanıldığında özellikle düzeltilmelidir. - T1 ve proton yoğunluğu haritaları oluşturun. O yankı zamanı (TE) varsayarak bir gradyan eko sekansı ile elde edilen T1A görüntülerde, T2 * değeri, piksel değeri tarafından belirlenir çok daha azdır
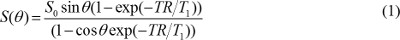
S 0 proton yoğunluğu olduğu, T 1 TR tekrarlama zamanı, T 1 gevşeme zamanı sabittir, ve θ bir flip açısıdır. Denklem (1) ile yazılabilir
641eq2.jpg "/>
S (θ) / sinθ Y ile ikame edilir, ve S (θ) zaman / tanθ X ile değiştirilir. Denklem (2) bir lineer denklem ve onun eğim ve kesişim sırasıyla T1 ve S 0 değerleri almak için kullanılabilir. - DCE-MR görüntüleri MR kontrast konsantrasyonunu hesaplayın. Gadolinyum bazlı MR kontrast madde enjekte edildiğinde, T 1 gevşeme zamanı sabiti zamanla değişti. Yani, denklem (1) için yeniden olabilir
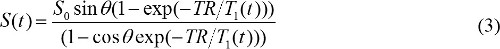
Aşağıdaki gibi, T 1 (t), MR kontrast konsantrasyonu, C (t) ile ilgilidir
burada r, 1 MR kontrast madde uzunlamasına relaksivitesi olup. Yani, birleştirerek denklemler (3) ve (4), MR kontrast konsantrasyonu ile belirlenir
- Kontrast enjeksiyonu başlatıldıktan sonra t MR kontrast ajan. C p (t) kan plazması MR kontrast konsantrasyonunu sunuyor farmakokinetik parametreleri ölçmek. C p (t) arteriyel giriş fonksiyonu (AIF) denir. AIF varsa, MR kontrast maddenin farmakokinetik parametreler hesaplanabilir
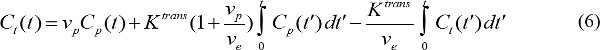
Cı t (t), MR kontrast konsantrasyonu, hedef dokuda etkinin ortaya çıkışıdır ve v s, h e fraksiyonel ekstravasküler ekstrasellüler hacim fraksiyonel kan plazma hacmi ve K, trans ses aktarma sabittir. Akı, k oran sabiti ep K tran eşittirv e bölünür s. AIF mevcut değilse, o zaman bir referans bölgesi, bir model yerine 18,19 kullanılabilir. Referans bölge modeli akış sınırlı Kety modeli 20 ve dayalı şöyle AIF ihtiyacını kaldırmak için bir referans bölgedeki kontrast konsantrasyonunu kullanır,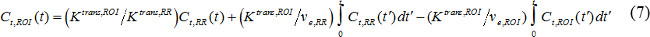
burada C t, ROI (t), K trans, YG ve v e ROI, ilgi (ROI) bölgede sırasıyla kontrast konsantrasyonu, hacim transferi sabit ve fraksiyonel ekstravasküler-dışı hacim, vardır C t iken, RR (t); K, trans, RR ve v, e, RR referans bölgesinin olanlardır. Paravertebral kas genellikle kemirgen pa v e RR referans bölge olarak seçilen veravertebral kas 0.08 21 sabit olduğu varsayılır. Biz referans bölge modeli kullanılır.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Insan pankreas tümörü hücreleri, fare pankreası bir katı tümör oluşturma başarılı bir şekilde büyür. 1, (A), tümör hücre solüsyonu enjekte edilir bir normal pankreas, ve (B) fotoğraflarını göstermektedir ortotopik pankreas tümörü xenograft taşıyan bir temsili fare (MIA PaCa-2 ). Tümör yanında dalak, karın sol üst kadranda yer almaktadır. Hücre implantasyon sonrası çapı 7 mm - tümörler 5 büyümek için 4 hafta - Genellikle 2 sürer.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu immunodefisiyan fareler, fare abdominal tümörlerin DCE MRG ve kinetik parametrelerinin ölçümü ile ortotopik pankreas tümörü modelleme ayrıntılı olacak şekilde kullanılır. Pankreas kuyruk içine bir iğne takarken ortotopik pankreas tümörü modellemede, dikkatli olunmalıdır. Eğer başarılı olursa, hücreler, küçük bir kabarcık oluşturma pankreas başı transfer edilecek. Bir dik bükülmüş plastik kurulu uygularken, tümör kurulu üst ucunun altında bulunduğunu doğrulamak için kritik ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Authors do not have any conflicts of interest to declare.
Teşekkürler
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
Referanslar
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797(2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303(2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484(2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır