このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
同所膵臓癌マウスモデルのダイナミックコントラスト強化磁気共鳴画像
要約
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
要約
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
概要
この方法の全体的な目的は、マウスにおける同所性膵臓腫瘍異種移植片のためのダイナミック造影磁気共鳴画像(DCE-MRI)を適用することである。 DCE-MRIは、注射後の一定期間にMRコントラストの変化を監視することにより、標的組織内の微小血管系を評価するための非侵襲的方法である。 DCE-MRIは、悪性腫瘍を診断し、種々の治療1-4腫瘍応答を評価するために利用されている。定量的DCE-MRIは、高い再現性5を提示した。標的組織におけるMR造影剤の薬物動態学的パラメータを定量するために、造影剤注入前の異なる時点およびT1マップで取得されたすべてのDCE-MR画像は、6を合わせが行われなければならない。しかし、腹部領域における呼吸器および蠕動運動に、定量的なDCE-MRIは、胃腸腫瘍の限定されたアプリケーションを持っています。
同所性膵臓腫瘍モデルを評価するために利用されている生物学的療法と化学療法7,8-以下の膵臓腫瘍応答。元の腫瘍部位での微小環境を反映し、それによって治療に対するヒト腫瘍の応答をより正確に予測することができるので、同所性腫瘍モデルは、従来の皮下モデルよりも優れて考えられている。しかし、マウスの膵臓は腹部の左上象限に位置しているので、マウスにおける同所性膵臓腫瘍異種移植片の定量的なDCE-MRIは、容易に実施されていない。
我々は、胸部9から運動伝達を防止するために直角に曲げられたプラスチック基板を使用して腫瘍を固定することにより、マウスにおける腹部腫瘍のDCE-MRIのプロトコールを確立した。このボードによって適用される圧力は腹部領域に局在していた、と呼吸困難をもたらしていない。自動画像coregistration技術は、自由呼吸モードの腹部臓器のDCE-MRIのために検証されているが、それはeffectivelを行い、yが唯一の標的領域は、ゆっくりと定期的に10移動したとき。動物の呼吸速度は、画像形成時に可変であるため、腹部領域における身体拘束は、同所性膵臓腫瘍のマウスモデルにおける信頼性の高い薬物動態パラメータを取得するために必要であろう。我々は、正常にDCE-MRI 11-13に直角に折り曲げられたプラスチック基板を用いた同所性膵臓腫瘍異種移植片におけるMR造影剤の薬物動態学的パラメータを定量化している。ここでは、同所性膵臓腫瘍モデルマウスにおける腫瘍異種移植片のDCE-MRI、および薬物動態学的パラメータの定量化の詳細な手順を提示する。
プロトコル
すべての手順は、アラバマ大学バーミンガム校での制度的動物実験委員会によって承認された。
1.同所膵臓腫瘍マウスモデル
- ダルベッコ改変イーグル培地(DMEM)で培養し、標準的なヒト膵臓癌細胞株は10%ウシ胎児血清を補充した。 5%のCO 2を含む加湿雰囲気中、37℃ですべての文化を維持します。
- 8-10週齢の雌重症複合免疫不全マウスを使用してください。 12時間の明とRTで12時間の暗闇のサイクル(21±2℃)および60%の湿度で、動物のケージを置きます。
- 手術を通じて酸素(2L /分)と混合イソフルラン2%の換気を使用して、すべての動物を麻酔。つま先ピンチ反射によって麻酔の深さを確認してください。体温を維持するために、加熱パッド(37℃)上に置いた動物。麻酔下ながら乾燥を防ぐために、目に獣医眼軟膏を適用します。  
- 各マウスの腹部の左上腹部に毛を削除して、領域に鎮痛薬(carpofen、体重皮下の5 mg / kgを)を得た。露出した皮膚にベータダインソリューションを適用します。オートクレーブ手術器具を準備します。
- アイリスのストレートはさみを使って皮膚や腹膜における1cmの切開を行います。静かに外科ピンセットを使って腹部から膵臓を削除します。
- 膵臓の尾に0.5ミリリットルのインスリン注射器の28 G針を挿入し、その後ゆっくりとDMEMの30μlの250万ヒト膵臓癌細胞の溶液を注入する。小胞が溶液による膵臓の頭の中に作成されていることを確認します。
- そっと背中外科ピンセットを用いて腹部に膵臓を置く。 2と1層で腹膜、皮膚を閉じて5-0プロレン縫合糸を中断し、その後、麻酔を終了します。完全に回復するまで、他の動物の会社に手術を受けた動物を返さないでください。60; 7〜10日後に手術で縫合糸を外します。
- 手術後24時間で鎮痛薬(carpofen、体重皮下の5mg / kgの)のさらなる用量を与える。
- 2本の指を使って手術面積を触診によって腫瘍の大きさを確認してください。腫瘍は一般的に、周囲の組織や臓器よりも高密度とbumpierに感じる。腫瘍を感じ始めるために2週間 - 通常は約1かかります。
- 病気の徴候について毎日動物を監視します。動物が病気(不足通常のグルーミングと回避行動を)現れるとき、私たちは麻酔下ながら頸椎脱臼を使用してそれらを終了しました。
2.磁気共鳴イメージング
- 細胞移植後、通常2〜4週間で直径7mm - 腫瘍サイズが約5である場合にMRIを適用する。小動物イメージングや小動物イメージングのための専門のコイルを搭載した臨床MRスキャナ専用のMRスキャナを使用してください。
注:我々は、1 Hボリューム共振器の組み合わせで9.4T小動物MRスキャナを使用/送信機及び表面コイル受信機(直径30mm)(ブルカー·バイオスピン社、ビレリカ、MA)。表面コイルは、より良好な信号対雑音比(SNR)14を提供する。 - 0.2mlのPBS(リン酸緩衝生理食塩水) - 〜0.1に各動物に0.2ミリモル/ kgを - 〜0.1を注入するためにガドリニウムベースのMRI造影剤を準備します。
注:我々はガドテリドールを使用し、15秒(0.1ミリリットル/秒)の期間にわたって0.15ミリリットルのPBSに0.2ミリモル/ kgを注入した。 - マイクロポリエチレン(polyethelene)チューブ(:7.62ミリメートル、内径:0.28ミリメートル、外径:0.64ミリメートル、長さ)を準備します。他方の端部にチューブの一端、および30 G鈍先端針(9.5ミリメートルの長さ)に30 G針(長さ12.7mm)を挿入。鈍い先端の針にMR造影剤を含む1mlのシリンジを接続し、ゆっくりとMR造影剤でチューブ全体を埋めるために、注射器を押す。
- 準備及びイメージング全体(2L /分)、酸素とイソフルランの混合の2% - 約1で換気を使用して動物を麻酔。アネスト岩田の深さを確認してくださいつま先ピンチ反射によってhesia。麻酔下ながら乾燥を防ぐために、目に獣医眼軟膏を適用します。針挿入の前に加熱ランプを使用して尾静脈を拡張する。ケリー鉗子を用いて30 G針の真ん中をつかみ、そして尾静脈に挿入します。プラスチックまたは段ボール紙(幅10mm×100mmの長さ)の一片上にテープの両方の尾筒は、尾をまっすぐに保つ。
- 撮像中に体温を調節するために暖かい水(または暖かい空気)を循環させる装備した動物のベッドで仰臥位で動物を置きます。 37℃にベッドの上で温度を設定します。撮像中に体温を監視するために直腸温度プローブを挿入する。
- 腹部領域に直角に曲がったプラスチック板を適用します。腫瘍がボードでキャッチされていることを確認するために(2ミリメートル〜)腫瘍がボードの上端の後ろに位置し、その後少しボードをプルダウンしていることを確認します。しっかりと動物のベッドにボードをテープで固定します。
- テープ呼吸パッド形質撮像中に動物の呼吸を監視するための胸の部分にR(SAインストゥルメント社、ストーニーブルック、ニューヨーク州)。腫瘍領域の上に表面コイルを配置し、しっかりと動物のベッドにそれをテープで固定します。 (:72ミリメートル内径)ボリュームコイルの中心に腫瘍領域を配置するMRスキャナに動物のベッドを押してください。
- 受信機と送信機の両方にマッチングし、チューニングを行って、シミングが続く。
- 腫瘍を見つけるために、解剖学的MRシーケンスで始まる。以下の取得パラメータと軸方向に画像を得るためにT2強調(T2W)ターボスピンエコーシーケンスを使用してください。繰り返し時間(TR)/エコー時間(TE)= 3000/34ミリ秒、128×128マトリックス、30×30 mmの視野、平均回数= 1、エコートレイン長= 4、および20個の連続した1mm厚のスライスで全体腫瘍領域(:1.6分総スキャン時間)をカバーするために、インターレースモード。
NOTE:同所性膵臓腫瘍を皮下ものよりも位置することがより困難であるので、従来のlocali解像度の低いZERイメージが有効でない場合があります。 - T1マップを取得するために、様々なフリップ角のT1強調(T1W)画像を取得する。繰り返し時間(TR)/エコー時間(TE)= 3分の115ミリ秒、128×128マトリックス、ビューの30×30ミリメートルフィールド、平均の数:このためには、次のパラメータを使用してmultiflip角度のアプローチエコー勾配を使用= 4〜5 - 腫瘍領域をカバーするインターレースモードで7連続した1mm厚のスライス、及び10、20、30、40、50、60、及び70七フリップ角(フリップ角当たりの総走査時間:1分)。
注:ただし、multiflip角度アプローチはB1の磁場均一性が高い場合にのみ効率的である。そうでない場合、T1マップの代わりに、複数のTR方式15を得ることができる。 - ガドリニウムベースのMR造影剤注入前後のT1W画像を取得。 espを、k空間の中心が取得されたときに、定常状態を確保するために、T1マッピングのための同じ取得パラメータおよびジオメトリを使用するが、30の利用線形符号化の固定されたフリップ角短いTRと低度のフリップ角が使用されているeciallyとき。造影剤注入前に5ベースライン画像を取得する。 (45分間の総走査時間)、その後、造影剤注入後の40の画像を取得する。一定速度(0.01ミリリットル/秒)で造影剤を注入するためにシリンジポンプを使用する。
- 継続的に動物の呼吸を監視し、50に呼吸速度を維持するためにイソフルラン濃度を調整 - 毎分100回の呼吸。イメージングを通じて、動物の体温を監視します。
- DCE-MRIを完了した後、針と他のプローブを脱いで、そしてペーパータオルでベッドの空のケージに動物を置く。そっと下腹部領域をマッサージします。ケージは、それが回復する動物は、熱勾配の内外に移動できるようにヒートランプの下半分に配置されるべきである。それは胸骨横臥位を維持するのに十分な意識を取り戻したまでは無人の動物を放置しないでください。
3.画像処理と解析
- セグメント腫瘍レジ T2W画像中の上。 T2W画像において、腫瘍領域における信号強度は、周囲の組織よりも明るいので、腫瘍の境界を手動で描写することができる。
注:そのようなグローバルしきい値またはアクティブ輪郭として半自動セグメント化技術は16,17を用いることができるが、表面コイルを用いた場合に不均一なバックグラウンド強度を特に補正する必要がある。 - T1およびプロトン密度マップを作成します。グラジエントエコーシーケンスを用いて取得T1W画像において、エコー時間(TE)は、T2 *値よりもはるかに小さいと仮定して、画素値によって決定される
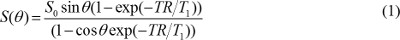
S 0は、プロトン密度であり、T 1は、TRは繰り返し時間であり、T 1緩和時間定数であり、θは、フリップ角である。式(1)に書き換えることができる
641eq2.jpg "/>
S(θ)/sinθとがYで置換され、S(θ)とき/tanθではXで置換されている。式(2)は線形方程式であり、その傾き及び切片は、それぞれT1およびS 0の値を取得するために使用することができる。 - DCE-MR画像におけるMR造影濃度を計算します。ガドリニウムベースのMR造影剤が注入されると、T 1緩和時間定数は、時間とともに変化する。そこで、式(1)に書き換えることができる。
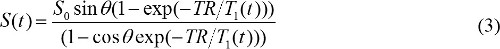
次のようにT 1(t)は 、MR造影濃度C(t)を用いて関連している
ここで、r 1は、MR造影剤の縦緩和である。そのように、組み合わせることにより、式(3)及び(4)、MR造影濃度によって決定される - 造影剤注入の開始後の時間tにおける血漿中のMR造影剤濃度を示すMR造影剤。Cでp(t)の薬物動態学的パラメータを定量する。Cでp(t)は 、動脈入力関数(AIF)と呼ばれている。 AIFが使用可能な場合、MR造影剤の薬物動態パラメーターは次式で計算することができる
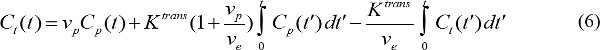
C tを (t)は 、標的組織におけるMR造影濃度、νpは分数血漿容積である場合、νeは小数血管外細胞外体積であり、K transは 、ボリューム移動定数である。フラックス速度定数、k個のepが 、K トランに等しいます。v eで割った秒。 AIFが使用できない場合、基準領域モデルではなく18,19を使用することができる。基準領域モデルは、流量が制限されたケティモデル20に基づいて、次のようにAIFの必要性を除去するための参照領域内の造影剤濃度を使用している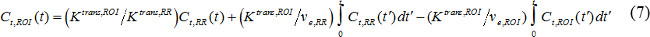
ここで、C tは、ROI(t)は、K トランスは、ROI、およびv eは、ROIは 、関心領域(ROI)におけるそれぞれ造影剤濃度、容積移送定数、分数血管外細胞外体積であり、C tは 、一方、RR (t)は、K トランス、RR、およびv e は、RRは、基準領域のものである。脊椎傍筋はしばしば基準領域、およびv e は、マウスパにおけるRRとして選択するravertebral筋肉は0.08 21で一定であると仮定される。我々は、基準領域モデルを用いた。
結果
ヒト膵臓腫瘍細胞は、固形腫瘍を生成するマウスの膵臓で正常に成長する。 図1(A)の写真で腫瘍細胞溶液が注入される正常な膵臓を示し、(B)同所性膵臓腫瘍異種移植片(MIAのPaCa-2を有する代表的なマウス)。腫瘍は次の脾臓に、腹部の左上腹部に位置しています。細胞移植後に直径7mm - 腫瘍が5まで成長するの4週間 - それは、通常2かかる。
モーション?...
ディスカッション
我々は、マウスにおいて、免疫不全マウスを用いて、腹部腫瘍のDCE-MRIを同所性膵臓腫瘍モデルの詳細な方法を導入し、その動力学的パラメータを定量化している。膵臓の尾に針を挿入するときに同所膵臓腫瘍モデリングでは、注意が必要です。成功した場合、細胞は小胞を作る膵臓の頭部に転送されます。直角に曲がったプラスチック基板を適用する場合、それは腫瘍が板の上端の下方に位...
開示事項
Authors do not have any conflicts of interest to declare.
謝辞
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
参考文献
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved