A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיית תהודה מגנטית משופרת ניגודיות דינמית של דגם orthotopic סרטן לבלב עכבר
In This Article
Summary
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Abstract
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Introduction
המטרה הכוללת של שיטה זו היא ליישם הדמיה ניגודיות המשופרת דינמית בתהודה מגנטית (DCE-MRI) לxenografts גידול בלבלב בעכברי orthotopic. DCE-MRI הוא שיטה לא פולשנית להעריך microvasculature ברקמות יעד על ידי ניטור השינוי של ניגוד MR על פני תקופה מסוימת של זמן לאחר הזרקה. DCE-MRI נוצל כדי לאבחן גידולים ממאירים וכדי להעריך את תגובת גידול לטיפולים שונים 1-4. DCE-MRI כמותי הציג שחזור גבוה 5. כדי לכמת את הפרמטרים pharmacokinetic חומר ניגוד MR של ברקמות יעד, את כל תמונות DCE-MR נרכשו בנקודות זמן שונות ומפת T1 שהושגו לפני הזרקה לעומת זאת יש coregistered 6. עם זאת, בשל תנועות נשימה וperistaltic באזור הבטן, DCE-MRI כמותי יש לו יישום מוגבל לגידולים במערכת העיכול.
מודלים גידול בלבלב Orthotopic כבר נוצלו כדי להעריךתגובת לבלב-גידול הבא טיפולי כימותרפיה ו7,8 ביולוגיים. מודלים גידול Orthotopic נחשבים עדיף על מודלים תת עורית קונבנציונליים, מאז מייקרו-הסביבה באתר הגידול המקורי באו לידי ביטוי ותגובת גידול ובכך אדם לטיפול ניתן לחזות בצורה מדויקת יותר. עם זאת, לבלב העכבר ממוקם ברבע העליון השמאלי של הבטן, DCE-MRI כך כמותי של xenografts גידול בלבלב בעכברי orthotopic לא יושם בקלות.
הקמנו פרוטוקול של DCE-MRI של גידולי בטן בעכברים על ידי תיקון הגידולים תוך שימוש בלוח פלסטיק orthogonally כפוף למניעת העברת תנועה מאזור החזה 9. הלחץ המופעל על ידי הפורום היה מקומי באזור הבטן, ולא הביא בקשיים נשימה. טכניקת coregistration תמונה אוטומטית אומתה לDCE-MRI של אברי בטן במצב חופשית-נשימה, אבל זה מבצע effectively רק כאשר אזורי היעד לנוע באיטיות ובאופן קבוע 10. קצב נשימה של בעלי חיים הוא משתנה במהלך הדמיה, איפוק כל כך פיזי באזור הבטן יהיה צורך לאחזר פרמטרים pharmacokinetic אמין במודלים של עכברי גידול בלבלב orthotopic. יש לנו בהצלחה ונרשמת הפרמטרים pharmacokinetic חומר ניגוד MR של בxenografts גידול בלבלב orthotopic באמצעות לוח פלסטיק orthogonally הכפוף בDCE-MRI 11-13. כאן אנו מציגים את ההליך מפורט של מודלים גידול בלבלב orthotopic, DCE-MRI של xenografts הגידול בעכברים, והכימות של פרמטרים pharmacokinetic.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ההליכים אושרו על ידי הוועדה המוסדית הטיפול בבעלי חיים ושימוש באוניברסיטת אלבמה בבירמינגהם.
דוגמנות 1. Orthotopic גידול עכבר הלבלב
- קווי תרבות סטנדרטיים אנושיים תא לבלב הסרטן במדיום של הנשר שונה Dulbecco (DMEM) בתוספת 10% בסרום שור עוברי. לשמור את כל התרבויות על 37 מעלות צלזיוס באווירת humidified עם 5% CO 2.
- השתמש 8-10 עכברים בשבוע ישן-נקבה חמורה בשילוב immunodeficient. הנח כלובי חיות באור 12 שעות ומחזור חושך 12 שעות בRT (21 ± 2 מעלות צלזיוס) ו -60% לחות.
- הרדימי את כל בעלי החיים באמצעות אוורור עם 2% מisoflurane מעורבב עם חמצן (2 L / min) בכל ניתוח. אשר את עומק ההרדמה על ידי רפלקס קמצוץ הבוהן. בעלי חיים מקום על כרית חימום (37 ° C) כדי לשמור על טמפרטורת הגוף. החל משחת עיני וטרינרית על עיניים כדי למנוע יובש ואילו בהרדמה. ו160 #;
- להסיר את השיער ברבע השמאלי העליון של הבטן של כל עכבר, ולתת תרופה לשיכוך כאבים (carpofen, 5 מ"ג / קילוגרם משקל גוף של תת עורי) לאזור. החל תמיסה פולידין על העור החשוף. הכן מכשירי ניתוח autoclaved.
- לעשות חתך 1 סנטימטר בעור הצפק באמצעות קשתית מספריים ישר. הוצא בעדינות את הלבלב מהבטן באמצעות פינצטה כירורגית.
- הכנס 28 מחט G של מזרק 0.5 מיליליטר אינסולין לתוך הזנב של לבלב ולאחר מכן להחדיר לאט פתרון של 2.5 מיליון תאי סרטן לבלב אנושיים ב -30 μl של DMEM. ודא שבועה קטנה נוצר בראש הלבלב על ידי הפתרון.
- מניח בעדינות את הלבלב בחזרה לתוך הבטן באמצעות פינצטה כירורגית. סגור את הצפק והעור בשכבה 1 עם 2 קטעו 5-0 תפרי Prolene, ולאחר מכן לסיים את ההרדמה. אל תחזרו לבעלי חיים שעברו ניתוח לחברה של בעלי חיים אחרים, עד שהתאושש לחלוטין.60; הסר תפרים בניתוח שלאחר 7 ~ 10 ימים.
- תן מנה נוספת של התרופה לשיכוך כאבים (carpofen, 5 מ"ג / קילוגרם משקל גוף של תת עורי) בשעה 24 שעות לאחר ניתוח.
- בדוק גודל גידול ע"י מישוש אזור הניתוח תוך שימוש בשתי אצבעות. גידולים בדרך כלל מרגישים צפופים וקופצניים יותר מאשר הרקמות ואיברים הסמוכים. בדרך כלל זה לוקח ~ 1-2 שבועות כדי להתחיל להרגיש גידול.
- צג בעלי חיים מדי יום בחיפוש אחר סימנים של מחלה. כאשר בעלי חיים מופיעים (התנהגויות נורמליות חוסר טיפוח והימנעות) חולים, אנחנו נסתיימו באמצעות נקע בצוואר הרחם בזמן הרדמה.
2. תהודה מגנטית
- החל MRI כאשר גודל גידול הוא כ 5-7 מ"מ בקוטר בבדרך כלל 2 ~ 4 שבועות לאחר השתלת תאים. השתמש בסורק MR המוקדש להדמית חיה קטנה או סורק MR קליני מצוידים בסליל ייעודי להדמיה של בעלי חיים קטנים.
הערה: השתמשנו בסורק MR חיה קטנה 9.4T עם שילוב של מהוד נפח H 1/ משדר ומקלט סליל פני השטח (30 מ"מ קוטר) (הברוקר BioSpin קורפ, Billerica, MA). סליל משטח מספק יותר יחס אות לרעש (SNR) 14. - הכן חומר ניגוד MRI מבוסס על גדוליניום להזריק ~ 0.1-0.2 mmol / קילוגרם לכל בעלי חיים ב~ 0.1-0.2 מיליליטר PBS (נאגר מלוח פוספט).
הערה: השתמשנו gadoteridol, והזרקתי 0.2 mmol / קילוגרם ב0.15 מיליליטר PBS על פני תקופה של 15 שניות (0.1 מיליליטר / sec). - להכין צינור מיקרו-polyethelene (אורך: 7.62 מ"מ, קוטר פנימי: 0.28 מ"מ, קוטר חיצוני: 0.64 מ"מ). הכנס מחט G 30 (אורך 12.7 מ"מ) לקצה אחד של הצינור, ומחט 30 G בוטה קצה (אורך מ"מ 9.5) לקצה השני. חבר מזרק 1 מיליליטר המכיל חומר ניגוד MR למחט הקצה הקהה, ולאט לדחוף את המזרק כדי למלא את כל הצינור עם חומר ניגוד MR.
- להרדים בעלי חיים באמצעות אוורור עם ~ 1 - 2% מisoflurane מעורבב עם החמצן (2 L / min) לאורך הכנה והדמיה. אשר את העומק של anesthesia על ידי רפלקס קמצוץ הבוהן. החל משחת עיני וטרינרית על עיניים כדי למנוע יובש ואילו בהרדמה. להרחיב את זנב וריד באמצעות מנורת חום לפני החדרת מחט. תפוס את אמצע מחט 30 G באמצעות מלקחיים קלי, ולהכניס אותו לתוך וריד הזנב. קלטת שני הזנב וצינור על גבי פיסת פלסטיק או נייר קרטון (רוחב x 100 מ"מ אורך 10 מ"מ) כדי לשמור על ישר הזנב.
- מניחים את החיה במצב שכיבה במיטת בעלי חיים מצוידים במחזור מים חמים (או אוויר חם) כדי לווסת את טמפרטורת גוף במהלך הדמיה. הגדר את הטמפרטורה על המיטה עד 37 מעלות צלזיוס. הכנס בדיקה טמפרטורה רקטלית כדי לפקח על טמפרטורת הגוף במהלך הדמיה.
- החל לוח פלסטיק orthogonally כפוף לאזור הבטן. ודא שהגידול ממוקם מאחורי הקצה העליון של הלוח, ולאחר מכן משוך את הלוח מעט (~ 2 מ"מ) כדי להבטיח את הגידול נתפס על ידי הדירקטוריון. הדבק את הלוח למיטה של בעלי חיים בתקיפות.
- קלטת transduce כרית נשימהr (SA Instrument, Inc., סטוני ברוק, ניו יורק) באזור החזה כדי לפקח על נשימה של בעלי החיים במהלך הדמיה. מניחים סליל פני השטח בחלק העליון של אזור הגידול, ואת הקלטת אותו למיטה של בעלי חיים בתקיפות. לדחוף את המיטה של בעלי החיים לתוך סורק MR למקם את אזור הגידול במרכז סליל נפח (הקוטר הפנימי: 72 מ"מ).
- לבצע כוונון התאמה ועבור שניהם המקלט והמשדר, ואחרי shimming.
- להתחיל עם רצף MR אנטומיים כדי לאתר את הגידול. השתמש ברצף ספין הד טורבו (T2W) T2 המשוקלל כדי להשיג תמונות ציריות עם הפרמטרים הרכישה הבאות. זמן החזרה (TR) / זמן הד (TE) = 3,000 / 34 אלפיות שנייה, 128 x 128 מטריצה, שדה 30 x 30 מ"מ מבט, מספר ממוצע = 1, אורך רכבת הד = 4, ו -20 מ"מ 1 רציף פרוסות עבות ב מצב interlaced כדי לכסות את האזור כולו גידול (סה"כ זמן סריקה: 1.6 דקות).
הערה: מאחר שגידולים בלבלב orthotopic קשים יותר מאשר להיות ממוקמים תת עורית אלה, locali הקונבנציונליתמונות זר שיש ברזולוציה נמוכה יותר לא יכולות להיות שימושיות. - לרכוש תמונות משוקללות T1 (T1W) עם זוויות להעיף שונות כדי לאחזר מפת T1. לשם כך, השתמש בשיפוע הד גישת זווית multiflip עם הפרמטרים הבאים: זמן החזרה (TR) / זמן הד (TE) = 115/3 אלפיות שנייה, 128 x 128 מטריצה, שדה 30 x 30 מ"מ מבט, מספר ממוצע = 4, ~ 5-7 פרוסות רציפות 1 מ"מ עבות במצב interlaced כדי לכסות את אזור הגידול, ושבע זוויות שני של 10, 20, 30, 40, 50, 60, ו -70 (זמן סריקה כולל לכל זווית להעיף: 1 דקות).
הערה: עם זאת, גישת זווית multiflip היא יעילה רק כאשר הומוגניות שדה B1 היא גבוהה. אם לא, ניתן לקבל מפות T1 עם גישת TR מרובה במקום 15. - לרכוש תמונות T1W לפני ואחרי הזרקת ניגוד MR גדוליניום מבוססת. השתמש באותם פרמטרים הרכישה וגיאומטריה למיפוי T1 אבל עם הזווית להעיף הקבוע של 30. קידוד ליניארי השתמש כדי להבטיח מצב יציב כאשר מרכז k-המרחב מתקבל, especially כאשר TR קצר וזווית להעיף תואר נמוך משמשים. לרכוש 5 תמונות בסיס לפני זריקת ניגוד. לאחר מכן לרכוש 40 תמונות לאחר הזרקה לעומת (סה"כ זמן סריקה: 45 דקות). השתמש משאבת מזרק כדי להזריק חומר ניגוד בקצב קבוע (0.01 מיליליטר / sec).
- לפקח נשימה של בעלי החיים באופן רציף, ולהתאים את ריכוז isoflurane לשמור על קצב הנשימה ל50-100 נשימות לדקה. מעקב אחר טמפרטורת גוף של בעלי חיים ברחבי הדמיה.
- לאחר שסיימתי את DCE-MRI, תוריד את המחט ובדיקות אחרות, והמקום חי בכלוב ריק מיטות עם מגבות נייר. לעסות בעדינות את אזור הבטן התחתון. הכלוב צריך להיות ממוקם חצי תחת מנורת חום כדי לאפשר לבעלי החיים לנוע פנימה והחוצה משיפוע החום כפי שהוא מתאושש. אל תשאיר חיה ללא השגחה עד שהוא שב להכרתו מספיק כדי לשמור על כיבה sternal.
3. עיבוד תמונה וניתוח
- regi גידול מגזר בתמונות T2W. בתמונות T2W, עוצמת האות באזור גידול היא בהירה יותר מזה של רקמות הסובבות, כך גבול הגידול יכול להיות שמסומן באופן ידני.
הערה: ניתן להשתמש בטכניקות פילוח אוטומטיות למחצה כגון thresholding הגלובלי או contouring הפעיל 16,17, אבל עוצמת רקע אחיד צריכה להיות מתוקנת במיוחד כאשר נעשה שימוש בסליל פני השטח. - יצירת מפות T1 וצפיפות פרוטון. בתמונות T1W רכשו עם רצף הד שיפוע, בהנחה שזמן ההד (TE) הוא הרבה פחות מT2 * ערך, ערך פיקסל נקבע על ידי
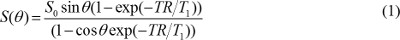
בי S 0 הוא צפיפות פרוטון, T 1 הוא זמן הרפיה T 1 מתמיד, TR הוא זמן החזרה, וθ הוא זווית להעיף. משוואה (1) ניתן לכתוב מחדש ל
641eq2.jpg "/>
כאשר S (θ) / sinθ מוחלף בY, ו- S (θ) / tanθ מוחלף בX. משוואה (2) היא משוואה ליניארית, והמדרון וליירטו ניתן להשתמש כדי לאחזר 0 ערכי T1 ו- S, בהתאמה. - חישוב ריכוז ניגוד MR בתמונות DCE-MR. כאשר חומר ניגוד MR מבוסס גדוליניום מוזרק, קבוע זמן הרפיה 1 T משתנה לאורך זמן. אז, משוואה (1) ניתן לכתוב מחדש ל
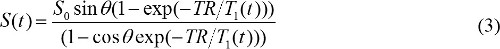
T 1 (t) קשור עם ריכוז ניגוד MR, C (t), כדלקמן,
שבו r 1 הוא relaxivity אורך חומר ניגוד MR של. אז, על ידי שילוב של משוואות (3) ו- (4), ריכוז ניגוד MR נקבע על ידי - לכמת את הפרמטרים pharmacokinetic של p MR ניגוד סוכן. C (t) מציג ריכוז ניגוד MR בפלזמת דם בזמן t לאחר ייזום הזרקת ניגוד. P C (t) נקרא פונקצית קלט עורקים (AIF). אם AIF זמין, הפרמטרים pharmacokinetic חומר ניגוד MR של יכולים להיות מחושבים על ידי
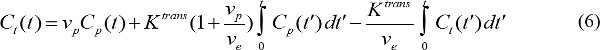
כאשר t C (t) הוא ריכוז ניגוד MR ברקמות יעד, עמ 'v הוא דם השבר נפח פלזמה, דואר v הוא נפח תאי extravascular השבר, וK טרנס הוא קבוע העברת נפח. קבוע שטף שיעור, ep k, שווה לטראן Ks מחולק בדואר v. אם AIF אינו זמין, אז מודל התייחסות האזור ניתן להשתמש במקום 18,19. מודל אזור ההתייחסות מבוסס על מודל Kety-מוגבל זרימה 20 ומשתמש בריכוז ניגוד באזור התייחסות להסיר את הצורך בAIF כדלקמן,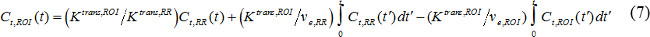
כאשר t C, החזר על ההשקעה (t), K טראנס, החזר על השקעה, ודואר v, החזר על ההשקעה הם ריכוז לעומת זאת, העברת נפח קבועה, ושבר extravascular-תאי נפח, בהתאמה, באזור של עניין (ROI), ואילו t C, RR (T), K טראנס, RR, ודואר v, RR הם אלה באזור ההתייחסות. שריר ליד חוליות עמוד שדרה הוא לעתים קרובות נבחר כאזור ההתייחסות, ודואר v, RR ברשות עכבריתשריר ravertebral הנחה הוא להיות קבוע ב0.08 21. השתמשנו במודל אזור ההתייחסות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תאי גידול בלבלב אנושיים לגדול בהצלחה בלבלב עכבר יצירת גידולים מוצקים. איור 1 מציג צילומים () לבלב נורמלי שבו פתרון תאים סרטניים מוזרק, ו- (ב) עכבר נציג נושאת xenograft גידול בלבלב orthotopic (MIA פאקא-2 ). גידול ממוקם ברבע העליון השמאלי של בטן, בסמוך לטחול. זה בדרך כלל לוקח 2-4...
Access restricted. Please log in or start a trial to view this content.
Discussion
יש לנו הצגנו שיטות מפורטות של מודלים גידול בלבלב orthotopic באמצעות עכברי immunodeficient, DCE-MRI של גידולי בטן בעכברים, וכימות של הפרמטרים שלו קינטית. בדוגמנות גידול בלבלב orthotopic, יש לנקוט בזהירות בעת החדרת מחט לתוך הזנב של לבלב. אם מוצלח, תאים יועברו לראש לבלב יצירת בועה קטנה. בעת ה?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Authors do not have any conflicts of interest to declare.
Acknowledgements
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
References
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797(2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303(2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484(2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved