Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Динамическая контрастность Улучшенная Магнитно-резонансная томография модели Ортотопическая Рак поджелудочной железы мыши
В этой статье
Резюме
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Аннотация
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Введение
Основная цель данного метода состоит в применении динамической контрастности повышается магнитно-резонансную томографию (DCE-MRI) для ортотопических поджелудочной железы ксенотрансплантатов опухоли у мышей. АКД-МРТ является неинвазивным методом оценки микроциркуляторного русла в ткани-мишени путем мониторинга изменения МР контрастных в течение определенного периода времени после инъекции. DCE-MRI была использована для диагностики злокачественных опухолей и для оценки ответа опухоли на различные виды терапии 1-4. Количественный DCE-MRI представил высокую воспроизводимость 5. Для количественной оценки фармакокинетических параметров с МР контрастного агента в ткани-мишени, все изображения АКД-MR, полученные в различные моменты времени и отображение T1, полученных перед инъекцией контрастного необходимо coregistered 6. Тем не менее, из-за респираторных и перистальтических движений в области живота, количественный АКД-МРТ имеет ограниченное применение для желудочно-кишечного тракта опухолей.
Ортотопической модели опухоли поджелудочной железы были использованы для оценкиответ поджелудочной железы, опухоль после биологической терапии и химиотерапии 7,8. Ортотопической модели опухоли рассматриваются превосходит обычные подкожные моделей, поскольку микроокружение в исходной опухоли отражается и, таким образом, ответ опухоли человека на терапию можно более точно предсказать. Тем не менее, поджелудочной железы мыши находится в левом верхнем квадранте брюшной полости, так что количественное АКД-МРТ ортотопической ксенотрансплантатов опухоли поджелудочной железы у мышей не было легко реализованы.
Мы создали протокол DCE-МРТ брюшной опухолей у мышей, фиксируя опухоли с использованием ортогонально изогнутую пластиковые доски, чтобы предотвратить передачу движения от области груди 9. Применяется форумом давление локализуется на брюшной области, и не привело к дыхательной сложности. Автоматизированная методика изображение Корегистрация была утверждена для DCE-МРТ органов брюшной полости в режиме свободного дыхания, но он выполняет effectivelу только тогда, когда целевые регионы двигаться медленно и регулярно 10. Частота дыхания животных является переменной во время съемки, так физические ограничения в области живота необходимо будет получить надежные фармакокинетические параметры в ортотопических поджелудочной железы мышиных моделях опухолей. Мы успешно количественно фармакокинетические параметры контрастного агента и краснухи в ортотопических поджелудочной железы ксенотрансплантатов опухоли с использованием ортогонально изогнутую пластиковую доску в DCE-MRI 11-13. Здесь мы представляем подробный порядок ортотопического поджелудочной моделирования опухоли, DCE-MRI опухолевых ксенотрансплантатов у мышей, и количественной оценки фармакокинетических параметров.
протокол
Все процедуры были одобрены уходу и использованию комитета Институциональная животных в университете штата Алабама в Бирмингеме.
Моделирование 1. Ортотопическая опухоли поджелудочной железы мыши
- Культура стандартные поджелудочной железы-клеточные линии человека в среде Игла в модификации Игла (DMEM) с добавлением 10% эмбриональной телячьей сыворотки. Поддержание всех культур при 37 ° С в увлажненной атмосфере с 5% CO 2.
- Используйте 8-10 недельных самок с тяжелым комбинированным иммунодефицитом мышей. Поместите клетки животных на 12 ч света и 12 ч темноты цикла при комнатной температуре (21 ± 2 ° C) и 60% влажности.
- Обезболить всех животных с использованием вентиляции с 2% изофлуран в смеси с кислородом (2 л / мин) в течение операции. Подтвердите глубину анестезии ног щепотку рефлекс. Место животных на грелку (37 ° C), чтобы поддерживать температуру тела. Применить ветеринарной глазной мази на глазах, чтобы предотвратить сухость в то время как под наркозом. И# 160;
- Удалить волосы в левом верхнем квадранте брюшной полости каждой мыши, и дать обезболивающее лекарство (carpofen, 5 мг / кг массы тела, подкожно) в этой области. Нанесите бетадин решение открытые участки кожи. Подготовка автоклавного хирургических инструментов.
- Сделать 1 см разрез в коже и брюшины с помощью IRIS прямые ножницы. Аккуратно удалить поджелудочную железу от живота с помощью хирургических пинцета.
- Вставка 28 G иглу на 0,5 мл инсулиновый шприц в хвосте поджелудочной железы, а затем медленно влить раствор 2500000 человека клеток рака поджелудочной железы в 30 мкл DMEM. Убедитесь, что маленький пузырь создается в головки поджелудочной железы раствором.
- Аккуратно поместите поджелудочную железу обратно в брюшную полость с помощью хирургических пинцета. Закрыть брюшины и кожи в 1 слой с 2 прерывается 5-0 PROLENE швы, а затем прекратить наркоз. Не возвращать животное, которое перенес операцию на компании других животных, пока полностью выздоровел.60; Удалить швов на 7 ~ 10 дней после операции.
- Дайте еще одну дозу обезболивающего препарата (carpofen, 5 мг / кг массы тела, подкожно) на 24 ч после операции.
- Проверьте размер опухоли, пальпации области хирургии, используя два пальца. Опухоли, как правило, чувствуют себя более плотной и более ухабистой, чем окружающие ткани и органы. Обычно это занимает ~ 1 - 2 недель, чтобы начать чувствовать себя опухоль.
- Монитор животных ежедневно на признаки болезни. Когда животные появляются вредные (бездействие нормальные уход, и уклонения от поведения), мы прервем их с помощью шейки дислокации под наркозом.
2. Магнитно-резонансная томография
- Применить МРТ, когда размер опухоли составляет около 5 - обычно при 2 ~ 4 недель после клеточной имплантации 7 мм в диаметре. Используйте МР-томограф, посвященный маленькое животное изображений или клинической МР-томографа, оснащенного специализированным катушки для малого изображений животных.
ПРИМЕЧАНИЕ: Мы использовали 9.4T Small Animal МР-томограф с комбинацией 1 H объемного резонатора/ Передатчик и приемник поверхность катушки (30 мм в диаметре) (Bruker Corp. BioSpin, Billerica, MA). Поверхностная катушка, обеспечивает лучшую сигнал-шум (SNR) 14. - Подготовка гадолиния на основе МРТ контрастное вещество чтобы придать ~ 0,1 - 0,2 ммоль / кг каждому животному в ~ 0,1 - 0,2 мл PBS (фосфатно-солевой буфер).
Примечание: Мы использовали gadoteridol, и вводили 0,2 ммоль / кг в 0,15 мл PBS в течение 15 сек (0,1 мл / с). - Подготовьте микро-Полиэтилен трубку (длина: 7,62 мм, внутренний диаметр: 0,28 мм, Внешний диаметр: 0.64 мм). Вставка 30 G иглу (12,7 мм длины) в один конец трубки, и 30 г тупым кончиком иглы (9,5 мм) длиной в другом конце. Подключите 1 мл шприц, содержащий МР контрастного агента, чтобы тупой конец иглы, и слегка надавите на шприц, чтобы заполнить всю трубу с МР контрастного агента.
- Обезболить животных с помощью вентиляции с ~ 1 - 2% изофлюрана в смеси с кислородом (2 л / мин) в течение подготовки и обработки изображений. Подтвердите глубину ANESThesia по схождение пинч рефлекса. Применить ветеринарной глазной мази на глазах, чтобы предотвратить сухость в то время как под наркозом. Разбавить в хвостовую вену с помощью тепла лампы перед введением иглы. Возьмите середины 30 G иглы, используя Келли щипцы, и вставьте его в хвостовую вену. Лента и хвост и трубки на кусок пластика или картона бумаги (10 мм ширина х длина 100 мм), чтобы держать хвост прямо.
- Место животное в положении лежа на спине в постели животных оборудованной с циркулирующим теплую воду (или теплый воздух), чтобы регулировать температуру тела во время съемки. Установите температуру на кровати до 37 ° C. Вставьте ректального датчика температуры для контроля температуры тела во время съемки.
- Применить ортогонально изогнутую пластиковую доску в области живота. Убедитесь, что опухоль находится за верхней части доски, а затем опустите доску незначительно (~ 2 мм), чтобы обеспечить опухоль поймали советом. Лента доску животного постели твердо.
- Лента с дыханием площадку преобразовыватьR (SA Инструмент, Inc., Стони Брук, штат Нью-Йорк) на область грудной клетки, чтобы контролировать дыхания животных во время съемки. Поместите поверхности катушки в верхней части области опухоли, и прикрепить ее к постели животных надежно. Нажмите кровати животных в МР-томографа, чтобы разместить область опухоли в центре объема катушки (внутренний диаметр: 72 мм).
- Выполните согласование и тюнинг приемника и передатчика, а затем прокладок.
- Начните с анатомической последовательности МР, чтобы найти опухоль. Используйте T2-взвешенных (T2W) Turbo спин-эхо последовательность, чтобы получить осевые изображения со следующими параметрами приобретения. Время повторения (TR) / Время эхо (TE) = 3000/34 мс, 128 х 128 матрицы, 30 х 30 мм поле зрения, число усреднений = 1, эхо длина поезда = 4 и 20 смежных толщиной 1 мм кусочки в режиме с чередованием, чтобы покрыть всю область опухоли (общее время сканирования: 1,6 мин).
Примечание: С ортотопической опухоли поджелудочной железы труднее быть расположены, чем те, подкожных, обычные Все местныеЗер изображения с более низкое разрешение не может быть полезным. - Приобретать Т1-взвешенные (T1W) изображения с различными флип углов для получения T1 карту. Для этого используйте градиент эхо multiflip угла подхода со следующими параметрами: Время повторения (TR) / Время эхо (TE) = 115/3 мс, 128 х 128 матрицы, а 30 х 30 мм поле зрения, количество средних = 4, ~ 5 - 7 смежных толщиной 1 мм срезов в режиме чересстрочной развёртки, чтобы покрыть область опухоли, и семь углов флип 10, 20, 30, 40, 50, 60 и 70 (общее время сканирования по углу оборотной: 1 мин).
ПРИМЕЧАНИЕ: Однако, multiflip угол подхода является эффективным только тогда, когда B1 однородность поля является высокой. Если нет, то T1 карты могут быть получены с несколькими TR подход вместо 15. - Приобретать T1W изображения до и после гадолиния на основе введения MR контраста. Используйте те же параметры сбора данных и геометрию для отображения T1, но с фиксированным углом флип 30. использовать линейные кодирования для обеспечения устойчивого состояния, когда центр K-пространство получается, особенноecially, когда короткое TR и низкой степени угол флип используются. Приобретать 5 базовых изображения перед инъекцией контраста. Тогда приобрести 40 изображений после инъекции контрастного вещества (общее время сканирования: 45 мин). Использование шприца для введения контрастного вещества с постоянной скоростью (0,01 мл / с).
- Монитор животных дыхание постоянно, и отрегулируйте концентрацию ИФ сохранить частоту дыхания до 50 - 100 вдохов в минуту. Монитор животных температуру тела на протяжении изображений.
- После завершения DCE-MRI, снять иглу и другие зонды, и поместить животное в пустую клетку местная с бумажными полотенцами. Массаж мягко нижней части брюшной полости. Клетка должна быть помещена половину под тепловой лампой, чтобы позволить животному входить и выходить из теплового градиента, как он восстанавливает. Не оставляйте животное без присмотра, пока он не пришел в достаточной сознание поддерживать грудины лежачее положение.
3. Обработка изображений и анализ
- Опухолевые сегмента Еврейской автономной на в T2W изображений. В T2W изображений, интенсивность сигнала в области опухоли ярче, чем окружающие ткани, так что граница опухоли могут быть выделены вручную.
Примечание: Полуавтоматические методы сегментации, такие как глобального порога или активного контура может быть использован 16,17, но интенсивность фона неравномерное должно быть исправлено в особенности при использовании поверхностной катушки. - Создать T1 и плотность протонов карты. В T1W изображений, полученных с эхо последовательности градиента, предполагая, что эхо время (TE) намного меньше, чем T2 * стоимость, значение пиксела определяется
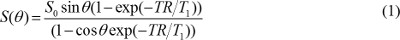
где S 0 плотность протонов, T 1 является постоянной T 1 релаксации, TR является повторение время, и θ является угол флип. Уравнение (1) можно переписать в
641eq2.jpg "/>
когда S (θ) / sinθ заменяется Y, и S (θ) / tanθ заменяется X. Уравнение (2) представляет собой линейное уравнение, и его наклон и перехвата могут быть использованы для получения T1 и S 0 значения, соответственно. - Рассчитать концентрацию контрастности и краснухи в DCE-МРТ. При гадолиния на основе МР контрастный агент вводят, Т постоянная времени релаксации 1 изменяется с течением времени. Таким образом, уравнение (1) можно переписать в
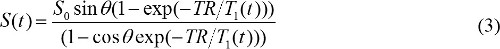
T 1 (T) связана с г-ном концентрации контрастного, C (T), а именно,
где R 1 является продольным релаксация МР контрастного агента. Таким образом, путем объединения уравнений (3) и (4), концентрация контраст МР определяется
- Количественной оценки фармакокинетических параметров МР контрастный агент. С р (Т) представляет концентрацию контрастности и краснухи в плазме крови в момент времени T после начала инъекции контраста. С р (Т) называется артериальной функция входа (AIF). Если AIF доступен, фармакокинетические параметры МР контрастного агента можно рассчитать путем
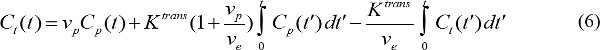
где С т (т) является концентрация контраст MR в ткани-мишени, v р, является дробным объем плазмы крови, v е дробно внесосудистая объема внеклеточной жидкости и K Транс коэффициент передачи звука. Flux константа скорости, к ЕР, равна K Tranы делится на V E. Если AIF не доступен, то модель опорной области может быть использован вместо 18,19. Модель опорной области на основе потока ограниченной Kety модели 20 и использует концентрации контрастного в эталонной области, чтобы устранить необходимость в AIF, как следует,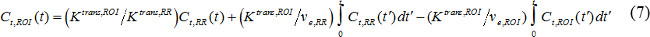
где С т, ROI (т), К транс, ROI и V е, ROI являются концентрации контраст, объем передачи постоянной и дробно-внесосудистая внеклеточного объема, соответственно, в области интереса (ROI), в то время как C T, RR (T), K транс, РР, и v е, RR являются те, в области сравнения. Паравертебральная мышцы часто выбирают в качестве опорного региона и л е, Р. Р. у мышей годовыхПредполагается, ravertebral мышцы неизменными на 0,08 21. Мы использовали модель опорной области.
Результаты
Человеческие клетки опухоли поджелудочной железы успешно расти в поджелудочной железы мыши создание солидной опухоли. Рисунок 1 приведены фотографии (А) нормальные поджелудочной железы, где раствор опухолевых клеток вводят, и (В) представитель мыши подшипника ортотопической...
Обсуждение
Мы ввели подробные методы ортотопического моделирования опухоли поджелудочной железы с помощью иммунодефицитных мышей, DCE-MRI опухолей брюшной полости у мышей и количественную оценку его кинетических параметров. В ортотопического поджелудочной моделирования опухоли, необходимо поза...
Раскрытие информации
Authors do not have any conflicts of interest to declare.
Благодарности
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
Ссылки
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены