Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Contraste dynamique amélioré imagerie par résonance magnétique d'un modèle orthotopique cancer du pancréas de souris
Dans cet article
Résumé
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Résumé
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Introduction
L'objectif global de cette méthode consiste à appliquer un contraste amélioré imagerie par résonance magnétique dynamique (DCE-MRI) pour des xénogreffes de tumeurs pancréatiques orthotopiques chez la souris. DCE-MRI est une méthode non invasive pour évaluer microvascularisation dans un tissu cible en contrôlant la variation de contraste MR sur une certaine période de temps après l'injection. DCE-MRI a été utilisée pour diagnostiquer des tumeurs malignes et pour évaluer la réponse de la tumeur à divers traitements 4.1. Quantitative DCE-MRI a présenté une reproductibilité élevée 5. Pour quantifier les paramètres pharmacocinétiques d'un agent de contraste pour MR dans un tissu cible, toutes les images DCE-RM acquises à différents points dans le temps et T1 carte obtenues avant l'injection de contraste doivent être recalées 6. Toutefois, en raison de mouvements respiratoires et péristaltiques dans la région abdominale, quantitative DCE-MRI a eu une application limitée pour les tumeurs gastro-intestinales.
Des modèles de tumeurs du pancréas orthotopique ont été utilisées pour évaluerréponse pancréatique-tumorale après des thérapies biologiques et chimiothérapies 7,8. Des modèles de tumeur orthotopique sont considérés comme supérieurs aux modèles sous-cutanés classiques, étant donné que le micro-environnement dans le site de la tumeur d'origine est réfléchie et de ce fait la réponse tumorale à la thérapie humaine peut être prédit de façon plus précise. Cependant, le pancréas de souris se trouve dans le quadrant supérieur gauche de l'abdomen, de sorte quantitative DCE-MRI de xénogreffes de tumeurs pancréatiques orthotopique chez la souris n'a pas été mis en oeuvre facilement.
Nous avons établi un protocole de DCE-MRI des tumeurs abdominales chez la souris en fixant les tumeurs en utilisant une carte en plastique orthogonalement plié pour empêcher le transfert de mouvement à partir de la région de la poitrine 9. La pression appliquée par ce forum a été localisé sur la zone abdominale, et n'a pas donné lieu à des difficultés respiratoires. Une technique image coregistration automatisé a été validée pour DCE-MRI des organes abdominaux dans un mode libre-respiratoire, mais il effectue effectively seulement quand les régions cibles se déplacent lentement et régulièrement 10. La fréquence respiratoire des animaux est variable au cours de l'imagerie, de retenue afin physique dans la région abdominale sera nécessaire de récupérer les paramètres pharmacocinétiques fiables dans les modèles de souris de tumeurs pancréatiques orthotopiques. Nous avons quantifié avec succès les paramètres pharmacocinétiques d'un agent de contraste IRM dans les xénogreffes de tumeurs pancréatiques orthotopiques utilisant la carte en plastique orthogonalement plié dans DCE-MRI 11-13. Ici, nous présentons la procédure détaillée de la modélisation de la tumeur du pancréas orthotopique, DCE-MRI des xénogreffes de tumeurs chez la souris, et la quantification des paramètres pharmacocinétiques.
Protocole
Toutes les procédures ont été approuvées par le soin et l'utilisation des animaux Commission institutionnelle à l'Université d'Alabama à Birmingham.
Modélisation 1. Orthotopique pancréatique tumeurs Souris
- Culture des lignées cellulaires cancéreuses humaines pancréatiques-standard dans du milieu de Eagle modifié par Dulbecco (DMEM) supplémenté avec du sérum bovin fœtal à 10%. Maintenir toutes les cultures à 37 ° C dans une atmosphère humidifiée avec 5% de CO 2.
- Utilisez 8-10 souris femelles graves semaine-vieux combinés immunodéficients. Placez les cages des animaux à 12 heures de lumière et le cycle de l'obscurité de 12 heures à température ambiante (21 ± 2 ° C) et 60% d'humidité.
- Anesthésier les animaux en utilisant une ventilation avec 2% d'isoflurane mélangé avec de l'oxygène (2 L / min) pendant toute la chirurgie. Confirmer la profondeur de l'anesthésie par pincement de l'orteil réflexe. La place des animaux sur un coussin chauffant (37 ° C) pour maintenir la température du corps. Appliquer une pommade ophtalmique vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie. &# 160;
- Enlever les poils dans le quadrant supérieur gauche de l'abdomen de chaque souris, et de donner un médicament analgésique (carpofen, 5 mg / kg de poids corporel sous-cutanée) dans la région. Appliquer une solution de bétadine sur la peau exposée. Préparer instruments chirurgicaux autoclave.
- Faire une incision de 1 cm dans la peau et du péritoine en utilisant l'iris ciseaux droits. Retirez délicatement le pancréas de l'abdomen en utilisant des pinces chirurgicales.
- Introduire 28 G aiguille d'une seringue 0,5 ml d'insuline dans la queue du pancréas et infuser ensuite lentement une solution de 2,5 millions de cellules cancéreuses pancréatiques humaines dans 30 pl de DMEM. Assurez-vous que une petite cloque se forme dans la tête du pancréas par la solution.
- Placez délicatement le pancréas dans l'abdomen en utilisant des pinces chirurgicales. Fermez le péritoine et la peau dans une couche avec deux interrompu 5-0 sutures Prolene, puis mettre fin à l'anesthésie. Ne retournez pas un animal qui a subi une intervention chirurgicale à la compagnie d'autres animaux jusqu'à guérison complète.60; Retirer sutures à la chirurgie de poste 7 ~ 10 jours.
- Donner une autre dose du médicament analgésique (carpofen, 5 mg / kg de poids corporel sous-cutanée) à 24 h après la chirurgie.
- Vérifiez la taille de la tumeur en palpant la zone de la chirurgie en utilisant deux doigts. Les tumeurs se sentent généralement plus dense et plus bosselée que les tissus et organes environnants. Habituellement, cela prend ~ 1-2 semaines pour commencer à se sentir une tumeur.
- De surveiller les animaux quotidiennement les signes de la maladie. Lorsque les animaux apparaissent (comportements de toilettage et d'évitement normales manque) malades, nous les résilié par dislocation cervicale sous anesthésie.
2. imagerie par résonance magnétique
- Appliquer IRM lorsque la taille de la tumeur est d'environ 5-7 mm de diamètre en général à 2 ~ 4 semaines après l'implantation des cellules. Utilisez un scanner RM dédiée à l'imagerie du petit animal ou un scanner RM clinique équipée d'une bobine spécialisé pour l'imagerie du petit animal.
NOTE: Nous avons utilisé un petit animal MR scanner 9.4T avec une combinaison d'un volume résonateur 1 H/ Émetteur et un récepteur de bobine de surface (30 mm de diamètre) (Bruker BioSpin Corp., Billerica, MA). Une bobine de surface offre une meilleure rapport (SNR) 14 signal-sur-bruit. - Préparer un agent de contraste IRM à base de gadolinium à injecter ~ de 0,1 à 0,2 mmol / kg à chaque animal dans ~ 0,1 au 0,2 ml de PBS (tampon phosphate salin).
NOTE: Nous avons utilisé gadotéridol, et injecté 0,2 mmol / kg dans 0,15 ml de PBS sur une période de 15 sec (0,1 ml / sec). - Préparer un tube micro-polyéthylène (longueur: 7,62 mm, diamètre intérieur: 0,28 mm, diamètre extérieur: 0,64 mm). Insérez une aiguille 30 G (longueur de 12,7 mm) dans une extrémité du tube, et une aiguille de 30 G émoussée de pointe (9,5 mm de longueur) dans l'autre extrémité. Connecter une seringue de 1 ml contenant MR agent de contraste à l'aiguille de pointe émoussée, et poussez lentement la seringue pour remplir le tube entier avec l'agent de contraste MR.
- Anesthésier des animaux à l'aide de la ventilation avec ~ 1 - 2% d'isoflurane mélangé avec de l'oxygène (2 L / min) tout au long de la préparation et de l'imagerie. Confirmer la profondeur de anesthesia par pincement de l'orteil réflexe. Appliquer une pommade ophtalmique vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie. Dilater la veine caudale en utilisant une lampe de chaleur avant l'insertion de l'aiguille. Prenez le milieu de l'aiguille de 30 G en utilisant une pince Kelly, et l'insérer dans la veine de la queue. Bande fois la queue et le tube sur un morceau de plastique ou de papier de carton (10 mm de largeur x 100 mm de longueur) pour garder la queue droite.
- Placez l'animal en position couchée dans un lit de l'animal équipé d'une circulation d'eau chaude (ou air chaud) pour réguler la température du corps pendant l'imagerie. Régler la température sur le lit à 37 ° C. Insérer une sonde de température rectale à surveiller la température du corps lors de l'imagerie.
- Appliquer une carte en plastique orthogonalement plié dans la région abdominale. Assurez-vous que la tumeur est située derrière l'extrémité supérieure de la planche, puis déroulez le bord légèrement (~ 2 mm) pour assurer la tumeur est pris par le conseil. Collez le conseil au lit animal fermement.
- Tape à transduce pad de la respirationr (SA Instrument, Inc., Stony Brook, NY) sur la région de la poitrine de surveiller la respiration de l'animal lors de l'imagerie. Placez une bobine de surface sur le dessus de la région de la tumeur, et la bande au lit animal fermement. Appuyez sur le lit animal dans le scanner MR de placer la région de la tumeur à l'axe de la bobine de volume (diamètre intérieur: 72 mm).
- Effectuer adaptation et d'accord à la fois pour l'émetteur et le récepteur, suivi par calage.
- Commencer avec une séquence d'MR anatomique pour localiser la tumeur. Utilisez une séquence d'écho de spin (T2) turbo T2 pour obtenir des images axiales avec les paramètres d'acquisition suivantes. temps de répétition (TR) / temps d'écho (TE) = 3000/34 ms, 128 x 128 matrice, le terrain de 30 x 30 mm de vue, nombre de moyennes = 1, écho longueur du train = 4, et 20 contiguës 1 mm tranches épaisses dans un mode entrelacé pour couvrir toute la région de la tumeur (durée totale du balayage: 1,6 min).
Remarque: Comme les tumeurs pancréatiques orthotopique sont plus difficiles à se trouver que celles sous-cutanées, locali conventionnelzer images ayant une résolution inférieure peuvent ne pas être utile. - Acquérir (en T1) images pondérées en T1 avec différents angles bascules pour récupérer T1 carte. A cet effet, utiliser un écho de gradient approche angle multiflip avec les paramètres suivants: temps de répétition (TR) / temps d'écho (TE) = 115/3 ms, 128 x 128 matrice, un terrain de 30 x 30 mm de vue, nombre de moyennes = 4, ~ 5-7 contigus 1 mm d'épaisseur des tranches en mode entrelacé pour couvrir la région de la tumeur, et sept angles de bascule de 10, 20, 30, 40, 50, 60, et 70 (temps total de balayage par angle de bascule: 1 min).
NOTE: Cependant, l'approche de l'angle multiflip ne est efficace que lorsque le champ B1 homogénéité est élevé. Si non, cartes T1 peut être obtenu avec l'approche de TR multiples au lieu de 15. - Acquérir des images en T1 avant et après injection de contraste MR à base de gadolinium. Utilisez les mêmes paramètres d'acquisition et de la géométrie pour la cartographie de T1, mais avec l'angle de bascule fixe de 30. Utiliser le codage linéaire pour assurer l'état d'équilibre lorsque le centre de l'espace k est obtenu, especially lors d'un court TR et un angle de bascule de faible degré sont utilisés. Acquérir cinq images de référence avant l'injection de contraste. Puis acquérir 40 images après injection de contraste (durée totale du balayage: 45 min). Utilisation d'une pompe à seringue pour injecter l'agent de contraste à une vitesse constante (0,01 ml / sec).
- Contrôler la respiration animale continue, et ajuster la concentration de l'isoflurane pour maintenir le taux respiratoire de 50 à 100 respirations par minute. Surveiller la température du corps des animaux tout au long de l'imagerie.
- Après avoir terminé DCE-MRI, enlever l'aiguille et d'autres sondes, et placer l'animal dans une cage vide lits avec des serviettes en papier. Masser doucement la zone inférieure de l'abdomen. La cage doit être placée moitié sous une lampe chauffante pour permettre à l'animal de se déplacer dans et hors du gradient thermique tel qu'il récupère. Ne pas laisser un animal sans surveillance tant qu'il a repris conscience suffisante pour maintenir décubitus sternal.
3. Traitement et analyse d'images
- REGI Segment tumorales dans les images T2. Dans images pondérées en T2, l'intensité du signal dans la région de la tumeur est plus brillante que celle de tissus environnants, de sorte que la limite de la tumeur peut être délimitée manuellement.
REMARQUE: techniques de segmentation semi-automatiques comme seuil global ou contour actif peuvent être utilisés 16,17, mais l'intensité de fond inégale doivent être corrigées surtout quand une bobine de surface est utilisé. - Créez des cartes T1 et densité de proton. En pondération T1 images acquises avec une séquence d'écho de gradient, en supposant que le temps d'écho (TE) est bien inférieure à la valeur T2 *, la valeur de pixel est déterminée par
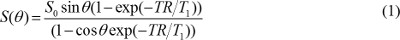
où S 0 est la densité de protons, T 1 T est une constante de temps de relaxation, TR est le temps de répétition, et θ est un angle de bascule. L'équation (1) peut être réécrite à
641eq2.jpg "/>
lorsque S (θ) / sin est remplacée par Y et S (θ) / tanθ est remplacé par X. L'équation (2) est une équation linéaire, et sa pente et l'interception peut être utilisé pour récupérer T1 et S 0 valeurs, respectivement. - Calculer M. concentration de contraste des images DCE-MR. Lorsque le gadolinium à base d'agents MR de contraste est injecté, T 1 de relaxation constante de temps est modifié au fil du temps. Donc, l'équation (1) peut être réécrit pour
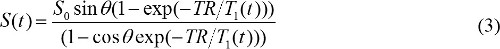
T 1 (t) est en relation avec la concentration de contraste RM, C (t), comme suit,
où r 1 est la relaxivité longitudinale d'agent de contraste RM. Ainsi, en combinant les équations (3) et (4), MR concentration de contraste est déterminée par
- Quantifier les paramètres pharmacocinétiques de l'agent de contraste MR. C p (t) présente MR concentration de contraste dans le plasma sanguin à l'instant t après le début de l'injection de contraste. C p (t) est appelée fonction d'entrée artérielle (AIF). Si AIF est disponible, les paramètres pharmacocinétiques de l'agent de contraste RM peuvent être calculées par
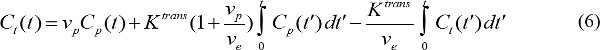
où C t (t) est la concentration de contraste MR dans un tissu cible, p v est le volume de plasma sanguin fractionnée, V e est le volume fractionnel extravasculaire extracellulaire, et K est trans constante de transfert de volume. Flux constante de vitesse, k ep, est égale à K trans divisé par v e. Si AIF ne est pas disponible, alors le modèle de région de référence peut être utilisé à la place 18,19. Le modèle de zone de référence est basé sur le modèle Kety écoulement limité 20 et utilise concentration de contraste dans une région de référence pour supprimer la nécessité d'AIF comme suit,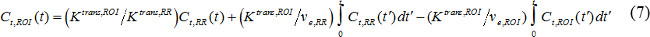
où C t, ROI (t), K trans, ROI, et v e, ROI sont la concentration de contraste, le transfert de volume constant, et le volume de extravasculaire extracellulaire fractionnée, respectivement, dans la région d'intérêt (ROI), tandis que C t, RR (t), K trans, RR, et v e, RR sont ceux de la région de référence. Musculaire paravertébrale est souvent choisi comme région de référence, et v e, RR dans murin paravertebral musculaire est supposé être constant à 0,08 21. Nous avons utilisé le modèle de région de référence.
Résultats
Des cellules tumorales pancréatiques humaines se développer avec succès dans le pancréas de souris créant une tumeur solide. La figure 1 représente des photographies de (A) un des pancréas normal où la solution de cellules tumorales est injecté, et (B) une souris représentant portant une xénogreffe de tumeur du pancréas orthotopique (MIA PACA-2 ). Tumeur est située dans le quadrant supérieur gauche de l'abdomen, à côté de la rate. Il prend habituellement 2-4 semaines pour que les tu...
Discussion
Nous avons introduit les méthodes détaillées de la modélisation de tumeur pancréatique orthotopique utilisant des souris immunodéficientes, DCE-MRI des tumeurs abdominales chez la souris, et la quantification de ses paramètres cinétiques. Dans la modélisation de tumeur pancréatique orthotopique, il faut prendre soin lors de l'insertion d'une aiguille dans la queue du pancréas. En cas de succès, les cellules seront transférées à la tête du pancréas créer une petite bulle. Lors de l'applicati...
Déclarations de divulgation
Authors do not have any conflicts of interest to declare.
Remerciements
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30 G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
Références
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon