A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مستقر وكفاءة التحوير الوراثي للخلايا في الكبار ماوس V-SVZ لتحليل العصبية الخلايا الجذعية الذاتية الحكم والآثار لغير المتمتعة بالحكم الذاتي
In This Article
Summary
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Abstract
نسبيا هادئة الخلايا الجذعية الجسدية تدعم تجديد الخلايا مدى الحياة في معظم أنسجة البالغين. وتقتصر الخلايا الجذعية العصبية في البالغين أدمغة الثدييات لاثنين من منافذ العصبية محددة: منطقة جزئي التحبب من التلفيف المسنن في قرن آمون ومنطقة البطين subventricular (V-SVZ، وتسمى أيضا منطقة تحت البطانة العصبية أو المناطق الاقتصادية الخاصة) في جدران الجانبية البطينين. تطوير في الجسم الحي استراتيجيات نقل الجينات للسكان الخلية الجذعية البالغة (أي تلك التي أدمغة الثدييات) مما أدى إلى التعبير على المدى الطويل من الجينات المحورة المطلوب في الخلايا الجذعية وذريتها المشتقة هي أداة حاسمة في مجال البحوث الطبية الحيوية والتكنولوجيا الحيوية الحالي. هنا، يتم تقديم الطريقة المباشرة في الجسم الحي للتعديل الجيني مستقر من خلايا-V SVZ الماوس الكبار أن يستفيد من العدوى دورة مستقلة الخلية لفس والتهندس الخلوي درجة عالية من التخصص من مكانة-V SVZ. على وجه التحديد، والبروتوكول الحالي ينطويق حقن لفس فارغة (السيطرة) أو لفس ترميز أشرطة التعبير التحوير معين إما إلى V-SVZ نفسها، لفي الجسم الحي استهداف جميع أنواع الخلايا في محراب، أو في تجويف البطين الجانبي، لاستهداف البطانة العصبية الخلايا فقط. ثم يتم دمج أشرطة التعبير في جينوم الخلايا transduced والبروتينات الفلورية، المشفرة أيضا لفس، والسماح للكشف عن الخلايا transduced لتحليل الخلية آثار المستقلة وغير المستقلة، التي تعتمد على مكانة في الخلايا المسمى والخاصة ذرية.
Introduction
والبطين subventricular منطقة الفئران (V-SVZ)، في جدران البطين الجانبي التي تواجه المخطط، هي منطقة جرثومي نشطة جدا فيه عملية مستمرة من تكرار خلية سلفية والتمايز النتائج في إنتاج مستمر من البصلة الشمية (OB ) interneurons و oligodendrocytes جسم الثفني 1. يظهر جيل مدى الحياة من هذه الخلايا لتكون معتمدة من قبل وجود في هذه المنطقة من الخلايا الجذعية العصبية (NSCs، وتسمى أيضا الخلايا B1)، والتي تعبر عن مستضد نجمي الخلايا ييفي الدبقية البروتين الحمضية (GFAP) ووقف علامات الخلية مثل nestin، ID1 وSox2 2. GFAP، معربا عن الخلايا B1 تولد عبور تضخيم السلف (وات) الخلايا (خلايا C)، التي تعبر عن النسخ عوامل Dlx2 (القاصي أقل علبة مثلية 2) وAscl1 (الثدييات-achaete شووت homolog 1) والانقسام بسرعة عدة مرات قبل أن تؤدي لالمهاجرة neuroblasts (خلايا) أو oligodendroblasts 3. حديثا ولدت-prolifneuroblasts erative تهاجر الأمامية، وتشكيل تيار الهجرة منقاري (RMS) إلى OB، حيث الاندماج في منطقة الحبيبية وطبقات الكبيبي كما interneurons المثبطة متباينة. المهاجرة oligodendroblasts الشباب الانتقال إلى CC، حيث تصبح غير ناضجة الخلايا NG2 الإيجابي الذي يستمر لتقسيم محليا أو تفرق في الخلايا قليلة التغصن myelinating ناضجة 1،4.
خلايا B1، التي تستمد من الخلايا الدبقية شعاعي الجنين، في الحفاظ على التشكل ممدود والاستقطاب أسلافهم وتظهر علاقة متخصصة للغاية مع مكانها المناسب. انها تمتد بين بطانة عصبية الذي يصطف البطين وشبكة من الأوعية الدموية التي تروي المتخصصة-V SVZ. عملية قمي صغيرة من الخلايا intercalates B1 بين ependymocytes multiciliated وتنتهي في هدب أساسي واحد غير متحرك، في حين أن عملية القاعدية التي تمتد لمسافات طويلة للاقتراب من الضفيرة الوعائية مستو الذي يروي هذا المتخصصة تنتهي في بالصفيحة العسل من الشعيرات الدموية الضفيرة 2،5-8.
الطريقة الأكثر موثوقية للتمييز B1-NSCs من الخلايا النجمية غير العصبية، والتي هي أيضا GFAP +، في محراب-V SVZ سليمة تقوم على كامل جبل الاستعدادات من البطين الجدار الجانبي وتحليل من قبل 3-D متحد البؤر المجهري بعد المناعية لGFAP لتسمية رقيقة B1-NSC عملية قمي، β-كاتينين لتحديد أغشية الخلايا، وإما γ تويولين كعلامة الهيئات القاعدية الهدبية أو الأسيتيل α تويولين لتسمية مدى كل هدب 5،8. وأشارت ملاحظات هذه يتصاعد كلها من سطح البطين أن الخلايا B1 و البطانة العصبية مرتبة في "دواليب الهواء" 5، والتي هي مطوقة العمليات قمي uniciliated من واحد أو عدة GFAP + B1 الخلايا وردة من خلايا البطانة العصبية multiciliated.
مورفولوجيا مميزة من الخلايا B1 يرتبط مع الأدلة التجريبية طndicating أن الأوعية الدموية / الخلايا البطانية والبطين السائل النخاعي (CSF) تشكل مصادر ينظم إشارات القابلة للذوبان التي تعمل على NSCs 2،6،9-11. على السطح البطيني، مثلي النمط والتفاعلات الجانبية apico غيروي التي تنطوي على خلايا البطانة العصبية وB1 تشمل منعطفات ضيقة والملتصقة تقاطعات 5،12. وعلاوة على ذلك، جزيئات الالتصاق المتورطين في المجمعات صلي بين الخلايا B1 و البطانة العصبية، مثل N-كادهيرين وV-CAM، وقد تبين لتنظيم ليس فقط المواقع منظم للغاية من B1 في محراب-V SVZ، ولكن أيضا هدوء من 12 13. تظهر الخلية أحادي الطبقة البطانة العصبية-B1 ليكون بمثابة حاجز نشر السماح للتدفق منظم من الماء وجزيئات صغيرة من السائل النخاعي، ولكن تقييد مرور بين الخلايا البروتينات الكبيرة 10،11. وتشير الأدلة التجريبية أن الخلية B1 هدب قمي في موقع فريد يمكن أن تلعب دورا كجهاز استشعار من الإشارات البروتينية الموجودة في السائل النخاعي 2،5-7. خلايا البطانة العصبية هي، في حد ذاته، وهو أيضا مصدر إشارات قابلة للذوبان وبغشاء التي لها دور في تنظيم السلوك مجلس الأمن القومي 14،15.
نوكليوسدس يمكن تتبعها، مثل برومو deoxyuridine (BrdU)، أو الفيروسات القهقرية وقد استخدمت على نطاق واسع لتسمية الخلايا الاصلية، بما في ذلك NSCs، في الجسم الحي. ومع ذلك، وهذه الأساليب ليست الأمثل لتتبع مصير طويلة الأجل لإشارات BrdU تمييع خلال انقسامات الخلية المتكررة والفيروسات القهقرية يبدو أنها تستهدف بشكل تفضيلي عابر تضخيم الخلايا بسبب احتياجاتهم من تكاثر الخلايا لالتنبيغ 16،17. لدراسة علم وظائف الأعضاء في مجلس الأمن القومي في الجسم الحي، بما في ذلك التفاعل مع المكونات المتخصصة، لا بد من وضع طريقة لتسمية وتعقب خلايا نادرا تقسيم، كما B1-NSCs هي هادئة إلى حد كبير وخلايا البطانة العصبية المجاورة لها أبدا تقسيم في ظل الظروف الفسيولوجية 3. هنا، وتبين لنا أن ناقلات lentiviral (لفس) تسمح للعلامة الجينات ذات الكفاءة العاليةجي والتعديل على المدى الطويل من NSCs الكبار وعدم تقسيم خلايا البطانة العصبية، ويرجع معظم معقول لقدرتها على تنبيغ وعلى الاندماج في جينوم الخلايا المستهدفة بطريقة دورة مستقلة الخلية. وعلاوة على ذلك، وتبين لنا كيف أن مسار تسليم والفيروسية عيار تساعد على تنبيغ تحديدا خلايا البطانة العصبية، ولكن ليس على الخلايا B1 مما يسمح للتحليل التي تعتمد على محراب، والآثار البطانة العصبية على NSCs.
Protocol
الأخلاق بيان: هذا البروتوكول يتبع المبادئ التوجيهية رعاية الحيوان من جامعة فالنسيا في الامتثال مع التوجيه الأوروبي 2010/63 / الاتحاد الأوروبي.
1. توليد LV لفي فيفو وسم الدراسات (انظر الشكل 1A)
تنبيه: الإجراء الموصوفة هنا هو مستوى السلامة الحيوية 2، وبالتالي تنفيذ كافة الإجراءات التالية في غطاء بيولوجية. تأكد من أن أفراد البحث والمؤهلين والمدربين في جميع الإجراءات. ارتداء معدات الوقاية الشخصية، بما في ذلك ثوب، قفازات مزدوج وحماية العين المناسبة. وأخيرا، تطهير شاملة في جميع الأدوات والأسطح التي يمكن أن يكون على اتصال مع الفيروسات وفقا للممارسات التطهير مرفق معتمد (عن طريق المسح مع الايثانول 70٪، 10٪ التبييض و / أو التعقيم).
- إنتاج LV في الجنينية البشرية خلايا الكلى 293T
- بدء هذا البروتوكول من خلال إعداد الحمض النووي النقي لترنسفكأيشن. إعداد وتنقية كل البلازميد بالنقر المزدوج غراد CSCLالطرد المركزي ient أو غيرها من وسائل العمود المتاحة تجاريا العائد الحمض النووي خالية من الذيفان الداخلي. في هذا البروتوكول استخدمنا نقل ناقلات البلازميد pRRL-SIN-PPT.PGK.EGFP.Wpre. أوصى البلازميدات التعبئة والتغليف الأساسية هي pMDLg / pRRE وpRSV.REV ومغلف البلازميد pMD2G 13،18،19.
- أربع وعشرين ساعة قبل ترنسفكأيشن، لوحة 5 × 10 6 293T الخلايا في Iscove في التعديل Dulbecco والمتوسطة (IMDM) (انظر الجدول المواد) في طبق من البلاستيك 10 سم من أجل الحصول على ثقافة ما يقرب من 1/4 إلى 1/3 متموجة ل ترنسفكأيشن. احتضان عند 37 درجة مئوية في حاضنة مرطب في جو من 5-7٪ CO 2.
- استبدال المتوسطة مع الطازجة المتوسطة 2 ساعة قبل ترنسفكأيشن.
- في مزيج أنبوب microcentrifuge 1.5 مل العقيمة 10 ميكروغرام البلازميد نقل ناقلات (التي تحتوي على كدنا] من التحوير أو shRNA ليتم تسليمها) مع 2.5 ميكروغرام من pRSV.REV و 5 ميكروغرام من البلازميدات pMDLg / pRRE التعبئة والتغليف، و 3.5 & #181؛ ز من البلازميد المغلف pMD2G. تشكل الحل البلازميد الحجم النهائي من 450 ميكرولتر مع العازلة 0.1X TE (انظر الجدول المواد) / درهم 2 0 (2: 1). ثم إضافة 50 ميكرولتر من 2.5 M CaCl 2.
- تشكل راسب بإضافة قطرة قطرة من 500 ميكرولتر من 2X HEPES مخزنة المالحة (HBS، انظر الجدول المواد) حل ل500 ميكرولتر الحمض النووي TE-CaCl 2 خليط بينما vortexing لبأقصى سرعة.
- إضافة راسب إلى الخلايا 293T على الفور. دوامة بلطف لوحة لالمزيج. عودة إلى الخلايا الحاضنة وتغيير المتوسطة 14-16 ساعة بعد ترنسفكأيشن.
- جمع supernatants خلية 30 ساعة بعد تغيير وسائل الإعلام. تصفية طاف من خلال مرشح النيتروسليلوز 0.22 ميكرون المسام، والشروع في تركيز.
- تركيز لفس
- تركيز المتوسطة مشروطة تنبيذ فائق في 50000 x ج (19،000 دورة في الدقيقة مع SW-28 نابذة الدوار) لمدة 2ساعة في درجة حرارة الغرفة (RT) في 30 مل البولي بروبلين شفافة أنبوب الدوار مخروطي الشكل.
ملاحظة: استخدام محولات نابذة للأنابيب الدوار المخروطية (انظر الجدول المواد). - تجاهل supernatants من قبل الصب و resuspend الكريات في حجم صغير (200 ميكرولتر أو أقل إذا تم تنفيذ الطرد المركزي واحد فقط) من الفوسفات عازلة المالحة (PBS، انظر جدول المواد). ثم ماصة صعودا وهبوطا نحو 20 مرات.
- تجمع الايقاف والتركيز مرة أخرى من قبل تنبيذ فائق، كما في 50000 ز س (23،000 دورة في الدقيقة مع SW-55 نابذة الدوار) لمدة 2 ساعة في درجة حرارة الغرفة. استخدام البولي بروبلين أنابيب الدوار شفافة مع حجم الاسمية من 5 مل (انظر الجدول المواد).
- resuspend الكرية النهائي في حجم صغير جدا (1/500 أو 1/1000 من حجم بدءا من المتوسط) من برنامج تلفزيوني العقيمة ويهز على عجلة دوارة لمدة 1 ساعة على RT. تنقسم إلى قسامات صغيرة (5-20 ميكرولتر) و freeze لهم في -80 درجة مئوية.
- علاج جميع أنابيب فارغة مع التبييض 10٪ قبل رميه.
- تركيز المتوسطة مشروطة تنبيذ فائق في 50000 x ج (19،000 دورة في الدقيقة مع SW-28 نابذة الدوار) لمدة 2ساعة في درجة حرارة الغرفة (RT) في 30 مل البولي بروبلين شفافة أنبوب الدوار مخروطي الشكل.
- Lentiviral المعايرة باستخدام التدفق الخلوي
- قبل يوم واحد، لوحة 5 × 10 4 خلايا هيلا لكل بئر في لوحات زراعة الأنسجة 6-جيدا في 2 مل التعديل المتوسطة Dulbecco والنسر (DMEM) (انظر الجدول المواد). احتضان عند 37 درجة مئوية في حاضنة مرطب في جو من ثاني أكسيد الكربون 05-07 فبراير٪ لمدة 24 ساعة.
- في يوم المعايرة، أذاب an قسامة من المخزون الفيروسي وإعداد التخفيفات المسلسل في الفترة من 10 إلى 10 -3 -8، في DMEM.
- للقيام بذلك، واتخاذ 24 لوحة جيدا وإضافة 2 مل من DMEM لأول بئر و 1.8 مل إلى آبار التالية. ثم يضاف إلى البئر الأولى 2 ميكرولتر من الأسهم الفيروسية المركزة (لتخفيف النهائي من 1: 1000 أو 10 -3).
- بعد pipetting لعدة مرات لمزيج دقيق الحل، تغيير معلومات سرية ونقل 200 ميكرولتر من التخفيف 10 -3إلى البئر الثانية. كرر الإجراء بشكل متسلسل في الآبار التالية حتى يتم إجراء 10 -8 التخفيف.
- أخذ خلايا هيلا مطلي في اليوم السابق من الحاضنة. إزالة بعناية متوسطة من الآبار. إضافة 1 مل من كل تخفيف الفيروسي مع 1 ميكرولتر من 8 ملغ / مل hexadimethrine بروميد إلى الآبار التي تحتوي على خلايا هيلا. دوامة بلطف لوحة لالمزيج.
ملاحظة: يتم إضافة بروميد Hexadimethrine لزيادة امتصاص الفيروس إلى الخلايا في الثقافة. - عودة إلى الخلايا الحاضنة والسماح للعدوى والمضي قدما لمدة 72 ساعة. بعد ذلك، وإزالة المتوسطة، وغسل خلايا مرة واحدة مع برنامج تلفزيوني وإضافة 200 ميكرولتر من التربسين-EDTA (انظر الجدول المواد) إلى كل بئر.
- بعد 5 دقائق عند 37 درجة مئوية، إضافة 2 مل من برنامج تلفزيوني على كل الخلايا بشكل جيد والحصاد في التدفق الخلوي الأنابيب.
- أجهزة الطرد المركزي في 300 × ز لمدة 5 دقائق على RT ونضح طاف.
- Resuspend وبيليه مع 1 مل من تحديد solutiعلى (1٪ الفورمالديهايد الإلكترون المجهري الصف و 2٪ مصل بقري جنيني في برنامج تلفزيوني)، ثم دوامة الأنابيب.
- تحليل الخلايا في قياس التدفق الخلوي باستخدام 488 نانومتر الأرجون ionlaser في 15 ميجاوات.
- إعداد وثيقة مع التكوين القياسية: إلى الأمام مبعثر (FS)، جنبا إلى مبعثر (SS)، ومضان لGFP (525/40 نانومتر). حدد النابضة سكان الخلية في FS مقابل SS نقطة مؤامرة لاستبعاد المجاميع الخلية والحطام. جمع مضان في مقياس لوغاريتمي. احسب عدد GFP + الخلايا في كل عينة.
- حساب ناقلات عيار باستخدام الصيغة التالية:٪ GFP + / 100 × عدد الخلايا المصابة س عامل التخفيف (DF) = وحدات transducing (TU) / مل.
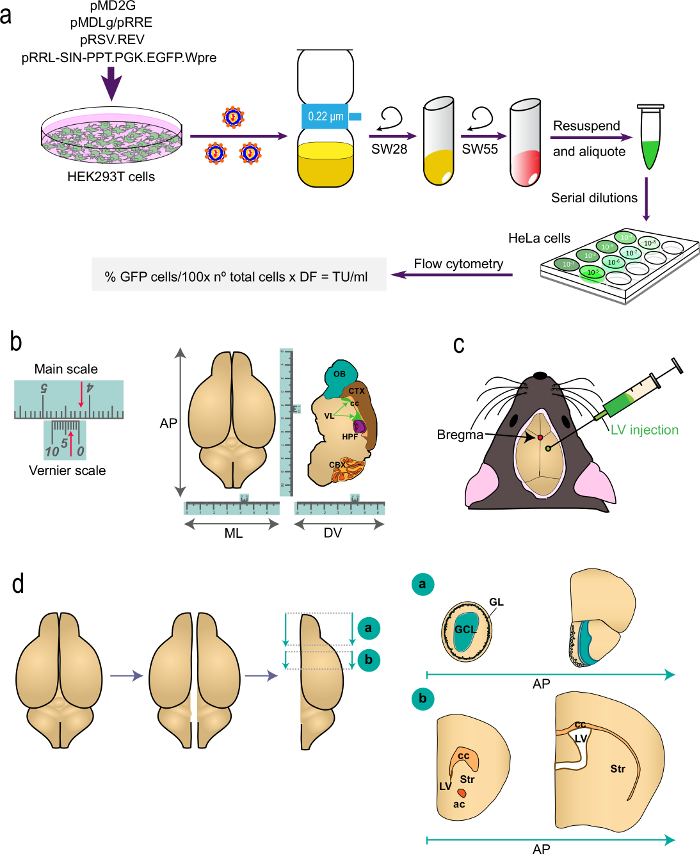
الشكل 1: تمثيل تخطيطي لأجزاء مختلفة من الإجراء (أ) الجزء 1 ر.كان بروتوكول: جيل من لفس لفي الدراسات المجراة وضع العلامات، من ترنسفكأيشن من الخلايا HEK293T مع البلازميدات المناسبة لتوليد لفس لتحديد عيار الفيروس عن طريق التدفق الخلوي باستخدام الصيغة المشار إليها. يشار إلى أسماء البلازميدات ومراوح الطرد المركزي. (ب) و (ج) الجزء 2 من البروتوكول: حقن التجسيمي من لفس. "ب" يصور مثال على نطاق ورنيه، وهو الجهاز الذي هو جزء من أدوات التجسيمي ويعمل لقياسات دقيقة. وكمثال على ذلك، وتبين الأسهم 4.23 سم. ويستخدم على نطاق ورنيه لتحديد الإحداثيات في انتيرو-الخلفي (ا ف ب)، ميديو الاطراف (ML)، وظهراني بطني (DV) محور كما هو مبين لأعلى عرض (يسار) ولمقطع سهمي (يمين ) من الدماغ. "ج" تدل على موقف bregma كما التقاطع بين الغرز السهمي والإكليلي. يتم حقن لفس باستخدام حقنة. (د) رسومات تخطيطية تبين كيف أنا الدماغق المجهزة للتحليل. يتم تقسيم نصفي الكرة الأرضية، وينقسم كل واحد إلى كتلتين. كتلة "أ"، التي تحتوي على OBS، وينتج عن خفض الاكليلية على مستوى AP الخلفية فورا إلى تقاطع OB مع الدماغ الانتهائي (bregma 2.46 مم، وانظر Paxinos' أطلس للإشارة). وينتج كتلة "ب" من قبل اثنين من التخفيضات الاكليلية، واحد على مستوى الأمامي فقط إلى الجانب الأكثر منقاري من الجسم الثفني (bregma 1.7 ملم)، والثاني على مستوى تقاطع اثنين من البطينات الجانبية (bregma -0.22 مم). GL، طبقة الكبيبي. GCL، طبقة الخلايا الحبيبية. الحادي و، المخطط. سم مكعب، الإحضار الثفني. ميلان، الصوار الأمامي. الوقف، البطين الجانبي.
2. التجسيمي حقن LV في الخامس SVZ / المخطط الحدود أو في البطين الجانبي (انظر الشكل 1B)
- تجهيز
- تعقيم حقنة سعة 5 ميكرولتر مع إبرة قياس 33 عن طريق الرش أسفل الجسم والإبرة مع 70٪ من الإيثانول مع المكبسانسحبت على طول الطريق. نضح مرارا الايثانول من أنبوب microcentrifuge 1.5 مل وإخراج على طول الطريق عدة مرات، وشطف حقنة جيدا بالماء المعقم بعد ذلك. وضع الحقنة جانبا بأمان في غطاء محرك السيارة والثقافة، واتركه حتى يجف.
- إعداد حاوية نفايات بيولوجية مع التبييض 10٪ لحجم مناسب لغمر جميع النفايات الناتجة عن هذا الإجراء (عادة 200 مل في وعاء 500 مل).
- إعداد وسخن 37 درجة مئوية مائي عن طريق ملء حقيبة التخزين البلاستيكية اغلاقها باحكام مع المياه وارتفاع درجات الحرارة إلى 37 درجة مئوية. وهذا سوف يسمح الفئران لاسترداد بعد الحقن.
- إزالة الأسهم الفيروسية من -80 ° C التخزين المجمد 1 ساعة قبل بدء الحقن ووضع قنينة على عجلة دوارة في RT. بعد ذوبان الجليد، والحفاظ على المخزون الفيروسي على الجليد خلال فترة الحقن. قبل الحقن التجسيمي من LV، يخفف من الأسهم الفيروسية المركزة إلى 10 6 TU / ميكرولتر باستخدام برنامج تلفزيوني في غطاء الثقافة.
- تطهير المنطقة المختارة لتنفيذ عملية جراحية مع 70٪ من الإيثانول.
- Microinjection من LV
- اختيار وتعقيم الأدوات اللازمة لعملية جراحية (مشرط، الحفر، وملاقط صغيرة).
- تخدير الماوس القديم أسابيع 6-8 قبل البريتونى (الملكية الفكرية) حقن خليط البيطري تحت إشراف الكيتامين وmedetomidine. وزن كل حيوان وجرعة كل منها 50-75 الكيتامين ملغ و 0.5-1 medetomidine ملغ لكل كيلوغرام من وزن جسم الفأر (حوالي 100-125 ميكرولتر من الكيتامين / medetomidine حل في الماوس العمل).
- تقييم الطائرة التخدير بواسطة معسر أصابع القدم أو الذيل أو الأذن والتأكد من أن الحيوان لا يظهر أي رد فعل.
- مرة واحدة يتم تخدير الماوس، وضخ بوتورفانول تحت الجلد بجرعة النهائية من 0،4-0،5 ملغ لكل كيلوغرام من وزن الفأر لتقليل الألم بعد العمليات الجراحية.
- حلق المنطقة الواقعة بين الأذنين وتطهير الجلد باستخدام حامل اليود مثل iodopovidone أو 70٪ من الإيثانول. تطهير باستخدام القطن المعقمتطبيقها -tipped. يجب الحرص على عدم الرطب بشكل مفرط الحيوان وهذا يمكن أن يؤدي إلى تفاقم انخفاض حرارة الجسم.
- وضع الحيوان في موقف المعرضة على إطار التجسيمي وبعناية إصلاح الرأس باستخدام قضبان الأذن والدعم الحنك من الجهاز. الحفاظ على الماوس مع مجموعة سادة التدفئة على 37 درجة مئوية، وتطبيق مواد التشحيم للعين للعيون.
- جعل شق 1 سم طويل على جلد الرأس طوليا باستخدام مشرط، وسحب بلطف الجلد لفضح الجمجمة باستخدام الملقط غرامة.
- بعناية تنظيف سطح العظم مع قضيب من القطن ذات الرؤوس العقيمة. تطهير عظم الجمجمة المكشوفة من أي نوع من الأنسجة المتبقية.
- جبل حقنة معقمة على الجهاز المجسم باستخدام حامل حقنة.
- نقل محور حامل حقنة X و Y و Z حتى يتم وضع غيض من إبرة حقنة على bregma، نقطة بالتزامن حيث تتقاطع الدرز السهمي (الطولية وسطي) عموديا من الدرز الإكليلي (شملت رقمالبريد 1B). تأكد من أن موقف "صفر" لل(DV) محور ظهراني بطني هو على سطح الجمجمة في bregma.
- نقل حقنة لإحداثيات جهة x و y (انظر الجدول رقم 1 والشكل 1B).
| منطقة الحقن | إحداثيات | ||
| انتيرو-الخلفي (ا ف ب) | ميديو الاطراف (ML) | ظهراني بطني (DV) | |
| المناطق الاقتصادية الخاصة / الحدود المخطط | +0.6 مم | +1.2 مم | -3.0 مم |
| البطين الجانبي | -0.3 مم | +1.0 مم | -2.6 مم |
الجدول 1: التجسيمي تنسق لفييتم إعطاء jections للحصول على وكالة اسوشييتد برس ومحور ML، إحداثيات س وص كما مسافة (مم) من bregma. "-" يدل على "نحو الخلفي". لDV بتنسيق "الصفر" هو سطح الجمجمة عند نقطة bregma والإحداثيات DV تشير إلى المسافة (مم) انخفاضا من هذه النقطة.
- علق س، ص وينسق ض جهة في نطاق رنيه من أجل أن تكون قادرة على العودة إلى موقع الحقن في وقت لاحق. علامة العظام في إحداثيات س وص باستخدام قلم الجراحي.
- نقل حقنة بعيدا عن منطقة العمل.
- استخدام بمثقاب كهربائي جعل ثقب في الجمجمة بعناية على عدم الإضرار الدماغ. لا حفر سطح حنوني لأن هذا قد يؤدي إلى تلف سطح الدماغ.
- تحميل المحاقن مع 1 ميكرولتر من 10 6 TU / حل الفيروسي ميكرولتر. استخدام قياس 33 حادة إبرة مشطوف التي لديها زاوية 10-12 درجة طرف. ضع إبرة حقنة في آنج 90 °لو فيما يتعلق سطح الدماغ.
- نقل حقنة الظهر لموقع الحقن وتحريكه لأسفل حتى يلامس طرف سطح حنوني.
- اختراق الدماغ مع حقنة لض تنسيق في محور DV.
- ببطء الافراج عن تعليق الفيروسي، بمعدل 0.2 ميكرولتر / دقيقة، وذلك للحد من الأضرار التي لحقت أنسجة المخ بسبب ضغط السائل الزائد.
- الانتظار لمدة 5-10 دقيقة لتقليل ارتجاع الفيروسي التعليق ثم سحب الحقنة ببطء شديد. وصمة عار أي فائض من السائل التي قد تظهر على السطح نتيجة للتراجع من الحقنة باستخدام مختبر مسح ووضعه مباشرة في السلامة الأحيائية حاوية النفايات التي تحتوي على مواد التبييض.
- خذ الحيوان من مجموعة التجسيمي، وضعه على وسادة دافئة، وإغلاق الجرح باستخدام لاصق الجلد. عكس التخدير باستخدام 0،1-1،0 ملغ / كغ من وزن الجسم atipamezole.
- حقن تحت الجلد Bupenorphrine بجرعة النهائية من 0.1 ملغ لكل كيلوغرام الماوس وزن كل 12 ساعة،ابتداء من 4 ساعات بعد إدارة قصيرة مسكن بوتورفانول دائم.
- وضع الحيوانات في قفص فردي مع وسادة دافئة وتراقب عن كثب حتى يسترد الماوس من التخدير. ضع كيس واحد من هيدروجيل في القفص لمساعدة هيدرات الحيوانات بعد الشفاء.
- تخلص من جميع النفايات الملوثة الحيوي في التخلص من التبييض واقية السائل. تنظيف حقنة بواسطة الشفط وطرد من الايثانول ويشطف بالماء. تطهير المنطقة، مجموعة التجسيمي والمواد الجراحية التي تم استخدامها مع التبييض و 70٪ من الإيثانول.
- حافظ على حقن الفئران المعزولة في السلامة الأحيائية مستوى 2 غرفة لمدة 24-48 ساعة بعد التي يمكن نقلها إلى منشأة سكنية التقليدية
3. تحليل النسيجي
- نضح، وجمع الأنسجة، وباجتزاء
- بعمق تخدير الفئران باستخدام مزيج تحت إشراف الطب البيطري من medetomidine والكيتامين (تقييم الطائرة التخدير بواسطة معسر رالتضامن الإماراتي أو الذيل أو الأذن)، كما هو موضح من قبل.
- Transcardially يروي الفئران مع 25 مل من محلول ملحي تليها 75 مل من 4٪ PFA في الجريدة الرسمية في نفس المعدل 17.
- استخراج المخ وبعد إصلاحه عن طريق غمر في 10 مرات على الأقل حجمه الباردة PFA 4٪ في الجريدة الرسمية لل1-16 ساعة (زيادة مرات بعد التثبيت قد يقلل من مناعية بعض المستضدات). اغسل ما تبقى من منهاج العمل مع PB.
- قطع الدماغ التالية مؤشرات 1D الشكل والغراء كتلة أدى إلى حامل vibratome باستخدام cyanoacrylate.
- جمع 30 أقسام الاكليلية مسلسل ميكرون سميكة باستخدام vibratome. تخزين شرائح الدماغ في 24 لوحات multiwell مع PB في 4 درجات مئوية. لمنع التلوث، ويمكن أن يضاف 0.05٪ أزيد الصوديوم في حل PB.
- المناعية
- احتضان المقاطع التعويم الحر في عرقلة العازلة (PB مع 0.05٪ أزيد الصوديوم، 1٪ الجلايسين، 5٪ طبيعي مصل الماعز، و 0.1٪ يسحقعلى X-100) ل1H في RT مع اهتزاز لطيف في منصة هزاز.
- بعناية إزالة عازلة تمنع مع ماصة، إضافة التخفيف المناسبة لمكافحة GFP الضد الأرنب الابتدائي (انظر الجدول من المواد) في عرقلة العازلة واحتضان الأنسجة مع هذا التخفيف لمدة 48 ساعة في 4 درجات مئوية مع الهز لطيف.
- يغسل حل الأجسام المضادة الأولية ما لا يقل عن 3 مرات مع PB، وغسل واحد كل 10 دقيقة.
- احتضان المقاطع التعويم الحر مع تخفيف مناسبة من الأجسام المضادة الثانوية fluorophore مترافق) في عرقلة الحل (انظر الجدول المواد) لمدة 1 ساعة على RT والهز لطيف. حماية أقسام من الضوء المباشر أثناء الحضانة.
- يغسل حل الأجسام المضادة الثانوية مع PB، و 3 مرات مرة واحدة كل 10 دقيقة، ومباين الأنسجة التي يحتضنها المقاطع مع دابي (4، 6 diamidino-2-phenylindole) في 1 ملغ / مل في الماء لمدة 5 دقائق. يغسل حل دابي قبل الشطف مرتين، وسرعان ما الطرافةح المياه.
- وضع بلطف المقاطع على شريحة المجهر باستخدام فرشاة الطلاء بشكل جيد. صب بضع قطرات من تصاعد المتوسطة للتحضير فلوري (انظر الجدول المواد) على الأنسجة ووضع بعناية ساترة على القمة، والتحقق من أن الحل تصاعد يتم توزيع بشكل صحيح على سطح كامل وعدم وجود فقاعات. الضغط بلطف أسفل ساترة لتصريف الفائض من تصاعد المتوسطة.
- عندما يجف حل المتصاعدة من (2-16 ساعة)، وتحليل عينة من متحد البؤر المجهر الليزر مع ليزر 488 نانومتر.
النتائج
نظام توصيل الجينات بوساطة LV يمكن استخدامها على المدى الطويل في ترنسدوكأيشن المجراة من الخلايا في الماوس الكبار V-SVZ، مما يتيح تتبع والتعديل الوراثي خلال الانتشار والهجرة والتمايز. العدوى والتعبير فعالة للغاية وتسفر عن العديد من الخلايا التي يمكن تمييزها ب?...
Discussion
لفس توفر مزايا هامة على الأنظمة الفيروسية الأخرى للتعديل الجيني الكبار NSCs 16،18. تسليم التجسيمي من lentiviruses إلى محراب-V SVZ يمثل وسيلة فعالة لتسمية وتتبع نادرا تقسيم B1-NSCs التغلب على القيود المفروضة على غيرها من الأساليب المستخدمة عادة مثل BrdU، التي تضعف بعد الانقساما...
Disclosures
وقدمت كل من التلاعب في غرفة مستوى السلامة الحيوية 2. تمت الموافقة على بروتوكولات الحيوان من قبل لجنة الأخلاق من جامعة فالنسيا وكان كل ما في الامتثال مع التوجيه الأوروبي 2010/63 / الاتحاد الأوروبي.
Acknowledgements
ونحن نعترف مساعدة من MJ بالوب والدعم الفني للSCSIE من جامعة دي فالنسيا. كما نشكر أنطونيا Follenzi لتعليقات مفيدة والمناقشة للمخطوطة. إذا كانت مدعومة من قبل مؤسسة بوتين، من خلال بانكو سانتاندر من خلال الشعبة العالمية سانتاندر جامعاتها، ومن المنح المقدمة من كتالونيا VALENCIANA (بروجراما PROMETEO، ACOMP، والتصنيف الصناعي الدولي الموحد) وMINISTERIO دي ECONOMIA ذ Competitividad (MINECO: SAF2011-23331، CIBERNED وRETIC تيرسل) . وأيد هذا العمل أيضا BFU2010-21823 وRETIC تيرسل المنح المقدمة من MINECO ومجلس الأبحاث الأوروبي (ERC) عام 2012 جنيها استرلينيا (260511- PD-HUMMODEL) إلى AC BM-P. وهو حاصل على زمالة FPI الإسبانية من MINECO.
Materials
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25X89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13X51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100x20 style |
| FACS tubes | Afora | DE400800 | 12x75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2X HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100X, used to prepare HeLa and 293T culture medium at a final concentration of 10X. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10X, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1X PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1000X stock solution at 8 mg/ml in dH2O |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33-gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11x21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
References
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved