A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הנדסה גנטית יציבה ויעילה של תאי V-SVZ העכבר למבוגרים עבור הניתוח של הגזע עצבי נייד אוטונומי והשפעות חד אוטונומיות
In This Article
Summary
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Abstract
יחסית בתאי גזע שקט סומטיים לתמוך התחדשות התאים לכל החיים ברוב רקמות בוגרות. תאי גזע עצביים במוח של יונקים בוגרים מוגבלים שתי גומחות נוירוגנית ספציפיים: אזור subgranular של gyrus משוננת בהיפוקמפוס ואת אזור חדרית-subventricular (V-SVZ; המכונה גם subependymal אזור או SEZ) בקירות של לרוחב חדרים. פיתוח אסטרטגיות העברת גני in vivo עבור אוכלוסיות תאי גזע בוגרים (כלומר אלה של מוח יונקים) וכתוצאה מכך ביטוי לטווח הארוך של transgenes הרצוי תאי הגזע וצאצאים הנגזרות מהם הוא כלי מרכזי במחקר ביו ביוטכנולוגיים הנוכחי. כאן, שיטה ישירה in vivo מוצגת לגבי ההנדסה הגנטית היציבה של תאי V-SVZ עכבר בוגר שמנצלת את זיהום המחזור עצמאי התא על ידי LVS ואת cytoarchitecture מאוד המיוחד של נישת V-SVZ. באופן ספציפי, הפרוטוקול הנוכחי לערבזה הזרקה של LVS ריק (שליטה) או LVS קידוד קלטות ביטוי transgene מסוים לתוך או V-SVZ עצמה, עבור in vivo מיקוד של כל סוגי התאים נישה, או לתוך לומן החדר לרוחב, עבור מיקוד של ependymal תאים בלבד. קלטות ביטוי אז הם משולבים לתוך הגנום של התאים transduced וחלבונים פלורסנט, מקודדים גם על ידי LVS, לאפשר זיהוי של תאי transduced לניתוח תא אוטונומיים ובלתי אוטונומיות, תופעות תלויות נישה בתאים שכותרתו שלהם צֶאֱצָאִים.
Introduction
אזור murine חדרית-subventricular (V-SVZ), בקירות החדר לרוחב מול בסטריאטום, הוא אזור נבטי מאוד פעיל בו תהליך מתמשך של תוצאות בידול שכפול תאים ובתאים בייצור מתמשך של הנורה חוש הריח (OB interneurons) ו oligodendrocytes כפיס המוח 1. הדור לכל החיים של תאים אלו מופיעים להיות נתמכים על ידי נוכחות באזור זה של תאי גזע עצביים (NSCs; המכונים גם תאי B1), המבטאים את חלבון גליה fibrillary חומצי אנטיגן astrocytic (GFAP) גזע סמני תא כגון nestin, ID1 ו Sox2 2. GFAP-לבטא בתאי B1 ליצור מעבר הגברה אבי תאים (TAP) (תאים C), המבטאים שעתוק גורמי Dlx2 (דיסטלי פחות homeobox 2) ו Ascl1 (homolog achaete-schute יונקים 1) ולחלק כמה פעמים במהירות לפני שהם להצמיח כדי neuroblasts הנודדת (תאי א) או oligodendroblasts 3. חדש שנוצר prolifneuroblasts erative להעביר anteriorly, ויצר נחל נודדות המקורי (RMS) אל OB, שם הם להשתלב הפרטניים ושכבות גלומרולרי כמו interneurons מעכבות בדיל. Oligodendroblasts הצעיר נודד לעבור CC, שם הם הופכים תאי NG2 חיובי מפותחים אשר ממשיכים להתחלק באופן מקומי או להתמיין oligodendrocytes myelinating הבוגר 1,4.
תאי B1, אשר נובעים ותאי גלייה רדיאלי עובריות, לשמר את המורפולוגיה המוארכת ומקוטבת של קודמיהם ולהציג מערכת יחסים מאוד מיוחדת עם הנישה שלהם. הם משתרעים בין התא אפנדימלי אילו קווים את החדר ואת הרשת של כלי דם להשקות את נישת V-SVZ. תהליך הפסגה הקטן של intercalates תאי B1 בין ependymocytes multiciliated ומסתיים cilium העיקרי יחיד שאינו ניע, ואילו התהליך הבסיסי שלהם משתרע למרחקים ארוכים להתקרב מקלעת כלי הדם מישוריים כי משקה סוף הנישה זו בlamina ASAL של נימי מקלעת 2,5-8.
הדרך האמינה ביותר להבחין B1-NSCs מ האסטרוציטים הלא נוירוגנית, שהן גם GFAP +, בגומחה V-SVZ שלם מבוסס על כל הר ההכנות של הקיר לרוחב החדר וניתוח שלהם על ידי מיקרוסקופ confocal 3-D אחרי immunostaining עבור GFAP לתייג את תהליך הפסגה B1-המל"ל דק, β-catenin להתוות קרום התא, ואו γ טובולין כסמן של גופים הבסיס cilial או acetylated α-טובולין לתייג את היקף כל cilium 5,8. תצפיות של כל-mounts אלה מפני שטח חדרית הראו כי תאי B1 ו- ependymal מסודרים "גלגלי רוח" 5, שבה תהליכי פסגת uniciliated של GFAP אחד או כמה + B1 תא מוקפים שושנה של תאי ependymal multiciliated.
המורפולוגיה האופיינית של תאי B1 בקורלציה עם ראיה נסיונית indicating כי כלי דם / תאי האנדותל חדרית נוזל השדרתי (CSF) מהווה מקורות מוסדרים של אותות מסיסים הפועלים NSCs 2,6,9-11. על פני החדר, homotypic ואינטראקציות apico-לרוחב heterotypic שמקורם בתאי דם ependymal ו- B1 כוללים צמתים הדוקים adherens צמתים 5,12. יתר על כן, מולקולות הדבקה מעורב מתחמי junctional בין התאים B1 ו- ependymal, כגון N-cadherin ו- V-CAM, הוכחו להסדיר לא רק את המיקום מאורגן של B1 בגומחה V-SVZ, אלא גם קפאון שלהם 12 , 13. Monolayer התא ependymal-B1 מופיע לפעול כמחסום דיפוזיה המאפשר השטף מוסדר מים ומולקולות קטנות מן CSF, אבל הגבלת המעבר בין תאית של חלבונים גדולים 10,11. ראיה נסיונית עולה כי cilium הפסגה בתא B1 ממוצבת באופן ייחודי יכול לשחק תפקיד כחיישן של איתות פוליפפטידים נוכח CSF 2,5-7. תאים Ependymal הם, כשלעצמם, גם מקור של אותות מסיסים קרום הנכנס עם תפקיד בוויסות התנהגות המל"ל 14,15.
נוקלאוזידים לעקיבה, כגון bromo-deoxyuridine (BrdU), או רטרווירוסים היה בשימוש נרחב לתייג ובתאים, כולל NSCs, in vivo. עם זאת, שיטות אלה אינן אופטימליים עבור מעקב גורל לטווח ארוך משום שאותות BrdU לדלל באמצעות חלוקות תא חוזרים רטרווירוסים נראה כי הן מיועדות מועדפות הגברה זמן תאים עקב הדרישה שלהם של התפשטות תאים עבור תמרת 16,17. כדי לבחון פיזיולוגית המל"ל in vivo, כולל אינטראקציות עם רכיבי נישה, חשוב להקים שיטה לתייג ואת העקבות לעתים נדירות תאים מתחלקים, כמו B1-NSCs הם שקט בעיקר ותאי ependymal השכנות שלהם מעולם לחלק בתנאים פיסיולוגי 3. כאן, אנו מראים כי וקטורים lentiviral (LVS) לאפשר סימן גן-יעילות גבוההing ושינוי ארוך הטווח של NSCs המבוגר ותאי ependymal הלא חלוקה, בשל בסבירות המרובה ליכולתם transduce וכדי להשתלב בגנום של תאי יעד באופן מחזור עצמאי תא. יתר על כן, אנו מראים כיצד תוואי עזרה כייל משלוח ויראלי transduce תאים ependymal במיוחד, אבל לא התאים B1 ובכך לאפשר ניתוח של תלויי נישה, תופעות ependymal על NSCs.
Protocol
המסר אתיקה: פרוטוקול זה פועל בהתאם להנחיות לטיפול בבעלי חיים של אוניברסיטת ולנסיה בהתאם להוראה אירופה 2010/63 / האיחוד האירופי.
דור 1. של LV עבור In Vivo סימון מחקרים (ראה איור 1 א)
זהירות: ההליך המתואר במסמך זה 2 בטיחות ביולוגית ברמה, ולכן לבצע את כל ההליכים הבאים במנדף Biohazard. ודא כי אנשי המחקר הם מתאימים כראוי ואומנה כל ההליכים. ללבוש ציוד מגן אישי, כולל חלוק, כפפות כפולות ומשקפי מגן מתאים. לבסוף, ביסודיות לטהר את כל הכלים ומשטחי שיכול היה להיות במגע עם וירוסים בהתאם לכללי חיטוי המתקן אושרה (על ידי מנגב עם 70% אתנול, 10% אקונומיקה ו / או מעוקר).
- הפקה של LV בתאים 293T כליה עובריים אנושיים
- התחל בפרוטוקול זה על ידי הכנת ה- DNA טהור עבור transfection. הכן ולטהר כל פלסמיד על ידי גראד כפול CsClצנטריפוגה ient או שיטות בטור השני זמינים מסחרית מניב DNA רעלן פנימי ללא. בפרוטוקול זה השתמשנו פלסמיד וקטור העברת pRRL-SIN-PPT.PGK.EGFP.Wpre. פלסמידים אריזה הליבה מומלץ הם pMDLg / pRRE ו pRSV.REV ומעטפה פלסמיד pMD2G 13,18,19.
- עשרים וארבע שעות לפני transfection, צלחת 5 x 10 6 293T התאים בינוני של Dulbecco Modified של Iscove (IMDM) (ראו טבלה של חומרים) בצלחת פלסטיק 10 ס"מ על מנת לקבל תרבות ומחוברות 1/4 עד 1/3 כ עבור transfection. לדגור על 37 מעלות צלזיוס חממה humidified באווירה של 5-7% CO 2.
- החלף בינוני עם hr 2 בינוני טרי לפני transfection.
- מערבבים צינור 1.5 מ"ל microcentrifuge סטרילית 10 מיקרוגרם של פלסמיד וקטור ההעברה (המכיל את cDNA של transgene או shRNA להימסר) עם 2.5 מיקרוגרם של pRSV.REV ו 5 מיקרוגרם של פלסמידים אריזה pMDLg / pRRE, ו -3.5 & #181; g של פלסמיד המעטפה pMD2G. איפור הפתרון פלסמיד לנפח סופי של 450 μl עם חיץ 0.1x TE (ראו טבלה של חומרים) / DH 2 0 (2: 1). לאחר מכן להוסיף 50 μl של 2.5 M CaCl 2.
- טופס המשקע על ידי תוספת dropwise של 500 μl של תמיסת מלח שנאגרו 2x Hepes (HBS, ראו טבלה של חומרים) פתרון לתערובת 500 μl DNA-TE-CaCl 2 תוך vortexing במלוא המהירות.
- מוסיפים את המשקע על התאים 293T מיד. מערבולת בעדינות את הצלחת לערבב. מחזירים את התאים החממה ולשנות את transfection 14-16 שעות לאחר בינוני.
- אסוף את supernatants תא 30 שעות לאחר שינוי התקשורת. סנן supernatant דרך פילטר nitrocellulose 0.22 מיקרומטר הנקבוביות והמשך ריכוז.
- ריכוז של LVS
- תתרכז המדיום מותנה ultracentrifugation ב -50,000 XG (19,000 סל"ד עם הרוטור ultracentrifuge SW-28) עבור 2שעות בטמפרטורת החדר (RT) בתוך פוליפרופילן 30 מ"ל צינור הרוטור חרוטי שקוף.
הערה: מתאמי ultracentrifuge השתמש עבור צינורות הרוטור חרוטים (ראה טבלה של חומרים). - מחק את supernatants באמצעות אחסון ו resuspend את הכדורים בנפח קטן (200 μl או פחות אם רק צנטריפוגה אחת מתבצעת) של החיץ המלוח פוספט (PBS; ראו טבלה של חומרים). ואז פיפטה למעלה ולמטה כ -20 פעמים.
- פינת השעיות ולהתרכז שוב על ידי ultracentrifugation, גם ב 50,000 x ז (23,000 סל"ד עם הרוטור ultracentrifuge SW-55) עבור 2 שעות בטמפרטורת החדר. השתמש צינורות הרוטור פוליפרופילן שקוף עם נפח נומינלי של 5 מ"ל (ראו טבלה של חומרים).
- Resuspend גלולה הסופי בנפח קטן מאוד (1/500 או 1 / 1,000 מהיקף להתנעה בינוני) של PBS סטרילי ולנער על גלגל מסתובב במשך שעה 1 ב RT. התפצלתי aliquots הקטן (5-20 μl) ו freeze אותם ב -80 ° C.
- פנק את כל הצינורות הריקים עם אקונומיקת 10% לפני השלכת.
- תתרכז המדיום מותנה ultracentrifugation ב -50,000 XG (19,000 סל"ד עם הרוטור ultracentrifuge SW-28) עבור 2שעות בטמפרטורת החדר (RT) בתוך פוליפרופילן 30 מ"ל צינור הרוטור חרוטי שקוף.
- Lentiviral טיטרציה שימוש cytometry זרימה
- יום קודם לכן, צלחת 5 x 10 4 תאים הלה לכל היטב צלחות תרבית הרקמה 6-היטב 2 מ"ל בינוני של הנשר שונה של Dulbecco (DMEM) (ראו טבלה של חומרים). לדגור על 37 מעלות צלזיוס חממה humidified באווירה של 5-7% CO 2 למשך 24 שעות.
- ביום טיטרציה, להפשיר aliquot של המניה ויראלי ולהכין דילולים סדרתי, מ 10 -3 עד 10 -8, ב DMEM.
- כדי לעשות זאת, לקחת צלחת 24 היטב ומוסיפים 2 מ"ל של DMEM אל הבאר הראשונה ו -1.8 מ"ל על בארות הבאה. לאחר מכן להוסיף את הבאר הראשונה 2 μl של מניית ויראלי המרוכזת (לדילול סופי של 1: 1,000 או 10 -3).
- לאחר pipetting מספר פעמים כדי לערבב ביסודיות את קצה הפתרון, שינוי ולהעביר 200 μl של דילול 10 -3אל הבאר השנייה. חזור על תהליך בהמשכים בעיתון הבארות הבאות עד הדילול 10 -8 הוא עשה.
- קח תאים הלה מצופה יום קודם לכן מן החממה. מוציאים בזהירות בינוני מבארות. הוסף 1 מ"ל של כל דילול ויראלי יחד עם 1 μl של 8 מ"ג / מ"ל hexadimethrine ברומיד על בארות תא המכיל הלה. מערבולת בעדינות את הצלחת לערבב.
הערה: ברומיד Hexadimethrine מתווסף להגדיל את ספיחת הווירוס אל התאים בתרבית. - מחזירים את התאים החממה ולאפשר הזיהום להמשיך במשך 72 שעות. לאחר מכן, להסיר את המדיום, לשטוף את התאים פעם עם PBS ולהוסיף 200 μl של טריפסין-EDTA (ראו טבלה של חומרים) זה טוב.
- אחרי 5 דקות ב 37 מעלות צלזיוס, להוסיף 2 מ"ל של PBS על כל התאים היטב הקציר בתזרים cytometry צינורות.
- צנטריפוגה ב g 300 x 5 דקות ב RT ו לשאוב supernatant.
- Resuspend גלולה עם 1 מ"ל של תיקון solutiעל (כיתה במיקרוסקופ אלקטרוני 1% פורמאלדהיד בסרום שור עובר 2% ב PBS), ואז מערבולת הצינורות.
- נתח את התאים cytometer זרימה באמצעות 488 ננומטר ארגון-ionlaser בהספק 15 mW.
- הגדר את המכשיר כאשר בתצורה סטנדרטית: פיזור קדימה (FS), בצד פיזור (SS), ואת הקרינה עבור GFP (525/40 ננומטר). Gating אוכלוסייה בחר בתא בתוך FS לעומת עלילת SS הנקודה להוציא אגרגטים תא ופסולת. אסוף קרינת סולם לוגריתמים. לחשב את מספר ה- GFP + תאים במדגם אחד.
- לחשב כייל וקטור באמצעות הנוסחה הבאה:% GFP + / 100 x מספר תאים נגועים גורם לדילול x (DF) = יחידות transducing (TU) / מ"ל.
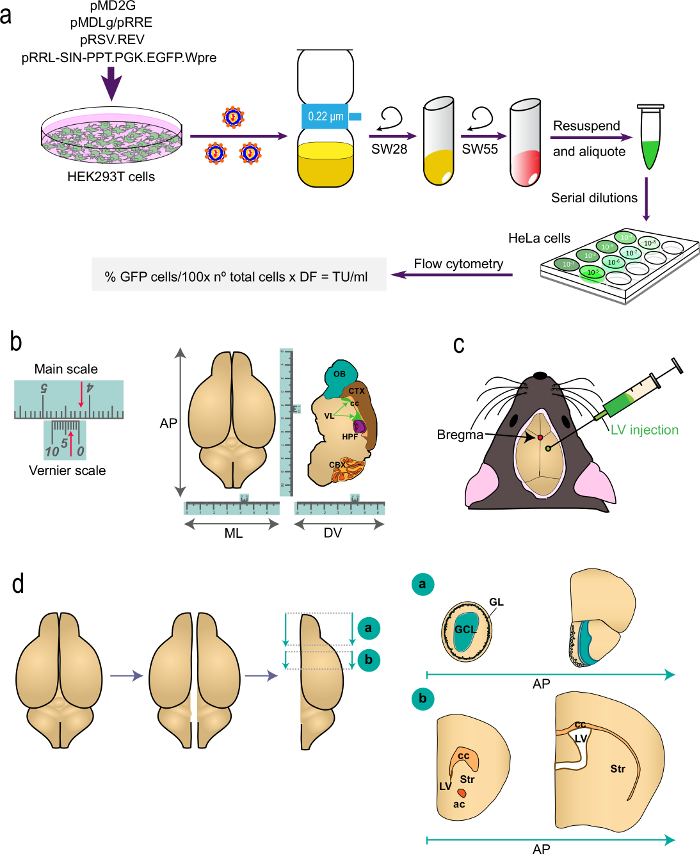
איור 1: ייצוג סכמטי של החלקים השונים של ההליך (א) חלק 1 של t.הוא פרוטוקול: דור של LVS עבור במחקרי vivo תיוג, מן transfection של תאי HEK293T עם פלסמידים מתאימים כדי ליצור את LVS קביעת כייל הנגיף על ידי cytometry זרימה באמצעות הנוסחא מצוינת. השמות של פלסמידים הרוטורים צנטריפוגות מסומנים. (B ו- C) חלק 2 של הפרוטוקול: הזרקת stereotaxic של LVS. "ב" מתארת דוגמה בקנה מידה Vernier, מכשיר זה הוא חלק מכשירים stereotaxic ומשמש למדידות בסדר. כדוגמה, החצים מצביעים 4.23 ס"מ. סולם Vernier משמש כדי לקבוע את הקואורדינטות-האחורי אנטרו (AP), מדיו-צדדיים (ML), ו dorso- הגחון (DV) ציר כמוצג עבור א-מבט מלמעלה (משמאל) עבור קטע sagittal (מימין ) של המוח. "ג" מציין את המיקום של גבחת כצומת בין התפרים sagittal ו העטרה. LVS מוזרק באמצעות מזרק. (ד) ציורים סכמטי המציג כיצד אני המוחs מעובד לניתוח. שתי האונות מפוצלות וכל אחד מחולק לשני גושים. בלוק "a", המכיל את Obs, מופק על ידי קיצוץ העטרה ברמת AP האחורי מיד לצומת OB עם telencephalon (גבחת 2.46 מ"מ; לראות Paxinos' אטלס עבור הפניה). בלוק "b" מופק על ידי שני חתכי עטרה, אחד ברמה פשוט קדמית להיבט המקורי ביותר של כפיס המוח (גבחת 1.7 מ"מ), והשני ברמה של הצומת של שני החדרים לרוחב (גבחת -0.22 מ"מ). GL, שכבת גלומרולרי; GCL, שכבת תאי גרגיר; st, הסטריאטום; סמ"ק, כפיס המוח; ac, השליך קדמי; LV, לרוחב החדר.
2. הזרקת Stereotaxic של LV לתוך V-SVZ / בסטריאטום הגבול או לתוך החדר לרוחב (ראה איור 1b)
- הכנה
- לעקר מזרק קיבולת 5 μl עם מחט 33 מד ידי ריסוס מטה את הגוף ואת המחט עם 70% אתנול עם הבוכנהשלף כל הדרך. שוב ושוב לשאוב אתנול מן צינור 1.5 מ"ל microcentrifuge והוצא אותו כל הדרך החוצה מספר פעמים, ולשטוף את המזרק ביסודיות עם מים סטריליים לאחר מכן. יש להכניס את המזרק בבטחה בצד בשכונת התרבות ולאפשר לו להתייבש.
- כן מכל פסול Biohazard עם אקונומיקה 10% עד נפח מתאים לטבילה של כל פסולת מן ההליך זה (בדרך כלל 200 מיליליטר במכל 500 מיליליטר).
- כן מחממי מיטת מי 37 ° C על ידי מילוי שקית אחסון מפלסטיק סגר עם מים מחממים אותו עד 37 מעלות צלזיוס. זה יאפשר עכברים להתאושש לאחר ההזרקה.
- הסר מניות ויראלי מ -80 ° C אחסון במקפיא 1 hr לפני תחילת זריקות ומניחים את הבקבוקון על גלגל מסתובב ב RT. לאחר הפשרה, לשמור על מלאי ויראלי על קרח במהלך הזמן של הזריקות. לפני הזרקת stereotaxic של LV, לדלל את מניות ויראלי מרוכזות 10 6 TU / μl באמצעות PBS בשכונת התרבות.
- לטהר את האזור שנבחר לביצוע הניתוח עם 70% אתנול.
- Microinjection של LV
- בחר לעקר הכלים הדרושים לניתוח (אזמל, תרגיל, ו פינצטה קטנה).
- להרדים עכבר 6-8 שבועות בן ידי intraperitoneally (IP) הזרקת תערובת וטרינרים בפיקוח של קטמין ו medetomidine. לשקול כל חיה והמנה בכל עם קטמין 50-75 מ"ג ו 0.5-1 מ"ג medetomidine לכל ק"ג של משקל גוף העכבר (סביב 100-125 μl של קטמין / medetomidine הפתרון עובד לכל עכבר).
- להעריך את מטוס ההרדמה על ידי צובט את בוהן, הזנב או אוזן והבטיח כי בעל חיים לא מראה שום תגובה.
- לאחר העכבר הוא הרדים, להזריק תת עורי butorphanol במינון הסופי של 0.4-0.5 מ"ג לכל ק"ג משקל העכבר כדי למזער את הכאב לאחר ניתוח.
- לגלח את האזור בין האוזניים ולחטא את העור באמצעות iodophor כגון iodopovidone או 70% אתנול. לטהר באמצעות צמר גפן סטריליאפליקטורים -tipped. תיזהר שלא להרטיב את החיה מוגזמת כמו זה יכול להחריף היפותרמיה.
- מניח את החיה במצב נוטה על מסגרת stereotaxic ובזהירות לתקן את הראש באמצעות סורגי האוזן ואת תמיכת החיך של מנגנון. שמור את העכבר עם סט כרית חימום על 37 מעלות צלזיוס וליישם חומר סיכה עיניים לעיניים.
- ביצוע חתך ארוך 1 סנטימטר על עור ראש longitudinally באמצעות אזמל, בעדינות לחזור בו העור כדי לחשוף את הגולגולת באמצעות פינצטה בסדר.
- בזהירות לנקות את פני העצם עם מוליך כותנה שקצו סטרילי. לנקות את עצם גולגולת החשופה של כל רקמה נותרת.
- הר את המזרק מעוקר בהתקן stereotactic באמצעות בעל מזרק.
- הזז את x מחזיק מזרק, Y ו- Z ציר עד קצה מחט המזרק ממוקם על גבחת, הנקודה בשיתוף שבו sagittal (אורכי המדיאלי) התפר הוא הצטלב בניצב ידי תפר העטרה (Figurדואר 1b). ודא כי עמדת "אפס" של ציר dorso- הגחון (DV) הוא על פני השטח הגולגולת גבחת.
- הזז את המזרק קואורדינטות היעד x ו- y (ראו טבלה 1 ו איור 1b).
| אזור ההזרקה | קואורדינטות | ||
| אנטרו-אחורי (AP) | Medio לטרלי (ML) | Dorso- הגחון (DV) | |
| SEZ / גבול בסטריאטום | 0.6 מ"מ | 1.2 מ"מ | -3.0 מ"מ |
| חדר לרוחב | -0.3 מ"מ | 1.0 מ"מ | -2.6 מ"מ |
טבלה 1: Stereotaxic מרכזת עבור בjections. עבור AP וצירים ML, x ו- y מקבלים כמרחק (במ"מ) מן גבחת. "-" מציין "לקראת אחורי". עבור DV קואורדינטות "אפס" הוא שטח הפנים של הגולגולת בנקודת גבחת קואורדינטות DV לציין את המרחק (במ"מ) למטה מנקודה זו.
- ותסמן את X, Y ו- Z יעד קואורדינטות סולם Vernier כדי להיות מסוגל לחזור על הזריקה בהמשך. סמן את עצם x ו- y באמצעות עט סימון כירורגית.
- הזז את המזרק הרחק מאזור העבודה.
- באמצעות מקדחה חשמלית לעשות חור בגולגולת בזהירות שלא לפגוע במוח. אין לקדוח לפני השטח pial כמו זה עלול להזיק לפני השטח המוח.
- טען את המזרק עם 1 μl של 10 6 TU / פתרון ויראלי μl. שימוש במחט משופע 33 מד חדה שקצה שלו יש בזווית של 10-12 מעלות. מקמו את המחט במזרק בכל אנג 90 °le ביחס פני שטח המוח.
- הזז את המזרק חזרה לאתר של הזרקה ולעבור אותו עד קצה נוגע משטח pial.
- לחדור למוח עם המזרק z לתאם בציר DV.
- לאט לשחרר את ההשעיה ויראלי, בשיעור של 0.2 μl / דקה, כדי למזער את הנזק לרקמת המוח עקב לחץ נוזלים מוגזמת.
- חכה 5-10 דקות כדי למזער את backflow השעית ויראלי ולאחר מכן לחזור בו המזרק מאוד לאט. כתם כל עודף של נוזל אשר עשויים להופיע על פני השטח כתוצאה של הביטול של המזרק באמצעות מעבדה לנגב ולמקם אותו מיידית מיכל פסולת בטיחות ביולוגית המכיל אקונומיקה.
- קח את החיה מתוך סט stereotaxic, והנח אותו על משטח חם, ולסגור את הפצע באמצעות דבק עור. הפוך את הרגעה באמצעות 0.1-1.0 מ"ג / ק"ג משקל גוף atipamezole.
- להזריק מתחת לעור Bupenorphrine במינון סופי של 0.1 מ"ג לכל ק"ג משקל העכבר כל 12 שעות,החל מה -4 שעות לאחר מתן של משכך כאבי Butorphanol קיימא הקצר.
- מניח את החיה בכלוב אישי עם כרית חמה לעקוב מקרוב עד העכבר מתאושש מן ההרדמה. מקום אחד בתיק של הידרוג'ל בכלוב לעזור מימה חיה לאחר ההחלמה.
- השלך את כל הפסולת ביו-מזוהמת לרשות Biohazard האקונומיקה הנוזלית. נקה את המזרק על ידי שאיפת פליטה של אתנול ולשטוף עם מים. לחטא את האזור, סט stereotaxic והחומר כירורגי, שבו נעשה שימוש עם אקונומיקה 70% אתנול.
- שמרו עכברים שהוזרקו מבודדים בחדר הבטיחות הביולוגי ברמת 2 במשך 24-48 שעות לאחר מכן הם יכולים להיות מועברים למתקן דיור קונבנציונלי
3. ניתוח היסטולוגית
- זלוף, אוסף רקמות, חתך
- עמוק לטשטש את העכברים באמצעות תערובת בפיקוח וטרינרי של medetomidine ו קטמין (להעריך את המטוס הרדמה על ידי צובט את tOES, זנב או אוזניים), כפי שתואר קודם לכן.
- Transcardially perfuse עכברים עם 25 מ"ל של תמיסת מלח ואחריו 75 מ"ל של PFA 4% ב PB באותו קצב 17.
- חלץ את המוח ופוסט לתקן את זה על ידי טבילה אותו נפחו פי 10 לפחות של PFA 4% קר PB עבור 1-16 שעות (בתקופה שלאחר קיבוע מוגברת עלולה לגרום לירידה immunoreactivity של כמה אנטיגנים). לשטוף ביסודיות את PFA הנותרים עם PB.
- חותכים את המוח לאחר סימנים של איור 1D ו להדביק את הבלוק וכתוצאה לבעל של vibratome באמצעות cyanoacrylate.
- אסוף 30 חלקים העטרה סדרתי מיקרומטר בעובי באמצעות vibratome. אחסן את פרוסות המוח בצלחות 24 multiwell עם PB ב 4 ° C. כדי למנוע זיהום, אזיד הנתרן 0.05% ניתן להוסיף את הפתרון PB.
- אימונוהיסטוכימיה
- דגירה סעיפים ריחוף ללא חסימת חיץ (PB עם אזיד הנתרן 0.05%, גליצין 1%, עז בסרום נורמלי 5%, ו -0.1% טריטעל X-100) עבור 1h ב RT עם רעד עדין פלטפורמת נדנדה.
- מוציאים בזהירות למאגר חסימת עם טפטפת, להוסיף דילול המתאים הנוגדן העיקרי ארנב נגד GFP (ראו טבלה של חומרים) בחסימת חיץ דגירה רקמות עם דילול זה במשך 48 שעות ב 4 ° C עם רעד עדין.
- לשטוף פתרון הנוגדן הראשוני מינימום של 3 פעמים עם PB, לשטוף אחד כל 10 דקות.
- דגירת סעיפים החופשיים צפו עם דילול מתאים של נוגדנים משני fluorophore מצומדות) בחסימת פתרון (ראה טבלה של חומרים) עבור שעה 1 ב RT ו רעד עדין. הגנו על קטעים מתוך אור ישיר במהלך הדגירה.
- לשטוף את הפתרון נוגדנים משני עם PB, 3 פעמים פעם כל 10 דקות, ו counterstain את הרקמה על ידי דוגרים את החלקים עם DAPI (4 ', 6-diamidino-2-phenylindole) הוא 1 מ"ג / מ"ל במים למשך 5 דקות. לשטוף פתרון DAPI ידי שטיפת שנינות פעמים ובמהירותמי h.
- הנח בעדינות את הסעיפים בשקופית מיקרוסקופ באמצעות מברשת צבע עדין. יוצק כמה טיפות של הרכבה בינונית להכנות ניאון (ראה טבלה של חומרים) על הרקמות ובזהירות במקום coverslip על גבי, בודק כי הפתרון גובר מופץ כראוי על פני כל שטח ואין בועות. יש ללחוץ בעדינות את coverslip כדי לנקז את עודף הרכבה בינונית.
- כאשר הפתרון גובר מתייבש (2-16 שעות), לנתח את המדגם על ידי מיקרוסקופ סריקת לייזר confocal עם לייזר 488 ננומטר.
תוצאות
LV בתיווך מערכת מסירת גן יכולה לשמש לטווח הארוך תמרת vivo של תאי V-SVZ העכבר הבוגר, המאפשרת המעקב שלהם הנדסה גנטית במהלך התפשטות, הגירה והבחנה. הזיהום ואת הביטוי הוא יעיל ויניב תאים רבים ניתן להבחין בקלות בין תאים שאינם נגועים אחרים על ידי הביטוי של הכתב כלל. יש לנ...
Discussion
LVS להציע יתרונות חשובים על פני מערכות ויראליות אחרות עבור ההנדסה הגנטית של מבוגר NSCs 16,18. משלוח Stereotaxic של lentiviruses לנישה V-SVZ מייצג שיטה יעילה לתייג ואת עקבות חלוקת B1-NSCs לעתים רחוקות להתגבר על המגבלות של שיטות נפוצות אחרות כגון BrdU, אשר נחלש לאחר חלוקות תא מרובים, או רט...
Disclosures
כל המניפולציות נעשו בחדר בטיחות ביולוגית ברמת 2. פרוטוקולים בעלי חיים אושרו על ידי ועדת האתיקה של אוניברסיטת ולנסיה והיו כל באמות הוראה אירופה 2010/63 / האיחוד האירופי.
Acknowledgements
אנו מכירים את עזרתו של MJ Palop ואת התמיכה הטכנית של SCSIE של ולנסיה Universidad de. אנו מודים גם אנטוניה Follenzi על הערות מועילות ודיון של כתב היד. אם הוא נתמך על ידי Fundacion Botìn, על ידי Banco Santander דרך חטיבת שלה סנטנדר אוניברסיטאות העולמי, ועל ידי מענקי Generalitat מוולנסיה (פרוגרמה Prometeo, ACOMP, ו ISIC) ו Ministerio דה Economìa y Competitividad (MINECO: SAF2011-23331, CIBERNED ו RETIC Tercel) . עבודה זו נתמכה גם על ידי BFU2010-21823 ו RETIC Tercel המענק MINECO ואת מועצת המחקר האירופית (ERC) 2012-STG (260511- PD-HUMMODEL) אי.סי BM-P. הוא זכה במלגה FPI ספרדי של MINECO.
Materials
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25 mm x 89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13 mm x 51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100 x 20 style |
| FACS tubes | Afora | DE400800 | 12 mm x 75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2x HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100x, used to prepare HeLa and 293T culture medium at a final concentration of 10x. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10x, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1x PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1,000x stock solution at 8 mg/ml in dHO |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | http://www.leicabiosystems.com/ |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33 gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11 cm x 21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25 G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
References
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved