JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
신경의 분석을위한 성인 마우스 V-SVZ에서 세포의 안정적이고 효율적인 유전자 변형 줄기 세포 자율 및 비 자치 효과
요약
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
초록
상대적으로 대기 체세포 줄기 세포는 대부분의 성인 조직에서 평생 세포 재생을 지원합니다. 성인 포유류 뇌의 신경 줄기 세포는 두 가지 특정 신경 인성 틈새로 제한됩니다 해마의 치아 이랑과 심실-뇌실 영역의 subgranular 영역, 측면의 벽 (V-SVZ는 subependymal 영역 또는 SEZ라고도 함) 심실. 장기 줄기 세포에서 원하는 유전자의 발현 및 유래 자손 결과 성체 줄기 세포 집단에 대한 생체 내 유전자 전달 전략의 개발 (즉, 포유 동물의 뇌들)은 현재 생물 의학 및 생명 공학 연구에서 중요한 도구이다. 여기서, 직접 생체 내 방법은 정맥 주사에 의한 세포주기 독립적 감염 V-SVZ 틈새 고도로 전문화 cytoarchitecture 활용 성인 마우스 V-SVZ 세포의 안정한 유전 적 변형을 위해 제공된다. 구체적으로는, 현재 프로토콜을 포함V-SVZ 자체 하나에 특정 유전자의 발현 카세트를 인코딩 빈 정맥 주사 (제어) 또는 정맥 주사의 주입은 뇌실막의 타겟팅, 생체 내 틈새에있는 세포의 모든 유형의 타겟팅, 또는 측면 뇌실 루멘으로,이야 세포 만. 발현 카세트는 허용, 또한 정맥 주사에 의해 코딩되는 형질 세포 및 형광 단백질의 게놈 내로 통합되는 표지화 된 세포 및 세포 자율 및 비 - 자율 틈새 의존적 효과 분석 형질 세포의 검출 그들의 자손.
서문
뮤린 심실-뇌실 영역 (V-SVZ)는 선조체 대향 뇌실의 벽에서 매우 활성 종자 영역 인 후각 망울의 지속적인 생산 전구 세포 복제 및 분화 결과 연속 처리 (OB )의 interneurons 및 뇌량의 희소 돌기 아교 세포 (1). , 성상 세포 항원 아교 섬유 성 산성 단백질 (GFAP)을 표현하고 같은 네 스틴, Id1을 같은 세포 마커 줄기, 이러한 세포의 평생 세대는 신경 줄기 세포 (또한 B1 세포라고 NSCs을)이 지역의 존재에 의해 지원 될 것으로 보인다 및 Sox2이 2. B1 세포가 교통 전구를 증폭 전사가 Dlx2 요인 표현 (TAP) 세포 (C 세포) 생성 GFAP 발현 (말초없는 호 메오 박스 2) Ascl1 (포유류 achaete-schute 동족체 1) 그들이 야기하기 전에 신속하게 몇 번 분할 마이그레이션 neuroblasts (세포) 또는 oligodendroblasts 3. prolif 새로 생성하는 다각적 neuroblasts는 세분화 및 차별화 된 억제의 interneurons으로 사구체 층에 통합 OB에 주동이의 철새 스트림 (RMS)을 형성, 전방으로 이동한다. 이주 젊은 oligodendroblasts는 로컬 분할 또는 성숙 myelinating의 희소 돌기 아교 세포 1,4로 분화 계속 미숙 NG2 양성 세포가 CC로 이동합니다.
태아 방사형 신경 교세포에서 파생 B1 세포는, 그들의 전임자의 연장 및 편광 형태를 유지하고 자신의 틈새 고도로 전문화 된 관계를 나타낸다. 그들은 어느 선 심실과 V-SVZ 틈새 시장을 관개 혈관의 네트워크까지 ependyma 사이에 걸쳐. 자신의 기초 과정은 나에이 틈새 결말을 관개 평면 혈관 신경 얼기에 접근하는 긴 거리를 확장하는 반면 multiciliated ependymocytes 중 B1 세포하게 인터의 작은 혀끝의 과정과는 단일 비 운동성이 차 섬모에 종료총 모세관 2,5-8의 ASAL의 얇은 판.
그대로 V-SVZ 틈새에도 GFAP + 아르 비 신경 인성 성상 세포,에서 B1-NSCs을 구별하는 가장 신뢰할 수있는 방법을 기반으로 한 후 3 차원 공 초점 현미경에 의한 심실 측벽의 준비 및 분석을 전체 마운트 GFAP에 대한 면역 염색은 세포막을 묘사하기 위해 얇은 B1-NSC 혀끝의 과정, β-catenin이 레이블, 각 섬모 5,8의 범위를 라벨을 cilial 기초 단체 또는 아세틸 화 α-튜 불린의 마커로 γ-tubulin의 하나입니다. 심실 표면에서 이러한 전체 마운트 관찰 B1과 뇌실막 세포는 하나 또는 여러 개의 GFAP + B1 셀의 uniciliated 혀끝의 프로세스가 multiciliated 뇌실막 세포의 장미에 의해 둘러 쌓여되는 "바람개비"5 배열되어 있음을 지적했다.
B1 세포의 특성 형태는 실험적 증거와 상관 관계 전NSCs의 2,6,9-11에 작용하는 수용성 신호의 조절 소스를 구성하며 그 혈관 / 내피 세포를 ndicating 및 뇌척수액 (CSF)를 심실. 심실 표면, 동형 및 뇌실막 및 B1 셀을 포함하는 이형 apico-측면의 상호 작용에 꽉 접합 및 adherens 접합 5,12-을 포함한다. 또한, 이러한 N 헤린 및 V-CAM 등 B1 및 뇌실막 세포 사이의 접합부 복합체에 관여 부착 분자는 V-SVZ 틈새 B1의 고도로 조직화 된 위치뿐만 아니라 조절하는 것으로 알려져 왔지만, 또한 정지 12 13. -B1 뇌실막 세포 단층은 확산 CSF로부터 물 및 작은 분자 조절 플럭스 배리어 허용하지만, 많은 단백질 10,11의 세포 간 통로를 제한하는 역할을 보인다. 실험 증거는 고유 위치 B1 셀 혀끝의 섬모가 CSF 2에 존재하는 폴리 펩타이드 신호의 센서로 역할을 할 수 있음을 나타냅니다5-7. 뇌실막 세포 자체, NSC 동작 14,15의 조절에서 역할 용해성 막 결합 신호 또한 소스이다.
예컨대 브로 모 우리 딘 (BrdU의) 또는 레트로 바이러스 뉴 클레오 시드가 추적 가능한 널리 생체에 포함 NSCs의 전구 세포를 라벨 사용되어왔다. BrdU의 신호가 반복 세포 분열 및 레트로 바이러스를 통해 희석 우선적으로 전달 (16, 17)에 대한 세포 증식 자신의 요구에 의한 세포를 증폭 일시적 대상으로 표시하기 때문에,이 방법은 장기간의 운명 추적을위한 최적되지 않습니다. 틈새 구성 요소와 상호 작용을 포함하여 생체 내에서 NSC의 생리를 조사하기 위해, 라벨 및 B1-NSCs을 크게 대기하고 자신의 주변 뇌실막 세포 생리 학적 조건 3에서 분할 결코로, 거의 구분되지 세포를 추적하는 방법을 설정하는 데 매우 중요합니다. 여기서는 렌티 바이러스 벡터 (정맥 주사)을 고효율 유전자 마크 있도록 보여ING와 능력 형질 도입하고 세포주기 독립적 인 방식으로 표적 세포의 게놈에 통합이 가장 합리적으로 인해 성인 NSCs의 비 분할 뇌실막 세포의 장기 수정. 또한, 우리는 배달 및 바이러스 역가 도움의 경로를 구체적으로하여 NSCs의 틈새 시장에 의존, 뇌실막 효과의 분석을 가능하게 B1 셀을 뇌실막 세포를 형질 도입,하지만하는 방법을 보여줍니다.
프로토콜
윤리 선언문 :이 프로토콜은 유럽 지침 63분의 2,010 / EU 준수 발렌시아 대학의 동물 관리 지침을 따른다.
연구를 표시 생체에 대한 LV의 1 세대 (그림 1a 참조)
주의 : 여기에 설명 된 절차에 따라서 생물 학적 후드에서 다음의 모든 절차를 수행, 바이오 안전성 레벨 2입니다. 이 연구 담당자가 적절하게 자격을 갖춘 모든 절차 훈련 있는지 확인. 가운, 이중 장갑과 적절한 눈 보호를 포함한 개인 보호 장비를 착용 할 것. 마지막으로, 철저하게 (70 % 에탄올, 10 % 표백제 및 / 또는 고압 증기 멸균으로 닦아) 승인 된 시설의 소독 방법에 따라 바이러스에 접촉되었을 수있는 모든 도구와 표면 오염을 제거.
- 인간 배아 신장 293T 세포에 LV의 생산
- 형질 전환을위한 순수한 DNA를 준비하여이 프로토콜을 시작합니다. 준비 및 이중 협동 학습 대학원 각 플라스미드를 정제ient 원심 분리 또는 독소없는 DNA를 산출 다른 상업적으로 이용 가능한 열 방법. 이 프로토콜에서 우리는 전송 벡터 플라스미드 pRRL-SIN-PPT.PGK.EGFP.Wpre을 사용했다. 추천 코어 포장 플라스미드 pMDLg / pRRE을하고 pRSV.REV하고 플라스미드 pMD2G 13,18,19 봉투.
- 스물 네 시간 형질 감염 전에, Iscove 개변 둘 베코 배지 (IMDM)에서 플레이트 (5) × 106 293T 세포에 대해 약 1/4 1/3 합류 배양을 얻기 위해 10cm 플라스틱 접시 (자재 표 참조) 형질 전환. 5~7%의 CO 2 분위기하에 가습 인큐베이터에서 37 ℃에서 인큐베이션.
- 형질 전환 전에 새로운 배지 2 시간과 매체를 교체합니다.
- 멸균 1.5 ml의 microcentrifuge 관 믹스에서 10 전이 벡터 플라스미드의 μg의 pRSV.REV의 2.5 μg의 및 pMDLg / pRRE을 포장 플라스미드 5 μg의, 3.5 &로 (유전자의 cDNA를 또는 shRNA를을 포함 배달합니다) #181; 봉투 플라스미드 pMD2G의 g. 0.1X TE 완충액 450 μL의 최종 부피 플라스미드 용액 메이크업 / 0 DH 2 (재료의 도표 참조) (2 : 1). 그런 다음 2.5 M 염화칼슘 (2) 50 μl를 추가합니다.
- 최고 속도로 텍싱 동안 2 배 헤 페스 완충 생리 식염수 500 ㎕를 적가하여 침전물을 형성하는 500 ㎕의 DNA-TE-CaCl2를 혼합물 용액 (HBS를, 재료의 표 참조).
- 즉시 293T 세포 침전물을 추가합니다. 부드럽게 섞어 접시를 소용돌이 친다. 인큐베이터로 세포를 반환하고 형질 전환 한 후 매체 14-16 시간을 변경합니다.
- 미디어를 변경 한 후 세포 상층 액 30 시간을 수집합니다. 0.22 μm의 기공 니트로 셀룰로오스 필터를 통해 뜨는을 필터링하고 농도를 진행합니다.
- 정맥 주사의 농도
- 2 50,000 XG (SW-28의 초 원심 분리기 로터와 19,000 RPM)에서 초 원심 분리에 의해 조절 매체에 집중30 ㎖ 폴리 프로필렌 투명한 원뿔 로터 튜브를 실온 (RT)에서 HR.
참고 : 원뿔 회 전자 튜브를 사용하여 초 원심 분리기 어댑터 (재료의 표 참조). - 경사 분리하여 상층 액을 버리고 작은 부피 (200 μL 또는 하나의 원심 분리가 수행되는 경우 이하) 포스페이트 완충 염수에 재현 탁 펠렛 (PBS; 자재 표 참조). 그런 다음 최대 피펫 약 20 배 아래로.
- 현탁액을 풀 실온에서 2 시간 동안 50,000 × g으로 (SW-55 초 원심 분리기 로터와 23,000 RPM)에서 또한, 초 원심 분리에 의해 다시 집중한다. 5 ML의 공칭 볼륨과 폴리 프로필렌 투명 회 전자 튜브를 사용하여 (재료의 표 참조).
- 멸균 PBS 매우 소량 (중간의 시작 양의 1/500 또는 1 / 1,000)에 최종 펠렛을 재현 탁하고 실온에서 1 시간 동안 회전 진탕 휠. 작은 분취 량 (5 ~ 20 μL) 및 F로 분할-80 ° C에서 그들을 reeze.
- 폐기하기 전에 10 % 표백제와 모든 빈 튜브를 취급합니다.
- 2 50,000 XG (SW-28의 초 원심 분리기 로터와 19,000 RPM)에서 초 원심 분리에 의해 조절 매체에 집중30 ㎖ 폴리 프로필렌 투명한 원뿔 로터 튜브를 실온 (RT)에서 HR.
- 렌티 바이러스 적정 유동 세포 계측법을 사용하여
- 전날, 플레이트 (2) 둘 베코의 변형 이글의 중간 (DMEM) 용액에 6 잘 조직 배양 플레이트에 웰 당 5 × 10 4 헬라 세포는 (재료의 표 참조). 24 시간 동안 5~7% CO 2 분위기하에 가습 인큐베이터에서 37 ℃에서 인큐베이션.
- 적정의 날, 바이러스 주식의 분취 량을 해동과 DMEM에서 10-8로 10-3에서 연속 희석을 준비합니다.
- 이렇게하려면 24 웰 플레이트를 가지고 다음 우물에 제 1 웰에 DMEM 2 ㎖ 및 1.8 ml에 추가 할 수 있습니다. 다음 (: 1,000 10-3 1의 최종 희석) 제 1 웰에 집중 바이러스 주식의 2 μl를 추가합니다.
- 완전히 용액 변경 팁 혼합 10-3 희석액 200 ㎕를 전송 수회 피펫 팅 한 후두 번째 잘합니다. 10-8 희석이 될 때까지 다음 우물에 직렬 절차를 반복합니다.
- 인큐베이터에서 전날 도금 헬라 세포를 가져 가라. 조심스럽게 우물에서 매체를 제거합니다. 헬라 세포 함유 우물 8 ㎎ / ㎖ hexadimethrine 브로마이드 1 μL와 함께 각각의 바이러스 희석 한 ML을 추가합니다. 부드럽게 섞어 접시를 소용돌이 친다.
참고 Hexadimethrine 브로마이드 배양 세포에 바이러스 흡착을 증가 첨가된다. - 인큐베이터로 세포를 반환하고, 감염이 72 시간 동안 진행 할 수 있습니다. 그 후, 매체를 제거 PBS로 한번 세포를 씻어 트립신 EDTA 200 μl를 추가 각도 (재료의 표 참조).
- 37 ° C에서 5 분 후, 튜브 유동 세포 계측법에 각 웰 수확 세포에 PBS 2 ㎖를 추가합니다.
- RT에서 5 분 300 X g에서 원심 분리기와 뜨는을 대기음.
- 고정 soluti 1 ㎖로 펠렛을 재현 탁(PBS에 1 % 포름 알데히드 전자 현미경 등급 2 % 소 태아 혈청)을 다음 튜브 소용돌이.
- 15 mW의 전력에서 488 나노 아르곤 ionlaser를 사용하여 사이토 흐름 세포를 분석 할 수 있습니다.
- 표준 구성 기기 설정 : GFP에 대한 미래 분산 (FS), 측면 산란 (SS) 및 형광 (40분의 525 ㎚). SS 도트 플롯 대 FS의 선택 세포 인구의 게이팅 셀 단위 및 파편을 제외합니다. 로그 스케일에서 형광을 수집합니다. 각 샘플에서 GFP + 세포의 수를 계산한다.
- 다음 식을 이용하여 벡터 역가를 계산한다 : X 희석 인자 감염된 세포 (DF)의 %의 GFP + / 100에서 x = 열 변환 유닛 (TU) / ml로.
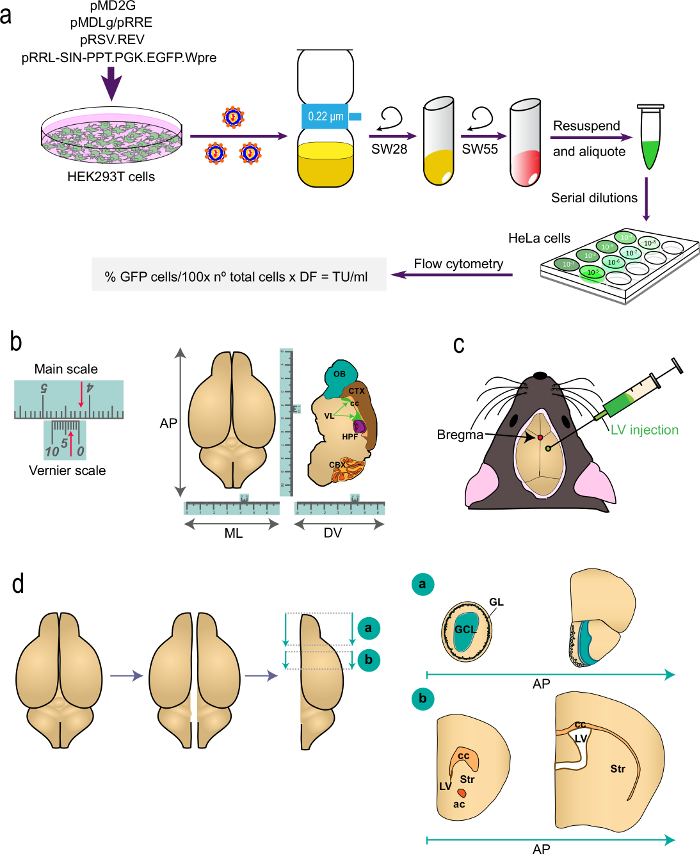
도 1 : 절차의 서로 다른 부분의 도식 표현 t의 (a) 1 부.그 프로토콜 : 적절한 플라스미드 HEK293T 세포의 형질 감염으로부터 생체 표지 연구 정맥 주사의 발생이 표시된 식을 이용하여 유세포 바이러스 역가의 결정에 정맥 주사를 생성한다. 플라스미드 및 원심 로터의 이름 표시된다. (b와 c) 프로토콜의 제 2 부 : 정맥 주사의 정위 주입. "B"는 버니어 스케일 정위 기기의 일부이고 정밀한 측정을 위해 제공하는 장치의 일례를 도시한다. 예를 들어, 화살표는 4.23 cm를 나타낸다. 버니어 스케일 ((ML) 메디 오 - 측면, 그리고 (왼쪽) 최고 뷰와 같이 배측 - 복부 (DV) 축과 시상 섹션의 안테 - 후방에서 좌표 (AP)를 마우스 오른쪽 결정하는 데 사용됩니다 ) 뇌의. "c"를 시상 및 관상 봉합의 교차점으로 브레 그마의 위치를 나타냅니다. 정맥 주사는 주사기를 사용하여 주입된다. (d)에 도식 도면에서는 뇌 난을 보여주는분석을 위해 처리 s의. 두 반구는 분할되어 각각 두 개의 블록으로 분할된다. (; 참조 Paxinos' 아틀라스를 참조 브레 그마 2.46 mm) 이전 기지국을 포함하는 블록 "은"즉시 telencephalon와 OB 접합에 후부 AP 수준에서 관상 절단에 의해 생성된다. 블록 "B"가 두 관상 인하, 레벨에 하나의 단지 (1.7 mm 브레 그마) 뇌량의 가장 주동이의 측면에 전방 두 측면 심실의 접합의 수준에서 두 번째에 의해 생성된다 (브레 그마 -0.22 mm). GL, 사구체 층; GCL, 과립제 전지 층; 일, 줄무늬; CC, 뇌량; 교류, 전방 접합면; 정맥 주사, 측면 뇌실.
V-SVZ / 줄무늬 테두리로 또는 측면 심실로 LV 2. 정위 주입은 (그림 1B)
- 예비
- 플런저 70 % 에탄올로 바늘 본체를 분무하여 33 게이지 바늘을 5 μL 용량 주사기 소독모든 방법을 꺼냈다. 반복적으로 1.5 ml의 microcentrifuge 관에서 에탄올을 기음과 여러 번 모든 방법을 밖으로 배출하고, 그 후 멸균 수로 철저하게 주사기를 씻어. 문화 후드에 안전하게 옆으로 주사기를 놓고는 건조 할 수 있습니다.
- 이 과정에서 모든 폐기물의 침수에 적합한 볼륨에 10 % 표백제와 생물 학적 폐기물 용기를 준비합니다 (일반적으로 500ml의 용기에 200 ㎖).
- 준비하고 물을 밀봉 플라스틱 저장 부대를 작성하고 37 ° C로 예열하여 37 ° C의 물침대를 예열. 이 마우스는 주입 다음 복구 할 수 있습니다.
- 주사를 시작하기 전에 C의 냉동고에 보관 -80 °에서 1 시간을 바이러스 주식을 제거하고 실온에서 회전 바퀴에 병을 놓습니다. 해동 후, 주사의 시간 동안 얼음에 바이러스 재고를 유지한다. LV의 정위 주입하기 전에, 10 (6) TU에 집중 바이러스 주식을 희석 / 문화 후드에 PBS를 사용 μL.
- 70 % 에탄올로 수술을 수행하는 선택된 영역 살균.
- LV의 미세 주입
- 선택 및 수술 (메스, 드릴, 작은 핀셋)에 필요한 도구를 소독.
- 케타민과 메데 토미의 동물 - 감독 혼합물을 주입 복강 (IP)에 의해 6 ~ 8 주령의 마우스를 마취. 각각의 동물을 체중 및 50-75 mg의 케타민 및 마우스의 체중 kg 당 0.5 mg을 메데 토미 (케타민 100-125 μL 해결 / 메데 토미 마우스 당 용액 작업) 각 선량.
- 발가락, 꼬리 나 귀를 곤란과 동물이 어떤 반응을 보여줍니다하도록하여 마취 비행기를 평가합니다.
- 마우스를 마취되면, 수술 - 후 통증을 최소화하기 위해 마우스 체중 kg 당 0.4-0.5 mg의 최종 투여 량 부토 르파 놀 피하 주사.
- 귀 사이의 영역을 면도 나 요오드 등 iodopovidone 또는 70 % 에탄올을 사용하여 피부를 소독. 멸균면을 사용하여 정화-tipped 어플리케이터. 이 저체온증을 악화시킬 수 있으므로 과도하게 동물을 적시하지 않도록주의.
- 정위 프레임에 발생하기 쉬운 위치에 동물을 배치하고주의 깊게 귀 바, 장치의 미각 지원을 사용하여 머리를 고정합니다. 37 ° C에서 가열 패드 세트와 마우스를 유지하고 눈 안과 윤활제를 적용합니다.
- 종 메스를 이용하여 두피에 1cm 긴 절개를 부드럽게 미세 핀셋을 이용하여 두개골을 노출시키기 위해 피부를 철회.
- 조심스럽게 멸균 면봉와 뼈 표면을 청소합니다. 남아있는 조직의 노출 된 두개골 뼈를 정화.
- 주사기 홀더를 사용하여 정위 장치의 멸균 주사기를 탑재합니다.
- 주사기 바늘의 끝 부분이 정수리, 시상 (종 방향 및 내측) 봉합사는 수직 관상 봉합에 의해 교차되는 결합 점에 위치 할 때까지 (Figur을 주사기 홀더 X, Y 및 Z 축 이동전자 1B). 배측 - 복부 (DV) 축 "제로"위치는 브레 그마의 두개골 표면에 있는지 확인합니다.
- X 및 Y 좌표를 대상으로 주사기를 이동 (표 1 및도 1B 참조).
| 주사의 지역 | 좌표 | ||
| 안테 - 후부 (AP) | 메디 오 - 측면 (ML) | 배측 - 복부 (DV) | |
| SEZ / 줄무늬 테두리 | 0.6 mm | 1.2 mm | -3.0 mm |
| 측면 뇌실 | -0.3 mm | 1.0 mm | -2.6 mm |
표 1 : 정위는의 좌표용 돌기. AP와 ML 축, x 및 y 좌표의 경우는 브레 그마에서 (mm)에 거리로 제공됩니다. "-" "후방을 향해"을 나타냅니다. DV는 "제로"좌표 정수리 점에서 두개골 표면이며 DV 좌표 다운이 시점에서 (mm)에서의 거리를 나타낸다.
- X, Y 및 Z 주석 목적지 나중에 다시 주사 부위에 올 수 있도록하기 위해 버니어 눈금 조정한다. 마크 수술 마커 펜을 사용하여 x 및 y 좌표에있는 뼈.
- 작업 영역에서 멀리 주사기를 이동합니다.
- 전기 드릴 신중하지 두개골에 구멍을 사용하면 뇌가 손상 될 수 있습니다. 이 뇌 표면에 손상을 줄 수 있으므로 pial 표면을 드릴하지 마십시오.
- 10 6 TU / μL 바이러스 솔루션의 1 μL와 주사기를로드합니다. 선단 10 ~ 12 °의 각도가 33 게이지 경 사진 날카로운 바늘을 사용합니다. 90 ° 중앙에 주사기 바늘의 위치를제작 뇌 표면에 대하여.
- 다시 주사 부위에 주사기를 이동하고 끝이 pial 표면에 닿을 때까지 아래로 이동합니다.
- DV 축 좌표 Z에 주사기와 뇌를 침투.
- 천천히 과도한 유체 압력 뇌 조직의 손상을 최소화하기 위해, 0.2 μL / 분의 속도로, 바이러스 현탁액을 해제.
- 바이러스 현탁액의 역류를 최소화하기 위해 5 ~ 10 분 동안 기다린 후 아주 천천히 주사기를 철회. 닦아 실험실을 사용하여 주사기의 수축의 결과로 표면에 표시하고, 표백제 함유 바이오 안전성 폐기물 용기에 즉시 배치 할 수 액체의 초과를시킨다.
- , 정위 세트에서 동물을 따뜻한 패드에 배치, 피부 접착제를 사용하여 상처를 닫습니다. 0.1 ~ 1.0 ㎎ / ㎏ 체중 atipamezole을 사용하여 마취 역방향.
- 피하 0.1 밀리그램 당 kg 마우스 중량 매 12 시간의 마지막 투여 량을 주입 Bupenorphrine,짧은 지속 부토 르파 놀의 진통제의 투여 후 4 시간을 시작.
- 따뜻한 패드 개별 새장에 동물을 배치하고 마우스가 마취에서 회복 될 때까지 긴밀하게 모니터링 할 수 있습니다. 복구 후 동물의 수화물을 돕기 위해 새장에 하이드로 겔의 한 가방을 놓습니다.
- 액체 표백제 생물 학적 처리의 모든 생물 오염 된 폐기물 폐기하십시오. 흡입 및 에탄올의 배출에 의해 주사기를 청소하고 물로 씻어. 지역, 정위 세트와 표백제 및 70 % 에탄올에 사용 된 수술 재료를 소독.
- 그들은 기존의 주거 시설로 전송할 수 있습니다 후 24 ~ 48 시간 동안 바이오 안전성 레벨 2 방에 격리 주입 된 쥐를 유지
3. 조직 학적 분석
- 관류, 조직 수집 및 단면
- 깊이 메데 토미와 케타민의 수의학 - 감독 혼합물을 사용하여 쥐를 마취시키다 (t 곤란하여 마취면을 평가OES, 꼬리 나 귀), 전술 한 바와 같이.
- 동일한 속도로 transcardially 17 PB 75 ml의 4 % PFA이어서 식염수 25 ㎖로 쥐를 관류.
- 뇌를 추출하고 16 시간 (증가 후 고정 시간은 어떤 항원의 면역 반응을 감소시킬 수있다)에 대한 PB 차가운 4 % PFA의 10 배 볼륨에 침지하여 포스트 - 수정. PB 충분히 남아 PFA 씻으십시오.
- 그림 1D의 표시 다음 뇌를 잘라 시아 노 아크릴 레이트를 사용하여 vibratome의 홀더에 결과 블록을 붙입니다.
- vibratome를 사용하여 30 μm의 두께 시리얼 코로나 섹션을 수집합니다. 4 ° C에서 PB와 24 멀티 웰 플레이트의 뇌 조각을 저장합니다. 오염을 방지하기 위해 0.05 % 나트륨 아 지드 PB 용액에 첨가 할 수있다.
- 면역 조직 화학
- 0.05 % 아 지드 화 나트륨, 1 % 글리신, 5 % 정상 염소 혈청 완충액 (PB 블로킹 부동성 섹션을 인큐베이션하고 0.1 % TritX-100) 부드러운가 흔들 플랫폼에서 진탕 실온에서 1 시간에 대한합니다.
- 조심스럽게 버퍼를 차단에 방지 GFP 토끼 차 항체 (재료의 표 참조)의 적절한 희석을 추가, 피펫 차단 버퍼를 제거하고 부드러운 흔들림 4 ° C에서 48 시간 동안이 희석 조직을 품어.
- 차 항체 용액을 PB로 3 회 최소 하나의 세척 매 10 분을 씻으십시오.
- 차단 솔루션에 형광 접합 된 이차 항체의 적합한 희석와 자유 떠있는 부분)을 품어 (RT 부드러운 흔들림에서 1 시간 동안) 재료의 표를 참조하십시오. 배양 중에 직접 빛의 섹션을 보호합니다.
- PB, 3 번에 한번 10 분간 함께 차 항체 용액을 세정하고, 5 분 동안 물에 1 ㎎ / ㎖에서 DAPI (4 ', 6-diamidino -2- 페닐 인돌)을 섹션을 배양하여 조직을 Counterstain과. 두 번 빠르게 재치를 세척하여 DAPI 솔루션을 씻어시간 물.
- 부드럽게 잘 페인트 브러시를 사용하여 현미경 슬라이드에 섹션을 배치합니다. 조직 위에 (자재 표 참조) 형광 제제 매체 장착 몇 방울 붓고 신중 장착 용액 정확하게 전체면에 걸쳐 분산되고, 기포가 없는지 검사 위에 커버 슬립을 놓는다. 부드럽게 매체 장착 과잉 드레인 커버 슬립을 짠다.
- 장착 용액 (2-16 시간)를 마르면 때 488 nm의 레이저와 공 초점 레이저 주사 현미경으로 샘플을 분석한다.
결과
LV - 매개 유전자 전달 시스템은 증식, 이동 및 분화 중에 그들의 추적 및 유전 적 변형을 허용 성인 마우스 V-SVZ 세포의 생체 내 전달에 장기간 사용할 수있다. 감염과 표현은 매우 효과적이며, 기자가 포함의 식으로 다른 감염되지 않은 세포들 사이를 쉽게 구별 할 수있는 다수의 세포를 얻을. 우리는 지금까지 보편적으로 발현 포스 포 키나제 프로모터에 의해 구동 GFP 형광 리포터 형질 세?...
토론
정맥 주사는 성인의 유전자 변형 NSCs의 16, 18에 대한 다른 바이러스 시스템에 비해 중요한 장점을 제공합니다. V-SVZ 틈새 시장에 렌티 바이러스의 정위 배달 레이블 만 세포를 대상으로 여러 세포 분열, 또는 레트로 바이러스 후 희석 등의 BrdU의 같은 다른 일반적으로 사용되는 방법의 한계를 극복 B1-NSCs을 나누어 자주 추적하는 효율적인 방법을 나타냅니다 즉, 응용 프로그램의 순간에 확?...
공개
모든 조작은 바이오 안전성 수준이 방에서 이루어졌다. 동물 프로토콜은 발렌시아 대학의 윤리위원회의 승인과 유럽 지침 63분의 2,010 / EU 준수 모든 있었다되었다.
감사의 말
우리는 MJ 팔롭의 도움말 및 대학교 드 발렌시아의 SCSIE의 기술 지원을 인정합니다. 우리는 또한 도움이 의견과 원고의 논의 안토니아 Follenzi 감사합니다. 그 산탄데르 대학교 글로벌 사업부를 통해 방코 산탄데르에 의해 재단이 보틴,에 의해 Generalitat 발렌시아 (Programa PROMETEO, ACOMP 및 ISIC)과 Ministerio 드 Economìa y를 Competitividad에서 보조금을 지원하는 경우 (MINECO : SAF2011-23331, CIBERNED 및 RETIC 수컷 매) . 이 작품은 또한 (260511- MINECO과 유럽 연구위원회 (ERC) 2012-STG에서 BFU2010-21823 및 RETIC 수컷 매 보조금 지원 PD-HUMMODEL AC BM-P)이다. MINECO의 스페인 FPI의 교제를받는 사람이다.
자료
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25 mm x 89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13 mm x 51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100 x 20 style |
| FACS tubes | Afora | DE400800 | 12 mm x 75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2x HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100x, used to prepare HeLa and 293T culture medium at a final concentration of 10x. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10x, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1x PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1,000x stock solution at 8 mg/ml in dHO |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | http://www.leicabiosystems.com/ |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33 gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11 cm x 21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25 G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
참고문헌
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유