É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estável e eficiente modificação genética de células do rato adulto V-SVZ para a Análise da Neural Stem Cell Autónoma e Efeitos não autónomos
Neste Artigo
Resumo
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Resumo
Relativamente células estaminais somáticas quiescentes apoiar a renovação celular ao longo da vida, na maioria dos tecidos adultos. As células estaminais neurais no cérebro de mamíferos adultos está restrita a dois nichos neurogénicos específicos: a zona subgranular do giro dentado no hipocampo e na zona ventricular-subventricular (V-SVZ; também denominada zona subependimal ou SEZ) nas paredes das laterais ventrículos. O desenvolvimento de estratégias de transferência in vivo de genes para as populações de células estaminais adultas (isto é, as do cérebro de mamíferos), resultando em expressão a longo termo de transgenes desejados nas células-tronco e a sua descendência resultante é uma ferramenta importante na investigação biomédica e biotecnológica corrente. Aqui, um método direto in vivo é apresentado para a modificação genética estável de células do rato adulto V-SVZ que se aproveita da infecção independente do ciclo celular por LVs ea citoarquitetura altamente especializada do nicho V-SVZ. Especificamente, o protocolo atual envolvems a injecção do LVS vazio (controlo) ou LVs que codificam as cassetes de expressão de transgenes específica para qualquer um do próprio V-SVZ, para o direccionamento in vivo de todos os tipos de células no nicho, ou para o lúmen do ventrículo lateral, para o direccionamento de ependimária células única. As cassetes de expressão são, em seguida, integrado no genoma das células transduzidas e proteínas fluorescentes, também codificados pelo LVS permitir a detecção das células transduzidas para a análise dos efeitos dependentes do nicho de células autónomos e não autónomos, em células marcadas e os seus progênie.
Introdução
A zona ventricular-subventricular murino (V-SVZ), nas paredes do ventrículo lateral de frente para o corpo estriado, é uma região germinal muito activa, na qual um processo contínuo de replicação de células progenitoras e diferenciação resulta na produção persistente de bolbo olfactivo (OB ) interneurônios e oligodendrócitos corpo caloso 1. A geração ao longo da vida destas células parece ser apoiada pela presença nesta região de células neurais estaminais (NCCC, também chamado células B1), que expressam a proteína ácida fibrilar glial antigénio astrócitos (GFAP) e a haste marcadores celulares, tais como a nestina, Id1 e Sox2 2. GFAP-expressando células B1 gerar células (TAP) (células C), que expressam fatores de transcrição Dlx2 trânsito ampliando progenitor (distal-less homeobox 2) e Ascl1 (mamíferos achaete-Schute homólogo 1) e se dividem rapidamente algumas vezes antes de dar lugar a neuroblastos que migram (células a) ou oligodendroblasts 3. Recém-gerado prolifneuroblasts operatória migrar anteriormente, formando o fluxo migratório rostral (RMS) para o OB, onde eles integrar o granular e camadas glomerular como interneurônios inibitórios diferenciados. A migração de jovens oligodendroblasts passar para o CC, onde eles se tornam células imaturas NG2-positiva que continuam a dividir localmente ou se diferenciar em oligodendrócitos myelinating maduros 1,4.
células B1, que derivam de células gliais radiais fetais, retêm a morfologia alongada e polarizada de seus antecessores e exibem uma relação altamente especializada, com o seu nicho. Eles abrangem entre a ependyma que alinha o ventrículo e da rede de vasos sanguíneos que irrigam o nicho V-SVZ. O pequeno processo apical das células intercala B1 entre ependimócitos multiciliated e termina em um único cílio primária não-móveis, ao passo que o seu processo basal estende longas distâncias para abordar o plexo vascular planar que irriga este nicho final no blamina asal dos capilares do plexo 2,5-8.
A maneira mais confiável para distinguir B1-NSCs a partir de astrócitos não-neurogênicas, que também são GFAP +, no nicho V-SVZ intacto é baseado em preparações com parede lateral do ventrículo e sua análise por microscopia confocal 3-D de toda a montar depois imunocoloração para GFAP para rotular o processo apical fina B1-NSC, β-catenina para delinear as membranas celulares, e ambos os γ-tubulina como um marcador de corpos basais cilial ou acetilado α-tubulina para rotular a extensão de cada cílio 5,8. Observações destas montagens inteiras-a partir da superfície do ventrículo indicaram que as células ependimais e B1 estão dispostas em "" cata-ventos 5, em que os processos apicais uniciliated de um ou vários GFAP + B1 células são cercadas por uma roseta de células ependimais multiciliated.
A morfologia característica de células B1 correlaciona-se com a evidência experimental indicating que os vasos sanguíneos / células endoteliais e ventriculares líquido cefalorraquidiano (LCR) constituem fontes reguladas de sinais solúveis que agem em NSCs 2,6,9-11. Na superfície ventricular, homot�ica e interações APICO-lateral heterotípicos envolvendo células ependimárias e B1 incluem junções apertadas e junções aderentes 5,12. Além disso, as moléculas de adesão implicados nos complexos juncionais entre as células B1 e ependimais, tais como N-caderina e V-CAM, têm sido mostrados para regular não só o posicionamento altamente organizada de B1 no nicho V-SVZ, mas também a sua quiescência 12 , 13. A monocamada de células ependimária-B1 parece actuar como uma barreira de difusão, permitindo o fluxo regulado de água e pequenas moléculas a partir do CSF, mas restringindo a passagem de grandes proteínas intercelular 10,11. A evidência experimental indica que o cílio apical de células B1 singularmente posicionada poderia desempenhar um papel como um sensor de sinalização polipeptídeos presentes no CSF 2,5-7. Células ependimais são, por si só, também uma fonte de sinais solúveis e ligadas à membrana, com um papel na regulação do comportamento NSC 14,15.
Rastreáveis nucleósidos, tais como bromo-desoxiuridina (BrdU), ou retrovírus têm sido amplamente utilizados para marcar células progenitoras, incluindo as NSC, in vivo. No entanto, estes métodos não são ideais para o rastreio destino a longo prazo em virtude dos sinais de BrdU diluído através de divisões celulares utilizadas e retrovírus parecem ter como alvo, preferencialmente, de forma transiente células, devido à sua exigência de proliferação celular para a transdução 16,17 amplificar. Para examinar NSC fisiologia in vivo, incluindo interações com componentes de nicho, é fundamental estabelecer um método para rotular e rastrear células raramente se dividem, como B1-NSCs são em grande parte de repouso e as suas células ependimárias vizinhos Nunca dividir em condições fisiológicas 3. Aqui, mostramos que vetores de lentivírus (VEs) permitir a marca de gene de alta eficiênciação e modificação de longo prazo de NSC adultas e células ependimais que não se dividem, devido razoavelmente mais a sua capacidade para transduzir e a integrar-se no genoma das células alvo de um modo independente do ciclo celular. Além disso, mostramos como a rota de entrega e viral título de ajuda para transduzir especificamente células ependimárias, mas não células B1 permitindo assim a análise dos efeitos, ependimárias dependente de nicho no NSC.
Protocolo
ÉTICA DECLARAÇÃO: Este protocolo segue as diretrizes de cuidados de animais da Universidade de Valência, em conformidade com a Directiva Europeia 2010/63 / UE.
1. Geração de LV para In Vivo Marcação Estudos (veja a Figura 1-A)
CUIDADO: O procedimento aqui descrito é o nível de biossegurança 2, portanto, executar todos os procedimentos a seguir em uma capa de risco biológico. Garantir que o pessoal de investigação são devidamente qualificados e treinados em todos os procedimentos. Usar equipamento de protecção pessoal, incluindo vestido, luvas duplas e proteção ocular adequada. Finalmente, completamente descontaminar todas as ferramentas e superfícies que poderiam ter estado em contacto com vírus de acordo com práticas de instalação de desinfecção aprovados (limpando com 70% de etanol, 10% de água sanitária e / ou autoclavagem).
- Produção de LV em embrionárias humanas células de rim 293T
- Comece este protocolo, preparando DNA puro para transfecção. Preparar e purificar cada plasmídeo com um duplo grad CsClcentrifugação tário ou outros métodos de coluna disponíveis comercialmente produzindo DNA livre de endotoxina. Neste protocolo temos usado o vetor plasmídeo de transferência pRRL-SIN-PPT.PGK.EGFP.Wpre. Recomendados plasmídeos de empacotamento principais são pMDLg / pRRE e pRSV.REV e envelope plasmídeo pMD2G 13,18,19.
- Vinte e quatro horas antes da transfecção, a placa 5 x 10 6 em células 293T de Iscove modificado por Dulbecco Médio (IMDM) (ver Tabela de Materiais) num prato de plástico de 10 cm de modo a obter uma cultura de cerca de 1/4 a 1/3 para confluentes transfecção. Incubar a 37 ° C num incubador humidificado numa atmosfera de 5-7% de CO 2.
- Substituir o meio com frescos média 2 horas antes da transfecção.
- Em uma mistura estéril tubo de microcentrífuga de 1,5 ml 10 ng do plasmídeo vector de transferência (contendo o ADNc do transgene ou a shRNA a ser entregue) com 2,5 ug do pRSV.REV e 5 ug dos plasmídeos de empacotamento pMDLg / pRRE, e 3.5 & #181; g do plasmídeo envelope pMD2G. Perfaz-se a solução de plasmídeo para um volume final de 450 ul com tampão de 0,1 x TE (ver Tabela de Materiais) / dH 2 0 (2: 1). Em seguida adicionar 50 uL de 2,5 M de CaCl2.
- Forma-se o precipitado por adição gota a gota de 500 ul de 2x o salina tamponada com HEPES (HBS, ver Tabela de Materiais) para a solução de DNA-CaCl-TE mistura 500 ul de 2 aquando da mistura à velocidade máxima.
- Adicionar o precipitado às células 293T imediatamente. Agite suavemente a placa para misturar. Devolver as células para a incubadora e alterar a forma 14-16 h após a transfecção.
- Recolher os sobrenadantes das células 30 horas após alterar a mídia. Filtrar o sobrenadante através de um filtro de nitrocelulose de 0,22 um poro e proceder à concentração.
- Concentração do LVS
- Concentra-se o meio condicionado por ultracentrifugação a 50000 xg (19000 rpm, com rotor de ultracentrífuga SW-28) para doish à temperatura ambiente (RT) em um tubo de rotor cónico de 30 ml de polipropileno transparente.
Nota: Utilize adaptadores de ultracentrífuga para tubos de rotores cônicos (ver tabela de Materiais). - Descartar o sobrenadante por decantação e voltar a suspender as pelotas em um pequeno volume (200 mL ou menos, se apenas uma centrifugação é realizada) de tampão de fosfato salino (PBS; ver Tabela de Materiais). Então pipeta cima e para baixo cerca de 20 vezes.
- Reunir as suspensões e concentra-se novamente por ultracentrifugação, também a 50000 x g (23000 rpm com SW-55 de rotor de ultracentrífuga) durante 2 horas à temperatura ambiente. Use polipropileno tubos de rotores transparente com um volume nominal de 5 ml (ver Tabela de Materiais).
- Ressuspender o sedimento final em um volume muito pequeno (ou 1/500 1/1000 do volume inicial de meio) de PBS estéril e agitar numa roda rotativa durante 1 h à TA. Dividir em pequenas alíquotas (5-20 uL) e freeze-las a -80 ° C.
- Tratar todos os tubos vazios com lixívia a 10% antes de descartar.
- Concentra-se o meio condicionado por ultracentrifugação a 50000 xg (19000 rpm, com rotor de ultracentrífuga SW-28) para doish à temperatura ambiente (RT) em um tubo de rotor cónico de 30 ml de polipropileno transparente.
- Lentivirus titulação utilizando Citometria de Fluxo
- O dias antes, a placa 5 4 x 10 células HeLa por poço em placas de seis cavidades de cultura de tecido em 2 ml de meio de Dulbecco modificado de Eagle (DMEM) (ver Tabela de Materiais). Incubar a 37 ° C num incubador humidificado numa atmosfera de 5-7% de CO 2 durante 24 horas.
- No dia da titulação, descongelar uma parte alíquota do estoque virai e preparar diluições em série, a partir de 10 -3 a 10 -8, em DMEM.
- Para fazer isso, tomar um prato de 24 cavidades e adicionar 2 ml de DMEM para o primeiro poço e 1,8 ml com os seguintes poços. Em seguida, adicionar à primeira cavidade 2 ul do estoque virai concentrada (para uma diluição final de 1: 1000 ou 10 -3).
- Após pipetagem várias vezes para misturar bem a solução, alteração ponta e transferir 200 ul da diluição de 10 -3para o segundo poço. Repetir o processo em série nos seguintes poços até à diluição de 10 ~ 8 é feita.
- Tome células HeLa banhados no dia anterior da incubadora. Cuidadosamente remova o meio de poços. Adicionar 1 ml de cada diluição virai, juntamente com 1 ml de 8 mg / ml de brometo de hexadimetrina aos poços contendo células HeLa. Agite suavemente a placa para misturar.
Nota: O brometo de Hexadimetrina é adicionado para aumentar a adsorção de vírus para as células em cultura. - Devolver as células para a incubadora e para permitir que a infecção prosseguir durante 72 horas. Depois disso, retirar o meio, lavar as células uma vez com PBS e adicionar 200 ul de tripsina-EDTA (ver Tabela de Materiais) para cada poço.
- Após 5 min a 37 ° C, adicionar 2 ml de PBS a cada poço e de colheita de células em tubos de citometria de fluxo.
- Centrifuga-se a 300 x g durante 5 min à temperatura ambiente e aspirar o sobrenadante.
- Ressuspender o sedimento com 1 ml de fixação solutiem (1% electrões formaldeído microscopia grau e soro fetal de bovino a 2% em PBS), em seguida, os tubos vortex.
- Analisar as células num citómetro de fluxo usando uma atmosfera de árgon a 488 nm-ionlaser a 15 mW de potência.
- Configurar o instrumento com a configuração padrão: frente-dispersão (FS), side-dispersão (SS) e de fluorescência para GFP (525/40 nm). Select gating população de células em um FS vs. SS ponto de excluir agregados de células e de detritos. Recolha de fluorescência em escala logarítmica. Calcular o número de células GFP + em cada amostra.
- Calcular vector título usando a seguinte fórmula:% de GFP + / 100 x Número de células infectadas x factor de diluição (FD) = unidades de transdução (TU) / ml.
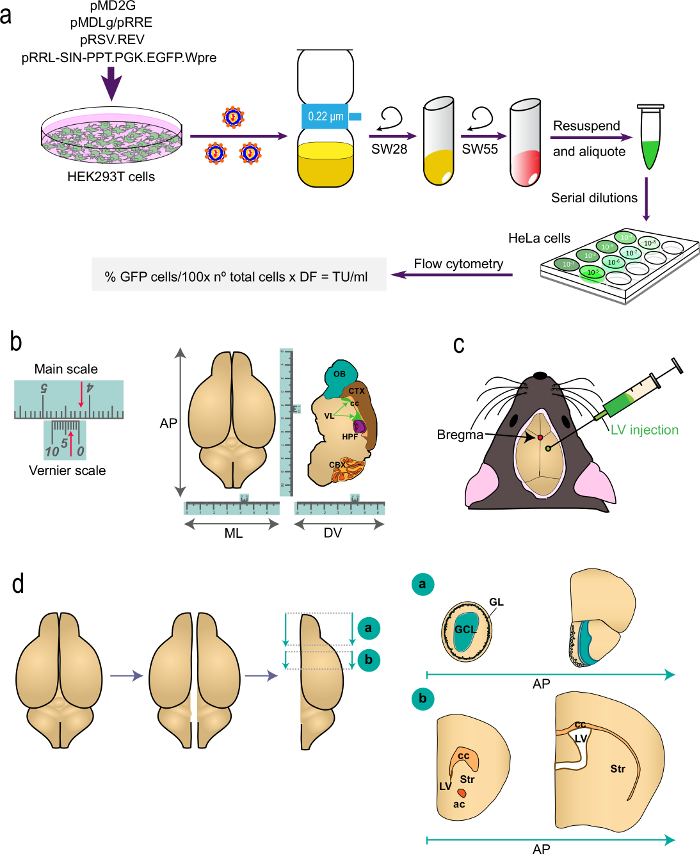
Figura 1: Representação esquemática das diferentes partes do procedimento (a), a parte 1 do t.ele protocolo: geração do LVS para estudos de marcação in vivo, a partir da transfecção de células HEK293T com plasmídeos apropriados para gerar os LVS da determinação do título de vírus por citometria de fluxo utilizando a fórmula indicada. Os nomes dos plasmídeos e os rotores de centrifugadoras são indicados. (B e c) Parte 2 do protocolo: a injeção estereotáxica de LVs. "B" representa um exemplo de uma escala de Vernier, um dispositivo que faz parte de instrumentos estereotáxica e serve para medições finas. Como um exemplo, as setas indicam 4.23 cm. Uma escala Vernier é usado para determinar as coordenadas na antero-posterior (AP), médio-lateral (ML) e dorso-ventral eixo (DV) como mostrado para um top-view (esquerda) e para um corte sagital (direita ) do cérebro. "C" indica a posição do bregma como a intersecção entre as suturas sagital e coronal. LVs são injectados utilizando uma seringa. (D) desenhos esquemáticos mostrando como o i cérebros processadas para análise. Os dois hemisférios são separados e cada um é dividido em dois blocos. Bloco de "a", que contém os OBS, é produzida por um corte coronal ao nível de AP imediatamente posterior à junção de OB com o telencéfalo (bregma 2,46 milímetros; ver Paxinos' Atlas para referência). Bloco de "b" é produzida por dois cortes coronais, uma ao nível imediatamente anterior à aspecto mais rostral do corpo caloso (bregma 1,7 mm) e um segundo no nível da junção dos dois ventrículos laterais (bregma -0,22 milímetros). GL, camada glomerular; GCL, camada de células granulares; st, estriado; cc, corpo caloso; ac, comissura anterior; lv, ventrículo lateral.
2. Injecção estereotáxica de LV no estriado beira / V-SVZ ou no ventrículo lateral (ver Figura 1b)
- Preparação
- Esterilizar uma seringa de capacidade de 5 mL com uma agulha de calibre 33 através da pulverização para baixo e o corpo da agulha com etanol a 70% com o êmbolotirou todo o caminho. Repetidamente aspirar etanol a partir de um tubo de microcentrífuga de 1,5 ml e ejetá-lo todo o caminho várias vezes, e lave a seringa cuidadosamente com água esterilizada depois. Coloque a seringa com segurança de lado na capa de cultura e deixe-a secar.
- Prepare um recipiente de resíduos de risco biológico com 10% de água sanitária para um volume adequado para imersão de todos os resíduos deste processo (geralmente 200 ml em um recipiente de 500 ml).
- Preparar e pré-aquecer a cama de água C 37 ° enchendo um saco de armazenamento plástico lacrado com água e aquecimento para 37 ° C. Isso permitirá que os ratos a recuperar a seguir à injecção.
- Remover os estoques virais de -80 ° C congelador armazenamento 1 h antes de iniciar as injecções e colocar o frasco numa roda rotativa à temperatura ambiente. Após o descongelamento, manter o estoque viral no gelo durante o tempo das injeções. Antes da injecção estereotáxica de LV, diluir as reservas virais concentrados para 10 6 TU / mL utilizando PBS na capa de cultura.
- Higienizar a área seleccionada para a realização da cirurgia com 70% de etanol.
- A microinjecção de LV
- Selecione e esterilizar instrumentos necessários para cirurgia (bisturi, broca, e pequenas pinças).
- Anestesiar um rato de 6-8 semanas de idade, por via intraperitoneal (ip) injecção de uma mistura veterinário-supervisionado de cetamina e medetomidina. Pesar cada animal e cada dose de 50-75 mg de cetamina, com 0,5-1 mg e medetomidina por kg de peso corporal do rato (cerca de 100-125 ul da cetamina / medetomidina solução de trabalho por ratinho).
- Avaliar o plano anestésico por beliscar a ponta dos pés, cauda ou orelha e garantir que o animal não mostra nenhuma reação.
- Uma vez que o mouse é anestesiado, injetar butorfanol por via subcutânea na dose final de 0,4-0,5 mg por kg de peso do mouse para minimizar a dor pós-cirúrgica.
- Raspar a área entre as orelhas e desinfectar a pele usando um iodoforo tal como iodopovidona ou 70% de etanol. Limpar com algodão estérilaplicadores -tipped. Tenha cuidado para não molhar excessivamente o animal, pois isso pode agravar a hipotermia.
- Colocar o animal em decúbito ventral em um quadro estereotáxico e fixar cuidadosamente a cabeça usando as barras de ouvido e o apoio paladar do aparelho. Mantenha o mouse com um conjunto almofada de aquecimento a 37 ° C e aplique o lubrificante oftálmica para os olhos.
- Faça uma longa incisão de 1 cm na pele da cabeça longitudinalmente utilizando um bisturi, e suavemente retrair a pele para expor o crânio usando uma pinça fina.
- Limpe cuidadosamente a superfície do osso com um aplicador com ponta de algodão estéril. Limpar o osso do crânio exposto de qualquer tecido remanescente.
- Montar a seringa esterilizada no dispositivo estereotáxico com o porta-seringa.
- Mover o eixo de suporte de seringa x, y e z até que a ponta da agulha da seringa é posicionado sobre a bregma, o ponto de articulação onde a sutura sagital (longitudinal e medial) é intersectada por perpendicularmente da sutura coronária (Figure 1b). Certifique-se de que a posição "zero" do eixo dorso-ventral (DV) é a superfície do crânio em bregma.
- Mover a seringa para as coordenadas x e y de destino (ver Quadro 1 e Figura 1b).
| Região de injecção | coordenadas | ||
| Antero-posterior (AP) | Medio-lateral (ML) | Dorso-ventral (DV) | |
| SEZ fronteira / striatum | +0,6 mm | +1,2 mm | -3.0 mm |
| ventrículo lateral | -0.3 mm | +1.0 mm | -2.6 mm |
Tabela 1: coordenadas estereotáxica para o noprojecções. para o AP e o eixo ML, coordenadas x e y são dadas como uma distância (em mm) a partir da bregma. "-" Indica "no sentido posterior". Para o DV coordenadas "zero", é a superfície do crânio em bregma e o ponto de coordenadas DV indicar a distância (em mm) para baixo a partir deste ponto.
- Anotar a x, y e z coordenadas de destino em escala vernier de modo a ser capaz de voltar para o local de injecção mais tarde. Mark osso nas coordenadas X e y usando uma caneta cirúrgica.
- Mover a seringa para fora da área de trabalho.
- Utilizando uma broca eléctrica fazer um orifício no crânio com cuidado para não danificar o cérebro. Não perfure a superfície pial, pois isso pode danificar a superfície do cérebro.
- Carregar a seringa com 1 ul da solução virai 6 10 TU / mL. Use uma agulha chanfrada afiada calibre 33 cuja ponta tem um ângulo de 10-12 °. Posicionar a agulha da seringa em um ang 90 °le em relação à superfície do cérebro.
- Mova a seringa de volta para o local da injecção e movê-lo para baixo até que a ponta toca a superfície pial.
- Penetrar no cérebro com a seringa para a coordenada z no eixo DV.
- libertar lentamente a suspensão virai, a uma velocidade de 0,2 ul / min, a fim de minimizar os danos para o tecido cerebral devido à pressão do fluido em excesso.
- Esperar por 5-10 min para minimizar o refluxo de suspensão viral e, em seguida, retirar a seringa muito lentamente. Blot qualquer excesso de líquido que podem aparecer na superfície como um resultado da retracção da seringa usando um laboratório limpar e colocá-lo imediatamente no recipiente de resíduos segurança biológica contendo lixívia.
- Levar o animal para fora do set estereotáxica, coloque-o em uma almofada quente, e fechar a ferida usando adesivo de pele. Reverter a sedação usando 0,1-1,0 mg / kg de peso corporal atipamezol.
- Injectar Bupenorphrine por via subcutânea numa dose final de 0,1 mg por kg de peso do rato a cada 12 horas,começando 4 horas após a administração do analgésico butorfanol curta duração.
- Colocar o animal em uma gaiola individualizado com uma almofada quente e acompanhar de perto até que o mouse se recupera da anestesia. Coloque um saco de hidrogel na gaiola para ajudar o hidrato de animais após a recuperação.
- Eliminar todos os resíduos contaminados com bio na alienação de branqueamento de risco biológico líquido. Limpe a seringa por aspiração e de ejeção de etanol e enxaguar com água. Desinfectar a área, o conjunto estereotáxico eo material cirúrgico que tem sido utilizado com água sanitária e 70% de etanol.
- Mantenha camundongos injetados isoladas no Nível de Biossegurança 2 sala de durante 24-48 h, após o que pode ser transferido para uma instalação de alojamento convencional
3. Análise histológica
- Perfusão, coleta de tecido e corte
- Profundamente anestesiar os ratos usando uma mistura supervisionado-veterinária do medetomidine e cetamina (avaliar o plano anestésico por beliscar a tOES, cauda ou orelha), tal como descrito antes.
- Transcardialmente perfundir os ratos com 25 ml de solução salina seguido por 75 mL de PFA a 4% em STP à mesma velocidade 17.
- Extrai-se a pós-cérebro e corrigi-lo por imersão em pelo menos 10 vezes o seu volume de frio PFA a 4% em STP durante 1-16 horas (maiores tempos de pós-fixação pode diminuir a imunorreactividade de alguns antigénios). Lavar a fundo as PFA restante com PB.
- Cortar o cérebro seguindo as indicações da Figura 1d e cola o bloco resultante para o titular de uma vibratome utilizando cianoacrilato.
- Colete 30 cortes coronais em série um de espessura usando um vibratome. Armazenar as fatias de cérebro em placas de 24 poços múltiplos com PB a 4 ° C. Para evitar a contaminação, 0,05% de azida de sódio pode ser adicionado à solução de PB.
- A imuno-histoquímica
- Incubar as secções de flutuação livre em tampão de bloqueio (PB com azida de sódio a 0,05%, 1% de glicina, soro de cabra normal a 5%, e 0,1% Tritem relação a X-100) durante 1 h à TA com agitação suave numa plataforma oscilante.
- Cuidadosamente remover o tampão de bloqueio com uma pipeta, adicionar uma diluição adequada de anticorpo primário de coelho anti-GFP (ver Tabela de Materiais) em tampão de bloqueio e incubar tecido com esta diluição durante 48 h a 4 ° C com agitação suave.
- Lavar a solução de anticorpo primário um mínimo de 3 vezes com PB, uma lavagem a cada 10 min.
- Incubar as secções de flutuação livre com uma diluição adequada de anticorpos secundários conjugados com fluoróforo) em solução de bloqueio (ver Tabela de Materiais) durante 1 h à temperatura ambiente e agitação suave. Proteger as seções de luz directa durante a incubação.
- Lavar a solução de anticorpo secundário com PB, 3 vezes, uma vez a cada 10 min, e contracoloração do tecido por incubação das secções com DAPI (4 ', 6-diamidino-2-fenilindol) a 1 mg / ml em água, durante 5 min. Lavar a solução DAPI por lavagem duas vezes e rapidamente with de água.
- Delicadamente, coloque as seções sobre uma lâmina de microscópio usando um pincel fino. Pour algumas gotas de meio de montagem para preparações fluorescentes (ver Tabela de Materiais) sobre o tecido e coloca cuidadosamente uma lamela por cima, a verificação de que a solução de montagem é correctamente distribuído sobre toda a superfície e que não há bolhas. Aperte suavemente para baixo a lamela para drenar o excesso de meio de montagem.
- Quando a solução de montagem seca (2-16 hr), analisar a amostra por microscopia confocal de varrimento laser com o laser de 488 nm.
Resultados
Sistema de entrega de genes mediada por LV pode ser utilizado para a longo prazo na transdução in vivo de células do ratinho adulto V-SVZ, permitindo que o seu controle e modificação genética durante a proliferação, a migração ea diferenciação. A infecção e a expressão são altamente eficazes e produzem numerosas células que podem ser facilmente distinguidos entre outras células não-infectadas por a expressão do repórter incluídos. Temos, assim, muito visualizado células transduzidas com G...
Discussão
LVs oferecer vantagens importantes sobre outros sistemas virais para a modificação genética de adultos NSCs 16,18. entrega estereotáxica de lentivírus para o nicho V-SVZ representa um método eficiente para identificar e rastrear raramente dividindo B1-NSC superar as limitações de outros métodos vulgarmente utilizados tais como BrdU, que se dilui depois de múltiplas divisões celulares, ou retrovírus, que apenas células alvo que estão a proliferar no momento da aplicação. LVS juntamente com aden...
Divulgações
Todas as manipulações foram feitas em um quarto de nível de biossegurança 2. protocolos animais foram aprovados pelo comitê de ética da Universidade de Valência e estavam todos em conformidade com a directiva europeia 2010/63 / UE.
Agradecimentos
Nós reconhecemos a ajuda de MJ Palop eo apoio técnico do SCSIE da Universidad de Valencia. Agradecemos também a Antonia Follenzi pelos comentários e discussão do manuscrito. IF é apoiado pela Fundação Botín, pelo Banco Santander através da sua Divisão Global Santander Universidades, e por doações da Generalitat Valenciana (Programa Prometeo, ACOMP e ISIC) e Ministerio de Economía y Competitividad (MINECO: SAF2011-23331, CIBERNED e RETIC Tercel) . Este trabalho também foi apoiada por BFU2010-21823 e RETIC Tercel doações de MINECO e pelo Conselho Europeu de Investigação (ERC) 2012-StG (260511- PD-HUMMODEL) para AC BM-P. é o destinatário de uma bolsa FPI espanhola do MINECO.
Materiais
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25 mm x 89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13 mm x 51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100 x 20 style |
| FACS tubes | Afora | DE400800 | 12 mm x 75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2x HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100x, used to prepare HeLa and 293T culture medium at a final concentration of 10x. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10x, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1x PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1,000x stock solution at 8 mg/ml in dHO |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | http://www.leicabiosystems.com/ |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33 gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11 cm x 21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25 G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
Referências
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados