È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Stabile ed efficiente Modificazione genetica di cellule nel topo adulto V-SVZ per l'analisi di cellule staminali neurali autonoma ed effetti non autonomi
In questo articolo
Riepilogo
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Abstract
Relativamente cellule staminali somatiche quiescenti sostenere il rinnovamento cellulare per tutta la vita nella maggior parte dei tessuti adulti. Le cellule staminali neurali nel cervello dei mammiferi adulti sono limitate a due specifiche nicchie neurogena: la zona subgranulare del giro dentato dell'ippocampo e la zona ventricolare-subventricolare (V-SVZ, chiamato anche zona subependimale o SEZ) nelle pareti del laterali ventricoli. Lo sviluppo di strategie in vivo di trasferimento genico per le popolazioni di cellule staminali adulte (cioè quelli del cervello dei mammiferi) con conseguente espressione a lungo termine di transgeni desiderati nelle cellule staminali e la loro progenie derivata è uno strumento cruciale nella corrente ricerca biomedica e biotecnologica. Qui, un metodo diretto in vivo è presentato per la modificazione genetica stabile di cellule di topo adulto V-SVZ che sfrutta la cella infezioni ciclo-indipendente LV e la citoarchitettura altamente specializzato della nicchia V-SVZ. In particolare, l'attuale protocollo comportas l'iniezione di LV vuoti (controllo) o LV codificanti cassette specifica espressione del transgene nelle memorie V-SVZ sé, per in vivo di targeting di tutti i tipi di cellule nella nicchia, o nel lume ventricolo laterale, per l'orientamento dei ependimali solo le cellule. cassette di espressione vengono poi integrati nel genoma delle cellule trasdotte e proteine fluorescenti, codificate anche dal LV, permettere la rivelazione delle cellule trasdotte per l'analisi di cellule, effetti autonomi e non autonomi nicchia-dipendente sulle cellule marcate e loro progenie.
Introduzione
La zona ventricolare-subventricular murino (V-SVZ), nelle pareti del ventricolo laterale rivolta verso lo striato, è una regione germinale molto attivo in cui un processo continuo di replicazione delle cellule progenitrici e differenziazione risultati nella produzione persistente bulbo olfattivo (OB ) interneuroni e oligodendrociti corpo calloso 1. La generazione per tutta la vita di queste cellule sembra essere sostenuta dalla presenza in questa regione di cellule neurali staminali (NSC; anche chiamate cellule B1), che esprimono l'antigene astrociti proteina silicea fibrillare gliale (GFAP) e gambo marcatori di cellule, come nestina, Id1 e Sox2 2. GFAP-cellule che esprimono B1 generare cellule (TAP) (cellule C), che esprimono fattori di trascrizione Dlx2 transito amplificando progenitore (distale-meno homeobox 2) e Ascl1 (mammiferi achaete-Schute omologo 1) e dividere rapidamente un paio di volte prima che danno luogo a neuroblasti migrazione (cellule a) o oligodendroblasts 3. Appena generata prolifneuroblasti migrano rative anteriormente, formando il flusso migratorio rostrale (RMS) per l'OB, in cui si integrano nel granulari e strati glomerulare come interneuroni inibitori differenziati. Migrazione giovani oligodendroblasts muovono al CC, dove diventano cellule NG2-positive immature che continuano a dividere localmente o differenziarsi in oligodendrociti mielinizzanti maturi 1,4.
celle B1, che derivano da cellule gliali radiali fetali, conservano la morfologia allungata e polarizzata dei loro predecessori e presentano un rapporto altamente specializzato con la loro nicchia. Essi spaziano tra il ependima che allinea il ventricolo e la rete di vasi sanguigni che irrigano la nicchia V-SVZ. Il piccolo processo apicale delle cellule B1 intercala tra ependymocytes multiciliated e termina in un singolo ciglio primario non mobili, mentre il loro processo basale si estende lunghe distanze per avvicinarsi il plesso vascolare planare che irriga questo finale nicchia nel BAsal lamina dei capillari del plesso 2,5-8.
Il modo più affidabile per distinguere B1-NSC da astrociti non neurogena, che sono anche GFAP +, nella nicchia V-SVZ intatto si basa sulla preparazione della parete laterale del ventricolo e la loro analisi del 3-D microscopia confocale tutto il montaggio dopo immunocolorazione per GFAP per etichettare il sottile processo apicale B1-NSC, β-catenina a delineare le membrane cellulari, e sia γ-tubulina come marcatore di corpi basali cilial o acetilata α-tubulina di etichettare l'entità di ogni ciglio 5,8. Le osservazioni di questi interi-monti dalla superficie ventricolare hanno indicato che le cellule B1 e ependimali sono disposti in "girandole" 5, in cui i processi apicali uniciliated di uno o più GFAP + B1 cellule sono circondate da una rosetta di cellule ependimali multiciliated.
La morfologia caratteristica delle cellule B1 correla con l'evidenza sperimentale indicating che i vasi sanguigni / cellule endoteliali e ventricolare liquido cerebrospinale (CSF) costituiscono fonti regolamentati di segnali solubili che agiscono su NSC 2,6,9-11. In superficie ventricolare, omotipica e le interazioni apico-laterale eterotipica che coinvolgono cellule ependimali e B1 comprendono giunzioni strette e giunzioni aderenti 5,12. Inoltre, molecole di adesione coinvolte nei complessi giunzionali tra cellule B1 e ependimali, come N-caderina e V-CAM, hanno dimostrato di regolare non solo il posizionamento altamente organizzato di B1 nella nicchia V-SVZ, ma anche la loro quiescenza 12 , 13. Il monostrato di cellule ependimali-B1 sembra agire come barriera di diffusione che consente il flusso regolamentato di acqua e piccole molecole dal CSF, ma limitando il passaggio intercellulare grandi proteine 10,11. Evidenze sperimentali indicano che la posizione unica ciglio apicale delle cellule B1 potrebbe svolgere un ruolo di sensore di segnalazione polipeptidi presenti nel liquor 2,5-7. Cellule ependimali sono, di per sé, anche una sorgente di segnali solubili e di membrana con un ruolo nella regolazione del comportamento NSC 14,15.
Nucleosidi tracciabili, come bromo-deossiuridina (BrdU), o retrovirus sono stati ampiamente utilizzati per marcare le cellule progenitrici, tra NSC, in vivo. Tuttavia, questi metodi non sono ottimali per il destino tracciamento a lungo termine, perché i segnali BrdU diluito attraverso divisioni cellulari ripetuti e retrovirus sembrano indirizzare preferenzialmente transitoriamente amplificare le cellule a causa della loro esigenza di proliferazione delle cellule per la trasduzione 16,17. Per esaminare NSC fisiologia in vivo, comprese le interazioni con i componenti di nicchia, è fondamentale stabilire un metodo per etichettare e tracciare le cellule raramente che dividono, come B1-NSC sono in gran parte a riposo e le loro cellule ependimali vicini non si dividono in condizioni fisiologiche 3. Qui, dimostriamo che vettori lentivirali (LV) consentono di marchio gene ad alta efficienzazione e modifica a lungo termine di NSC adulti e non dividendo le cellule ependimali, causa più ragionevolmente alla loro capacità di trasdurre e di integrarsi nel genoma delle cellule bersaglio in modo indipendente ciclo cellulare. Inoltre, si mostra come il percorso di consegna e virali aiuto titolo di trasdurre specificamente cellule ependimali, ma non le cellule B1 consentendo in tal modo l'analisi di nicchia-dipendente, effetti ependimali su NSC.
Protocollo
ETICA DICHIARAZIONE: Questo protocollo segue le linee guida per la cura degli animali dell'Università di Valencia in conformità con la direttiva europea 2010/63 / UE.
1. Generazione di LV per In Vivo marcatura studi (si veda la Figura 1a)
ATTENZIONE: La procedura qui descritta è livello di biosicurezza 2, eseguire quindi tutte le seguenti procedure in una cappa di rischio biologico. Assicurare che il personale di ricerca sono adeguatamente qualificato e preparato in tutte le procedure. Indossare dispositivi di protezione individuale, tra cui abito, guanti doppie e protezione per gli occhi adatto. Infine, a fondo decontaminare tutti gli strumenti e le superfici che potrebbero essere stati a contatto con i virus in base alle pratiche di impianto di disinfezione, approvate (strofinando con etanolo al 70%, il 10% di candeggina e / o autoclave).
- Produzione di LV in embrionali umane cellule renali 293T
- Inizia questo protocollo per la preparazione del DNA puro per trasfezione. Preparare e purificare ogni plasmide con un doppio grad CsClcentrifugazione iente o altri metodi di colonne disponibili in commercio che producono DNA privo di endotossine. In questo protocollo abbiamo usato il trasferimento vettore plasmidico pRRL-SIN-PPT.PGK.EGFP.Wpre. Plasmidi di imballaggio di base consigliate sono pMDLg / pRRE e pRSV.REV e busta plasmide pMD2G 13,18,19.
- Ventiquattro ore prima della transfezione, piastra 5 x 10 6 cellule 293T in Iscove Modified Medium (IMDM) Dulbecco (vedi TABELLA MATERIALI) in un piatto di plastica 10 cm, per ottenere una coltura circa 1/4 a 1/3 confluenti per trasfezione. Incubare a 37 ° C in un incubatore umidificato in un'atmosfera di 5-7% CO 2.
- Sostituire il mezzo con fresca media 2 ore prima della trasfezione.
- In uno sterile mix provetta da 1,5 ml microcentrifuga 10 pg di trasferimento vettore plasmidico (contenente il cDNA del transgene o shRNA da consegnare) con 2,5 ug del pRSV.REV e 5 ug del plasmide Confezioni pMDLg / pRRE e 3.5 & #181; g del plasmide busta pMD2G. Portare la soluzione plasmide ad un volume finale di 450 ml con tampone 0.1x TE (vedi Tabella dei materiali) / DH 2 0 (2: 1). Quindi aggiungere 50 ml di 2,5 M CaCl 2.
- Formare il precipitato per aggiunta goccia a goccia di 500 microlitri della 2x Hepes Buffered Saline (HBS, vedi Tabella dei Materiali), soluzione al DNA-TE-CaCl2 miscela 500 microlitri mentre vortex a tutta velocità.
- Aggiungere il precipitato alle cellule 293T immediatamente. Agitare delicatamente la piastra per mescolare. Ritorna le cellule per l'incubatore e cambiare il mezzo 14-16 ore dopo la trasfezione.
- Raccogliere i surnatanti cellulari 30 ore dopo aver cambiato i media. Filtrare il surnatante attraverso un filtro di nitrocellulosa 0,22 micron pori e procedere alla concentrazione.
- Concentrazione di LV
- Concentrare il terreno condizionato da ultracentrifugazione a 50.000 xg (19.000 rpm con rotore ultracentrifuge SW-28) da 2hr a temperatura ambiente (RT) in una provetta conica rotore trasparente 30 ml polipropilene.
Nota: utilizzare adattatori ultracentrifuga per tubi rotori conici (vedi tabella dei Materiali). - Eliminare il surnatante per decantazione e risospendere il pellet in un piccolo volume (200 ml o meno se viene eseguita una sola centrifugazione) di tampone fosfato salino (PBS; vedi Tabella Materiali). Poi pipetta su e giù per circa 20 volte.
- Pool sospensioni e concentrare nuovamente ultracentrifugazione, anche 50.000 x g (23.000 rpm con SW-55 rotore ultracentrifuge) per 2 ore a temperatura ambiente. Utilizzare tubi rotori trasparenti in polipropilene con un volume nominale di 5 ml (vedi Tabella dei Materiali).
- Risospendere il pellet finale in un volume molto piccolo (1/500 o 1 / 1.000 del volume iniziale del mezzo) di PBS sterile e agitare su una ruota girevole per 1 ora a RT. Suddiviso in piccole aliquote (5-20 microlitri) ed fli reeze a -80 ° C.
- Trattare tutti i tubi vuoti con il 10% di candeggina prima dello smaltimento.
- Concentrare il terreno condizionato da ultracentrifugazione a 50.000 xg (19.000 rpm con rotore ultracentrifuge SW-28) da 2hr a temperatura ambiente (RT) in una provetta conica rotore trasparente 30 ml polipropilene.
- Lentivirali titolazione mediante citometria a flusso
- Il giorno prima, piatto 5 x 10 4 cellule HeLa per pozzetto in piastre di coltura dei tessuti 6 pozzetti in 2 ml di Modified Media Dulbecco di Eagle (DMEM) (vedi tabella dei materiali). Incubare a 37 ° C in un incubatore umidificato in un'atmosfera di 5-7% CO 2 per 24 ore.
- Il giorno della titolazione, scongelare un'aliquota dello stock virale e preparare diluizioni seriali, dal 10 -3 a 10 -8, in DMEM.
- Per fare questo, prendere un 24-pozzetti e aggiungere 2 ml di DMEM al primo pozzo e 1,8 ml alle seguenti pozzi. Quindi aggiungere al primo pozzo 2 ml di magazzino virale concentrato (ad una diluizione finale di 1: 1000 o 10 -3).
- Dopo pipettando più volte per mescolare bene la soluzione, il cambiamento punta e trasferire 200 ml di diluizione 10 -3al secondo pozzo. Ripetere la procedura serialmente nelle seguenti pozzetti finché non viene effettuata la diluizione 10 -8.
- Prendere cellule HeLa placcato il giorno precedente dal termostato. Rimuovere con cautela media dai pozzi. Aggiungere 1 ml di ciascuna diluizione virale insieme con 1 ml di 8 mg / ml di bromuro hexadimethrine rispettivi pozzetti di cellule contenenti HeLa. Agitare delicatamente la piastra per mescolare.
Nota: Hexadimethrine bromuro viene aggiunto per aumentare l'adsorbimento del virus alle cellule in coltura. - Riportare le cellule per l'incubatore e consentire l'infezione di procedere per 72 ore. Dopo di che, rimuovere il supporto, lavare le cellule una volta con PBS e aggiungere 200 ml di tripsina-EDTA (vedi Tabella dei Materiali) in ciascun pozzetto.
- Dopo 5 minuti a 37 ° C, aggiungere 2 ml di soluzione salina in ogni cellule bene e raccolto in citometria a flusso tubi.
- Centrifugare a 300 g per 5 min a temperatura ambiente e aspirare il surnatante.
- Risospendere il pellet con 1 ml di soluti fissaon (formaldeide elettroni grado microscopia 1% e il 2% di siero fetale bovino in PBS), quindi vortice i tubi.
- Analizzare le cellule in un citofluorimetro utilizzando un 488 nm argon-ionlaser a 15 mW di potenza.
- Impostare lo strumento con la configurazione standard: forward-scatter (FS), side-scatter (SS), e fluorescenza per GFP (525/40 nm). Selezionare gating popolazione di cellule in un FS vs SS dot plot di escludere aggregati di cellule e detriti. Raccogliere fluorescenza in scala logaritmica. Calcolare il numero di cellule GFP + in ciascun campione.
- Calcola vettore titolo con la seguente formula:% GFP + / 100 x numero di cellule infette fattore x di diluizione (DF) = unità di trasduzione (TU) / ml.
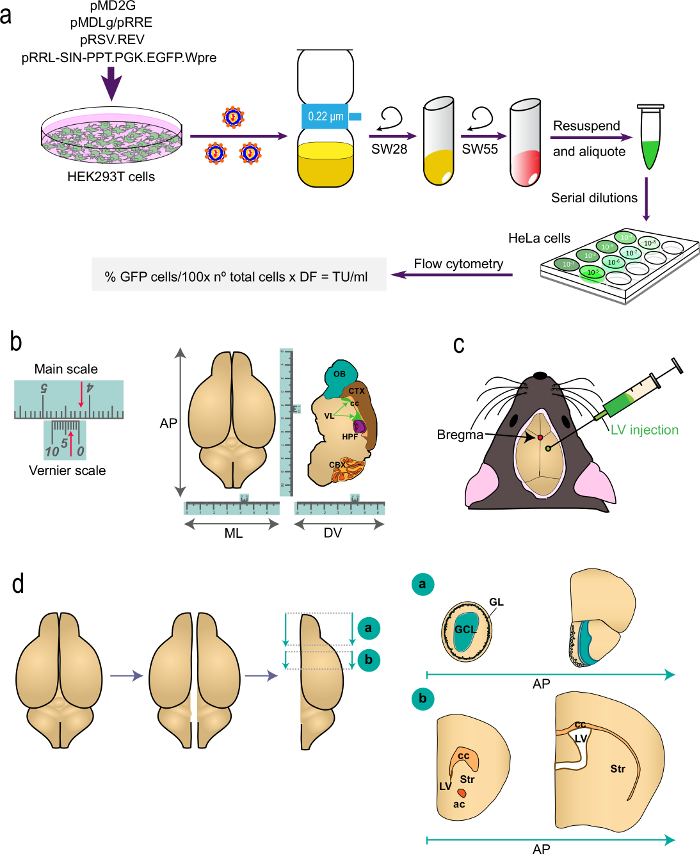
Figura 1: Rappresentazione schematica delle diverse parti del procedimento (a) La parte 1 t.egli protocollo: generazione di LV per gli studi in vivo di etichettatura, dalla trasfezione di cellule HEK293T con plasmidi appropriati per generare i LV alla determinazione del titolo del virus mediante citometria di flusso con la formula indicata. I nomi dei plasmidi e rotori centrifughe sono indicati. (B e C) Parte 2 del protocollo: l'iniezione stereotassica di LV. "B" raffigura un esempio di una scala Vernier, un dispositivo che è parte di strumenti stereotassica e serve per misure fini. Come esempio, le frecce indicano 4.23 cm. Una scala Vernier viene utilizzato per determinare le coordinate del antero-posteriore (AP), medio-laterale (ML), e dorso-ventrale asse (DV) come mostrato per un top-view (sinistra) e per una sezione sagittale (destra ) del cervello. "C" indica la posizione del bregma come intersezione tra le suture sagittali e coronali. LV sono iniettati con una siringa. (D) disegni schematici che mostra come il cervello is preparate per l'analisi. I due emisferi sono divisi ed ognuno è diviso in due blocchi. Blocco "a", contenente gli OB, è prodotto da un taglio coronale a livello AP immediatamente posteriormente alla giunzione OB con telencefalo (bregma 2,46 millimetri; vedi Paxinos' Atlas per riferimento). Blocco "b" è prodotta da due tagli coronali, uno al livello appena anteriormente alla aspetto più rostrale del corpo calloso (bregma 1,7 mm) e una seconda a livello della giunzione dei due ventricoli laterali (bregma -0.22 mm). GL, strato glomerulare; GCL, strato di cellule dei granuli; st, striato; cc, corpo calloso; AC, commissura anteriore; lv, ventricolo laterale.
2. Stereotassica Iniezione di LV in / Striatum bordo V-SVZ o nel ventricolo laterale (vedi figura 1b)
- Preparazione
- Sterilizzare una capacità siringa 5 microlitri con un ago 33 gauge spruzzando lungo il corpo e l'ago con il 70% di etanolo con lo stantuffotirato fuori tutta la strada. Ripetutamente aspirare l'etanolo da un tubo da 1,5 ml microcentrifuga ed espellere tutta la via d'uscita più volte, e sciacquare la siringa accuratamente con acqua sterile in seguito. Posizionare la siringa in modo sicuro da parte nel cofano della cultura e lasciarlo asciugare.
- Preparare un contenitore per rifiuti a rischio biologico con il 10% di candeggina ad un volume adatto ad immersione di tutti i rifiuti dalla presente procedura (in genere 200 ml in un contenitore da 500 ml).
- Preparare e preriscaldare un letto ad acqua C 37 ° riempiendo un sacchetto di plastica sigillato con l'acqua e il riscaldamento a 37 ° C. Questo permetterà di recuperare i topi dopo l'iniezione.
- Rimuovere stock virali da -80 ° C stoccaggio freezer 1 ora prima di iniziare le iniezioni e posizionare il flacone su una ruota girevole a RT. Dopo lo scongelamento, mantenere lo stock virale sul ghiaccio durante il periodo delle iniezioni. Prima l'iniezione stereotassica di LV, diluire le scorte virali concentrati per 10 6 TU / ml con PBS nel cofano cultura.
- Sanificare l'area selezionata per eseguire l'operazione con il 70% di etanolo.
- La microiniezione di LV
- Selezionare e sterilizzare gli strumenti necessari per la chirurgia (bisturi, trapano, e piccole pinzette).
- Anestetizzare un mouse 6-8 settimane di età per via intraperitoneale (ip) iniezione di una miscela di veterinaria-supervisione di ketamina e medetomidina. Pesare ogni animale e dosare ciascuno con 50-75 mg di ketamina e 0,5-1 mg medetomidina per kg di peso corporeo del mouse (circa 100-125 ml di ketamina / medetomidina soluzione per il mouse di lavoro).
- Valutare il piano anestetico pizzicando la punta dei piedi, la coda o orecchie e far sì che l'animale non mostra alcuna reazione.
- Una volta che il mouse è anestetizzato, iniettare butorfanolo per via sottocutanea ad una dose finale di 0,4-0,5 mg per kg di peso del mouse per ridurre al minimo il dolore post-operatorio.
- Radere l'area tra le orecchie e disinfettare la pelle utilizzando un iodoforo come iodopovidone o 70% di etanolo. Pulire con cotone sterileapplicatori -tipped. Fare attenzione a non bagnare eccessivamente l'animale come questo può esacerbare l'ipotermia.
- Posto l'animale in posizione prona su un telaio stereotassico e con attenzione fissare la testa utilizzando le barre orecchio e il sostegno palato dell'apparato. Mantenere il mouse con un set pad di riscaldamento a 37 ° C e lubrificare oftalmica per gli occhi.
- Fare un lungo un'incisione di 1 cm sulla pelle testa longitudinalmente con un bisturi, e ritrarre delicatamente la pelle per esporre il cranio con una pinzetta sottile.
- Pulire accuratamente la superficie ossea con un applicatore con punta di cotone sterile. Pulire l'osso del cranio esposto di qualsiasi tessuto rimanente.
- Montare la siringa sterilizzata sul dispositivo stereotassico utilizzando il supporto della siringa.
- Spostare l'asse titolare siringa x, yez finché la punta dell'ago della siringa è posizionato sul bregma, il punto di congiunzione in cui la sutura sagittale (longitudinale e mediale) è perpendicolarmente interseca con la sutura coronale (Figure 1b). Assicurarsi che la posizione "zero" dell'asse dorso-ventrale (DV) è alla superficie del cranio a bregma.
- Spostare la siringa per le coordinate X e Y di destinazione (vedi Tabella 1 e Figura 1b).
| Regione di iniezione | coordinate | ||
| Antero-posteriore (AP) | Medio-laterale (ML) | Dorso-ventrale (DV) | |
| SEZ / striato confine | +0,6 mm | +1,2 mm | -3.0 mm |
| ventricolo laterale | -0.3 mm | +1.0 mm | -2.6 mm |
Tabella 1: Coordinate Stereotassica per l'aproiezioni. Per l'AP e l'asse ML, coordinate x e y sono dati come distanza (in mm) dal bregma. "-" Indica "verso posteriori". Per coordina il DV "zero" è la superficie del cranio nel punto bregma e coordinate DV indicano la distanza (in mm) rispetto a questo punto.
- Annotare il x, Y e Z destinazione nella scala Vernier, al fine di essere in grado di tornare al sito di iniezione in seguito. Mark l'osso alle coordinate x e y utilizzando un pennarello chirurgico.
- Spostare la siringa dalla zona di lavoro.
- Utilizzando un trapano elettrico praticare un foro sul cranio attenzione a non danneggiare il cervello. Non forare la superficie piale in quanto ciò potrebbe danneggiare la superficie del cervello.
- Caricare la siringa con 1 ml di soluzione virale 10 6 TU / ml. Utilizzare un calibro 33 ago tagliente smussato la cui punta ha un angolo di 10-12 °. Posizionare l'ago della siringa in un 90 ° angle rispetto alla superficie del cervello.
- Spostare la siringa al sito di iniezione e spostarlo verso il basso fino a quando la punta tocca la superficie piale.
- Penetrare il cervello con la siringa al coordinata z lungo l'asse DV.
- Rilasciare lentamente la sospensione virale, ad una velocità di 0,2 ml / min, per ridurre al minimo i danni al tessuto cerebrale causa dell'aumento della pressione del fluido.
- Attendere 5-10 minuti per minimizzare il riflusso di sospensione virale e quindi ritrarre la siringa molto lentamente. Blot ogni eccesso di liquido che possono apparire in superficie a seguito della retrazione della siringa con un laboratorio pulire e collocarlo immediatamente nel contenitore rifiuti biosicurezza candeggina contenenti.
- Prendere l'animale fuori del set stereotassica, posizionarlo su un pad caldo, e chiudere la ferita con adesivo pelle. Invertire la sedazione con 0,1-1,0 mg / kg di peso corporeo atipamezolo.
- Iniettare Bupenorphrine per via sottocutanea ad una dose finale di 0,1 mg per kg di peso del mouse ogni 12 ore,a partire dal 4 ore dopo la somministrazione del corto analgesico Butorfanolo durata.
- Posto l'animale in una gabbia individualizzato con un pad caldo e monitorare da vicino fino a quando il mouse recupera da anestesia. Mettere un sacchetto di idrogel nella gabbia per aiutare l'idrato animali dopo il recupero.
- Smaltire tutti i rifiuti bio-contaminati nello smaltimento di candeggina rischio biologico liquido. Pulire la siringa per aspirazione ed espulsione di etanolo e risciacquare con acqua. Disinfettare la zona, il set stereotassica e il materiale chirurgico che è stato utilizzato con candeggina e il 70% di etanolo.
- Mantenere i topi iniettati isolati nel biosicurezza di livello 2 spazio per 24-48 ore dopo di che possono essere trasferiti ad una struttura di alloggiamento convenzionale
3. analisi istologica
- Perfusione, la raccolta dei tessuti, e sezionamento
- Profondamente anestetizzare il mouse utilizzando una miscela veterinaria-supervisione di medetomidina e ketamina (valutare il piano anestetico pizzicando la tOES, la coda o orecchie), come descritto prima.
- Transcardially profumato topi con 25 ml di soluzione salina seguiti da 75 ml di 4% PFA nel PB alla stessa velocità 17.
- Estrarre il cervello e post-fissarlo immergendolo in almeno 10 volte il suo volume di freddo 4% PFA in PB per 1-16 ore (aumento dei tempi di post-fissazione possono diminuire l'immunoreattività di alcuni antigeni). Lavare accuratamente il restante PFA con PB.
- Tagliare il cervello seguendo le indicazioni della figura 1d e incollare il blocco risultante al titolare di un vibratome con cianoacrilato.
- Raccogliere 30 micron di spessore sezioni coronali di serie con un vibratome. Conservare le fette di cervello in piastre da 24 pozzetti con PB a 4 ° C. Per prevenire la contaminazione, 0,05% di sodio azide può essere aggiunto alla soluzione PB.
- immunoistochimica
- Incubare sezioni libero di fluttuare in tampone di bloccaggio (PB con sodio azide 0,05%, 1% glicina, 5% di siero normale di capra, e 0,1% Triton X-100) per 1h a RT con agitando delicatamente in una piattaforma oscillante.
- Rimuovere con attenzione il tampone di bloccaggio con una pipetta, aggiungere una diluizione appropriata di anticorpi di coniglio primaria anti-GFP (vedi Tabella dei materiali) in tampone di bloccaggio e incubare il tessuto con questa diluizione per 48 ore a 4 ° C con un leggero scuotimento.
- Lavare la soluzione di anticorpo primario un minimo di 3 volte con PB, un lavaggio ogni 10 min.
- Incubare sezioni free-floating con opportuna diluizione di anticorpi secondari fluoroforo coniugato) in soluzione bloccante (vedi Tabella dei materiali) per 1 ora a temperatura ambiente e agitando delicatamente. Proteggere le sezioni dalla luce diretta durante l'incubazione.
- Lavare la soluzione di anticorpo secondario con PB, 3 volte ogni 10 min, e colorazione di contrasto tessuto incubando le sezioni con DAPI (4 ', 6-diamidino-2-fenilindolo) a 1 mg / ml in acqua per 5 min. Lavare la soluzione DAPI risciacquando due volte e rapidamente ingegnoh di acqua.
- Posizionare delicatamente sezioni su un vetrino da microscopio utilizzando un pennello fine. Versare alcune gocce di mezzo di montaggio per i preparati fluorescenti (vedi Tabella dei Materiali) sopra il tessuto e con attenzione inserire un coprioggetto sopra, controllando che la soluzione di montaggio è distribuito correttamente su tutta la superficie e non ci sono bolle. Premere delicatamente verso il basso il vetrino per drenare l'eccesso di mezzo di montaggio.
- Quando la soluzione di montaggio si asciuga (2-16 ore), analizzare il campione microscopio confocale a scansione laser con il laser 488 nm.
Risultati
Sistema di erogazione gene LV-mediata può essere utilizzato per il lungo termine in vivo trasduzione di cellule nel topo adulto V-SVZ, permettendo loro di inseguimento e modificazione genetica durante la proliferazione, la migrazione e la differenziazione. L'infezione e l'espressione sono altamente efficaci e producono numerose cellule che possono essere facilmente distinta tra le altre cellule non infette con l'espressione del reporter incluso. Abbiamo finora visualizzato cellule trasdotte con i g...
Discussione
LV offrono importanti vantaggi rispetto ad altri sistemi virali per la modificazione genetica degli adulti NSC 16,18. consegna stereotassica del lentivirus alla nicchia V-SVZ rappresenta un metodo efficace per etichettare e tracciare rado dividendo B1-NSC superare i limiti di altri metodi di uso comune come BrdU, che è diluito dopo molteplici divisioni cellulari, o retrovirus, che prendono di mira solo le cellule che proliferano al momento dell'applicazione. LV, insieme con adenovirus, può infettare le ...
Divulgazioni
Tutte le manipolazioni sono state effettuate in una camera di livello di biosicurezza 2. protocolli di animali sono stati approvati dal comitato etico dell'Università di Valencia e sono stati tutti in conformità alla direttiva europea 2010/63 / UE.
Riconoscimenti
Riconosciamo l'aiuto di MJ Palop e il supporto tecnico del SCSIE della Universidad de Valencia. Ringraziamo anche Antonia Follenzi per gli utili commenti e la discussione del manoscritto. IF è supportato dalla Fundación Botín, dal Banco Santander Santander attraverso la sua Università Divisione Global, e da sovvenzioni dal Generalitat Valenciana (Programa Prometeo, ACOMP, e ISIC) e Ministerio de Economia y Competitividad (MINECO: SAF2011-23331, CIBERNED e RETIC tercel) . Questo lavoro è stato supportato anche da BFU2010-21823 e RETIC tercel sovvenzioni dal MINECO e il Consiglio europeo della ricerca (CER) 2012-StG (260511- PD-HUMMODEL) per AC BM-P. è il destinatario di una borsa di studio FPI spagnolo del MINECO.
Materiali
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25X89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13X51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100x20 style |
| FACS tubes | Afora | DE400800 | 12x75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2X HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100X, used to prepare HeLa and 293T culture medium at a final concentration of 10X. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10X, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1X PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1000X stock solution at 8 mg/ml in dH2O |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33-gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11x21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
Riferimenti
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon