Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стабильной и эффективной генетической модификации клеток у мышей взрослых V-СВЗ для анализа нейронных стволовых клеток автономный и Неавтономные эффекты
В этой статье
Резюме
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Аннотация
Относительно спокойные соматические стволовые клетки поддерживают пожизненное обновление клеток в большинстве тканей взрослого. Нервные стволовые клетки в головном мозге млекопитающих взрослого ограничены двумя конкретными нейрогенных ниш: The субгранулярной зона зубчатой извилине в гиппокампе и желудочковой-субвентрикулярная зоне (V-SVZ; также называемый Субэпендимальные зоны или ОЭЗ) в стенках бокового желудочки. Развитие в естественных стратегий переноса генов для популяций взрослых стволовых клеток (т.е. тех из мозга млекопитающих), в результате долгосрочного экспрессии желаемых трансгенов в стволовых клетках и их производного потомства является важным инструментом в текущем биомедицинских и биотехнологических исследованиях. Здесь прямой метод в естественных представлена для стабильного генетической модификации взрослых мышей V-СВЗ клеток, которое использует цикл независимый инфекции в клетку путем РН и узкоспециализированных цитоархитектуры в V-СВЗ нише. В частности, в настоящее время протокол привлекатьS инъекция пустых РН (контроль) или РН кодирующих специфические трансгенной экспрессии кассеты в либо самого V-СВЗ, для ориентации в естественных всех типов клеток в нише, или в боковой желудочек просвета, для нацеливания эпендимные клетки только. Экспрессионные кассеты, затем интегрируются в геном трансдуцированных клеток и флуоресцентных белков, также кодируемых РН, позволяют обнаружение трансдуцированных клеток для анализа клеточных автономных и неавтономных, ниши-зависимых эффектов в меченых клеток и их потомство.
Введение
Мышиный желудочка-субвентрикулярная зона (V-SVZ), в стенках бокового желудочка, обращенной к полосатое тело, является очень активным зародышевых область, в которой непрерывный процесс репликации и дифференцировки клеток-предшественников приводит к стойким производства обонятельной луковицы (OB ) интернейронов и мозолистого тела олигодендроциты 1. Пожизненное поколение этих клеток, как представляется, подтверждается наличием в этом регионе нейронных стволовых клеток (НСК; также называемым B1 клеток), которые выражают астроцитов антиген глиальных фибриллярный кислый белок (GFAP) и стволовых клеточных маркеров, таких как нестина, Id1 и Sox2 2. GFAP-экспрессирующих B1 клетки вырабатывают транзит усиливающую прародителя (TAP) клетки (C клеток), которые выражают транскрипционные факторы Dlx2 (дистальный менее гомеобоксный 2) и Ascl1 (млекопитающих achaete-schute гомолог 1) и разделить быстро несколько раз, прежде чем они порождают чтобы мигрирующих нейробластов (клетки а) или oligodendroblasts 3. Недавно созданный Пролифerative нейробласты мигрируют кпереди, образуя ростральный миграционный тракт (RMS) на ОВ, где они интегрироваться в гранулированных и клубочков слоев как дифференцированных ингибирующих интернейронов. Перенастройка молодые oligodendroblasts двигаться в ЦК, где они становятся незрелые NG2-позитивных клеток, которые продолжают делить локально или дифференцироваться в зрелые myelinating олигодендроцитов 1,4.
B1 клетки, которые вытекают из эмбриональных радиальных глиальных клеток, сохраняют вытянутую и поляризованный морфологию своих предшественников и имеют узкоспециализированный отношения с их нишу. Они охватывают между Эпендима, которая выстраивается желудочка и сети кровеносных сосудов, что орошать V-СВЗ нишу. Небольшой верхушечный процесс B1 клеток интеркалатов среди multiciliated ependymocytes и заканчивается в одной неподвижные первичной реснички, а их базальная процесс распространяется на большие расстояния, чтобы подойти к плоскую сосудистого сплетения, что орошает эту нишу окончание в бASAL пластинка из сплетения капилляров 2,5-8.
Самый надежный способ отличить B1-НСК из экологически нейрогенных астроцитов, которые также GFAP +, в неповрежденной V-СВЗ нише основан на весь монтажа препараты желудочка боковой стенке и их анализ от 3-D конфокальной микроскопии после иммунным для GFAP маркировать тонкие В1-НСК апикальная процесса, -катенин очертить клеточные мембраны, и либо γ-тубулина в качестве маркера cilial базальных телец или ацетилированный альфа-тубулина для мечения степень каждой реснички 5,8. Наблюдения этих цельного монтирует из желудочков поверхности показали, что B1 и эпендимные клетки расположены в "флюгеры" 5, в которой uniciliated апикальные процессы одного или нескольких GFAP + B1 клеток окружены розеткой multiciliated эпендимных клеток.
Характерная морфология B1 клеток коррелирует с экспериментальными данными яndicating, что кровеносные сосуды / эндотелиальные клетки и желудочковой цереброспинальной жидкости (ликвора) составляют регулируемые источники растворимых сигналов, действующих на НСК 2,6,9-11. В желудочковой поверхности, гомотипических и гетеротипические апикально-боковой взаимодействий с участием эпендимные и B1 клеток включают плотные соединения и слипчивые соединения 5,12. Кроме того, молекулы адгезии, вовлеченные в соединительных комплексов между B1 и эпендимных клеток, таких как N-кадгерина и V-CAM, как было показано, регулирует не только высоко организованную позиционирование B1 в V-SVZ нише, но также и их неподвижность 12 , 13. Клеточный монослой эпендимные-В1-видимому, действует в качестве диффузионного барьера, позволяющего регулируемое поток воды и малых молекул от CSF, но ограничивая межклеточное прохождение крупных белков 10,11. Экспериментальное доказательство показывает, что в уникальном положении В1 клеток апикальной ресничка может играть определенную роль в качестве датчика сигнализации полипептидов, присутствующих в CSF 2,5-7. Эпендимные клетки, как таковой, также является источником растворимых и мембраносвязанных сигналов с роли в регуляции поведения НСК 14,15.
Прослеживаемые нуклеозиды, такие как бром-дезоксиуридина (BrdU), или ретровирусов широко были использованы для обозначения клетки-предшественники, в том числе NSC, в естественных условиях. Тем не менее, эти методы не являются оптимальными для долгосрочного отслеживания судьбы, потому что BrdU сигналы разбавить путем многократных делений и ретровирусов клеток, по всей видимости преимущественно нацелены временно усиливая клетки из-за их требованию клеточной пролиферации для трансдукции 16,17. Чтобы исследовать НСК физиологию в естественных условиях, в том числе взаимодействия с компонентами ниши, очень важно создать способ маркировать и отслеживать редко делящиеся клетки, а B1-НСК в основном в состоянии покоя и их соседние эпендимные клетки никогда не разделить в физиологических условиях 3. Здесь мы покажем, что лентивирусов векторов (ПЗ) позволяют отметки гена высокоэффективнойING и долгосрочное изменение взрослых НСК и без разделительных эпендимных клеток, из-за наиболее разумно с их способностью к трансдукции и интеграции в геном клетки-мишени в пути клеточного цикла-независимыми. Кроме того, мы покажем, как маршрут доставки и титр вируса помощью специально преобразовывать эпендимные клетки, но не В1 клетки, тем самым позволяя анализировать ниши-зависимыми, эпендимных воздействия на НСК.
протокол
ЭТИКА ЗАЯВЛЕНИЕ: Этот протокол следует рекомендациям по уходу за животными Университета Валенсии в соответствии с Европейской директивой 2010/63 / ЕС.
1. Генерация LV для IN VIVO Маркировка исследования (рис 1а)
ВНИМАНИЕ: Процедура, описанная в настоящем документе, уровня биобезопасности 2, поэтому выполнять все следующие процедуры в биологически опасных капотом. Обеспечить проведение исследований персонал соответствующей квалификации и обучение во всех процедурах. Средства индивидуальной защиты, в том числе платье, двойные перчатки и защитные очки. Наконец, тщательно обеззаразить все инструменты и поверхности, которые могли бы были в контакте с вирусами в соответствии с утвержденными практики дезинфекции объект (протиранием 70% этанола, 10% хлорной и / или в автоклаве).
- Производство РН в эмбриональной почки человека 293Т
- Начало этот протокол получения чистого ДНК для трансфекции. Подготовка и очистить каждую из плазмид с помощью двойного град CsClнике, центрифугирования или другие коммерчески доступные методы столбцов дающие эндотоксина свободной ДНК. В этом протоколе мы использовали вектора переноса плазмиды pRRL-SIN-PPT.PGK.EGFP.Wpre. Рекомендуемые намотка плазмиды pMDLg / pRRE и pRSV.REV и конверт плазмиды pMD2G 13,18,19.
- Двадцать четыре часа до трансфекции, пластина 5 × 10 6 клеток 293Т в Айскоува модифицированной Дульбекко среде (IMDM) (табл материалов) в 10 см пластиковую чашку, чтобы получить приблизительно от 1/4 до 1/3 сливающийся культуры для трансфекции. Инкубировать при 37 ° С в увлажненном инкубаторе в атмосфере 5-7% CO 2.
- Заменить среду свежей средой 2 ч до трансфекции.
- В стерильной смеси 1,5 мл микроцентрифужных трубки 10 мкг вектора переноса плазмиды (содержащий кДНК трансгена или shRNA быть доставлены) с 2,5 мкг pRSV.REV и 5 мкг pMDLg / pRRE упаковки плазмид, и 3,5 & #181; г огибающей плазмиды pMD2G. Составляют плазмиды раствора до конечного объема 450 мкл с помощью буфера 0,1 x TE (см Таблицу материалов) / дН 2 0 (2: 1). Затем добавить 50 мкл 2,5 М CaCl 2.
- Формируют осадка путем добавления по каплям 500 мкл 2x Hepes-солевом буферном (HBS, табл материалов) решение смеси в 500 мкл ДНК-TE-CaCl 2 в то время вортексе на полной скорости.
- Добавить осадка на клетках 293Т немедленно. Аккуратно водоворот пластины для смешивания. Возвращение клетки в инкубатор и изменяет среднюю 14-16 ч после трансфекции.
- Собирают Клеточные супернатанты 30 ч после изменения информации. Фильтр супернатанта через нитроцеллюлозный фильтр 0,22 мкм пор и приступить к концентрации.
- Концентрация РН
- Концентрат кондиционированной среды с помощью ультрацентрифугирования при 50000 х г (19000 оборотов в минуту с SW-28 ультрацентрифуге ротора) в течение 2ч при комнатной температуре (RT) в прозрачном коническую трубку ротора 30 мл полипропиленовую.
Примечание: Используйте ультрацентрифуг адаптеры для конических труб ротора (см таблицу материалов). - Отменить супернатанты декантацией и ресуспендируют гранул в небольшом объеме (200 мкл или менее, если только один центрифугирование выполняется) из фосфатного буфера физиологический раствор (ЗФР; табл Материалов). Затем пипеткой вверх и вниз примерно в 20 раз.
- Объединяют суспензий и сконцентрировать снова с помощью ультрацентрифугирования, также при 50000 х г (23000 оборотов в минуту с SW-55 ультрацентрифуге ротора) в течение 2 ч при комнатной температуре. Используйте полипропиленовые прозрачные роторных труб с номинальным объемом 5 мл (см таблицу материалов).
- Ресуспендируют конечный осадок в очень малом объеме (1/500 или 1/1000 от исходного объема среды) стерильного PBS и встряхивают на вращающемся колесе в течение 1 часа при комнатной температуре. Разделить на небольших аликвот (5-20 мкл) и Рreeze их при температуре -80 ° С.
- Лечить все пустые трубы с 10% хлорной перед утилизацией.
- Концентрат кондиционированной среды с помощью ультрацентрифугирования при 50000 х г (19000 оборотов в минуту с SW-28 ультрацентрифуге ротора) в течение 2ч при комнатной температуре (RT) в прозрачном коническую трубку ротора 30 мл полипропиленовую.
- Лентивирусов титрования с использованием проточной цитометрии
- Накануне, пластина 5 х 10 4 HeLa клеток на лунку в 6-луночных тканевых культуральных планшетах в 2 мл модифицированной среде Дульбекко Игла (DMEM) (см таблицу материалов). Инкубировать при 37 ° С в увлажненном инкубаторе в атмосфере 5-7% CO 2 в течение 24 ч.
- В день титрования, оттаивают аликвоты вирусной складе и подготовить серийных разведений от 10 -3 до 10 -8, в DMEM.
- Для этого взять 24-луночного планшета и добавьте 2 мл DMEM в первую лунку и 1,8 мл в следующих скважин. Затем добавить в первую лунку по 2 мкл концентрированного вирусного запаса (с конечным разбавлением 1: 1000 или 10 -3).
- После пипетки несколько раз, чтобы тщательно перемешать раствора, изменение наконечник и передавать 200 мкл 10 -3 разбавленияна второй скважины. Повторите процедуру последовательно в следующих скважинах до 10 -8 разбавления не производится.
- Возьмите клетки HeLa плакированные накануне из инкубатора. Осторожно снимите среды из скважин. Добавить 1 мл каждого вирусного разведения вместе с 1 мкл 8 мг / мл полибрен к сотовым содержащих скважин HeLa. Аккуратно водоворот пластины для смешивания.
Примечание: бромид Hexadimethrine добавляют для повышения адсорбции вируса к клеткам в культуре. - Возвращение клетки в инкубатор и позволить инфекции проводили в течение 72 ч. После этого, извлекайте носитель, промыть клетки один раз PBS и добавьте 200 мкл трипсина-ЭДТА (табл материалов) в каждую лунку.
- После 5 мин при 37 ° С, добавляют 2 мл PBS в каждую лунку и урожай клеток в проточной цитометрии трубок.
- Центрифуга при 300 х г в течение 5 мин при комнатной температуре и аспирата супернатант.
- Ресуспендируют осадок с 1 мл фиксирующего Solutiна (1% формальдегида электронного класса микроскопии и 2% фетальной телячьей сыворотки в PBS), затем вихрь трубы.
- Анализ клеток в проточном цитометре с использованием 488 нм аргонового-ionlaser при 15 мВт.
- Установите инструмент в стандартной конфигурации: прямого рассеяния (ФС), боковой разброс (SS), и флуоресценции GFP для (525/40 нм). Выберите стробирования клеточной популяции в FS против участка СС точка, чтобы исключить клеточных агрегатов и мусора. Сбор флуоресценции в логарифмической шкале. Рассчитать количество GFP + клеток в каждой пробе.
- Рассчитать вектор титр, используя следующую формулу:% GFP + / 100 х количество клеток, инфицированных фактор х разбавления (DF) = преобразовательного единиц (ТУ) / мл.
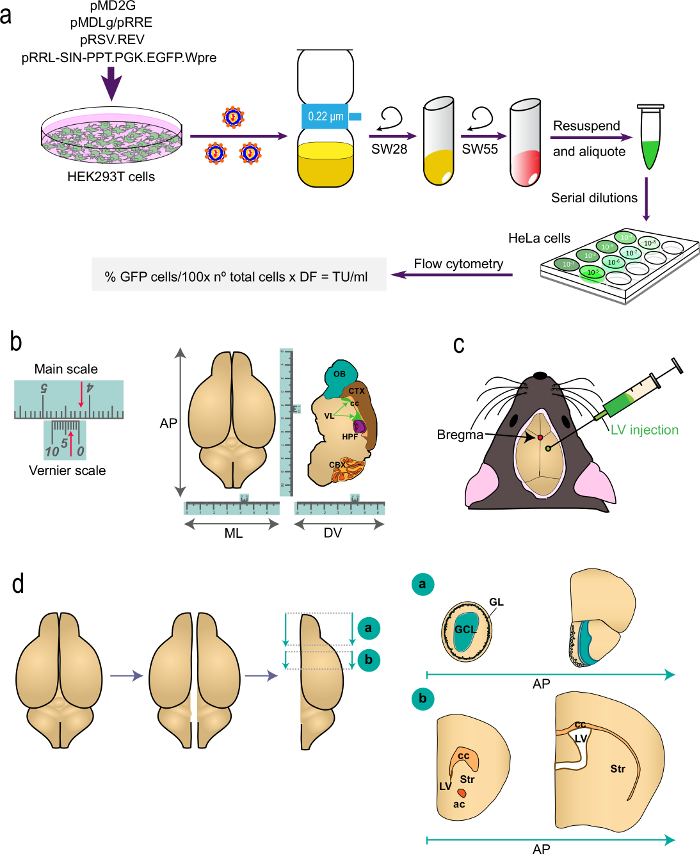
Рисунок 1: Схематическое представление различных частях процедуры (а) часть 1 т.он Протокол: поколение РН для исследований маркировки в живом организме, из трансфекции клеток HEK293T с соответствующими плазмидами для генерации LVs к определению титра вируса с помощью проточной цитометрии с использованием указанного формулу. Имена плазмид и роторов центрифуг указаны. (Б и в) Часть 2 протокола: стереотаксической инъекции РН. "Б" изображает пример нониуса, устройство, которое является частью стереотаксической инструментов и служит для измерения высокого. В качестве примера, стрелки указывают 4,23 см. Шкала Вернье используется для определения координат в передне-задний (AP) медио-латеральной (ML), и спинно-вентральной (DV) оси, как показано на верхнем зрения (слева) и для сагиттальной разделе (справа ) головного мозга. "С" указывает положение темени как пересечение между сагиттальной и корональной швов. ПЗ вводят с помощью шприца. (Г) чертежи, показывающий, как я мозгаы обработаны для анализа. Двух полушарий делятся и каждая из них разделена на два блока. Блок "А", содержащий ОВ, производится корональной разреза на уровне AP сразу за OB стыке с телэнцефалоне (брегма 2,46 мм; см Paxinos' Атлас для справки). Блок "б" производится двумя корональных порезов, один на уровне чуть впереди наиболее ростральной аспекте мозолистого тела (брегма 1,7 мм) и второй на уровне стыке двух боковых желудочков (брегма -0,22 мм). GL, клубочковой слоя; GCL, гранулы клеточный слой; ул, стриатуме; куб.см, мозолистое; AC, передняя спайка; LV, бокового желудочка.
2. Стереотаксическая инъекция РН в V-SVZ / стриатуме границе или в боковой желудочек (рис 1б)
- подготовка
- Стерилизовать 5 мкл емкости шприц с иглой 33 путем распыления вниз по телу и иглу с 70% этанола с поршнемвытащил всю дорогу. Неоднократно аспирата этанола из 1,5 мл трубки микроцентрифужных и извлечь ее всю дорогу несколько раз, и промыть шприц тщательно стерильной водой после этого. Поместите шприц безопасно сторону в капот культуре и дают ей высохнуть.
- Приготовьте для биологически опасных отходов контейнер с 10% хлорной извести на подходящего объема для погружения всех отходов от этой процедуры (обычно 200 мл в 500 мл контейнере).
- Подготовка и подогреть 37 ° C водяную путем заполнения закрывающийся пластиковый пакет для хранения воды и нагревания его до 37 ° С. Это позволит восстановить мышей после инъекции.
- Удалить вирусные акции от -80 ° C хранения морозильника 1 час перед началом инъекции и поместите флакон на вращающемся колесе при комнатной температуре. После оттаивания поддерживать вирусную запас на льду в течение времени инъекции. До стереотаксической инъекции Л.В., развести концентрированный вирусные акции до 10 6 ТУ / мкл с помощью PBS в капот культуре.
- Санируйте зоны, выбранной для выполнения операции с 70% этанола.
- Микроинъекция Л.В.
- Выберите и стерилизовать инструменты, необходимые для проведения операции (скальпелем, дрель, и малых пинцетом).
- Обезболить в 6-8-недельных мышь, внутрибрюшинно (IP) инъекции ветеринарный надзором смесь кетамина и медетомидина. Взвесить каждое животное и дозы каждый с 50-75 мг кетамина и 0,5-1 мг медетомидина на кг массы тела мыши (около 100-125 мкл на кетамин / медетомидин рабочего раствора на мышь).
- Оценка обезболивающий самолет, зажимая пальцами, хвост или ухо и обеспечение того, чтобы животное не показывает никакой реакции.
- После того, как мышь под наркозом, впрыснуть буторфанола подкожно в дозе окончательного 0,4-0,5 мг на кг веса мыши, чтобы минимизировать послеоперационные боли.
- Бритье область между ушами и дезинфекции кожи с использованием иодофор такие как iodopovidone или 70% этанола. Очисти помощью стерильного ватного-tipped аппликаторы. Будьте осторожны, чтобы не слишком влажный животное так как это может усугубить переохлаждение.
- Поместите животное в положении лежа на стереотаксической рамы и тщательно фиксировать головку с помощью ушные баров и поддержку нёбо аппарата. Хранить мышь с набором грелку при 37 ° С и применять глазной смазки для глаз.
- Сделать 1 см длиной разрез на коже головы в продольном используя скальпель и аккуратно убрать кожу, чтобы выставить череп с использованием тонких пинцетом.
- Тщательно очистить поверхность кости со стерильной ватным аппликатором. Очисти подвергаются кости черепа любого оставшегося ткани.
- Установите стерилизованного шприца на стереотаксической устройства, использующего держатель шприца.
- Перемещение держатель шприца х, у и г ось, пока верхушка иглы шприца не позиционируется на темени, точки связке, где сагиттальной (продольной и медиальная) шовный материал перпендикулярно пересекает венечного шва (Figurе 1b). Убедитесь, что положение «ноль» из дорсо-вентральной (DV) оси на поверхности черепа в темени.
- Перемещение шприц с координатами назначения х и у (см Таблицу 1 и Рисунок 1b).
| Регион впрыска | Координаты | ||
| Переднезадней (AP) | Медио-боковой (ML) | Дорзо-вентральной (DV) | |
| ОЭЗ / стриатуме границы | +0,6 мм | +1,2 мм | -3.0 мм |
| бокового желудочка | -0.3 мм | +1,0 мм | -2.6 мм |
Таблица 1: стереотаксическая координаты для инпроекций. Для АР и оси мл, х и у координат даны как расстояние (в мм) от темени. "-" Указывает "в сторону задней". Для DV координаты "ноль" является поверхность черепа в точке темени и координаты DV указывают расстояние (в мм) вниз от этой точки.
- Аннотации х, у и г назначения координаты в нониуса для того, чтобы иметь возможность вернуться к месту инъекции позже. Марк кость на координатами х и у, используя хирургическую маркером.
- Перемещение шприц от рабочей зоны.
- Использование электродрели сделать отверстие на черепе осторожно, чтобы не повредить мозг. Не сверлить пиальных поверхности, поскольку это может привести к повреждению поверхности мозга.
- Загрузите шприц с 1 мкл / мкл вирусного раствора 10 6 ТУ. Используйте 33 калибра острый скошенный иглу которого наконечник имеет угол 10-12 °. Расположите иглу шприца в 90 ° англе по отношению к поверхности мозга.
- Перемещение шприц обратно в месте инъекции и переместить его вниз, пока наконечник не коснется пиальные поверхность.
- Проникнуть в мозг с шприца координаты г по оси DV.
- Медленно отпустить вирусную суспензию, со скоростью 0,2 мкл / мин, чтобы свести к минимуму повреждение ткани мозга из-за чрезмерного давления жидкости.
- Подождите в течение 5-10 мин, чтобы свести к минимуму обратного потока суспензии вируса, а затем убрать шприц очень медленно. Пятно излишки жидкости, которые могут появиться на поверхности в результате втягивания шприца с использованием лабораторной вытереть и поместить его сразу в мусорный контейнер биобезопасности содержащих отбеливатель.
- Возьмите животное из стереотаксического набора, поместите его на теплый коврик, и закрыть рану с помощью клея кожи. Обратный седации, используя 0,1-1,0 мг / кг массы тела Атипамезол.
- Вводят Bupenorphrine подкожно в конечной дозе 0,1 мг на кг веса мыши каждые 12 ч,С 4 ч после введения короткого прочного буторфанола анальгетика.
- Место животное в индивидуализированной клетку с теплой площадку и тщательно контролировать пока мышь не восстанавливается после анестезии. Поместите один пакетик гидрогеля в клетке, чтобы помочь животным гидрат после восстановления.
- Утилизация всех био-загрязненных отходов в распоряжении жидкого отбеливателя биологической. Очистите шприц по аспирации и выталкивания этанола и смыть водой. Лечить области, стереотаксической набор и хирургического материала, который был использован с отбеливателем и 70% этанола.
- Хранить вводили мышам изолированных в области биобезопасности уровня 2 комнаты в течение 24-48 ч, после чего они могут быть переданы обычным жилищного объекта
3. Гистологический анализ
- Перфузии, коллекция тканей и секционирования
- Глубоко обезболивания мышей с помощью ветеринарного надзором смесь медетомидина и кетамина (оценить обезболивающий самолет, зажимая тOES, хвост или ухо), как описано выше.
- Транскардиальную заливать мышей с помощью 25 мл физиологического раствора с последующим 75 мл 4% PFA в PB с той же скоростью 17.
- Выписка мозг и пост-это исправить путем погружения его в по меньшей мере 10-кратном объеме холодного 4% PFA в ПБ в течение 1-16 ч (увеличение раз после фиксации может снизить иммунореактивности некоторых антигенов). Тщательно вымыть оставшуюся PFA с ПБ.
- Вырезать мозг следующей показаний рис 1d и склеить полученный блок держателя vibratome использованием Цианоакрилат.
- Соберите 30 мкм толщиной серийных корональные разделы с помощью vibratome. Хранить срезах мозга в 24-луночные планшеты с РВ при 4 ° С. Для предотвращения загрязнения, 0,05% азида натрия может быть добавлен к раствору PB.
- иммуногистохимия
- Инкубируйте свободно плавающие секции в блокирующем буфере (PB с 0,05% азида натрия, 1% глицина, 5% нормальной козьей сывороткой и 0,1% Tritна X-100) в течение 1 часа при комнатной температуре при осторожном встряхивании в качающейся платформе.
- Осторожно вынуть блокирующий буфер с помощью пипетки, добавьте соответствующую разбавление анти-GFP кролика первичным антителом (таблица материалов) в блокирующем буфере и инкубировать ткани с этим разведения для 48 ч при 4 ° С при осторожном встряхивании.
- Смыть раствора первичного антитела минимум 3 раза с ПБ, один мыть каждые 10 мин.
- Инкубируйте свободно плавающие секции с подходящим разбавлением флуорофором-конъюгированные вторичными антителами) в блокирующем растворе (табл Материалов) в течение 1 ч при комнатной температуре и осторожном встряхивании. Защита разделов от прямого света во время инкубации.
- Отмойтесь вторичного раствора антител с РВ, 3 раза каждые 10 мин, и контрастное ткани путем инкубации срезов с DAPI (4 ', 6-диамидино-2-фенилиндол) при 1 мг / мл в воде в течение 5 мин. Смыть решение DAPI промывкой дважды и быстро остроумиеч воды.
- Аккуратно поместите разделы на предметное стекло микроскопа, используя тонкую кисточку. Налейте несколько капель монтажа среды для люминесцентных препаратов (табл Материалов) над тканью и осторожно поместите покровное сверху, проверив, что монтажное устройство правильно распределены по всей поверхности и нет пузырьков. Осторожно сожмите вниз покровное для слива избытка монтажа среду.
- Когда решение для монтажа высыхает (2-16 ч), анализировать образец с помощью конфокальной лазерной сканирующей микроскопии с 488 нм лазер.
Результаты
LV-опосредованной система доставки гена может быть использован для долгосрочной перспективе в естественных условиях трансдукции клеток у взрослых мышей V-СВЗ, позволяя их отслеживание и генетическую модификацию в процессе пролиферации, миграции и дифференциации. Инфекция и эксп?...
Обсуждение
ПЗ предложить важные преимущества перед другими вирусными систем для генетической модификации взрослого НСК 16,18. Стереотаксическая доставка лентивирусах к V-СВЗ нише представляет собой эффективный метод, чтобы маркировать и отслеживать нечасто деления B1-НСК преодолеть огранич...
Раскрытие информации
Все манипуляции проводились в уровень биологической безопасности 2 комнаты. Протоколы животных были одобрены Комитетом по этике Университета Валенсии и все были в соответствии с Европейской директивой 2010/63 / ЕС.
Благодарности
Мы признаем помощь MJ Палоп и техническую поддержку SCSIE из Университета Валенсии. Мы также благодарим Antonia Follenzi за полезные замечания и обсуждение рукописи. ЕСЛИ поддерживается Фонд Ботин, по Banco Santander через ее Сантандер университетов глобальным вопросам, и за счет субсидий из генералитета Valenciana (Programa Prometeo, ACOMP и МСОК) и Ministerio де Economia у Competitividad (MINECO: SAF2011-23331, CIBERNED и RETIC TERCEL) , Эта работа была поддержана BFU2010-21823 и RETIC TERCEL грантов MINECO и Европейского исследовательского совета (ERC) 2012-STG (260511- PD-HUMMODEL) к сети переменного BM-P. является получателем испанской FPI общении MINECO.
Материалы
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25X89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13X51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100x20 style |
| FACS tubes | Afora | DE400800 | 12x75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2X HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100X, used to prepare HeLa and 293T culture medium at a final concentration of 10X. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10X, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1X PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1000X stock solution at 8 mg/ml in dH2O |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33-gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11x21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
Ссылки
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены