需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在成年小鼠V-SVZ细胞的神经分析的稳定,高效的基因修饰干细胞自主和非自主的影响
摘要
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
摘要
相对静止的成体干细胞支持在大多数成人组织终身细胞更新。在成年哺乳动物脑的神经干细胞被限制在两个特定神经源性龛:在海马的齿状回和心室脑室下区的颗粒下区(V-SVZ;也称为室管膜下区或SEZ)在横向的壁心室。的成人干细胞群在体内基因转移策略导致干细胞所需的转基因的长期表达和它们的衍生后代的发展(即那些哺乳动物大脑的)是在当前生物医学和生物技术研究的一个重要工具。这里,一个直接的体内方法提出了成年小鼠的V-SVZ细胞的稳定遗传修饰采用由LV的细胞周期无关的感染和V SVZ龛的高度专业化的细胞结构的优势。具体地,目前的协议涉及是空的LV(对照)或LV编码特定基因的表达盒插入相应的V-SVZ本身的注入,对于所有类型的壁龛细胞的体内靶向 ,或进入侧脑室管腔,为室管膜的定位只有细胞。然后表达盒被整合到转导的细胞和荧光蛋白,也被的LV编码的基因组中,允许在检测到转导的细胞的对的细胞中自主和非自主,小生依赖效应的标记的细胞并分析它们的后代。
引言
鼠心室脑室下区(V-SVZ),在面对纹状体侧脑室的壁,是一种非常活跃的生发区域,其中在持久生产嗅球祖细胞复制和分化的结果的一个持续的过程(OB )的interneurons和胼胝体少突胶质细胞1。终身代这些细胞似乎是由在神经干细胞(NSCs;也称为B1细胞)的此区域中的存在来支持,该表达星形细胞抗原胶质纤维酸性蛋白(GFAP)和干细胞标记物如巢蛋白,ID1和Sox2 2。 GFAP表达B1细胞产生的过境放大祖(TAP)细胞(C细胞),表达转录因子DLX2(远端无同源2)和ASCL1(哺乳动物achaete-schute同源物1)和除法迅速几次就会使人产生之前在迁移神经母细胞(A细胞)或oligodendroblasts 3。 prolif新生成erative神经细胞迁移前方,形成喙迁移流(RMS)的OB,在那里他们融入颗粒和肾小球层的分化抑制性。迁移年轻oligodendroblasts移动到CC,在那里他们成为未成熟的NG2阳性细胞继续分裂本地或分化为成熟的少突胶质细胞髓鞘形成1,4。
B1细胞,胎儿放射状胶质细胞获得,留住他们的前辈的拉长和偏光形态和表现出与自己的优势高度专业化的关系。他们跨越室管膜哪些行了心室和血管灌溉V-SVZ利基的网络之间。 multiciliated室管膜细胞之间B1细胞插层的小心尖进程和单一非能动初级纤毛结束,而其基底处理延伸很长的距离接近平面血管丛,在将b灌溉这个利基结局丛毛细血管2,5-8的荒漠和半荒漠层。
从非神经胶质细胞,这也是GFAP +在完整的V-SVZ利基区分B1〜神经干细胞的最可靠的方法是基于整个安装由三维共聚焦显微镜心室侧壁的制剂和它们的分析后免疫染色GFAP标记薄B1-NSC心尖过程,β连环蛋白划定细胞膜,和任一γ微管蛋白作为纤毛基体或乙酰化α微管蛋白的标记物来标记每个纤毛5,8的程度。从室面这些全坐骑观测表明,B1和室管膜细胞被布置在"风车"5,其中一个或几个GFAP + B1细胞的uniciliated根尖过程由multiciliated室管膜细胞的莲座包围。
B1细胞的形态特征与实验相关的证据我ndicating该血管/内皮细胞和心室脑脊液(CSF)构成作用于神经干细胞2,6,9-11可溶性信号调节源。在心室的表面,同型和室管膜参与和B1细胞异型apico侧向相互作用包括紧密连接和粘着路口5,12。此外,在B1和室管膜细胞,如N-钙粘蛋白和V-CAM之间的连接复合牵连粘附分子,已显示出调节不仅B1的高度组织定位在V SVZ小生,而且它们的静止12 13。室管膜-B1细胞单层似乎充当扩散屏障,允许水和小分子从CSF调节的流量,但限制大蛋白10,11的细胞间通道。实验证据表明,独特的定位B1根尖细胞纤毛可以发挥信令存在于CSF 2多肽的传感器的作用,5-7。室管膜细胞本身,也具有在NSC行为14,15的调节作用的可溶性和膜结合信号源。
可追踪核苷,如溴代脱氧尿苷(BrdU)标记,或逆转录病毒已被广泛地用于标记的祖细胞,包括神经干细胞, 在体内 。然而,这些方法不是最佳的长期命运跟踪因为BrdU的信号稀释经过反复的细胞分裂和逆转录病毒似乎优先靶向瞬时放大,由于其为转导16,17的细胞增殖的必要条件的细胞。为了检查体内 NSC生理学,包括与小生组分的相互作用,这是至关重要的,以建立到标签和跟踪很少分裂细胞,如B1〜神经干细胞基本上是静止的和它们相邻室管膜细胞从未生理条件3下分割的方法。这里,我们表明,慢病毒载体(LVS)允许高效率基因标记ING和成人神经干细胞和非分裂室管膜细胞的长期维护,由于最合理其转导,并整合到靶细胞中的细胞周期无关的方式的基因组中的能力。此外,我们显示如何递送和病毒滴度的帮助路由特异性转导室管膜细胞,但不是B1细胞从而允许对神经干细胞生态位依赖性,室管膜影响的分析。
研究方案
道德守则:该协议遵循符合欧洲指令63分之2010/ EU瓦伦西亚大学的动物护理准则。
1. LV 在体内生成标记研究(见图1a)
注意:此处描述的步骤,是生物安全等级2,因此执行在生物危害罩下面的所有过程。确保研究人员适当资格,并在所有程序的培训。穿戴个人防护装备,包括长袍,双层手套和适当的保护眼睛。最后,彻底净化的所有工具和表面可能已经根据批准的设施消毒做法一直在与病毒接触(通过用70%乙醇,10%漂白剂和/或高压灭菌擦拭)。
- LV的生产人胚肾293T细胞
- 通过准备纯DNA转染启动此协议。准备和双氯化铯毕业生净化每个质粒ient离心或其它市售列方法得到无内毒素的DNA。在这个协议中,我们已经使用了转移载体质粒pRRL-SIN-PPT.PGK.EGFP.Wpre。推荐的核心包装质粒pMDLg / pRRE和pRSV.REV和包膜质粒pMD2G 13,18,19。
- 转染前二十四小时,板5×10 6个293T细胞在Iscove氏改良的Dulbecco氏培养基(IMDM)( 参见材料的表 )在10cm的塑料培养皿中,以获得一个大约1/4到1/3汇合培养转染。在5-7%的CO 2气氛中孵育在37℃下在湿润的培养箱中。
- 更换转染前新鲜培养基2小时的网上平台。
- 在无菌1.5 ml离心管混合10转移载体质粒微克(含转基因的cDNA或shRNA的待递送)与pRSV.REV 2.5微克和5微克的pMDLg / pRRE包装质粒,和3.5& #181;克包膜质粒pMD2G的。弥补质粒溶液,以450微升用0.1×TE缓冲液的终体积( 见材料的表 )/ DH 2 O(2:1)。然后加入2.5M的氯化钙的50微升。
- 形成通过滴加500微升2倍的Hepes缓冲盐水的沉淀物(HBS,参见材料的表)溶液到500μl的DNA的TE- 氯化钙混合物,同时在全速涡旋。
- 将沉淀加入到紧接在293T细胞。轻轻地摇晃板混合。返回细胞培养箱和转染后改变介质14-16小时。
- 收集细胞上清改变了媒体后30小时。通过0.22微米孔径硝酸纤维素滤膜过滤上清,进行浓度。
- LV的浓度
- 精矿超速离心条件培养基50,000 XG(19,000 RPM与SW-28超速离心机转子)2小时在30ml的聚丙烯透明锥形转子管室温(RT)。
注:锥形转子管使用超速适配器(请参阅材料表)。 - 通过倾析弃去上清液,并在小体积(200微升或更少,如果只进行一次离心)的磷酸盐缓冲盐水的悬浮颗粒(PBS; 参见材料的数据表)。然后移液器上下20次左右。
- 凝聚悬浮液和通过超速离心再次浓缩,还以50,000×g下(23000 rpm的转速SW-55超速离心机转子),在室温下2小时。使用聚丙烯透明转筒用5毫升标称容量( 见材料表 )。
- 悬浮最终沉淀在无菌PBS的非常小的体积(介质的起始体积的1/500或1/1000),并在旋转轮摇在RT 1小时。拆分成小等份(5-20微升)和freeze他们在-80℃。
- 丢弃之前对待10%的漂白粉所有空管。
- 精矿超速离心条件培养基50,000 XG(19,000 RPM与SW-28超速离心机转子)2小时在30ml的聚丙烯透明锥形转子管室温(RT)。
- 慢病毒滴定采用流式细胞仪
- 的前一天,板5×10 4个每孔的HeLa细胞中的2ml Dulbecco氏改良的Eagle氏培养基(DMEM)6-孔组织培养板( 参见材料的数据表)。孵育在37℃下在湿润的培养箱中的5-7%的CO 2的气氛中24小时。
- 上滴定的当天,解冻病毒库存的等分试样和制备系列稀释液,从10 -3到10 -8,在DMEM中。
- 这样做,取24孔平板并加2ml的DMEM到第一井和1.8毫升以下的孔中。然后加入2μl浓缩的病毒的股票的添加到第一井(以1:1的最终稀释度:1,000或10 -3)。
- 吹打几次彻底混合的解决方案,改变针尖与转移200微升10 -3稀释后到第二阱。串联重复该过程在下面的井,直到10 -8稀释而成。
- 就拿从孵化器镀前一天HeLa细胞。小心地从井中取出网上平台。 1微升8毫克/毫升聚凝胺的HeLa细胞含有细胞的井一起加入1毫升每个病毒稀释。轻轻地摇晃板混合。
注意:加入聚凝胺,以增加病毒吸附到在培养的细胞中。 - 返回细胞培养箱并允许感染进行72小时。在此之后,除去培养基,用PBS洗一次细胞,并添加200μl的胰蛋白酶-EDTA(见材料表 )至各孔中。
- 在37℃5分钟后,在流式细胞仪管加入2毫升的PBS至每孔,并收获细胞。
- 离心在RT 5分钟300×g且吸出上清液。
- 悬浮颗粒用1毫升固定soluti的上(1%甲醛电子显微级和2%胎牛血清的PBS中),然后涡管中。
- 分析将细胞在流式细胞仪在15毫瓦的功率使用的488nm氩ionlaser流。
- 成立了以标准配置仪器:前向散射(FS),侧散射(SS)和荧光的GFP(四十分之五百二十五纳米)。在FS 与 SS点图选择的细胞群体门控,以排除细胞聚集和碎片。收集在对数标度的荧光。计算每个样品中的GFP +细胞的数目。
- 使用下列公式计算矢量滴度:% 的 GFP + / 100感染×稀释因子的细胞(DF)的x个=转导单位(TU)/毫升。
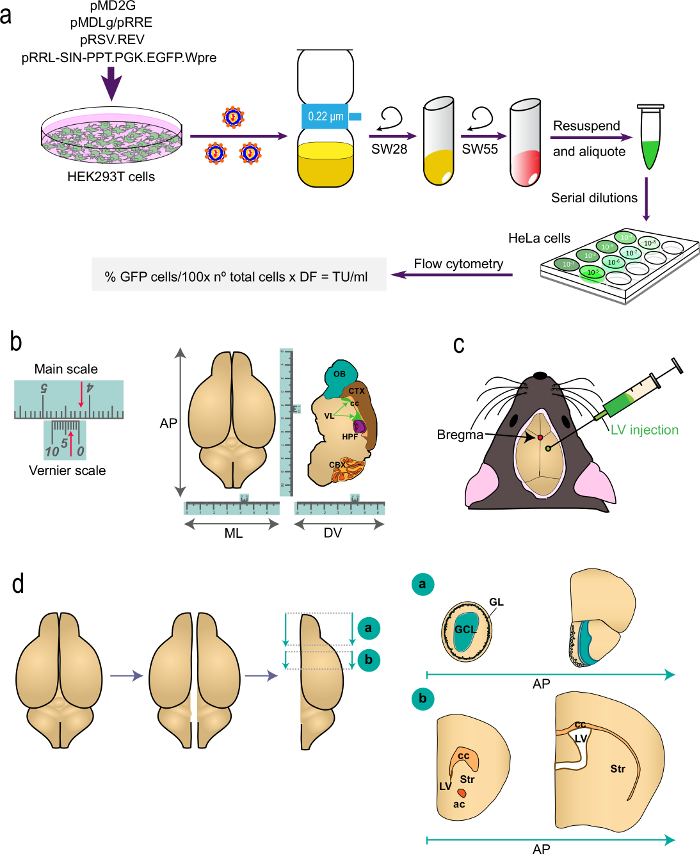
图1:该过程的不同部分的示意图 ( 一 )的t 1部分。他协议:一代的LV 用于体内标记研究,从HEK293T细胞用合适的质粒转染的,以通过流式细胞术使用所述公式生成的LV到病毒滴度的测定。质粒和离心机转子的名称表示。 (b和c)协议的第2部分:LV的立体定向注射。 "b"的描绘了一个游标刻度,即立体文书的一部分,并且提供用于精细测量的装置的一个例子。作为一个例子中,箭头表示4.23厘米。游标刻度被用来确定在前 - 后的坐标(AP),内 - 外(ML),并且如图对的顶视图(左)背腹(DV)轴和弧矢剖面(右)的大脑。 "C"表示囟作为矢状面和冠状缝线之间的交点的位置。的LV使用注射器注射。 (四)简图大脑如何我Ş处理进行分析。两半球被分割,每一个被分成两个块。块"a"的,包含的OB,由在AP水平冠状切产生立即后路与端脑的转播结(前囟2.46毫米;参见Paxinos'阿特拉斯为基准)。 "b"块由两个冠状切口,一个在电平只是前胼胝体的最喙方面(前囟1.7毫米),并在两个侧脑室的交界处的电平的第二个生产(前囟-0.22毫米)。 GL,肾小球层;保利协鑫,颗粒细胞层; ST,纹状体; CC,胼胝体; AC,前连合; LV,侧脑室。
2. LV的立体定向注入V-SVZ /纹状体边缘或侧脑室(参见图1b)
- 制备
- 通过喷雾向下本体和针,用70%的乙醇与柱塞消毒用33号针头的5微升容量注射器掏出所有的方式。多次从1.5 ml离心管吸出乙醇和弹出一路数次,事后用无菌水彻底冲洗注射器。将注射器安全抛开文化引擎盖和晾干。
- 制备具有10%的漂白剂的生物危险废物容器至合适体积的所有废物浸没这个过程(通常200毫升在500毫升容器)。
- 准备并通过填充一个密封的塑料保鲜袋水,并加热到37℃预热37℃的水床。这将允许小鼠恢复以下注入。
- 在开始之前注射℃下冷冻储存在-80删除病毒的股票1小时,然后将小瓶上在RT旋转的轮子。解冻后,保持在冰上病毒库存期间注射的时间。此前LV的立体喷射,稀释浓缩的病毒股票10 6 TU /微升的培养罩采用PBS。
- 消毒选择用于执行用70%乙醇的手术的区域。
- LV显微注射
- 选择和消毒需要手术(手术刀,钻头,小镊子)的工具。
- 经腹腔注射麻醉6-8周龄注射小鼠和氯胺酮美托咪定的兽医监督的混合物。称量每只动物并用50-75毫克氯胺酮和每小鼠体重公斤(大约100-125微升氯胺酮/美托咪定工作每只小鼠溶液)0.5-1毫克美托咪定剂量每。
- 按捏脚趾,尾部或耳朵,并确保该动物没有显示出反应评估麻醉平面。
- 一旦鼠标被麻醉,以每千克小鼠体重减少手术后疼痛0.4-0.5毫克最终剂量注入布托啡诺皮下。
- 剃耳朵之间的区域,并使用一个碘伏如iodopovidone或70%的乙醇消毒皮肤。清洁使用无菌棉-tipped喷头。要小心,不要过度潮湿的动物,因为这可能会加剧低温。
- 放在俯卧位的动物立体框架上,并精心修复使用耳酒吧和腭支持设备的头上。保持与加热垫组小鼠在37℃和应用眼用润滑剂眼睛。
- 使头部皮肤上的1厘米长的切口纵向使用手术刀,轻轻缩回皮肤用细镊子暴露颅骨。
- 仔细清理用消毒棉签骨面。清洗任何残留的组织的暴露颅骨。
- 安装使用注射器座的立体定向装置上的无菌注射器。
- 移动至注射器座的x,y和z轴直到注射器针头的尖端被定位在前囟,会合点矢状(纵向和内侧)缝合线垂直通过冠状缝相交(FIGURË1B)。确保背腹(DV)轴的"零"位置是在囟门颅骨表面。
- 移动注射器x和y目的地坐标( 见表 1和图1b)。
| 注射区 | 坐标 | ||
| 前-后(AP) | 内-外(ML) | 背腹(DV) | |
| SEZ /纹状体边缘 | 0.6毫米 | 1.2毫米 | -3.0毫米 |
| 侧脑室 | -0.3毫米 | 1.0毫米 | -2.6毫米 |
表1:立体坐标为中jections对于在AP和ML轴,x和y坐标被给定为来自前囟的距离(单位mm)。 " - "表示"朝后"。用于DV坐标"零"是颅骨的前囟点的表面和DV坐标表示(单位mm)的距离从该点向下。
- 注释在x,y和z目的地在游标规模,为了能够回来注射部位以后坐标。标记使用外科记号笔在x和y坐标的骨。
- 从工作区移动至注射器程。
- 使用电钻使在头骨的孔小心不要损伤大脑。不要钻软脑膜表面,因为这可能会损害大脑的表面。
- 加载与1微升10 6 TU /μl病毒溶液的注射器。使用33量规尖锐斜面的针,其尖端具有10-12°的角度。注射器针头以90°昂定位乐相对于脑表面。
- 移动注射器回注射部位直到尖端触及软脑膜表面移动下来。
- 穿透用注射器于z大脑坐标在DV轴。
- 缓慢释放的病毒悬浮液,以0.2微升/分钟的速率,以最小化对脑组织损伤由于过度的流体压力。
- 等待5-10分钟,以尽量减少病毒悬浮液的回流,然后缩回注射器非常缓慢。吸干液体任何过量可能在表面上出现使用实验室擦拭注射器的回缩的结果,并立即将其放置在含有漂白剂的生物安全废物容器中。
- 就拿动物出立体的设定,将其放置在温暖垫,并用皮肤粘合关闭伤口。反向使用0.1-1.0毫克/公斤体重的阿替美唑镇静。
- 注入Bupenorphrine皮下注射,每12小时0.1毫克每千克小鼠体重的最终剂量,在开始短持久布托啡诺镇痛的给药后4小时。
- 放置动物一个温暖的垫个性化的笼子,直到鼠标从麻醉中复苏密切监测。将水凝胶的一包在笼子里,以帮助恢复后的动物水合物。
- 部署在漂白液生物危害掌握的一切生物污染的废弃物。清洁吸和乙醇弹射注射器,并用清水冲洗。消毒区,立体组和已被用于与漂白剂和70%的乙醇的外科手术材料。
- 保持在生物安全水平2室分离小鼠注射24-48小时后,他们可以被转移到一个常规住房设施
3.组织学分析
- 灌注,组织收集和切片
- 使用美托咪定和氯胺酮的兽医监督深深的混合物麻醉小鼠(按捏的T评估麻醉平面OES,尾或耳),如前面所述。
- Transcardially用25ml生理盐水溶液中,接着将75ml 4%PFA中的PB以相同的速率17灌注小鼠。
- 提取大脑和通过在至少10倍于其在PB中冷的4%PFA中的体积浸渍1-16小时(增加后固定时间可能会降低某些抗原的免疫反应性)的后固定。用PB彻底清洗剩下的煤灰。
- 切下图1d的指示大脑和所得嵌段胶水使用氰基丙烯酸酯一vibratome的持有者。
- 收集使用振动30微米厚的串行冠状切片。在4℃下储存于用PB 24多孔板的脑切片。为防止污染,0.05%叠氮化钠可以加入到PB溶液。
- 免疫组化
- 孵育自由浮动切片在含0.05%叠氮化钠,1%甘氨酸,5%正常山羊血清封闭缓冲液(PB和0.1%三叔上X-100)在室温1小时,在一个摇动平台轻柔摇动。
- 小心地用移液管除去封闭缓冲液,在封闭缓冲液中添加抗GFP兔初级抗体(见材料的表)的一个适当的稀释,并用此稀释为48小时,在4℃下轻轻摇动孵育组织。
- 洗掉初级抗体溶液用PB至少3次,每次10分钟,洗涤一次。
- 孵育在封闭溶液与荧光团共轭次级抗体的合适稀释的自由浮动部分)( 参见材料的数据表),在室温和轻轻摇动1小时。保护孵化过程中直接光部分。
- 洗掉用PB,3次,每次10分钟,一次二次抗体溶液,并通过在水中用DAPI(4',6-二脒基-2-苯基)以1mg / ml的温育切片5分钟,染液的组织。通过冲洗两次,并迅速机智洗掉DAPI解决方案h进水。
- 轻轻地放在用细刷油漆载玻片的部分。倾( 见材料的数据表)安装平台荧光制剂在组织几滴并小心地将一个盖玻片放在上面,检查安装溶液正确地分布在整个表面上,也没有气泡。轻轻挤压下盖玻片排出多余的安装介质。
- 当安装溶液变干(2-16小时),分析通过用488纳米激光共聚焦激光扫描显微镜的样品。
结果
LV-介导的基因传递系统可用于在成年小鼠的V-SVZ细胞体转导的长期,允许中增殖,迁移和分化的跟踪和遗传修饰。感染和表达是高度有效的,并产生大量的细胞,它可以由表达式的记者包括是其它非感染细胞中容易辨别。我们迄今为止已经显现转导的细胞用GFP荧光报告,由遍在表达磷酸甘油酸激酶启动子驱动的,但也可使用其他的记者或蛋白质标签。我们经常使用抗体GFP而不是依赖?...
讨论
LV的提供超过成人神经干细胞的16,18遗传修饰其他病毒系统的重要优势。到V-SVZ利基立体递送慢病毒的代表一个有效的方法来标记和跟踪不常除以B1-的NSCs克服其他常用的方法,例如BrdU的,这是多种细胞分裂,或逆转录病毒稀释后,只靶细胞的局限这是在应用程序的时刻增殖。的LV,与腺病毒一起,可以独立的其循环状态感染细胞,这是对于那些不循环,如室管膜细胞,或者是相对静止...
披露声明
所有操作均在生物安全2级的房间进行。动物方案得到瓦伦西亚大学伦理委员会的批准,均符合欧洲指令63分之2010/ EU。
致谢
我们承认MJ帕洛普的帮助和技术支持大学去瓦伦西亚SCSIE的。我们也感谢安东尼Follenzi了有益的意见和手稿的讨论。如果这个是由基金会博坦,由桑坦德银行通过其桑坦德大学全球业务部门,并通过从Generalitat瓦伦西亚(Programa PROMETEO,acomp中,与ISIC)和部:EconomìaŸCompetitividad资助项目(MINECO:SAF2011-23331,CIBERNED和网织红细胞雄鹰) 。这项工作也由MINECO 和欧洲研究委员会(ERC)2012年STG BFU2010-21823和网织红细胞雄鹰资助项目(260511- PD-HUMMODEL)到交流 BM-P上。是MINECO的西班牙FPI奖学金的获得者。
材料
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25X89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13X51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100x20 style |
| FACS tubes | Afora | DE400800 | 12x75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2X HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100X, used to prepare HeLa and 293T culture medium at a final concentration of 10X. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10X, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1X PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1000X stock solution at 8 mg/ml in dH2O |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33-gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11x21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
参考文献
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。