Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nöral Analizi Yetişkin Fare V-SVZ'una Hücre istikrarlı ve verimli Genetik Modifikasyon Kök Hücre Özerk ve Non-özerk Etkileri
Bu Makalede
Özet
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Özet
Nispeten sakin somatik kök hücreler çoğu yetişkin dokularda yaşam boyu hücre yenilenmesini destekler. Yetişkin memeli beyninde sinir kök hücreleri iki özel nörojenik nişler ile sınırlıdır: hipokampus dentat girus ve ventriküler-subventricular bölgenin subgranuler kısmında lateral duvarlarında (V-SVZ'unda da subependimal bölgesi veya SEZ olarak adlandırılır) karıncıklar. Uzun süreli kök hücreleri istenen transgenlerin sentezlenmesi ve elde edilen döl elde yetişkin kök hücre popülasyonlarının in vivo gen transferi stratejilerinin geliştirilmesi (örneğin, memeli beyin olanlar) mevcut biyomedikal ve biyoteknolojik araştırma önemli bir araçtır. Burada, doğrudan in vivo yöntem, karaciğer hacimleri ile hücre döngüsü bağımsız enfeksiyon ve V-SVZ nişin çok özel hücre mimarisini yararlanır yetişkin fare V SVZ hücrelerinin kararlı genetik modifikasyon sunulmuştur. Özellikle, mevcut protokol dahilV-SVZ'unda kendisi ya spesifik transgen sentezleme kasetlerini şifreleyen boş Lys (kontrol) veya karaciğer hacimleri enjekte ependim hedeflenmesi için, in vivo niş hücrelerin her türlü hedefleme için, ya da lateral ventrikül lümenine, s hücreler sadece. İfade kasetleri daha sonra izin da karaciğer hacimleri ile kodlanan kalıt aktarımlı hücreler ve floresan proteinleri, genomu içine entegre edilmiştir etiketli hücre ve hücre bağımsız ve otonom-olmayan, niş bağımlı etkilerinin analizi için kalıt aktarımlı hücrelerin tespit kendi soy.
Giriş
fare ventrikül-subventricular bölgesi (V-SVZ), striatum bakan lateral ventrikül duvarlarında, çok aktif bir germinal bölge olduğu koku ampul kalıcı üretiminde progenitör hücre replikasyonu ve farklılaşma sonuçlarının sürekli bir süreç (OB ) internöron ve korpus kallosum oligodendrosit 1. , Astrositik antijen glial fibriller asidik protein (GFAP) ifade ve Nestin, ID1 olarak hücre belirteçleri kök, bu hücrelerin yaşam boyu nesil nöral kök hücreler (ayrıca B1 hücreleri olarak adlandırılan NSC'lerde) bu bölgede varlığı ile desteklenen gibi görünüyor ve Sox2 2. B1 hücreleri geçiş progenitör amplifiye transkripsiyon Dlx2 faktörleri ifade (TAP) hücreleri (Cı hücreleri) oluşturmak GFAP-sentezleyen (uzak-az homeobox 2) ve Ascl1 (memeli Achaete-Schute homologu 1) ve yol açmadan önce hızlı bir şekilde birkaç kez bölmek göç neuroblasts (A hücreleri) ya da oligodendroblasts 3. Silahların yayılması yeni oluşturulanliğine açık Nöroblastlar onlar granül ve farklılaştırılmış inhibitör olarak glomerüler katmanlara entegre OB, rostralinde göç akışı (RMS) oluşturan öne göç. Geçiş genç oligodendroblasts yerel olarak bölmek veya olgun Myelinating oligodendrositlere 1,4 içine ayırt etmeye devam olgunlaşmamış NG2-pozitif hücreler haline CC, hareket.
Fetal radyal glial hücrelerden elde B1 hücreleri, seleflerinin uzun ve polarize morfoloji korumak ve onların niş ile son derece uzmanlaşmış bir ilişki sergiler. Onlar hangi hatlar ventrikül ve V-SVZ niş sulamak kan damarlarının ağı yukarı ependima arasında kapsar. bazal süreç b bu niş biten sular düzlemsel vasküler pleksusu yaklaşım uzun mesafelerde uzanır oysa multiciliated ependymocytes arasında B1 hücreleri intercalates küçük apikal süreci ve tek bir non-motil birincil cilium biterpleksus kılcal damarların 2,5-8 arasında asal lamina.
Bozulmamış V-SVZ niş içinde de GFAP + non-nörojenik astrositler, B1-NSCs ayırt etmek en güvenilir yolu dayanmaktadır sonra 3-D konfokal mikroskobu ile ventrikül lateral duvar hazırlıklarını ve bunların analizlerini tüm montaj GFAP immün hücre zarlarını belirginleştiren ince B1-MGK apikal süreci, beta-katenin etiket ve her cilium 5,8 kapsamını etiket cilial bazal organları veya asetile α-tubulin bir belirteç olarak γ-tubulin birine. Ventriküler yüzeyinden bu tam bağlar Gözlemler B1 ve ependimal hücreleri bir veya birkaç GFAP + B1 hücreleri uniciliated apikal süreçleri multiciliated ependimal hücre rozet çevrili olduğu "pinwheels" 5, düzenlenmiş olduğunu göstermiştir.
B1 hücrelerinin karakteristik morfolojisi deneysel kanıt ile ilişkilidir iNSC'lerde 2,6,9-11 üzerinde etkili çözünür sinyallerin düzenlenmiş kaynakları teşkil kan damarlarını / endotel hücreleri ndicating ve beyin omurilik sıvısı (BOS) ventriküler. Ventriküler yüzey homotipik ve ependim B1 hücrelerini kapsayan heterotipik apico yanal etkileşimler sıkı kavşaklar ve adherens birleşme 5,12 içerir. Ayrıca, bu tür N-kaderin, V-CAM gibi B1 ve ependimal hücreleri arasında bağlantı komplekslerinde rol yapışma molekülleri, V-SVZ niş B1 yüksek organize konumlandırma sadece düzenleme gösterilmiştir, aynı zamanda sessizlik 12 13. Ependim-B1 hücre tekli-tabakası, bir difüzyon CSF su ve küçük moleküllerin düzenli bir akı sağlayan bir bariyer, ancak büyük proteinlerin 10,11 arası geçiş sınırlayıcı olarak hareket ettiği görülmektedir. Deneysel kanıtlar, benzersiz bir konuma sahip B1 hücresi apikal kirpik CSF 2 mevcut polipeptitleri sinyal bir sensör olarak bir rol oynayabileceğini göstermektedir5-7. Ependimal hücreleri per se NSC davranış 14,15 düzenlenmesinde bir rol ile çözünebilir ve zara bağlı sinyallerin bir kaynağıdır.
Örneğin bromo-deoksiüridin (BrdU) veya retrovirüsler gibi, izlenebilir nükleositler, yaygın olarak, in vivo olarak, NSC'lerde dahil projenitör hücreleri etiketlemek için kullanılmıştır. BrdU sinyalleri tekrarlanan hücre bölünmeleri ve retrovirüslerin ile sulandırmak tercihen iletimi 16,17 için hücre çoğalmasının onların ihtiyacına bağlı hücrelerin yükseltme geçici hedef görünür Ancak, bu yöntemler uzun vadeli kader izleme için uygun değillerdir. Niş bileşenleri ile etkileşim de dahil olmak üzere in vivo MGK fizyoloji, incelemek için, etiket ve B1-NSC'lerde büyük ölçüde durgun ve bunların komşu ependimal hücreler fizyolojik şartlar altında 3 bölmek asla, nadiren bölünen hücreleri izlemek için bir yöntem oluşturulması için çok önemlidir. Burada, lentiviral vektörler (LVs) yüksek verimli gen işareti izin olduğunu göstermektedirING ve kabiliyetleri transdüksiyonu için ve hücre devre bağımlı biçimde hedef hücrelerin genomu içine entegre için en uygun olan yetişkin NSC'lerde ve bölünmeyen ependim hücrelerin uzun süreli modifikasyonu. Ayrıca, biz teslim ve viral titre yardım rota özellikle böylece NSC'lerde üzerinde niş bağımlı, ependimal etkilerin analizi sağlayan B1 hücrelerini ependimal hücreleri nakletmek değil, nasıl gösterir.
Access restricted. Please log in or start a trial to view this content.
Protokol
ETİK TABLOSU: Bu protokol, Avrupa direktifi 2010/63 / AB ile uyumlu Valencia Üniversitesi'nin hayvan bakım kuralları takip eder.
Çalışmaları İşaretleme In Vivo için LV 1. Kuşak (Şekil 1a bakınız)
DİKKAT: Burada açıklanan prosedür nedenle biyolojik tehlike kaput tüm aşağıdaki prosedürleri gerçekleştirmek, biyogüvenlik düzeyi 2 'dir. Bu araştırma personeli uygun niteliklere ve tüm prosedürler eğitimli olduğundan emin olun. elbisesi, çift eldiven ve uygun göz koruması dahil olmak üzere kişisel koruyucu ekipman giyin. Son olarak, iyice (% 70 etanol,% 10 çamaşır suyu ve / veya otoklav ile silerek) onaylı tesis dezenfeksiyon uygulamalarına göre virüsler ile temas olabilirdi tüm araçlar ve yüzeyleri dezenfekte.
- Insan embriyonik böbrek 293T hücrelerinde LV üretimi
- Transfeksiyon için saf DNA hazırlayarak bu protokolü başlatın. Hazırlayın ve çift CsCl grad her plazmid arındırmaksağ- lasa santrifüj veya endotoksin içermeyen DNA elde edildi, diğer ticari olarak temin edilebilen kolon yöntemleri. Bu protokolde transfer vektörü plazmid pRRL-SIN-PPT.PGK.EGFP.Wpre kullandık. Tavsiye edilen ana paketleme plasmidleri pMDLg / pRRE ve pRSV.REV ve plasmid pMD2G 13,18,19 zarf.
- Yirmi dört saat transfeksiyondan önce, Iscove Modifiye Dulbecco ortamı (IMDM) içinde plaka 5 x 10 6 293T hücreleri için yaklaşık 1/4 ile 1/3 Birleşik kültür elde etmek için bir 10 cm'lik plastik tabak (Malzeme Tablo) transfeksiyon. 5-7% CO2 atmosferinde nemlendirilmiş bir inkübatörde 37 ° C'de inkübe edin.
- transfeksiyondan önce taze ortam 2 saat ile orta yerine.
- steril 1.5ml mikrosantrifüj tüpü karışımı içinde 10 transfer vektörü plazmidi ug pRSV.REV 2.5 ug ve pMDLg / pRRE ambalaj plazmid 5 ug, ve 3.5-ile (transgenin cDNA veya shRNA ihtiva teslim edilmesi) #181, zarf plazmid pMD2G g. 0.1x TE tamponu ile 450 ul'lik nihai bir hacme kadar plazmid solüsyonu yapmak / 0 dH 2 (Malzeme Tablo) (2: 1). Daha sonra 2.5 M CaCI2 50 ul ekle.
- Tam hızda vorteks edilirken 2x Hepes tamponlu tuz 500 ul damlalar halinde ilave edilerek bir çökelti oluşmaya 500 ul DNA TE-CaCl2 karışımına çözeltisi (HBS, Malzemelerin Tablo).
- Hemen 293T hücrelerine çökelti ekleyin. Yavaşça karıştırın plaka girdap. inkübatör hücreleri dönün ve transfeksiyon sonra orta 14-16 saat değiştirin.
- ortamının değiştirilmesi sonra hücre üst fazları 30 saat toplayın. 0.22 mikron gözenek nitroselüloz filtre ile süpernatan filtre ve konsantre geçin.
- LVS konsantre
- 2 50.000 xg (SW-28 ultrasantrifüjdeki rotorlu 19.000 rpm) ultrasantrifiij ile klimalı ortam Konsantre30 ml polipropilen konik şeffaf rotor tüp içinde oda sıcaklığında (RT) sa.
Not: konik rotor tüpleri için kullanın ultrasantrifüjdeki adaptörleri (Malzeme tabloya bakınız). - Boşaltılarak Süpernatantlar atın ve küçük bir hacme (200 ul veya sadece bir santrifüj gerçekleştirilirse daha az) Fosfat Tampon Tuzlu Su içinde tekrar süspansiyon pelet (PBS; Malzemelerin Tablo). Sonra yukarı pipet ve yaklaşık 20 kez aşağı.
- Süspansiyonlar havuz ve oda sıcaklığında 2 saat süre ile 50.000 x g (SW-55 ultra santrifüj rotoru ile 23,000 rpm), aynı zamanda, ultra-santrifüj ile tekrar konsantre edilir. 5 ml nominal hacmi ile polipropilen şeffaf rotor tüpleri kullanın (Malzeme Tablo).
- steril PBS çok küçük bir hacimde (orta başlangıç hacminin 1/500 veya 1/1000), son pelet yeniden süspanse edin ve oda sıcaklığında 1 saat için bir döner tekerlek üzerine sallayın. küçük alikotları (5-20 ul) ve f bölünmüş-80 ° C sıcaklıkta tekrar dondurulması.
- atılmadan önce% 10 çamaşır suyu ile tüm boş tüpler davranın.
- 2 50.000 xg (SW-28 ultrasantrifüjdeki rotorlu 19.000 rpm) ultrasantrifiij ile klimalı ortam Konsantre30 ml polipropilen konik şeffaf rotor tüp içinde oda sıcaklığında (RT) sa.
- Lentiviral Titrasyon Akım Sitometri Kullanımı
- Bir gün önce, levha 2 Dulbecco Modifiye Eagle Ortamı (DMEM) mi içindeki bir 6-yuvalı doku kültürü plakaları içinde yuva başına 5 x 10 4 HeLa hücreleri (Malzeme Tablo). 24 saat süre ile% 5-7 CO2 atmosferinde nemlendirilmiş inkübatörde 37 ° C'de inkübe edin.
- Titrasyon gününde viral stoklar bir kısım Çözülme ve DMEM içinde 10 -8 10 -3 arasında, seri dilüsyonları hazırlayın.
- Bunu yapmak için, 24-çukurlu bir levha alır, Oyuklara ilk oyuğuna DMEM 2 ml ve 1,8 ml ekleyin. Daha sonra, (: 1.000 ya da 10 -3 1 nihai seyreltme) birinci oyuk konsantre viral stok 2 ul ekle.
- Iyice çözüm, değişim ucu karıştırın ve 10 -3 seyreltme 200 ul aktarmak için birkaç kez pipetleme sonraİkinci kuyu için. 10 -8 seyreltme yapılıncaya kadar aşağıdaki kuyularda seri işlemi tekrarlayın.
- inkübatör önceki gün kaplı HeLa hücreleri atın. Dikkatle kuyulardan orta çıkarın. HeLa hücre ihtiva eden oyuklara 8 mg / ml heksadimetrin bromür 1 ul ile birlikte her bir virüs seyreltme 1 ml ilave edilir. Yavaşça karıştırın plaka girdap.
Not: heksadimetrin bromit kültürdeki hücrelerin virüs adsorpsiyonu geliştirmek için ilave edilir. - inkübatör hücreleri dönün ve enfeksiyon 72 saat devam etmesine izin verir. Bundan sonra, orta kaldırmak kez PBS ile hücreleri yıkayın ve tripsin-EDTA 200 ul eklediğiniz her iyi (Malzeme Tablo).
- 37 ° C'de 5 dakika sonra, tüpler akış sitometrisinde her bir ve hasat hücrelere 2 ml PBS ilave edin.
- Oda sıcaklığında 5 dakika boyunca 300 x g santrifüj ve süpernatan aspire.
- sabitleme soluti 1 ml pelletini(PBS içinde% 1 formaldehid elektron mikroskobu derecesi ve% 2 fetal sığır serumu), daha sonra vorteks tüpleri.
- 15 mW gücünde 488 nm argon ionlaser kullanarak bir akış sitometresinde hücreleri analiz edin.
- Standart yapılandırma ile enstrüman ayarlayın: GFP için ileriye dağılım (FS), yan-dağılım (SS) ve floresan (525/40 nm). SS nokta arsa vs FS seç hücre popülasyonu yolluk hücre agrega ve enkaz dışlamak için. logaritmik ölçekte floresan toplayın. Her bir numune, GFP + hücrelerinin sayısını hesaplayın.
- Aşağıdaki formülü kullanarak vektör titresi hesaplanır: x seyreltme faktörü enfekte edilmiş hücreler (DF) sahiptir,% GFP + / 100 X numarası = iletici birimleri (TU) / ml'dir.
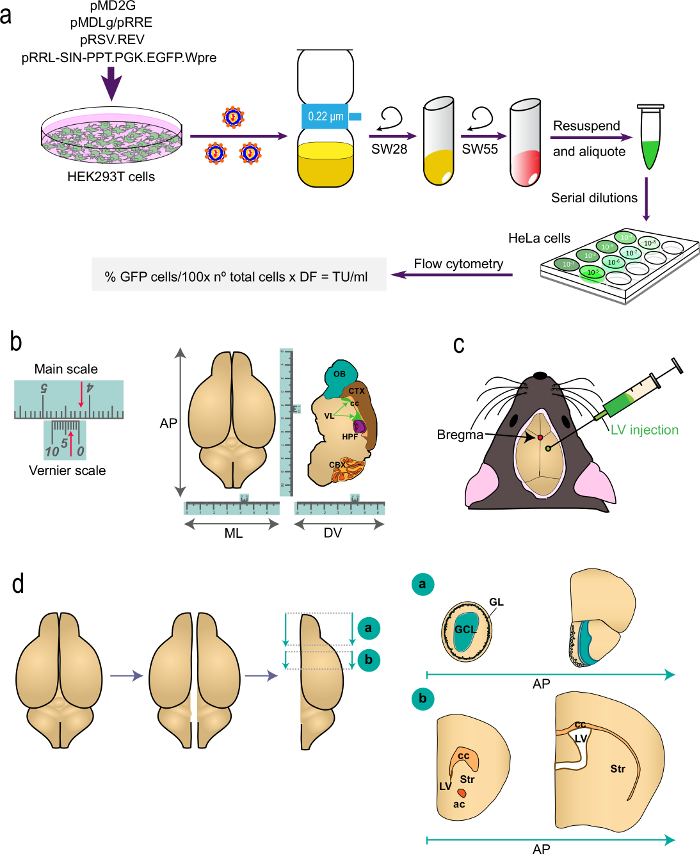
Şekil 1: prosedürün farklı bölgelerinde şematik gösterimi t (a) Bölüm 1.O protokolü: Uygun plazmid ile HEK293T hücreleri transfeksiyondan in vivo markalama çalışmaları için VLS ismi, üretimi belirtilen formül kullanılarak akış sitometrisi ile, virüs titresinin belirlenmesi LVs üretir. plazmidler ve santrifüj rotor isimleri belirtilmiştir. (B ve C) protokol Bölüm 2: LVS stereotaksik enjeksiyonu. "B", bir Vernier ölçek, stereotaksik araçlarının bir parçası olan ve ince ölçümler için hizmet veren bir cihazın bir örneğini tasvir etmektedir. Bir örnek olarak, oklar 4.23 cm göstermektedir. Bir Vernier ölçeği ((ML) medio-lateral ve (solda) bir üst görünüm için gösterilen dorso-ventral (DV) ekseni ve sagital bölüm için ön-arka koordinatları (AP), sağ belirlemek için kullanılır ) beyin. "C" sagital ve koronal sütür arasındaki kesişme olarak bregma konumunu gösterir. LVs bir şırınga ile enjekte edilir. (D) şematik çizimleri nasıl beyin i gösterenanalizi için işlenmiştir s. İki hemisfer ayrılır ve her biri iki blok ayrılır. (A başvuru için Paxinos' Atlas bkz Bregma 2.46 mm) OBS içeren blok "a", hemen telencephalon ile OB kavşak posterior AP düzeyinde bir koronal kesim tarafından üretilir. Blok "B" iki koronal kesim, seviyesinde biri sadece (1.7 mm Bregma) korpus kallosum en rostral yönüne ön ve iki yan ventriküllerin birleştiği seviyesinde ikinci bir tarafından üretilir (Bregma -0,22 aa). GL, glomerüler katman; GCL, granül hücre tabakası; st, striatum; cc, korpus kallosum; ac, ön komissür; lv, lateral ventrikül.
V-SVZ / Striatumunda Sınır içine veya Yanal Ventrikül içine LV 2. Stereotaksik enjeksiyon (bkz Şekil 1b)
- Hazırlık
- dalgıç% 70 etanol ile gövde ve iğne aşağı püskürtme ile 33 ölçü bir iğne ile 5 ul kapasitesi şırınga sterilizetüm yol çıkardı. Art arda 1.5 ml mikrosantrifüj tüp etanol aspirat ve birkaç kez tüm yol dışarı çıkarmak ve daha sonra steril su ile iyice şırınga durulayın. kültürü kaputu güvenle kenara şırınga yerleştirin ve kurumaya bırakın.
- Bu prosedür tüm atık batırmak için uygun bir hacmi% 10 oranında çamaşır suyu ile bir biyolojik tehlikeli atık konteyneri hazırlayın (genellikle 500 ml bir kapta 200 ml).
- Hazırlama ve su ile kapatılabilen plastik saklama torbası, doldurma ve 37 ° C de ısıtılarak 37 ° C su yatağı ısıtın. Bu fareler aşağıdaki enjeksiyon kurtarmak için izin verecektir.
- enjeksiyonları başlamadan önce C dondurucu saklama -80 ° 1 saat viral stokları çıkarın ve oda sıcaklığında dönen bir tekerlek üzerinde şişe yerleştirin. Çözündükten sonra, enjeksiyon süresi boyunca buz üzerinde viral stok tutmak. LV stereotaksik enjeksiyondan önce, 10 6 TU konsantre viral stokları sulandırmak / kültürü kaputu PBS kullanarak ul.
- % 70 etanol ile cerrahi gerçekleştirmek için seçilen alanı dezenfekte edin.
- LV Mikroenjeksiyon
- Seçin ve cerrahi (neşter, matkap ve küçük cımbız) için gerekli araçları sterilize edin.
- ketamin ve medetomidin'den bir veteriner denetiminde karışımı enjekte intraperitoneal (ip) tarafından 6-8 haftalık fare anestezisi. Her bir hayvan tartılır ve 50-75 mg ketamin ve fare vücut ağırlığının kg'ı başına 0,5-1 mg medetomidin (ketamin 100-125 ul / etrafında medetomidin fare başına çalışma çözeltisi), her doz.
- ayak parmakları, kuyruk ya da kulak sıkışması ve hayvan hiçbir reaksiyon gösterir sağlayarak anestezik uçağı değerlendirin.
- fare anestezi sonra, ameliyat sonrası ağrı en aza indirmek için kg fare ağırlığı başına 0.4-0.5 mg nihai dozda butorfanol deri altına enjekte edilir.
- kulakları arasındaki alanı Tıraş ve bir yodofor gibi iodopovidone veya% 70 etanol kullanarak cilt dezenfekte edin. Steril pamuk kullanarak temizleyin-tipped uygulayıcılar. Bu hipotermi azdırmak gibi aşırı hayvan ıslak için dikkatli olun.
- stereotaksik çerçeve üzerinde yüzüstü pozisyonda hayvan yerleştirin ve dikkatlice kulak çubukları ve aparatın damak desteğini kullanarak kafayı düzeltmek. 37 ° C'de bir ısıtma yastığı seti ile fare tutmak ve gözlere oftalmik yağlayıcı uygulayın.
- uzunlamasına bir neşter kullanılarak kafa derisinde 1 cm uzunluğunda bir kesi yapmak ve yavaşça ince cımbız kullanarak kafatası açığa cildi geri çekin.
- Dikkatle steril pamuk uçlu bir aplikatör ile kemik yüzeyini temizleyin. Kalan doku maruz kafatası kemiği arındır.
- Şırınga tutucu kullanarak stereotaktik cihazda sterilize şırınga monte edin.
- Şırınga iğnesinin ucu bregma, sagital (boyuna ve medial) sütür dik koronal sütür ile kesişen kesişme noktasında konumlandırılmış kadar (Figür şırınga tutucu x, y ve z ekseni Taşıe 1b). dorso-ventral (DV) ekseninin "sıfır" pozisyon bregma kafatası yüzeyinde olduğundan emin olun.
- X ve y hedef koordinatlarına şırınga taşı (Tablo 1 ve 1b Şekil bakınız).
| Enjeksiyon bölgesinde | koordinatlar | ||
| Ön-arka (AP) | Medial-yanal (ML) | Dorso-ventral (DV) | |
| SEZ / striatum sınır | 0,6 mm | 1,2 mm | -3.0 mm |
| lateral ventrikül | -0.3 mm | 1,0 mm | -2.6 mm |
Tablo 1: Stereotaksik in koordinatlarıjections. AP ve ML ekseni, x ve y koordinatları için bregmadan (mm) bir mesafe olarak verilmiştir. "-" "Posterior doğru" olduğunu gösterir. DV "sıfır" koordinatları için Bregma noktasında kafatası yüzeyi ve DV koordinatları aşağı bu noktadan (mm) mesafesini gösterir.
- x, y açıklama ve z hedef daha sonra tekrar enjeksiyon yerinde gelmek edebilmek için Vernier ölçekte koordine eder. Mark cerrahi işaretleyici kalem kullanarak x ve y koordinatları kemik.
- çalışma alanından uzak şırınga taşıyın.
- elektrikli matkap dikkatli değil kafatası üzerinde bir delik yapmak kullanarak beyin zarar. Bu beyin yüzeyine zarar verebilir pial yüzeyi matkap etmeyin.
- 10 6 TU / ul viral çözeltinin 1 ul şırınga yükleyin. kimin ucu 10-12 ° lik bir açı vardır bir 33 ayar keskin eğimli iğne kullanın. 90 ° ang şırınga iğnesi yerleştirinLe, beyin yüzeyine göre.
- geri enjeksiyon siteye şırıngayı hareket ettirin ve ucu pial yüzeyine temas edene kadar aşağı hareket ettirin.
- DV eksendeki koordinatları z şırınga ile beyin nüfuz eder.
- Yavaş yavaş aşırı sıvı basıncı beyin dokusu hasarı en aza indirmek amacıyla, 0.2 ul / dakikalık bir oranda, viral süspansiyonun bırakın.
- Viral süspansiyon geri akmasını en aza indirmek için 5-10 dakika bekleyin ve sonra çok yavaş şırınga geri çekin. silme bir laboratuvar kullanarak şırınganın geri çekilmesi sonucu yüzeyde görünür ve ağartıcı içeren biyogüvenlik çöp bidonuna hemen yerleştirebilirsiniz herhangi bir sıvı fazlalığı kurulayın.
- Stereotaksik set dışında hayvan alın, sıcak bir ped üzerine yerleştirin ve cilt yapıştırıcı kullanılarak yarayı kapatmak. 0.1-1.0 mg / kg vücut ağırlığı atipamezol kullanarak sedasyon ters.
- deri altından 0.1 mg kg fare ağırlığı, her 12 saat bir nihai doz Bupenorphrine enjekteKısa süreli butorfanol analjezik verilmesinden sonra 4 saat başlayan.
- Sıcak bir ped ile bireyselleştirilmiş kafeste hayvan koyun ve fare anestezi kurtarır kadar yakından takip. iyileştikten sonra hayvan hidrat yardımcı olmak için kafes içinde hidrojel bir torba koyun.
- Sıvı çamaşır suyu biyolojik tehlike bertaraf tüm biyo-kontamine atık olarak imha ediniz. aspirasyon ve etanol ejeksiyon şırıngayı temizleyin ve su ile durulayın. alanı, stereotaksik seti ve çamaşır suyu ve% 70 etanol ile kullanılmıştır cerrahi malzemelerin dezenfekte.
- Onlar geleneksel konut tesisine transfer edilebilir sonra 24-48 saat biyogüvenlik düzeyi 2 odada izole enjekte fareler tutun
3. Histolojik analiz
- Perfüzyon, doku toplama ve kesit
- Derinden medetomidine ve ketamin bir veteriner denetiminde karışımı kullanılarak Fareler uyuşturan (t kısma anestezi uçağı değerlendirmekOES, kuyruk veya kulak), daha önce tarif edildiği gibi.
- Transkardiyal aynı hızda 17 PB 75 mi% 4 PFA, ardından tuzlu su çözeltisi, 25 ml fareler serpmek.
- beyin Özü ve 1-16 saat (artan post-fiksasyon süreleri bazı antijenlerin immunoreaktivitesini azalabilir) için PB soğuk% 4 PFA en az 10 kez hacmine onu daldırarak onu post-düzeltin. PB ile iyice kalan PFA yıkayın.
- Şekil 1d işaretlere beyin kesin ve siyanoakrilat kullanılarak vibratome sahibine ortaya çıkan blok tutkal.
- Bir vibratome kullanarak 30 mikron kalınlığında seri koronal kesitler toplayın. 4 ° C de, PB ile 24-çok-yuvalı plakalarda beyin dilimleri saklayın. kirlenmesini önlemek için,% 0.05 sodyum azid PB çözeltisine ilave edilebilir.
- immünohistokimya
- % 0.05 sodyum azit,% 1 glisin,% 5 normal keçi serumu ile tampon (PB bloke serbest yüzen bölümleri inkübe ve% 0.1 TritX-100) yumuşak bir sallanan platform çalkalanarak oda sıcaklığında 1 saat süreyle.
- Dikkatle bloke edici tampon içinde bir anti-GFP tavşan birincil antikor (Malzeme Tabloya bakınız), uygun bir seyreltme ekleme, pipet ile Bloklama tamponunu çıkarın ve hafifçe çalkalanarak 4 ^ 'de 48 saat süre ile, bu seyreltme ile doku inkübe edin.
- Birincil antikor çözeltisi PB ile 3 kez, en az bir yıkama her 10 dakikada bir yıkayın.
- Çözümü engelleme florofor-konjuge sekonder antikor, uygun bir seyreltme ile serbest yüzen bölümleri) inkübe (RT hafifçe çalkalanarak 1 saat boyunca) Malzemelerin Tabloya bakınız. İnkübasyon sırasında doğrudan ışıktan bölümleri koruyun.
- PB, 3 kez her 10 dk ikincil antikor çözeltisi yıkayın, ve 5 dakika su içinde 1 mg / ml DAPI (4 ', 6-diamidino-2-fenilindol) ile bölümleri inkübe edilerek doku counterstain. iki kez ve hızlı bir şekilde zekâ durulama ile DAPI çözüm yıkayınh su.
- Yavaşça ince bir boya fırçası kullanarak bir mikroskop lamı üzerine bölümleri yerleştirin. Doku üzerinde (Malzeme Tabloya bakınız) floresan hazırlıkları için montaj orta birkaç damla dökün ve dikkatlice montaj çözümü doğru tüm yüzey üzerinde dağıtılır ve kabarcıklar olduğunu kontrol üstünde bir lamel yerleştirin. Yavaşça montaj orta fazlalığını boşaltmak için lamel sıkmak.
- montaj çözümü (2-16 saat) kurur zaman, 488 nm lazer ile konfokal lazer tarama mikroskobu ile numune analiz.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
AG-aracılı gen iletim sistemi proliferasyon, yayılma ve farklılaşma sırasında izleme ve genetik modifikasyonu sağlayan yetişkin fare V SVZ'una hücrelerin in vivo transdüksiyon uzun bir dönem için kullanılabilir. Enfeksiyon ve ifade son derece etkili ve raportör yer sentezlenmesiyle olmayan diğer enfekte olmuş hücreler arasında kolayca ayırt edilebilir pek çok hücre verir. Bu, şimdiye kadar her yerde ifade fosfogliserat kinaz promoteri tarafından tahrik edilen GFP floresan ga...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
LVs yetişkin genetik modifikasyon NSC'lerde 16,18 için diğer viral sistemlere göre önemli avantajlar sunmaktadır. V-SVZ niş Lentivirüslerden stereotaksik teslim etiket ve sadece hücreleri hedef çoklu hücre bölünmeleri ya da retrovirüs sonra sulandırılır gibi BrdU gibi diğer yaygın olarak kullanılan yöntemler, sınırlamaları aşmak B1-NSCs bölen seyrek iz etkili bir yöntem temsil bu uygulama anındaki artıyor. LVs birlikte adenovirüs ile bağımsız olarak bisiklet durumunun hüc...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Tüm manipülasyonlar bir biyogüvenlik düzeyi 2 odada yapılmıştır. Hayvan protokolleri Valencia Üniversitesi etik komitesi tarafından onaylanmış ve Avrupa direktifi 2010/63 / AB ile uyumlu tüm idi.
Teşekkürler
Biz MJ Palop yardım ve Universidad de Valencia SCSIE teknik destek için minnettarım. Biz de yararlı yorumlar ve yazının tartışma için Antonia Follenzi teşekkür ederiz. onun Santander Üniversiteler Küresel Bölümü aracılığıyla Banco Santander tarafından Fundacion Botin, tarafından ve Generalitat Valenciana (Programa Prometeo, ACOMP ve ISIC) ve Ministerio de Economia y Competitividad hibe ile desteklenen IF (MINECO: SAF2011-23331, CIBERNED ve RETIC Tercel) . Bu çalışma aynı zamanda (260511- MINECO ve Avrupa Araştırma Konseyi (ERC) 2012-StG gelen BFU2010-21823 ve RETIC Tercel hibe ile desteklenmiştir PD-HUMMODEL AC BM-P). MINECO bir İspanyol FPI burs almıştır.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25 mm x 89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13 mm x 51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100 x 20 style |
| FACS tubes | Afora | DE400800 | 12 mm x 75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2x HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100x, used to prepare HeLa and 293T culture medium at a final concentration of 10x. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10x, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1x PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1,000x stock solution at 8 mg/ml in dHO |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | http://www.leicabiosystems.com/ |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33 gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11 cm x 21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25 G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
Referanslar
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow! Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır