Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Stable et efficace modification génétique de cellules dans le Adulte souris V-SVZ pour l'analyse des cellules souches neurales autonome et effets non autonomes
Dans cet article
Résumé
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Résumé
Relativement cellules souches somatiques repos appuyer le renouvellement cellulaire long de la vie dans la plupart des tissus adultes. les cellules souches neurales dans le cerveau adulte de mammifère sont limités à deux niches neurogènes spécifiques: la zone sous-granulaire du gyrus denté de l'hippocampe et la zone ventriculaire-ventriculaire (V-SVZ; également appelé zone épendymaire ou SEZ) dans les parois latérales ventricules. Le développement de vivo stratégies de transfert de gène pour les populations de cellules souches adultes (ceux du cerveau des mammifères) résultant de l'expression à long terme de transgènes souhaités dans les cellules souches et de leur descendance issue est un outil essentiel dans la recherche biomédicale et biotechnologique actuelle. Ici, une méthode in vivo directe est présentée pour la modification génétique stable de cellules V-SVZ souris adulte qui tire parti de la cellule indépendante du cycle infection par VL et l'cytoarchitecture hautement spécialisée de la niche de V-SVZ. Plus précisément, le protocole actuel impliques l'injection de volumes logiques vides (témoins) ou VL codant pour des cassettes d'expression spécifique d'un transgène soit dans le V-SVZ lui-même, pour le ciblage in vivo de tous les types de cellules dans la niche ou dans la lumière du ventricule latéral, pour le ciblage des épendymaire cellules seulement. Les cassettes d'expression sont ensuite intégrés dans le génome des cellules transduites et des protéines fluorescentes, également codées par le LV, permettre la détection des cellules transduites pour l'analyse de cellules effets autonomes et non autonomes, niche-dépendante dans les cellules marquées et leur progéniture.
Introduction
La zone ventriculaire-ventriculaire murin (V-SVZ), dans les parois du ventricule latéral face au striatum, est une région germinal très actif dans lequel un processus continu de réplication de cellules souches et de différenciation des résultats dans la production persistante du bulbe olfactif (OB ) interneurones et les oligodendrocytes corps calleux 1. La génération permanente de ces cellules semble être soutenu par la présence dans la région de cellules neuronales souches (les NSC, également appelées cellules B1), qui expriment l'antigène astrocytaire protéine acide fibrillaire gliale (GFAP) et de la tige marqueurs cellulaires tels que la nestine, Id1 et Sox2 2. GFAP cellules exprimant B1 génèrent transit amplifier progénitrices (TAP) (cellules C), qui expriment les facteurs de transcription Dlx2 (distal-less homeobox 2) et Ascl1 (mammifère Achaete-Schute homologue 1) et de diviser rapidement un certain nombre de fois avant qu'ils ne donnent lieu à la migration des neuroblastes (cellules A) ou oligodendroblasts 3. Nouvellement généré prolifneuroblastes ratives migrent en avant, formant le courant de migration rostrale (RMS) de l'OB, où ils intègrent dans le granulaire et couches glomérulaire interneurones inhibiteurs différenciés. Migration jeunes oligodendroblasts passer à la CC, où ils deviennent des cellules NG2 positif immatures qui continuent de diviser localement ou se différencier en oligodendrocytes myélinisantes matures 1,4.
cellules B1, qui dérivent de cellules gliales radiales fœtales, conservent la morphologie allongée et polarisée de leurs prédécesseurs et présentent une relation hautement spécialisée avec leur niche. Ils couvrent entre l'épendyme qui aligne le ventricule et le réseau de vaisseaux sanguins qui irriguent le créneau de la V-SVZ. Le petit processus apicale des cellules B1 intercale entre ependymocytes multiciliées et se termine en un seul cil primaire non mobiles, alors que leur processus de base étend de longues distances pour approcher le plexus vasculaire plane qui irrigue ce créneau fin dans le basal lamina des capillaires du plexus 2,5-8.
Le moyen le plus fiable de distinguer B1-NSCs des astrocytes non neurogène, qui sont aussi GFAP +, dans le créneau intacte de V-SVZ est basé sur l'ensemble du montage des préparations de la paroi latérale du ventricule et leur analyse par 3-D microscopie confocale après immunocoloration pour GFAP d'étiqueter la mince processus apical B1-NSC, β-caténine pour délimiter les membranes cellulaires, et soit γ-tubuline comme un marqueur de corps basaux ciliaire ou acétylée α-tubuline pour marquer la mesure de chaque cil 5,8. Observations de ces entiers montures de la surface ventriculaire ont indiqué que les cellules B1 et épendymaires sont disposés en "soleils" 5, dans lequel les processus apical uniciliated d'un ou de plusieurs GFAP + B1 cellules sont encerclés par une rosette de cellules épendymaires multiciliées.
La morphologie caractéristique des cellules B1 est en corrélation avec des données expérimentales indicating que les vaisseaux sanguins / cellules endothéliales et ventriculaire liquide céphalo-rachidien (LCR) constituent des sources réglementées de signaux solubles agissant sur NSCs 2,6,9-11. À la surface ventriculaire, homotypique et interactions apico-latérale hétérotypiques impliquant des cellules épendymaires et B1 inclure jonctions serrées et jonctions adhérentes 5,12. En outre, les molécules d'adhésion impliquées dans les complexes de jonction entre les cellules B1 et épendymaires, tels que la N-cadhérine et V-CAM, il a été démontré pour réguler non seulement la mise en place très organisée de B1 dans le créneau de V-SVZ, mais aussi leur quiescence 12 , 13. La monocouche de cellules épendymaires-B1 semble agir comme une barrière de diffusion permettant au flux régulé d'eau et de petites molécules à partir de la peste porcine classique, mais en limitant le passage de grosses protéines intercellulaire 10,11. Des expériences montrent que la cellule B1 cil apical position unique pourrait jouer un rôle en tant que capteur de polypeptides présents dans le LCR 2 de signalisation,7.5. Cellules épendymaires sont, en soi, une source de signaux solubles et membranaires avec un rôle dans la régulation du comportement NSC 14,15.
Traçables nucleosides, tels que bromo-désoxyuridine (BrdU) ou des rétrovirus ont été largement utilisés pour marquer les cellules progénitrices, y compris NSC, in vivo. Cependant, ces procédés ne sont pas optimales pour le traçage destinée à long terme parce que les signaux de BrdU dilué par divisions cellulaires et des retrovirus répétées apparaissent de manière transitoire pour cibler préférentiellement les cellules d'amplification en raison de leur exigence de la prolifération cellulaire de transduction 16,17. Pour examiner NSC physiologie in vivo, y compris les interactions avec des composants de niche, il est crucial d'établir une méthode d'étiqueter et de tracer les cellules en division rarement, comme B1-CSN sont en grande partie de repos et leurs cellules épendymaires voisins ne se divisent dans les conditions physiologiques 3. Ici, nous montrons que les vecteurs lentiviraux (LV) permettent à haut rendement gène marquement et la modification à long terme du CNS adultes et les cellules épendymaires ne se divisant pas, en raison de la plus raisonnable de leur aptitude à la transduction et l'intégration dans le génome des cellules cibles d'une manière indépendante du cycle cellulaire. En outre, nous montrons comment la voie d'administration et virale titre d'aide pour la transduction spécifiquement les cellules épendymaires, mais pas les cellules B1 permettant ainsi l'analyse des effets, épendymaires de niche dépendant sur NSC.
Protocole
ÉTHIQUE ÉTAT: Ce protocole suit les directives de protection des animaux de l'Université de Valence en conformité avec la directive européenne 2010/63 / UE.
1. Génération de LV pour In Vivo Marquage études (voir la figure 1a)
ATTENTION: La procédure décrite ici est du niveau de biosécurité 2, donc effectuer toutes les procédures suivantes dans une hotte de risque biologique. Veiller à ce que le personnel de recherche sont dûment qualifiés et formés dans toutes les procédures. Porter un équipement de protection individuelle, y compris la robe, des gants doubles et une protection oculaire adaptée. Enfin, décontaminer soigneusement tous les outils et les surfaces qui auraient pu être en contact avec des virus en fonction des pratiques de désinfection des installations approuvées (par essuyage avec 70% d'éthanol, 10% l'eau de Javel et / ou autoclave).
- Production de LV dans les cellules embryonnaires humaines de rein 293T
- Lancer ce protocole par la préparation de l'ADN pur pour la transfection. Préparer et purifier chaque plasmide en double grad CsClcentrifugation ient ou d'autres méthodes de colonnes disponibles dans le commerce rendement ADN sans endotoxine. Dans ce protocole, nous avons utilisé le vecteur plasmide de transfert pRRL-SIN-PPT.PGK.EGFP.Wpre. Plasmides d'emballage de base recommandées sont pMDLg / pRRE et pRSV.REV et l'enveloppe plasmide pMD2G 13,18,19.
- Vingt-quatre heures avant la transfection, plaque 5 x 10 6 cellules 293T dans Iscove modifié moyenne (l'IMDM) Dulbecco (voir le tableau des matériaux) dans une boîte en plastique de 10 cm afin d'obtenir une culture d'environ 1/4 à 1/3 de confluence pour transfection. Incuber à 37 ° C dans un incubateur humidifié dans une atmosphère de 5-7% de CO 2.
- Remplacer le milieu avec du milieu frais 2 heures avant la transfection.
- Dans un tube de microcentrifugation de 1,5 ml stérile mélange 10 pg de vecteur de transfert plasmidique (contenant l'ADNc du transgène ou le shRNA à livrer) avec 2,5 pg du pRSV.REV et 5 ug des plasmides pMDLg / pRRE emballage et 3,5 et #181; g du plasmide pMD2G enveloppe. Faire remonter la solution de plasmide à un volume final de 450 pi avec un tampon 0,1 x TE (voir le tableau des matériaux) / DH 2 0 (2: 1). Puis ajouter 50 ul de 2,5 M CaCl 2.
- Former le précipité par addition goutte à goutte de 500 pi de la solution saline tamponnée Hepes 2x (HBS, voir le tableau des matériaux) solution à 500 ul ADN-TE-CaCl2 mélange tout en vortex à pleine vitesse.
- Ajouter le précipité aux cellules 293T immédiatement. Agiter doucement la plaque pour mélanger. Retour aux cellules de l'incubateur et de changer le moyen 14-16 heures après transfection.
- Recueillir les surnageants de cellules 30 heures après avoir changé les médias. Filtrer le surnageant à travers un filtre de nitrocellulose de 0,22 um et des pores de procéder à la concentration.
- Concentration des VL
- Concentrer le milieu conditionné par ultracentrifugation à 50.000 xg (19.000 tours par minute avec SW-28 ultracentrifugation rotor) pour 2h à la température ambiante (RT) dans un tube de rotor conique transparent 30 ml de polypropylène.
Remarque: Utilisez les adaptateurs d'ultracentrifugation pour bols coniques (voir le tableau des matériaux). - Jeter le surnageant par décantation et remise en suspension des culots dans un petit volume (200 ul ou moins si seulement une centrifugation est réalisée) de solution saline tamponnée au phosphate (PBS, voir le tableau des matériaux). Puis la pipette de haut en bas d'environ 20 fois.
- Mutualiser les suspensions et de se concentrer à nouveau par ultracentrifugation, également à 50.000 x g (23.000 tours par minute avec SW-55 ultracentrifugation rotor) pendant 2 heures à la température ambiante. Utilisez bols transparents en polypropylène avec un volume nominal de 5 ml (voir le tableau des matériaux).
- Reprendre le culot final dans un volume très faible (1/500 ou 1/1000 du volume à partir du milieu) de PBS stérile et agiter sur une roue en rotation pendant 1 heure à température ambiante. Divisé en petites portions (5-20 pi) et fles reeze à -80 ° C.
- Traiter tous les tubes vides avec 10% eau de Javel avant de les jeter.
- Concentrer le milieu conditionné par ultracentrifugation à 50.000 xg (19.000 tours par minute avec SW-28 ultracentrifugation rotor) pour 2h à la température ambiante (RT) dans un tube de rotor conique transparent 30 ml de polypropylène.
- Lentiviral titrage par cytométrie en flux
- La veille, la plaque 5 x 10 4 cellules HeLa par puits dans les tissus à 6 puits des plaques de culture dans 2 ml milieu de Eagle modifié par Dulbecco (DMEM) (voir le tableau des matériaux). Incuber à 37 ° C dans un incubateur humidifié dans une atmosphère de 5-7% de CO2 pendant 24 heures.
- Le jour de titration, décongeler un aliquote du stock viral et de préparer des dilutions en série, de 10 -3 à 10 -8, dans du DMEM.
- Pour ce faire, prendre une plaque de 24 puits et ajouter 2 ml de DMEM dans le premier puits et 1,8 ml dans les puits suivants. Puis ajouter à la première et 2 pl du stock viral concentré (à une dilution finale de 1: 1000 ou 10 -3).
- Après pipetage plusieurs fois pour bien mélanger la solution, le changement pointe et transférer 200 ul de la dilution 10 -3dans le deuxième puits. Répéter la procédure en série dans les puits suivants jusqu'à ce que le 10 -8 dilution est effectué.
- Prenez cellules HeLa plaqué la veille de l'incubateur. Retirez délicatement moyen de puits. Ajouter 1 ml de chaque dilution virale avec 1 pi de 8 mg / ml de bromure d'hexadiméthrine dans les puits contenant des cellules HeLa. Agiter doucement la plaque pour mélanger.
Remarque: le bromure d'hexadiméthrine est ajouté pour augmenter l'adsorption du virus sur les cellules en culture. - Retourner les cellules dans l'incubateur et permettre à l'infection de se poursuivre pendant 72 heures. Après cela, éliminer le milieu, laver les cellules une fois avec PBS et ajouter 200 pi de trypsine-EDTA (voir le tableau des matériaux) à chaque puits.
- Après 5 min à 37 ° C, ajouter 2 ml de PBS dans chaque cellule ainsi et de récolte en cytométrie en flux tubes.
- Centrifuger à 300 x g pendant 5 min à température ambiante et aspirer le surnageant.
- Reprendre le culot avec 1 ml de fixation solutile (1% de formaldehyde électrons teneur en microscopie et 2% de sérum fœtal bovin dans du PBS), puis vortex les tubes.
- Analyser les cellules dans un cytomètre en flux en utilisant un 488 nm ionlaser argon à 15 mW de puissance.
- Mettre en place l'instrument avec la configuration standard: l'avant-diffusion (FS), dispersion latérale (SS), et la fluorescence pour la GFP (525/40 nm). Sélectionnez déclenchement de la population de cellules dans un FS vs SS dot complot visant à exclure des agrégats de cellules et de débris. Recueillir fluorescence en échelle logarithmique. Calculer le nombre de cellules GFP + dans chaque échantillon.
- Calculer vecteur titre en utilisant la formule suivante:% GFP + / 100 x nombre de cellules infectées x facteur de dilution (DF) = unités de transduction (TU) / ml.
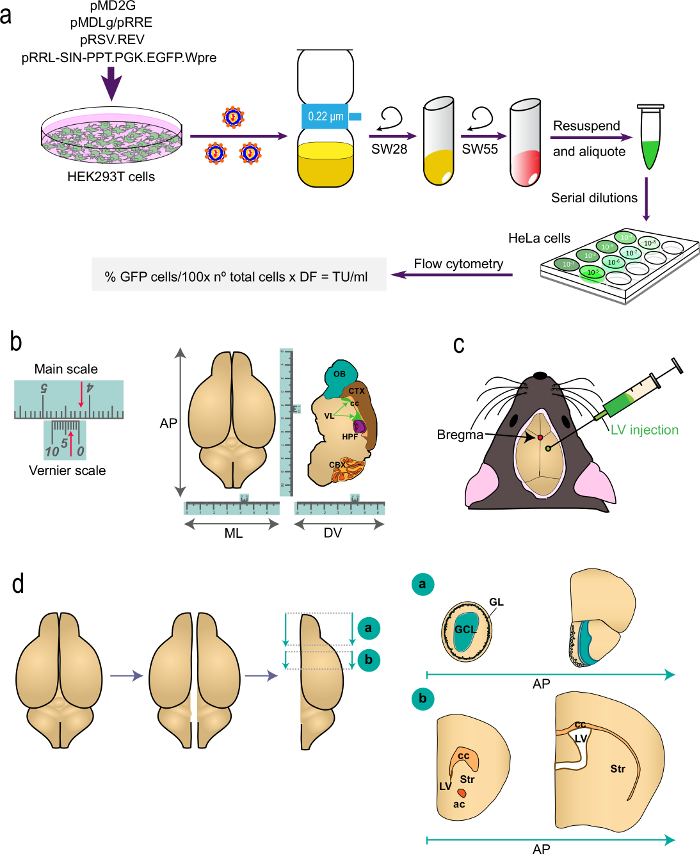
Figure 1: Représentation schématique des différentes parties de la procédure (a) une partie de t.il protocole: génération de VL pour les études in vivo d'étiquetage, de la transfection des cellules HEK293T avec des plasmides appropriés pour générer les LVs à la détermination du titre viral par cytométrie de flux en utilisant la formule indiquée. Les noms des plasmides et des rotors de centrifugeuses sont indiqués. (B et c) la partie 2 du protocole: injection stéréotaxique des VL. "B" représente un exemple d'une échelle Vernier, un dispositif qui fait partie des instruments stéréotaxiques et sert pour les mesures fines. A titre d'exemple, les flèches indiquent 4,23 cm. Une échelle Vernier est utilisé pour déterminer les coordonnées dans le antéro-postérieur (AP), médio-latérale (ML), et dorso-ventral (DV) axes comme le montre une vue de dessus (à gauche) et pour une coupe sagittale (à droite ) du cerveau. "C" indique la position du bregma comme l'intersection entre les sutures coronale et sagittale. VL est injecté à l'aide d'une seringue. (D) les dessins schématiques montrant comment le cerveau is traitées pour l'analyse. Les deux hémisphères sont séparés et chacun d'eux est divisé en deux blocs. Bloquer "a", contenant les OB, est produit par une coupe coronale au niveau AP postérieur immédiatement à la jonction avec le OB télencéphale (bregma 2,46 mm; voir Paxinos' Atlas pour une référence). Block "b" est produit par deux coupes coronales, l'un au niveau juste en avant l'aspect le plus rostrale du corps calleux (bregma 1,7 mm) et un second au niveau de la jonction des deux ventricules latéraux (bregma -0.22 mm). GL, couche glomérulaire; GCL, couche de cellules granule; st, le striatum; cc, le corps calleux; ac, commissure antérieure; lv, ventricule latéral.
2. Injection stéréotaxique de LV dans le V-SVZ / striatum frontière ou dans le ventricule latéral (voir la figure 1b)
- Préparation
- Stériliser la seringue d'une capacité de 5 pi d'une aiguille de calibre 33 en pulvérisant sur le corps et l'aiguille avec 70% d'éthanol avec le pistonsorti tout le chemin. Plusieurs reprises aspirer l'éthanol à partir d'un tube de 1,5 ml et éjecter tout le chemin à plusieurs reprises, et rincer la seringue avec de l'eau stérile après. Placez la seringue côté en toute sécurité dans la hotte de culture et laisser sécher.
- Préparer un récipient pour déchets biologiques dangereux avec 10% de l'eau de Javel à un volume adapté à l'immersion de tous les déchets de cette procédure (généralement 200 ml dans un récipient de 500 ml).
- Préparer et préchauffer un matelas d'eau C 37 ° en remplissant un sac en plastique refermable de stockage avec de l'eau et le réchauffement à 37 ° C. Cela permettra à des souris pour récupérer après l'injection.
- Retirer stocks viraux de -80 ° C entreposage au congélateur 1 heure avant le début des injections et placez le flacon sur une roue tournant à RT. Après décongélation, maintenir le stock viral sur de la glace pendant le temps des injections. Avant l'injection stéréotaxique de LV, diluer les stocks viraux concentrés pour 10 6 TU / ul en utilisant du PBS dans la hotte de culture.
- Désinfectez la zone sélectionnée pour effectuer la chirurgie avec 70% d'éthanol.
- La micro-injection de LV
- Sélectionnez et stériliser les outils nécessaires pour la chirurgie (scalpel, forage, et de petites pinces).
- Anesthésier une souris 6-8 semaines d'âge par voie intrapéritonéale (ip) à injecter un mélange vétérinaire supervisé de kétamine et de médétomidine. Peser chaque animal et chaque dose de 50-75 mg de kétamine et de 0,5 à 1 mg médétomidine par kg de poids corporel de souris (environ 100 à 125 pi de la kétamine / médétomidine solution de travail par souris).
- Évaluer le plan anesthésique en pinçant les doigts, la queue ou de l'oreille et d'assurer que l'animal ne montre aucune réaction.
- Une fois que la souris est anesthésiée, injecter butorphanol sous-cutanée à une dose finale de 0,4-0,5 mg par kg de poids kg souris pour minimiser la douleur post-chirurgicale.
- Raser la zone entre les oreilles et désinfecter la peau à l'aide d'un iodophore comme iodopovidone ou 70% d'éthanol. Nettoyer à l'aide de coton stérileapplicateurs -tipped. Veillez à ne pas trop mouiller l'animal car cela peut aggraver l'hypothermie.
- Placez l'animal en position couchée sur un cadre stéréotaxique et fixer soigneusement la tête à l'aide des barres d'oreilles et le soutien du palais de l'appareil. Gardez la souris avec un ensemble de coussin chauffant à 37 ° C et appliquer du lubrifiant ophtalmique pour les yeux.
- Faites une longue incision de 1 cm sur la peau de la tête à l'aide d'un scalpel longitudinalement, et se rétracter doucement la peau pour exposer le crâne à l'aide des pinces fines.
- Nettoyez soigneusement la surface de l'os avec un coton-tige stérile. Nettoyer l'os du crâne exposé de tout tissu restant.
- Monter la seringue stérilisée sur le dispositif stéréotaxique utilisant le support de seringue.
- Déplacer l'axe du porte-seringue x, y et z jusqu'à ce que la pointe de l'aiguille de la seringue est positionnée sur le bregma, au point où la suture sagittale (longitudinale et médiane) est coupé par la perpendiculaire suture coronale liaison (Figure 1b). Assurez-vous que la position "zéro" de la (DV) axe dorso-ventral est à la surface du crâne au bregma.
- Déplacer la seringue pour les coordonnées x et y de destination (voir tableau 1 et figure 1b).
| La région d'injection | coordonnées | ||
| Antéro-postérieur (AP) | Médio-latérale (ML) | Dorso-ventral (DV) | |
| SEZ / striatum frontière | +0,6 mm | +1,2 mm | -3.0 mm |
| ventricule latéral | -0.3 mm | +1,0 mm | -2.6 mm |
Tableau 1: coordonnées stéréotaxiques pour l'enprojections. Pour l'AP et l'axe ML, coordonnées x et y sont donnés en tant que distance (en mm) du bregma. "-" Indique "vers postérieure". Pour le DV coordonnées "zéro" est la surface du crâne au point de bregma et coordonnées DV indiquent la distance (en mm) vers le bas à partir de ce point.
- Annoter les x, y et z les coordonnées de destination dans l'échelle Vernier afin d'être en mesure de revenir sur le site d'injection plus tard. Mark l'os dans les coordonnées x et y en utilisant un marqueur chirurgical.
- Déplacer la seringue loin de la zone de travail.
- En utilisant une perceuse électrique faire un trou sur le crâne soigneusement à ne pas endommager le cerveau. Ne pas percer la surface pial car cela pourrait endommager la surface du cerveau.
- Charger la seringue avec 1 pl de la / solution virale ul 10 6 TU. Utiliser une aiguille biseautée pointue 33 de calibre dont la pointe a un angle de 10-12 °. Placez l'aiguille de seringue à une 90 ° angle par rapport à la surface du cerveau.
- Déplacer la seringue vers le site de l'injection et de déplacer vers le bas jusqu'à ce que la pointe touche la surface pial.
- Pénétrer dans le cerveau avec la seringue à la coordonnée z dans l'axe DV.
- Relâchez doucement la suspension virale, à un taux de 0,2 ul / min, afin de minimiser les dommages aux tissus du cerveau due à une pression excessive de liquide.
- Attendez 5-10 min pour minimiser le reflux de la suspension virale, puis retirer la seringue très lentement. Éponger tout excès de liquide qui peut apparaître à la surface à la suite de la rétraction de la seringue à l'aide d'un laboratoire essuyer et le placer immédiatement dans la prévention des risques biotechnologiques conteneur de déchets contenant de l'eau de Javel.
- Prenez l'animal sur l'ensemble stéréotaxique, placez le sur une surface chaude, et fermer la plaie avec de la colle de peau. Inverser la sédation en utilisant 0,1-1,0 mg / kg atipamezole de poids corporel.
- Injecter Bupenorphrine voie sous-cutanée à une dose finale de 0,1 mg par kg de poids de la souris toutes les 12 h,à partir de 4 heures après l'administration de la courte durée butorphanol analgésique.
- Placez l'animal dans une cage individuelle avec un tampon chaud et suivre de près jusqu'à ce que la souris se remet de l'anesthésie. Placez un sac d'hydrogel dans la cage pour aider l'hydrate d'animaux après la récupération.
- Éliminer tous les déchets bio-contamination dans le liquide disposition l'eau de Javel à risque biologique. Nettoyer la seringue par aspiration et l'éjection d'éthanol et rincer à l'eau. Désinfecter la zone, l'ensemble stéréotaxique et le matériel chirurgical qui a été utilisé avec l'eau de Javel et de 70% d'éthanol.
- Gardez souris injectées isolés dans le niveau de biosécurité 2 pièces pendant 24-48 h, après quoi ils peuvent être transférés dans un centre de logement classique
3. Analyse histologique
- Perfusion, recueil de tissu, et la coupe
- anesthésier profondément les souris en utilisant un mélange de vétérinaire-supervisé de médétomidine et la kétamine (évaluer le plan d'anesthésie en pinçant le toes, queue ou des oreilles), comme décrit précédemment.
- Transcardiaque perfuser les souris avec 25 ml de solution saline suivi par 75 ml de 4% de PFA dans PB à la même vitesse 17.
- Extraire le cerveau et post-réparer en l'immergeant dans au moins 10 fois son volume de froid PFA 4% en PB pour 1-16 heures (augmentation du temps post-fixation peuvent diminuer la réactivité immunologique de certains antigènes). Laver soigneusement la PFA restant avec PB.
- Couper le cerveau en suivant les indications de la figure 1d et coller le bloc résultant pour le titulaire d'un vibratome utilisant cyanoacrylate.
- Recueillir 30 coupes coronales série um d'épaisseur en utilisant un vibratome. Rangez les tranches de cerveau dans des plaques à 24 puits multiples avec PB à 4 ° C. Pour éviter la contamination, de l'azoture de sodium à 0,05% peut être ajouté à la solution PB.
- immunohistochimie
- Incuber les sections flottant librement dans un tampon de blocage (PB avec de l'azoture de sodium à 0,05%, 1% de glycine, 5% de sérum de chèvre normal, et 0,1% Tritle X-100) pendant 1 h à température ambiante avec agitation douce dans une plate-forme à bascule.
- Retirez délicatement le tampon de blocage avec une pipette, ajouter une dilution appropriée de l'anticorps primaire de lapin anti-GFP (voir le tableau des matériaux) dans un tampon de blocage et incuber tissu avec cette dilution pendant 48 heures à 4 ° C en agitant doucement.
- Laver la solution d'anticorps primaire, un minimum de 3 fois avec PB, un lavage toutes les 10 min.
- Incuber les sections flottantes avec une dilution appropriée d'anticorps secondaires fluorophores-conjugué) dans une solution de blocage (voir le tableau des matériaux) pendant 1 heure à température ambiante et sous agitation douce. Protéger les sections de la lumière directe pendant l'incubation.
- Laver la solution d'anticorps secondaire avec PB, 3 fois, une fois toutes les 10 min, et contre-colorer le tissu en incubant les sections avec du DAPI (4 ', 6-diamidino-2-phénylindole) à 1 mg / ml dans l'eau pendant 5 min. Laver la solution DAPI en rinçant deux fois et rapidement with eau.
- Placez délicatement les sections sur une lame de microscope à l'aide d'un pinceau fin. Verser quelques gouttes de milieu de montage pour les préparations fluorescentes (voir le tableau des matériaux) sur le tissu et placer soigneusement une lamelle sur le dessus, en vérifiant que la solution de montage est correctement répartie sur toute la surface et il n'y a pas de bulles. presser doucement la lamelle pour drainer l'excès de milieu de montage.
- Lorsque la solution de montage se dessèche (2-16 h) analyser l'échantillon par microscopie confocale à balayage laser avec le laser 488 nm.
Résultats
Système de distribution à médiation par le gène LV peut être utilisé à long terme dans la transduction in vivo des cellules de la V-SVZ de souris adulte, ce qui permet leur repérage et la modification génétique au cours de prolifération, la migration et la différenciation. L'infection et l'expression sont très efficaces et produisent de nombreuses cellules qui peuvent être facilement distingué parmi d'autres cellules non-infectées par l'expression de la journaliste inclus. Nous a...
Discussion
LV offrent des avantages importants par rapport à d'autres systèmes viraux pour la modification génétique des adultes NSCs 16,18. livraison stéréotaxique des lentivirus à la niche de V-SVZ représente une méthode efficace pour étiqueter et tracer rarement divisant B1-CSN surmonter les limites des autres méthodes couramment utilisées telles que BrdU, qui est dilué après de multiples divisions cellulaires, ou rétrovirus, qui ne ciblent les cellules qui prolifèrent au moment de l'applicati...
Déclarations de divulgation
Toutes les manipulations ont été faites dans un niveau de biosécurité 2 pièces. protocoles d'animaux ont été approuvés par le comité d'éthique de l'Université de Valence et étaient tous en conformité avec la directive européenne 2010/63 / UE.
Remerciements
Nous reconnaissons l'aide de MJ Palop et l'appui technique de l'SCSIE de l'Université de Valence. Nous remercions également Antonia Follenzi pour leurs précieux commentaires et discussion sur le manuscrit. SI est soutenu par la Fondation Botin, par Banco Santander grâce à son Santander Universities Global Division, et par des subventions de la Generalitat Valenciana (Programa Prometeo, ACOMP et CITI) et Ministerio de Economía y Competitividad (MINECO: SAF2011-23331, CIBERNED et RETIC Tercel) . Ce travail a été également soutenue par BFU2010-21823 et RETIC Tercel subventions de MINECO et le Conseil européen de la recherche (ERC) 2012-STG (260511- PD-HUMMODEL) à AC BM-P. est le destinataire d'un FPI bourse espagnole du MINECO.
matériels
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25X89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13X51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100x20 style |
| FACS tubes | Afora | DE400800 | 12x75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2X HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100X, used to prepare HeLa and 293T culture medium at a final concentration of 10X. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10X, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1X PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1000X stock solution at 8 mg/ml in dH2O |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33-gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11x21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
Références
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon