A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المجهر من دورة حياة الجنسية الانشطار الخميرة
* These authors contributed equally
In This Article
Summary
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Abstract
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Introduction
على الرغم من صرف الجيني بين خليتين هو الحدث المركزي في التكاثر الجنسي، فإنه يعتمد على سلسلة من الفعاليات التي تعزز تمايز الخلايا، والسماح للاختيار الشريك، والقيام الانصهار خلية خلية والحفاظ على الاستقرار الجيني. وهكذا تقدم دورة الحياة الجنسية نفسها كنظام نموذج لدراسة عدد من المسائل الحيوية المتعلقة مفاتيح التنموية، والاستجابة للمؤثرات خارجي، والانصهار غشاء البلازما والعزل الصبغي، الخ استكشاف الانشطار الخميرة دورة الجنسية لدراسة هذه الظواهر يجلب فوائد لل علم الوراثة قوية نظام النموذج، راسخة النهج الإنتاجية العالية والفحص المجهري متطورة. الجنس في الخميرة الانشطار هو حدث مغاير بين P-خلية وM-خلية من أنواع التزاوج متميزة. أنواع الخلايا اثنين من التعبير عن تفاضلي عدد من الجينات 1،2 بما في ذلك لإنتاج P- يفرز وM-الفيرومونات، فرمون مستقبلات Map3 وMam2 وكذلك فرمون-بروتيإس إي إس Sxa1 وSxa2. سلالات Homothallic، مثل سلالة H90 شيوعا، وتحمل المعلومات الوراثية لكلا النوعين التزاوج في الجينوم واحد والخلايا الخضوع لنمط معقد من نوع التزاوج التبديل طوال دورة حياة الإنقسامية (إعادة النظر في المرجع 3). كما تستخدم عزلة متعددة من الخميرة الانشطار heterothallic التي نادرا أو أبدا تبديل نوع التزاوج عادة 4، أبرزها ح + N (P-نوع) وح -S (M-نوع) السلالات.
في الخميرة الانشطار، دخول دورة حياة جنسية قيد التنظيم الغذائي الصارم. فقط خلايا الخميرة الانشطار المتعطشة النيتروجين تعتقل الاستنساخ الإنقسامية وتنتج الفيرومونات إنتشاري للإشارة إلى وجود شريك التزاوج وتشجيع المزيد من الخطوات للدورة الجنسية (إعادة النظر في المرجع 5). الحرمان من النيتروجين دي يقمع المنظم النسخي رئيسيا من Ste11 التزاوج الذي يعمل بمثابة مفتاح التنمية ويعزز هxpression من التزاوج جينات معينة بما في ذلك مستقبلات فرمون وفرمون جينات إنتاج 6،7. مشاركة فرمون مستقبلات ينشط يقترن مستقبلات البروتين G-ألفا والمصب إشارات MAPK الذي يعزز ذلك من Ste11 النشاط النسخي 8-10، وبالتالي زيادة إنتاج فرمون في ردود الفعل الإيجابية بين شركاء التزاوج. مستويات فرمون حاسمة للحث على مختلف الدول خلية الاستقطاب من خلال تنظيم منظم سيد قطبية الخلية، رو-عائلة GTPase Cdc42 11. عند التعرض لتركيزات منخفضة فرمون، هو تصور نشط Cdc42 في بقع حيوية استكشاف محيط الخلية، ويلاحظ أي نمو الخلايا في هذه المرحلة. زيادة مستويات فرمون تعزيز استقرار النشاط Cdc42 إلى منطقة واحدة ونمو إسقاط الاستقطاب، ووصف shmoo، الذي يجمع خلايا شريك في الاتصال. وفي وقت لاحق، وهما شركاء التزاوج فرداني تلتحم لتشكل البيضة الملقحة مضاعفا. العمل الأخير يكشف عشرالبريد جود هيكل الأكتين رواية ضروري لالانصهار التي يتم تجميعها من قبل formin الناجم عن التزاوج Fus1 12. هذا التركيز الانصهار يركز العمليات تعتمد نوع-V الميوسين ومواقف آلية تدهور جدار الخلية، مما يتيح إعادة تشكيل جدار الخلية للسماح البلازما غشاء الاتصال دون خلية تحلل 12. على الانصهار خلية خلية، ونوى تأتي في اتصال وتخضع تزاوج نووي. والتي تعتمد على داينين بارزة حركة ذهابا وإيابا للنواة داخل البيضة الملقحة (حركة ذيل حصان) ثم يشجع على المزاوجة بين homologs كروموسوم 13،14، والتي تبعتها الانقسام الاختزالي. وأخيرا، يتم تعبئتها المنتجات أربعة من الانقسام الاختزالي إلى جراثيم الفردية خلال تبوغ.
بسبب تعقيدها والخطوات العديدة المشاركة، ورصد تفصيلي من التزاوج تم تحديا. اثنين من الصعوبات البارزة هي أن العملية برمتها تستغرق ما يزيد على خمس عشرة ساعة وأن الخلايا هي صعبة لمزامنة. هذه دالالتفاف ifficulties بنهج المجهر وحيدة الخلية. هنا بروتوكول العام للتحقيق وتقديم دورة حياة الجنسية في الخميرة الانشطار. مع تعديلات طفيفة، يسمح هذا البروتوكول دراسة جميع الخطوات المختلفة لهذه العملية، وهي تحريض منتج الجين التزاوج، الاستقطاب الخلية والاقتران بين خلايا شقيقته بعد نوع التزاوج التحويل وبين شركاء غير شقيقة، والانصهار خلية خلية، وبعد الانصهار الحصان ذيل الحركة، الانقسام الاختزالي والتجرثم. يسمح هذا الأسلوب ل1) بسهولة الموسومة تصور fluorescently البروتينات مع مرور الوقت ما قبل وأثناء وبعد الانصهار. 2) تميز سلوك خلايا المعاكس نوع التزاوج. و3) قياس وتحديد المعايير مثل shmooing، التزاوج، والانصهار أو كفاءة تبوغ.
Protocol
التحليل المجهري التكاثر الجنسي الانشطار الخميرة
1. إعداد وسائل الإعلام
- إعداد الدنيا تبوغ المتوسطة (MSL-N) 15 عن طريق خلط المكونات التالية: الجلوكوز: 10 جم / لتر، KH 2 PO 4: 1 جم / لتر، كلوريد الصوديوم: 0.1 جرام / لتر، MgSO 4 · 7H 2 O: 0.2 غرام / L. إضافة عناصر تتبع (10،000x): 100 ميكرولتر / L، فيتامينات (1،000x): 1 مل / لتر، و 0.1 M CaCl 2 مل / لتر. فلتر تعقيم باستخدام حجم مرشح 0.22 ميكرون المسام وتخزينها في درجة حرارة الغرفة (RT).
- استخدام الفيتامينات التالية (1،000x) الأسهم: بانتوثينات: 1 جم / لتر، حمض النيكوتينيك: 10 جم / لتر، إينوسيتول: 10 جم / لتر، البيوتين: 10 ملغم / لتر. فلتر تعقيم باستخدام حجم مرشح 0.22 ميكرون المسام وتخزينها في 4 درجات مئوية.
- استخدام عناصر تتبع التالية (10،000x) الأسهم: حمض البوريك: 5 جم / لتر، MnSO 4: 4 جم / لتر، ZnSO 4 · 7H 2 O: 4 جم / لتر، FeCl 2 · 6H 2 O: 2 ز / L ، زارة النفط 3: 0.4 جرام / لتر، KI: 1 جم / لتر، كبريتات النحاس 4· 5H 2 O: 0.4 جرام / لتر، حمض الستريك: 10 جم / لتر. فلتر تعقيم باستخدام حجم مرشح 0.22 ميكرون المسام وتخزينها في 4 درجات مئوية.
- إعداد MSL-N الاغاروز 2٪ (التي تستخدم لجعل الدوائر وحة agarose) عن طريق الجمع بين 10 مل من MSL-N مع 0.2 غرام من الاغاروز. تذوب ب ~ 2 دقيقة في الطاقة العالية في فرن الميكروويف حتى يذوب الاغاروز وقسامة 0.5 مل في أنابيب microcentrifuge. تخزين في RT.
- إعداد المتوسطة الدنيا تبوغ مع النيتروجين (MSL + N) من MSL-N بإضافة (NH 4) 2 SO 4: 1 جم / لتر، لوسين: 0.225 غرام / لتر، أدينين: 0.225 غرام / لتر، يوراسيل: 0.225 غرام / لتر . فلتر تعقيم باستخدام 0.22 ميكرون مرشح حجم المسام. تخزين في RT.
ملاحظة: يتم إضافة يسين، الأدينين واليوراسيل إلى هذه الوسيلة للسماح للنمو سلالات بعامل نمائي. وينبغي أن تدرج الملحق الأحماض الأمينية إضافية إذا السلالة المستخدمة يحمل auxotrophy متميز (على سبيل المثال his3Δ). يرجى أيضا ملاحظة أن العمل مع سلالات أنموذجي التغذي بشكل كامل ويوصى، وفقطوهذه السلالات تسمح كفاءة عالية التزاوج. - إعداد 200 مل VALAP لختم الغرفة. في كوب إضافة أوزان متساوية من اللانولين، الفازلين (أو غيرها من الفازلين)، والبارافين. خليط الحرارة عند درجة حرارة منخفضة ويقلب من حين لآخر حتى المخلوطة بدقة. قسامة المزيج في عدة أطباق بتري الصغيرة. تخزين في RT.
2. زراعة الانشطار سلالات الخميرة للتجارب التزاوج (الشكل 1).
- يوم 1، مساء:
تطعيم سلالات يشوبه حديثا من وسائل الاعلام الصلبة في أنابيب الثقافة التي تحتوي على 3 مل من MSL + N. استخدام أنابيب أسفل شقة من حوالي 2.5 سم القطر. استخدام أنابيب ثقافة أخرى أو قوارير مع حجم ثقافة تكييفها. احتضان بين عشية وضحاها (O / N) مع اهتزاز عند 25 درجة مئوية، 200 دورة في الدقيقة. إذا كان يعمل مع سلالات heterothallic، تطعيم على حدة.- تمييع تعليق خلية في وسائل الإعلام صباح اليوم التالي للتأكد من أن الثقافات والكثافة الضوئية قياس في 600 نانومتر (OD 600) من 0.4-0.8 في المساء.
ملاحظة:OD 600 القياسات كوكيل للتركيز خلية الخميرة الانشطار هي الخطية في مجموعة من حوالي 0،1-1،0. لدينا OD معمل 600 = 0.1 يتوافق مع 1.4 × 10 6 خلايا لكل مل. وبالتالي، إذا يقرأ OD الأولي 600 هي خارج هذا النطاق تحتاج إلى أن تضعف / تركزت على قياسات موثوقة العينات.
- تمييع تعليق خلية في وسائل الإعلام صباح اليوم التالي للتأكد من أن الثقافات والكثافة الضوئية قياس في 600 نانومتر (OD 600) من 0.4-0.8 في المساء.
- يوم 2، مساء:
تمييع الخلايا في 20 مل من وسائل الاعلام MSL + N لOD 600 = 0.025 في 100 مل القوارير. احتضان سلالات O / N عند 30 درجة مئوية، 200 دورة في الدقيقة.
ملاحظة: يجب مزارع الخلايا من النوع البري تصل إلى OD 600 ~ 0.8 في صباح اليوم التالي (بعد 15 ساعة). إذا كان يعمل مع سلالات مع وقتا أطول الجيل ضبط تخفيف وفقا لذلك. - يوم 3، صباح:
قياس OD 600 للتحقق من الثقافات لديها كثافة الخلايا من OD 600 ~ 0.8. إذا كان يعمل مع سلالات heterothallic، مزيج أعداد متساوية من خلايا شريك. بيليه الخلايا في 1000 x ج ونقل إلى 1.5 ملأنبوب. غسل الخلايا ثلاث مرات في 1 مل من MSL-N المتوسطة. اعادة تعليق الخلايا في 3 مل من MSL-N المتوسطة وتمييع الخلايا لOD 600 = 1.5.- لمراقبة التزاوج بين الخلايا شقيقة تحميل مباشرة خلايا للتصوير (انظر القسم بروتوكول 2.4). استخدام سلالات H90 homothallic، في أي نوع التزاوج التبديل ستجري خلال الانقسامات الإنقسامية التي تحدث بعد الحرمان النيتروجين. تركيب فوري للخلايا على لوحة الأغاروس يضمن أنه بعد انقسام الخلايا، لا تزال خلايا الشقيقة بجانب بعضها البعض.
- لمراقبة الاستقطاب الخلية (ديناميات الاستكشافية وshmooing) احتضان 1-3 مل من زراعة الخلايا عند 30 درجة مئوية، 200 دورة في الدقيقة لمدة 3-4 ساعة قبل خلايا المتزايدة للتصوير. في هذه ساعة 3-4، وتقسيم الإنقسامية الماضي حدثت. سيكون قد بدأ عدد قليل من خلايا الاستقطاب، ولكن معظم سوف يكون مجرد تبدأ ديناميات الاستقطاب الاستكشافية الخاصة بهم.
- لمراقبة الانصهار خلية خلية احتضان 1-3 مل من زراعة الخلايا عند 30 درجة مئوية، 200 دورة في الدقيقة لمدة 4-6 ساعة الحزب الثوري المؤسسيأو لتركيب خلايا للتصوير.
- لمراقبة أحداث ما بعد الانصهار احتضان 1-3 مل من مزارع الخلايا عند 30 درجة مئوية، 200 دورة في الدقيقة لمدة 8 ساعة قبل تركيب خلايا للتصوير.
- لمراقبة استجابة لتركيز فرمون معين (فقط للسلالات heterothallic) احتضان 3 مل من زراعة الخلايا عند 30 درجة مئوية، 200 دورة في الدقيقة لمدة 3-4 ساعة قبل تركيب خلايا للتصوير.
- إزالة أنبوب microcentrifuge MSL-N-يحتوي من كتلة C الحرارة 95 درجة (انظر القسم بروتوكول 2.4.1. أدناه). إضافة P-عامل أو M-عامل في التركيز المطلوب مباشرة في الاغاروز MSL-N ذاب. مزيج جيد من قبل vortexing قبل إعداد لوحة فوري.
- بعد تصاعد الخلية، واحتضان لوحة ل15-30 دقيقة في درجة حرارة 25 درجة مئوية قبل التصوير. استخدمت ف عامل و M-عامل الفيرومونات من حل سهم 1 ملغ / مل في الميثانول.
ملاحظة: إذا كان يعمل مع متحولة سلالات قد تتباين فترات الحضانة. قد يحدث تراكمها من الخلايا بعد الحضانة لفترات طويلة في م السائلالقانونين ويمكن أن تكون قوية بشكل خاص في بعض سلالات متحولة. الخلايا تجمعت لا يمكن رصدها على منصات الأغاروس في طبقة واحدة، وبالتالي من الصعب ضبط تلقائي للصورة وصورة. في حالة تكتل خلية واسعة جبل الخلايا على منصات الأغاروس مباشرة بعد غسيل وإعادة تعليق في وسائل الإعلام التي تفتقر إلى النيتروجين (كما في القسم بروتوكول 2.3.1.)، واحتضان لهم عند 30 درجة مئوية قبل التصوير.
- تركيب خلايا التصوير:
- إعداد MSL-N منصات الأغاروس 16 ذوبان قسامة في 95 ° C الحرارة كتلة لمدة 10-15 دقيقة، وإضافة 200 ميكرولتر بين اثنين من الشرائح الزجاجية مفصولة الفواصل (الشكل 1B). استخدام الفواصل مع سمك ~ 0.5 مم. لجعل الفواصل، قطع شرائط استخدام للخروج من الورق المقوى، مثل التي سلمت مع الانزيمات قيود.
- بيليه 100 ميكرولتر من الخلايا في 1000 x ج لمدة 1 دقيقة، وإزالة طاف واعادة تعليق الخلايا في المتبقي المتوسطة 2-4 ميكرولتر. لا اعادة تعليق في المتوسط الطازجة لأنها تؤخرالتزاوج.
- بعد 2-3 دقائق إزالة بعناية الفواصل وأعلى شريحة زجاجية. إذا عدة سلالات هي لتركيبها، وإعداد الخلية تركز قبل إعداد لوحة الاغاروز.
- إضافة 1 ميكرولتر من الخلايا لوحة والانتظار حتى يبدأ انخفاض التجفيف (~ 1 دقيقة) قبل تغطي مع انزلاق الغطاء وختم مع VALAP.
- السماح لوحة الجلوس لمدة 30 دقيقة على الأقل قبل التصوير عند 25 درجة مئوية أو RT.
- للحصول على مزيج من الخلايا في مراحل مختلفة من التزاوج، وجعل وسادة على الفور بعد يغسل في MSL-N (انظر القسم 2.3.)، واحتضان عند 18 درجة CO / N (~ 15 ساعة). هذا النهج هو مفيد لتصوير الخلايا في مراحل التزاوج متميزة لقرار زمنية عالية أو العينات مع إشارة ضعيفة.
التصوير 3. تعيش خلية من خلايا الخميرة التزاوج
- ضبط إعدادات الحصول على الصور.
تم ضبط إعدادات الحصول على الصور المعروضة هنا لمنصة DeltaVision تتألف من تخصيص أوليمبوس IX-71: ملاحظةالمجهر المقلوب مع خطة آبو 60X / 1.42 NA أو U-خطة آبو 100X / 1.4 أهداف NA، كاميرا CoolSNAP HQ2 والبصيرة مباحث أمن الدولة 7 لون وحدة مجتمعة إضاءة. يتم التحكم في الأجهزة عن طريق softWoRx v4.1.2 تمكن أيضا autofocusing الرقمي.- تأكد من أن فترات autofocusing لا تتجاوز 15 دقيقة منذ Z-الانجراف مع مرور الوقت الطويل يمكن ان تتجاوز قدرة نظام البرمجيات autofocusing. في حالة استخدام نظام autofocusing الأجهزة القائمة على استخدام فترات أكبر.
- ضبط الفاصل الزمني التصوير. التقاط صور كل 10 دقيقة لمدة 15 ساعة ~ كنقطة انطلاق عند العمل مع الموسومة fluorescently البروتين لأول مرة. يوفر هذا الفاصل الزمني لمحة جيدة عن عملية التزاوج بأكملها دون تبيض واسعة النطاق.
- صورة مع 5 فترات دقيقة أو أقصر لأحداث الساعة أكثر تحديدا مثل الانصهار. تتطلب فترات أقصر fluorophores قوية تمكن مرات التعرض المنخفضة وتبيض قليلا. للتصوير مع فترات أقل من 1 دقيقة تجنب O / N المجهروبدلا من ذلك إعداد خليط من جميع مراحل التزاوج على النحو المفصل في القسم بروتوكول 2.4.6.
- ضبط الصورة التعرض الوقت. مرات التعرض الاختبار ما بين 50 و 300 مللي ثانية. تهدف إلى تحقيق التوازن بين نسبة الإشارة إلى الضوضاء وphotobleaching من أجل تحقيق عدد كبير من وقت نقاط مع إشارة ملحوظ (عادة أكثر من 100).
- ضبط Z-باجتزاء. أقسام توفر كل 0.3 ميكرون تغطي 5 ميكرون عمق التصوير جيد. لاحظ أن-باجتزاء Z مزيد من الزيادات الصور الضرر، والتي يمكن التقليل من استخدام OAI (بصري محور التكامل - حملة اقتناء واحد من مجموع عمق العينة). حسن نظام التركيز التلقائي يقلل من الحاجة إلى العديد من Z-أقسام ويوصى بشدة.
- نصائح لدراسة سلوك التزاوج نوع محددة:
- لسلالات heterothallic، استخدم ح- والخلايا ح + يعبرون عن fluorophores متميزة، بحيث يمكن تمييز أنواع الخلايا اثنين. استخدام أي fluoropho المشفرة وراثياإعادة أعرب كإصدار عصاري خلوي أو الانصهار إلى البروتين الذاتية، على الرغم من أننا قد حققت نجاحا جيدا مع sfGFP، وهو البديل للطي سريع من GFP 17. وعادة ما تكون الموسومة البروتينات الذاتية في موضع الجيني الذاتية من خلال إعادة التركيب مثلي 14.
- لسلالات homothallic، والتعبير عن بروتين فلوري عصاري خلوي المشفرة وراثيا تحت سيطرة من نوع التزاوج المروجين محددة مثل تلك التي map3 جينات مستقبلات فرمون وmam2 لدفع التعبير في الخلايا P و M، على التوالي. دعاة map3 وmam2 غير نشطة أثناء النمو الخضري وحفز على النيتروجين المجاعة 18،19. تتكامل بنيات القيادة التعبير عن GFP عصاري خلوي أو mCherry تحت سيطرة هؤلاء مروجي عادة في مكان الجيني (ura4، leu1) لا تتداخل مع تطور طبيعي من دورة الحياة الجنسية 12.
- استخدام نوع التزاوج fluorophores عصاري خلوي محددة (كما هو الحال في القسم بروتوكول 3.2.2) لتحديد توقيت دقيق للاندماج خلية تصور كما نقل إشارة الفلورسنت من الخلايا شريك واحد على الآخر.
4. الكمي من التزاوج والانصهار الكفاءة
- لتحديد التزاوج والانصهار الكفاءة 11،12، خلايا البقعة مباشرة بعد MSL-N يغسل على منصات الأغاروس MSL-N، كما في الخطوة 2.3.1 أعلاه، ويترك لمدة 24 ساعة على 25 درجة مئوية قبل التصوير (الشكل 1A). باستخدام هذا البروتوكول على homothallic من النوع البري كفاءة سلالة التزاوج تصل ~ 60٪ وكفاءة الانصهار 99٪. لاختبار ما إذا كان أي انخفاض في هذه القيم التي لوحظت في سلالات متحولة تعكس النمط الظاهري محطة أو تأخير، وتكرار التجربة مع فترة حضانة 36 ساعة.
- حساب الكفاءة التزاوج كما
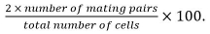 وتشمل التزاوج أزواج بيضات ملقحة، زقاق، وأزواج خلية غير مدمجة تم التعرف عليها منموقف ونموها نحو بعضها البعض.
وتشمل التزاوج أزواج بيضات ملقحة، زقاق، وأزواج خلية غير مدمجة تم التعرف عليها منموقف ونموها نحو بعضها البعض. - حساب كفاءة الانصهار كما
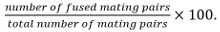
ملاحظة: يتم تحديد تنصهر أزواج التزاوج من خلال قدرتها على تشكيل أبواغ إذا فمن المعروف أن متحولة قيد الدراسة لا تؤثر على تكاثر. إذا تبوغ لا يمكن استخدامها للقراءة خارج، يتم تحديد الانصهار من خلال مراقبة انتشار علامة عصاري خلوي المعبر عنها في شريك التزاوج واحد فقط في كل من الشركاء.
النتائج
الانشطار نمو الخميرة والتزاوج حيوية عند إزالة مصدر النيتروجين
كما النيتروجين التجويع هو شرط أساسي لبدء التكاثر الجنسي في الخميرة الانشطار، تم رصد نوع السلالة البرية H90 homothallic على التحول من النيتروجين الغنية والمتوسطة الذين حرموا من النيت?...
Discussion
الظروف البيئية، وتوافر المواد الغذائية على وجه الخصوص، تؤثر بقوة على علم وظائف الأعضاء الانشطار الخميرة. النيتروجين المجاعة ضروري للالتزام التكاثر الجنسي ويؤدي إلى ضرب التغيرات في الإنقسامية تقدم دورة الخلية (المرجع 21) والشكل (2) في البداية. على إزالة...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
وأيد AV من قبل EMBO على المدى الطويل زمالة ما بعد الدكتوراه. ويتم تمويل البحوث في مختبر مارتن من منحة ERC البداية (GeometryCellCycle) ومنحة مؤسسة العلوم الوطنية السويسرية (31003A_155944) إلى SGM.
Materials
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
References
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved