Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микроскопия делящихся дрожжей Жизненный цикл сексуальной
В этой статье
Резюме
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Аннотация
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Введение
Хотя обмен генетическим материалом между двумя ячейками является центральным событием в половом размножении, он опирается на цепи событий, которые способствуют дифференциации клеток, позволяют по выбору партнера, осуществляют слияние клеток клеток и поддержания стабильности генома. Таким образом, половой жизненный цикл представляет себя в качестве модельной системы для изучения ряда биологических вопросов , связанных с развитием коммутаторов, реакция на внешние раздражители, плазма слияния мембран, сегрегации хромосом и т.д. исследуя делящихся дрожжей полового цикла для изучения этих явлений приносит выгоды от мощные генетика Модель системы, устоявшихся высокой пропускной способности подходов и утонченный микроскопии. Секс в делящихся дрожжей является гетеротипичной событие между Р-клетки и М-клетки различных типов спаривания. Эти два типа клеток дифференцированно выражают ряд генов , в том числе 1,2 для производства секретируемого Р- и М-феромоны, феромонов-рецепторов Map3 и Mam2, а также феромона-протеяSES Sxa1 и Sxa2. Homothallic штаммы, такие как обычно используемые H90 штамма, несут генетическую информацию для обоих типов спаривания в одном геноме , и клетки претерпевают сложную картину переключения типа спаривания на протяжении митотического жизненного цикла (см. Обзор 3). Множественные изоляты гетероталличных делящихся дрожжей , которые редко или никогда не переключать тип спаривания также обычно используются 4, наиболее заметно Н + N (P-типа) и Н (М -S-типа) штаммов.
В делящихся дрожжей, вступление в половой жизненный цикл находится под строгим питательного регулирования. Только азотные голодали дрожжевые клетки деления задержать митотическую воспроизводства и производят диффундирующего феромоны , чтобы сигнализировать наличие брачного партнера и продвигать дальнейшие шаги полового цикла (см. Обзор 5). лишение азота де-репрессирует ключевым регулятором транскрипционный спариванию Ste11, который действует в качестве переключателя развития и способствует еXpression скрещивания специфических генов , включая рецептор феромона и феромона генов производства 6,7. Взаимодействие с феромонами-рецептор активирует рецептор белка связью G-альфа и вниз по течению сигнализации МАРК , который дополнительно усиливает Ste11 транскрипционную активность 8-10, тем самым увеличивая выработку феромонов в положительной обратной связи между брачных партнеров. Уровни Феромонные имеют решающее значение , чтобы побудить различные состояния клеточной поляризации путем регулирования главного организатора клеточной полярности, в Rho-семейства GTPase Cdc42 11. При воздействии низких концентрациях феромонов, активный Cdc42, визуализируется в динамических пластырей, исследующих периферию клетки, а не роста клеток не наблюдается на данном этапе. Повышенные уровни феромона способствовать стабилизации активности Cdc42 в одной зоне и роста поляризованной проекции, называют Shmoo, который приносит партнерам клетки в контакте. Впоследствии два гаплоидных партнеры сопрягаемые сплавить, чтобы сформировать диплоидные зиготы. Последние работы показывает, тысе существование нового структуры актина , необходимой для слияния , который собран с помощью сопрягаемой-индуцированной формина Fus1 12. Этот слитый фокус концентратов типа V миозина зависимые процессы и позиционирует клеточной стенки машины деградации, таким образом , позволяя ремоделирование клеточной стенки , чтобы обеспечить контакт с плазматической мембраной без лизиса клеток 12. После слияния клетка-клетка, ядра вступают в контакт и подвергаются кариогамии. Известный динеин-зависимой возвратно-поступательное движение ядра внутри зиготы (лошадь хвост движения) , а затем способствует спаривание хромосом гомологов 13,14, за которым следует мейоза. И, наконец, четыре продукты мейоза упаковывают в индивидуальные споры во время споруляции.
Из-за своей сложности и многочисленных этапов, детальный мониторинг вязки была сложной. Два заметных трудностей в том, что весь процесс занимает хорошо более пятнадцати часов, и что клетки трудно синхронизировать. Эти difficulties обходят с помощью подходов микроскопии одноклеточных. Здесь общий протокол для исследования половой жизненный цикл у делящихся дрожжей представлен. С незначительными изменениями, этот протокол позволяет исследовать все различные этапы процесса, а именно индукции продукта гена спаривания, поляризации клеток и спаривания между сестринских клеток после переключения типа спаривания и между партнерами, не сестра, слияния клетка-клетка, и пост-фьюжн хвощ движения, мейоза и спорообразование. Этот метод позволяет 1) легко визуализировать флуоресцентно меченных белков с течением времени до, во время и после слияния; 2) различать поведение клеток противоположного типа спаривания; и 3) измерения и количественной оценки таких параметров, как shmooing, вязки, фьюжн или эффективность спорообразования.
протокол
Микроскопия анализ делящихся дрожжей полового размножения
1. Подготовка СМИ
- Подготовка Минимальная споруляционная среда , (MSL-N) 15 путем смешивания следующих компонентов: глюкоза: 10 г / л, КН 2 РО 4: 1 г / л, NaCl: 0,1 г / л, MgSO 4 · 7H 2 O: 0,2 г / Л. Добавить Микроэлементы (10,000x): 100 мкл / л, витамины (1,000x): 1 мл / л, и 0,1 М CaCl 2 мл / л. Фильтр-стерилизовать с помощью фильтра с размером частиц 0,22 мкм пор и хранить при комнатной температуре (RT).
- Используйте следующие витамины (1,000x) Наличие на складе: пантотенат: 1 г / л, никотиновая кислота: 10 г / л, инозитол: 10 г / л, биотин: 10 мг / л. Фильтр-стерилизовать с помощью фильтра с размером частиц 0,22 мкм пор и хранят при температуре 4 ° С.
- Используйте следующие элементы трассировки (10,000x) Наличие на складе: борная кислота: 5 г / л, MnSO 4: 4 г / л, ZnSO 4 · 7H 2 O: 4 г / л, FeCl 2 · 6H 2 O: 2 г / л , МоО 3: 0,4 г / л, К.И.: 1 г / л, CuSO 4· 5H 2 O: 0,4 г / л, Лимонная кислота: 10 г / л. Фильтр-стерилизовать с помощью фильтра с размером частиц 0,22 мкм пор и хранят при температуре 4 ° С.
- Подготовка MSL-N 2% агарозный (для изготовления агарозном камер ДОП) путем объединения 10 мл MSL-N с 0,2 г агарозы. Melt в течение ~ 2 мин при высокой мощности в микроволновой печи до агарозном не растворится и аликвотные 0,5 мл в микроцентрифужных пробирках. Хранить при комнатной температуре.
- Готовят Минимальная споруляционная среда , с азотом (MSL + N) от MSL-N путем добавления (NH 4) 2 SO 4: 1 г / л, лейцин: 0,225 г / л, аденин: 0,225 г / л, урацил: 0,225 г / л , Фильтр-стерилизовать с использованием фильтра размером пор 0,22 мкм. Хранить при комнатной температуре.
Примечание: лейцин, аденина и урацила добавляют к этой среде, чтобы обеспечить рост ауксотрофных штаммов. Дополнительная добавка аминокислотному должна быть включена , если используемый штамм несет ярко выраженный ауксотрофию (например his3Δ). Обратите внимание, что работа с полностью прототроф штаммов рекомендуется, так как толькотакие штаммы позволит высокую эффективность спаривании. - Подготовьте 200 мл VALAP для камеры уплотнения. В химическом стакане, добавить равные веса ланолин, вазелин (или другого вазелин) и парафином. Тепловая смесь при низкой температуре и помешивать, пока тщательно не смешано. Аликвотировать смесь на несколько маленьких чашках Петри. Хранить при комнатной температуре.
2. Культивирование делящихся дрожжей Штаммы для вязки экспериментов (Рисунок 1).
- День 1, Вечер:
Привить свеже прожилками штаммов из твердых сред в культуральные пробирки, содержащие 3 мл MSL + N. Используйте плоским дном трубы диаметром около 2,5 см. Используйте другие трубки культуры или колб с адаптированной объема культуры. Выдержите в течение ночи (O / N) при встряхивании при 25 ° C, 200 оборотов в минуту. При работе с гетероталличных штаммов, прививают отдельно.- Развести суспензии клеток в средствах массовой информации на следующее утро , чтобы убедиться , что культуры имеют оптическую плотность при 600 нм (OD 600) от 0,4-0,8 в вечернее время .
Заметка:OD 600 измерений как прокси - сервер концентрации клеток для делящихся дрожжей линейны в диапазоне приблизительно 0,1-1,0. Для нашего спектрофотометра OD 600 = 0,1 соответствует 1,4 × 10 6 клеток на мл. Таким образом, если исходная OD 600 считывает находятся за пределами этого диапазона образцы должны быть разбавлены / сгущенного для надежных измерений.
- Развести суспензии клеток в средствах массовой информации на следующее утро , чтобы убедиться , что культуры имеют оптическую плотность при 600 нм (OD 600) от 0,4-0,8 в вечернее время .
- 2-й день, вечер:
Развести клеток в 20 мл MSL + N сред для OD 600 = 0,025 в 100 мл колбах. Инкубируйте штаммы O / N при 30 ° C, 200 оборотов в минуту.
Примечание: культуры дикого типа клеток должна достигать OD 600 ~ 0,8 следующее утро (15 ч позже). При работе со штаммами с более длительным временем генерации регулировки разбавления соответственно. - 3-й день, Утро:
Мера OD 600 , чтобы проверить , что культуры имеют плотность клеток OD 600 ~ 0,8. При работе с гетероталличных штаммов, смешать равные количества клеток-партнеров. Гранул клетки при 1000 XG и передачи в 1,5 млтрубка. Мыть клетки три раза в 1 мл MSL-N среды. Повторное приостановить клеток в 3 мл MSL-N среды и разбавленных клетки до OD 600 = 1,5.- Для того, чтобы следить за спаривание между родственными клетками непосредственно монтировать клетки для получения изображений (см Protocol раздел 2.4). Используйте homothallic H90 штаммы, в которых переключение типа спаривания будет происходить во время митотических делений , происходящих после лишения азота. Непосредственная установка ячеек на агарозном колодки гарантирует, что, после того, как клеточное деление, сестра-клетки остаются рядом друг с другом.
- Для контроля поляризации клеток (динамики поисково-разведочных и shmooing) инкубировать 1-3 мл клеточной культуры при 30 ° С, 200 оборотов в минуту в течение 3-4 ч перед монтажом клеток для визуализации. В течение этих 3-4 ч, последний митотическое деление будет иметь место. Несколько клетки инициировали поляризацию, но большинство из них будет просто начинать их разведочные динамику поляризации.
- Для того, чтобы контролировать слияние клеток-клеток инкубировать 1-3 мл клеточной культуры при 30 ° С, 200 оборотов в минуту в течение 4-6 ч ИРПили монтажа ячеек для работы с изображениями.
- Для мониторинга пост-синтеза инкубировать 1-3 мл клеточных культур при температуре 30 ° С, 200 оборотов в минуту в течение 8 часов перед монтажом клеток для получения изображения.
- Для того, чтобы контролировать реакцию на определенной концентрации феромона (только для гетероталличных штаммов) инкубировать 3 мл клеточной культуры при 30 ° С, 200 оборотов в минуту в течение 3-4 ч до начала монтажа клеток для получения изображения.
- Удалите MSL-N-содержащий микроцентрифужных трубку от C тепла блока 95 ° (смотри раздел 2.4.1 протокола. Ниже). Добавить P-фактор, или М-фактор в нужной концентрации непосредственно в расплавленном MSL-N агарозы. Хорошо перемешать встряхиванием перед тем непосредственной подготовки площадки.
- После монтажа клеток, инкубировать площадку в течение 15-30 мин при температуре 25 ° C до визуализации. P-фактор и М-фактор феромоны были использованы из исходного раствора 1 мг / мл в метаноле.
Примечание: При работе с мутантные штаммы, время инкубации может изменяться. Слипание клеток может происходить после длительной инкубации в жидком мEdia и может быть особенно сильным в некоторых мутантных штаммов. Слипаются клетки не могут быть замечены на агарозном колодки в одном слое и, следовательно, трудно автофокусировкой и изображения. В случае обширной клеточной слипания клеток смонтировать на агарозном колодки сразу после промывки и повторно суспензию, в азотом не хватает средств массовой информации (как и в разделе 2.3.1 протокола.) И инкубировать их при 30 ° С до визуализации.
- Монтаж ячейки для работы с изображениями:
- Подготовьте MSL-N агарозном колодки 16 путем плавления аликвоты в 95 ° C тепловой блок в течение 10-15 мин и добавляя 200 мкл между двумя стеклянными слайдами , разделенных прокладками (рис 1B). Используйте распорки толщиной ~ 0,5 мм. Для того, чтобы распорки, использование полосы вырезать из картона, как, например, поставляется с ферментами рестрикции.
- Гранул 100 мкл клеток при 1000 х г в течение 1 мин, удалить супернатант и повторно приостанавливать клетки в остаточном 2-4 мкл среды. НЕ повторно приостанавливать в свежей среде, как он задерживаетспаривание.
- Через 2-3 мин осторожно снимите распорки и верхнюю предметное стекло. Если несколько штаммов должны быть установлены, подготовить клетка концентрируется перед приготовлением агарозном площадку.
- Добавляют 1 мкл клеток на площадку и ждать, пока капля не начнет сушки (~ 1 мин) перед покрытием с крышкой скольжения и уплотнения с VALAP.
- Пусть площадку сидеть в течение по крайней мере за 30 мин до обработки изображений при 25 ° С или комнатной температуре.
- Для того, чтобы получить смесь клеток на различных стадиях спаривания, сделать площадку сразу после мытья в MSL-N (см раздел 2.3.) И инкубировать при температуре 18 ° CO / N (~ 15 ч). Этот подход полезен для визуализации клеток на различных стадиях спаривания с высоким временным разрешением или образцов со слабым сигналом.
3. Live-ячейки изображения дрожжевых клеток стыковочных
- Настройка параметров изображения приобретения.
Примечание: Настройки получения изображения, представленные здесь, были оптимизированы для платформы DeltaVision, состоящей из настроенного Olympus IX-71инвертированный микроскоп с Plan Apo 60X / 1.42 NA или U-Plan Apo 100Х / 1.4 цели NA, камера CoolSNAP HQ2 и Insight SSI 7 цвета в сочетании блок осветителя. Оборудование управляется softWoRx v4.1.2, который также позволяет цифровой автофокусировку.- Убедитесь в том, что интервалы автофокусировка не превышают 15 мин, так как Z-дрейф в течение длительного времени может превысить пропускную способность системы программного обеспечения автофокусировку. При использовании аппаратных средств на основе системы автофокусировку, использовать большие интервалы.
- Настройка интервала формирования изображения. Делать снимки каждые 10 мин в течение ~ 15 часов в качестве отправной точки при работе с флуоресцентно меченый белок впервые. Этот интервал обеспечивает хороший обзор всего процесса спаривания без обширного отбеливания.
- Изображение с 5-минутными интервалами или короче для более точного времени событий, таких как слияние. Более короткие интервалы требуют сильных флуорофоры, позволяющие малое время воздействия и немного отбеливания. Для получения изображений с интервалом менее 1 мин избегать O / N микроскопиии вместо того, чтобы приготовить смесь из всех стадий сопрягаемых как подробно описано в Протоколе раздел 2.4.6.
- Настройка изображения времени экспозиции. Время экспозиции испытания от 50 до 300 мс. Цель, чтобы найти баланс между отношением сигнал-шум и фотообесцвечивания, чтобы достичь большого количества временных точек с различимым сигналом (обычно более 100).
- Отрегулируйте Z-секционирования. Разделы каждые 0,3 мкм покрытие 5 мкм обеспечивают хорошую глубину изображения. Следует отметить, что Z-секционирования еще больше увеличивает фото-повреждения, которые могут быть сведены к минимуму с помощью УРР (оптической оси интеграции - один захват развертки от общей глубины образца). Хорошая система автоматической фокусировки уменьшает потребность во многих Z-образных секций и настоятельно рекомендуется.
- Советы по изучению Спаривание типоспецифичной Behaviors:
- Для гетероталличных штаммов используют H- и H + клеток , экспрессирующих различные флуорофоры, таким образом , что два типа клеток можно отличить. Используйте любой генетически кодируемых fluorophoвновь выражается в виде цитозольного версии или слияния с эндогенного белка, хотя мы имели хороший успех с sfGFP, быстро складывая вариант GFP 17. Эндогенные белки, как правило , помечены на их эндогенного геномного локуса с помощью гомологичной рекомбинации 14.
- Для homothallic штаммов, выражают генетически кодируемых цитозольного флуоресцентный белок под контролем специфических промоторов типа спаривания таких как генов рецептора феромона map3 и mam2 для управления экспрессией в P и M клеток, соответственно. Инициаторы map3 и mam2 неактивны во время вегетативного роста и индуцируется при голодании азота 18,19. Формирует вождения выражение цитозольного GFP или mCherry под контролем этих промоторов , как правило , интегрированы в геномный локус (ura4, leu1) , что не мешает нормальной прогрессии полового жизненного цикла 12.
- Использование типа спаривания специфические цитозольных флуорофоры (как в Протоколе Раздел 3.2.2) для определения точного времени слияния клеток визуализировали как передача флуоресцентного сигнала от одного партнера клетки к другой.
4. Количественное присоединительных и Fusion Efficiencies
- Для количественной оценки спаривание и слитые эффективность 11,12, SPOT клеток непосредственно после того, как MSL-N моют на MSL-N агарозы колодки, как в шаге 2.3.1 выше, и оставьте в течение 24 ч при 25 ° С до визуализации (рис 1А). Используя этот протокол о homothallic дикого типа штамма эффективность спаривание достигает ~ 60% и эффективность сварки 99%. Чтобы проверить любое уменьшение этих значений, наблюдаемых у мутантных штаммов, отражают ли терминальную фенотип или задержку, повторить эксперимент с временем инкубации 36 ч.
- Рассчитать эффективность как ответная
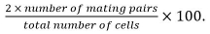 Спаривание пары включают зиготы, аски и Незакрепленное пар клеток, выявленных изих положение и рост в сторону друг друга.
Спаривание пары включают зиготы, аски и Незакрепленное пар клеток, выявленных изих положение и рост в сторону друг друга. - Рассчитать эффективность синтеза в качестве
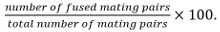
Примечание: Конденсированные пары сопрягаемых идентифицируют по их способности образовывать споры, если известно, что мутант при исследовании не влияет на спорообразование. Если спорообразования не может быть использован в качестве считывания, слитый определяется путем наблюдения за распространением цитозольного маркера, выраженное в только одного сопрягаемой партнера в обоих партнеров.
Результаты
Деление роста дрожжей и Спаривание динамика при удалении источника азота
В азотное голодание является необходимым условием для начала полового размножения в делящихся дрожжей дикого типа homothallic H90 штамм контролировали при переходе от азота богатых азотом л?...
Обсуждение
Условия окружающей среды, а также наличие питательных веществ, в частности, сильно влияют на физиологию делящихся дрожжей. Азотное голодание необходимо для приверженности к половому размножению и первоначально приводит к поразительным изменениям в прогрессии митотического клеточно...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
AV была поддержана долгосрочной докторантуру EMBO. Исследования, проведенные в лаборатории Мартина финансируется за счет гранта ERC Starting (GeometryCellCycle) и грант научного фонда Швейцарский национальный (31003A_155944) до СГМ.
Материалы
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
Ссылки
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены