A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרוסקופי של שמרי ביקוע Lifecycle המיני
* These authors contributed equally
In This Article
Summary
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Abstract
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Introduction
למרות חילופי גנטי בין שני תאים הוא האירוע המרכזי ברבייה מינית, היא מסתמכת על שרשרת האירועים מקדמים התמיינות תאים, לאפשר בחירה שותף, לבצע איחוי תאי תאים ולשמור על יציבות גנומית. כך מחזור החיים המיניים מציגים את עצמו כמערכת מודל ללמוד מספר השאלות ביולוגיות לגבי מתגים התפתחותי, בתגובה לגירויים חיצוניים, היתוך קרום פלזמה, פרדה כרומוזום, וכו 'היכרות עם שמרי ביקוע מחזור מיני ללמוד תופעות אלה מביאה את היתרונות של גנטיקת העצמה של מודל המערכת, ומבוסס גישות תפוקה גבוהה במיקרוסקופ משוכלל. סקס בשמרי ביקוע הוא אירוע heterotypic בין תא-P ו- M-תא של סוגי הזדווגות ברורים. שני סוגי התאים דיפרנציאלי להביע מספר הגנים 1,2 כולל אלה לייצור של P-המופרש ו- M-פרומונים, פרומון קולטנים Map3 ו Mam2 וכן פרומון פרוטיאהses Sxa1 ו Sxa2. זנים Homothallic, כגון זן h90 נפוץ, לשאת את המידע הגנטי לשני סוגי ההזדווגות בגנום יחיד התאים עוברים דפוס מורכב של מיתוג סוג ההזדווגות לאורך כל מחזור החיים mitotic (הנסקרת נ"צ. 3). מבודד מרובה של ביקוע שמרי heterothallic כי לעתים רחוקות או אף פעם לא יחליף את סוג ההזדווגות משמש גם 4 נפוץ, ובעיקר את h + N (P-type) ו- h -S (M-סוג) זנים.
בשמרי ביקוע, כניסת מחזור החיים המיניים נמצאת תחת רגולציה קפדנית תזונתית. רק בתאי שמרי ביקוע מורעבי חנקן לעצור רביית mitotic ולייצר פרומונים diffusible לאותת נוכחות של שותף הזדווגות ולקדם צעדים נוספים של המחזור המיני (הנסקרת נ"צ. 5). מניעת חנקן דה-מדחיק את הרגולטור תעתיק המפתח של Ste11 ההזדווגות שפועל כמתג התפתחותי ומקדם דוארxpression הזדווגות גנים ספציפיים כולל קולטן פרומון ואת הגנים ייצור פרומון 6,7. אירוסי פרומון קולטן מפעילים את החלבון בשילוב קולטן G-אלפא ואיתות MAPK במורד זרם אשר משפר עוד יותר פעילות תעתיק Ste11 8-10, ובכך להגדיל ייצור פרומון בתוך משוב חיובי בין בני זוג הזדווגות. רמות פרומון הם קריטיים כדי לגרום מצבי קיטוב תאים שונים על ידי ויסות מארגן אדון קוטביות התא, Cdc42 GTPase Rho-משפחה 11. בחשיפה לריכוזים נמוכים פרומון, פעיל Cdc42 היא דמיינה בטלאים דינמיים לחקור את פריפרית התא, ולא צמיחת תאים הוא ציינה בשלב זה. רמות פרומון מוגברים לקדם את התייצבות פעילות Cdc42 לאזור וצמיחה יחיד של הקרנה מקוטבת, כינה את shmoo, מה שמביא תאים שותף בקשר. בהמשך לכך, שני שותפי הזדווגות הפלואידים פתיל כדי ליצור זיגוטה דיפלואידי. מחקר שנערך לאחרונה מגלה הקיומו דואר של מבנה יקטין רומן חיוני היתוך שמורכב על ידי formin מושרה ההזדווגות Fus1 12. מוקד היתוך זה מתרכז תהליכים התלויים שרירן הסוג-V ו- ממקם את המכונות שפלות דופן תא, ובכך מאפשר שיפוץ של דופן התא כדי לאפשר מגע קרום פלזמה ללא תא תמוגה 12. לאחר איחוי תאים תאים, הגרעינים באים במגע ועוברים karyogamy. תנועה בולטת-dynein תלויים גב ו-ושוב של גרעין בתוך הזיגוטה (תנועת זנב סוס) אז מקדם ההתאמה של homologs כרומוזום 13,14, אשר מלווה המיוזה. לבסוף, ארבעה מוצרים של המיוזה ארוזים לתוך נבגים בודדים במהלך נביגה.
בגלל המורכבות שלה ואת הצעדים הרבים המעורבים, ניטור של הזדווגות מפורט כבר מאתגר. שני קשיים בולטים הן כי התהליך כולו לוקח הרבה מעל חמישה עשר שעות וכי תאים קשים לסנכרן. אלה דifficulties אפשר להערים על ידי גישות מיקרוסקופיה תא בודד. הנה פרוטוקול החקירה כללי מחזור החיים מינית בשמרי ביקוע מוצגים. עם שינויים קלים, פרוטוקול זה מאפשר הלימוד של כל השלבים השונים של התהליך, כלומר האינדוקציה של תוצר גן הזדווגות, קיטוב תא זיווג בין-תאי ואחות אחרי מיתוג סוג ההזדווגות בין בני זוג לא-אחות, היתוך תאי תאים, ופוסט היתוך סוס זנב התנועה, המיוזה ו נביגה. שיטה זו מאפשרת ל -1) בקלות לדמיין fluorescently מתויג חלבונים לאורך זמן מראש, במהלך פיוז'ן פוסט; 2) להפלות את התנהגותם של תאים מסוג ההזדווגות מול; ו -3) למדוד ולכמת פרמטרים כגון shmooing, הזדווגות, איחוי או יעיל נביגה.
Protocol
ניתוח מיקרוסקופי של רבייה מינית שמרי ביקוע
1. הכנת Media
- הכן בינוני מינימום נביגה (MSL-N) 15 על ידי ערבוב המרכיבים הבאים: גלוקוז: 10 גר '/ ל, KH 2 PO 4: 1 גר' / ל, NaCl: 0.1 גר '/ ל, MgSO 4 · 7H 2 O: 0.2 גר' / ל הוספת יסודות קורט (10,000x): 100 μl / L, ויטמינים (1,000x): 1 מ"ל / L, ו -0.1 M CaCl 2 מ"ל / L. מסנן לעקר באמצעות מסנן גודל 0.22 מיקרומטר נקבוביים ולאחסן בטמפרטורת חדר (RT).
- השתמש ויטמינים הבאים (1,000x) במלאי: Pantothenate: L / g 1, ניקוטינית חומצה: 10 גר '/ ל, אינוזיטול: 10 גר' / ל, ביוטין: 10 מ"ג / ליטר. מסנן לעקר באמצעות מסנן גודל נקבובי 0.22 מיקרומטר ולאחסן ב 4 מעלות צלזיוס.
- השתמש יסודות קורט הבאים (10,000x) במלאי: חומצת בור: 5 גר '/ ל, MnSO 4: 4 g / L, ZnSO 4 · 7H 2 O: 4 g / L, FeCl 2 · 6H 2 O: 2 גר' / ל Moo 3,: 0.4 גר '/ ל, KI: 1 גר' / ל, CuSO 4· 5H 2 O: 0.4 גר '/ ל, חומצה ציטרית: 10 גר' / ל. מסנן לעקר באמצעות מסנן גודל נקבובי 0.22 מיקרומטר ולאחסן ב 4 מעלות צלזיוס.
- הכן MSL-N Agarose 2% (המשמש לייצור תאי כרית agarose) על ידי שילוב של 10 מ"ל MSL-N עם 0.2 גרם של agarose. ממיסים עבור ~ 2 דקות בהספק גבוה במיקרוגל עד להמסת agarose ו -0.5 מ"ל aliquot צינורות microcentrifuge. חנות ב RT.
- הכן בינוני מינימום נביגה עם חנקן (MSL + N) מ MSL-N ידי הוספת (NH 4) 2 SO 4: 1 גר '/ ל, לאוצין: 0.225 g / L, אדנין: 0.225 g / L, אורציל: 0.225 g / L . מסנן לעקר באמצעות מסנן גודל נקבובי 0.22 מיקרומטר. חנות ב RT.
הערה: לאוצין, אדנין ו אורציל מתווספים בינוני זו כדי לאפשר צמיחה של זני auxotrophic. יש לכלול תוספת חומצות אמינו נוספת אם הזן המשמש נושא auxotrophy מובהק (למשל his3Δ). כמו כן, שים עבודה עם זני prototroph מלא מומלץ, כמו שרקזנים כאלה ייאפשרו יעילות הזדווגות גבוהה. - כן 200 מיליליטר VALAP לאיטום קאמרי. בכוס להוסיף משקל זהה של לנולין, וזלין (או וזלין אחר), וכן פרפין. תערובת חום בטמפרטורה נמוכה ומערבבים מדי פעם עד לקבלת תערובת אחידה היטב. Aliquot את התערובת לתוך כמה צלחות פטרי קטנות. חנות ב RT.
2. זני שמרים Culturing ביקוע לניסויים מזווגים (איור 1).
- יום 1, ערב:
לחסן טרי זנים ומפוספסים מן התקשורת מוצקה לתוך צינורות תרבות המכילים 3 מיליליטר של MSL + N. השתמש צינורות שטוח בתחתית בקוטר כ -2.5 ס"מ. השתמש צינורות או צלוחיות תרבות אחרים עם נפח תרבות מותאם. דגירה לילה (O / N) עם רועד ב 25 ° C, 200 סל"ד. אם עובד עם זני heterothallic, לחסן בנפרד.- לדלל השעיות תא התקשורת למחרת בבוקר כדי לוודא שיש תרבויות צפיפות אופטית נמדד ב 600 ננומטר (OD 600) של 0.4-0.8 בערב.
הערה:OD 600 מדידות כמו פרוקסי של ריכוז התא עבור שמרים ביקוע הם ליניאריים בטווח של כ 0.1-1.0. לקבלת OD ספקטרופוטומטר שלנו 600 = 0.1 תואמים 1.4 x 10 6 תאים לכל מיליליטר. לכן, אם ראשוני OD 600 קורא הם מחוץ לטווח זה דגימות צריכות להיות דלילות / מרוכז למדידות אמינות.
- לדלל השעיות תא התקשורת למחרת בבוקר כדי לוודא שיש תרבויות צפיפות אופטית נמדד ב 600 ננומטר (OD 600) של 0.4-0.8 בערב.
- יום 2, ערב:
לדלל התאים ב 20 מ"ל של התקשורת MSL + N כדי OD 600 = 0.025 100 מ"ל צלוחיות. דגירת זני O / N ב 30 מעלות צלזיוס, 200 סל"ד.
הערה: בתרביות תאי wild-type צריכות להגיע OD 600 ~ 0.8 למחרת בבוקר (15 שעות מאוחר יותר). אם עובד עם זנים עם זמן דור כבר להתאים דילול בהתאם. - יום 3, הבוקר:
מדוד OD 600 לוודא שיש תרבויות צפיפות התאים של OD 600 ~ 0.8. אם עובד עם זני heterothallic, לערבב מספר שווה של תאי שותף. תאים גלולים XG ב 1000 ולהעביר 1.5 מיליליטרצינור. שטפו תאים שלוש פעמים 1 מ"ל של מדיום MSL-N. Re להשעות תאים 3 מ"ל של מדיום MSL-N ו לדלל התאים OD 600 = 1.5.- כדי לפקח זיווג בין תאי אחות ישירות הר תאי הדמיה (ראה פרוטוקול סעיף 2.4). השתמש זני h90 homothallic, שבה מיתוג סוג ההזדווגות יתקיים במהלך חטיבות mitotic שהתרחשו לאחר קיפוח חנקן. הרכבה מיידי של תאים על כרית agarose מבטיח כי, לאחר חלוקת התא, אחות-התאים נשארים אחד ליד השני.
- כדי לפקח קיטוב תא (דינמיקת גישוש shmooing) דגירה 1-3 מיליליטר של תרבית תאים על 30 מעלות צלזיוס, 200 סל"ד במשך 3-4 שעות לפני תאי הרכבת הדמיה. בתוך 3-4 אלה hr, חטיבת mitotic האחרונה תהיה התרחשה. כמה תאים יהיו יזמיו קיטוב, אבל הכי פשוט יהיה החל דינמיקת קיטוב הגישוש שלהם.
- כדי לפקח איחוי תאים תאים דגירה 1-3 מ"ל של תרבית תאים על 30 מעלות צלזיוס, 200 סל"ד במשך 4-6 שעות פריאו הרכבת תאי הדמיה.
- כדי לפקח אירועים שלאחר היתוך דגירת 1-3 מיליליטר של תרביות תאים על 30 מעלות צלזיוס, 200 סל"ד במשך 8 שעות לפני הרכבת תאי הדמיה.
- כדי לפקח בתגובת ריכוז פרומון מסוים (רק עבור זני heterothallic) דגירה 3 מיליליטר של תרבית תאים על 30 מעלות צלזיוס, 200 סל"ד במשך 3-4 שעות לפני הרכבת תאי הדמיה.
- הסר את צינור microcentrifuge MSL-N-המכיל מהגוש 95 ° C החום (ראה סעיף 2.4.1 פרוטוקול. להלן). להוסיף P-גורם או M-גורם בריכוז הרצוי ישירות agarose MSL-N נמס. מערבבים היטב על ידי vortexing לפני ההכנה כרית מיידית.
- לאחר תא הרכבה, דגירת הכרית במשך 15-30 דק 'ב 25 ° C לפני ההדמיה. P-factor ו פרומונים M-גורם שימשו מפתרון המניות של 1 מ"ג / מ"ל מתנול.
הערה: אם עובד עם מוטצית זני פעמי דגירה עשויות להשתנות. התקבצות של תאים עלולה להתרחש לאחר דגירה ממושכת מ נוזלedia ועלול להיות חזק במיוחד זנים מוטנטים כמה. תאים מגושמים לא ניתן הבחינו על כריות agarose בשכבה אחת ובכך שקשה פוקוס אוטומטי ותמונה. במקרה התקבצות תא נרחב הר תאים על כריות agarose מייד לאחר שטיפות מחדש השעיה בתקשורת חסרת-חנקן (כמו באזור הפרוטוקול 2.3.1.) דגירה אותם ב 30 מעלות צלזיוס לפני ההדמיה.
- הרכבת תאי הדמיה:
- כן MSL-N רפידות agarose 16 על ידי המסת דוגמא מתמיסה בסיסית בתוך גוש חום 95 מעלות צלזיוס במשך 10-15 דקות והוספה 200 μl בין שתי שקופיות זכוכית מופרדות מפרידים (האיור 1B). השתמש מפרידים בעובי של ~ 0.5 מ"מ. כדי להפוך מפרידים, רצועות שימוש לגזור קרטון, כגון נמסר כי עם אנזימי הגבלה.
- גלולה 100 μl של תאים XG ב 1000 דקות 1, להסיר את supernatant מחדש להשעות תאים בינוניים שיורית 2-4 μl. לא מחדש להשעות במדיום טרי כמו שהוא מעכבהזדווגות.
- לאחר 2-3 דקות להסיר בזהירות מפרידי שקופיות הזכוכית העליונות. אם מספר זנים הם להיות מותקנים, להכין את התא מתרכז לפני הכנת כרית agarose.
- הוסף 1 μl של תאים לרפד ולחכות עד הטיפה ומתחילה לנגב (~ 1 דק ') לפני הכיסוי עם תלוש כיסוי ואיטום עם VALAP.
- תן הכרית לשבת במשך לפחות 30 דקות לפני ההדמיה של 25 מעלות צלזיוס או RT.
- כדי לקבל תערובת של תאים בשלבים שונים של הזדווגות, לבצע משטח מיד לאחר שטיפות ב MSL-N (ראה סעיף 2.3.) ו לדגור על 18 ° CO / N (~ 15 שעות). גישה זו שימושית עבור הדמית תאים בשלבי הזדווגות נפרדות עם רזולוציה גבוהה זמנית או דוגמאות עם אות חלשה.
3. Live- תא הדמיה של תאי שמרי הזדווגות
- התאם גדרות רכישת תמונה.
הערה: הגדרות רכישת תמונה המוצגת כאן היו אופטימיזציה עבור פלטפורמת DeltaVision המורכבת IX-71 אולימפוס אישיתמיקרוסקופ הפוכה עם תכנית Apo 60X / 1.42 NA או U-תכנית Apo 100X / 1.4 מטרות NA, מצלמת CoolSnap HQ2 וכן מאייר היחיד בשילוב Insight SSI 7 צבע. החומרה נשלטת על ידי v4.1.2 softWoRx כי גם מאפשר autofocusing הדיגיטלי.- ודא כי מרווחי autofocusing לא יעלו על 15 דקות מאז להיסחף-Z לאורך זמן ארוך יותר יכול לעלות את היכולת של מערכת autofocusing תוכנה. אם באמצעות מערכת autofocusing מבוסס חומרה, להשתמש במרווחים גדולים יותר.
- התאם מרווח הדמיה. קח תמונות כל 10 דקות במשך ~ 15 שעות כנקודת מוצא כשעובדים עם מתויג חלבון fluorescently בפעם הראשונה. מרווח זה מספק סקירה טובה של תהליך ההזדווגות כולו ללא הלבנה נרחבת.
- תמונה עם 5 מרווחי דקות או קצרים לאירועי שעה במדויק יותר כגון היתוך. במרווחי זמן קצרים יותר דורשים fluorophores החזק המאפשר פעמי חשיפה נמוכות לבן קטן. עבור הדמיה עם מרווחים מתחת ל -1 דקות להימנע O / מיקרוסקופיה Nובמקום להכין תערובת של כל שלבי ההזדווגות כמפורט בסעיף 2.4.6 פרוטוקול.
- התאם זמן חשיפת תמונה. פעמי חשיפת מבחן בין 50 ל 300 אלפיות שניים. מטרתם היא למצוא איזון בין יחס אות-רעש photobleaching כדי להשיג מספר רב של נקודות זמן עם אות ניתן להבחין (בדרך כלל מעל 100).
- התאם-חתך Z. מדורים כל 0.3 מיקרומטר 5 מיקרומטר כיסוי לספק עומק הדמיה טוב. שים לב-נזק התמונה עליות נוספות חתך-Z, אשר ניתן למזער על ידי שימוש OAI (אינטגרציה לציר האופטי - רכישה לטאטא יחיד של עומק כלל המדגם). מערכת פוקוס אוטומטי טוב מפחיתה את הצורך Z- קטעים רבים והוא מומלץ מאוד.
- טיפים ללמוד התנהגויות זיווג סוג ספציפיות:
- עבור זני heterothallic, השתמש h- ו- H + תאי מבטאי fluorophores ברור, כך ששני סוגי התאים ניתן להבחין. השתמש בכל fluoropho מקודד גנטימחדש הביע כגרסה או היתוך cytosolic לחלבון אנדוגני, אם כי יש לנו הצלחה טובה עם sfGFP, גרסה מהירה מתקפלים של GFP 17. חלבונים אנדוגניים בדרך כלל מתויגים ב מוקד הגנומי אנדוגני שלהם על ידי רקומבינציה הומולוגי 14.
- עבור זני homothallic, לבטא חלבון פלואורסצנטי cytosolic מקודד גנטי בשליטת יזמים ספציפיים סוג ההזדווגות כגון אלה של גני קולטן פרומון map3 ו mam2 לנהוג הביטוי בתאי P ו- M, בהתאמה. היזמים של map3 ו mam2 אינם פעילים במהלך הצמיחה וגטטיבי והם המושרה על רעב חנקן 18,19. בונה נהיגה הביטוי של ה- GFP cytosolic או mCherry בשליטת היזמים אלה משולבים בדרך כלל מוקד גנומית (ura4, leu1) כי אינו מתערב עם התקדמות נורמלית במחזור חיי המין 12.
- השתמש בסוג ההזדווגות fluorophores ספציפיים cytosolic (כמו בסעיף פרוטוקול 3.2.2) כדי לקבוע תזמון מדויק של איחוי תאים דמיינו כמו העברת אות ניאון מתא שותף אחד למשנהו.
4. כימות היעילות המזווגת ופיוז'ן
- כדי לכמת את היעילות ההזדווגות ואיחוי 11,12, תאים במקום מיד לאחר MSL-N לשטוף על כריות agarose MSL-N, כמו בשלב 2.3.1 לעיל, ולהשאיר למשך 24 שעות ב 25 ° C לפני הדמיה (איור 1 א). שימוש בפרוטוקול זה יעילות הזדווגות זן פראי סוג homothallic מגיעה ~ 60% ויעילות פיוז'ן 99%. כדי לבחון האם ירידה בכמות הערכים אלה נצפו זנים מוטנטים לשקף פנוטיפ מסוף או עיכוב, לחזור על הניסוי עם זמן דגירה 36 שעות.
- חישוב יעילות הזדווגות כמו
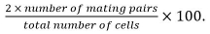 זוגות זיווג לכלול zygotes, asci, וזוגות תא unfused זיהה מןהמיקום ואת הצמיחה שלהם אחד כלפי אחרים.
זוגות זיווג לכלול zygotes, asci, וזוגות תא unfused זיהה מןהמיקום ואת הצמיחה שלהם אחד כלפי אחרים. - חישוב יעיל היתוך כמו
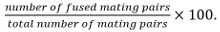
הערה: זוגות הזדווגות חיפוי מזוהים על ידי היכולת שלהם ליצור נבגים אם ידוע כי המוטציה נחקרת אינה משפיעה נביגה. אם נביגה לא ניתן להשתמש כמו-אאוט לקרוא, ההיתוך נקבע על ידי התבוננות הפצת סמן cytosolic לידי ביטוי רק אחד מבני זוג הזדווגות לתוך שני בני הזוג.
תוצאות
צמיחת ביקוע שמרים והזדווגות Dynamics עם וסילוק מקור חנקן
כמו רעב חנקן הוא תנאי הכרחי חניכה של רבייה מינית בשמרי ביקוע, h90 זן homothallic wild-type היה פיקוח על מעבר בין חנקן עשיר עד בינוני מקופח חנקן (איור 2), בעקבות הפרוטוקול המתואר באיור 1.
Discussion
תנאים סביבתיים, וזמינות מזינה בפרט, מאוד משפיעים על הפיסיולוגיה שמרים ביקוע. רעב חנקן הכרחי מחויב הרבייה המינית בתחילה מובילה לשינויים בולטים את התקדמות מחזור תא mitotic (Ref. 21 ואיור 2). לאחר הסרת חנקן מן האוכלוסייה גדלה באופן אקספוננציאלי, גודל תא בחטיבה י?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
AV נתמכה על ידי עמיתי הבתר EMBO לטווח ארוך. מחקר במעבדת מרטין ממומן על ידי מענק מוצא ERC (GeometryCellCycle) ומענק קרן הלאומי למדע שוויצרי (31003A_155944) כדי SGM.
Materials
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
References
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved