É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microscopia do ciclo de vida sexual por fissão de levedura
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Resumo
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Introdução
Apesar de intercâmbio genético entre duas células é o evento central na reprodução sexual, ele depende de uma cadeia de eventos que promovem a diferenciação celular, permitem a escolha do parceiro, realizar a fusão célula-célula e manter a estabilidade genômica. Assim, o ciclo de vida sexual se apresenta como um sistema modelo para estudar uma série de questões biológicas sobre interruptores de desenvolvimento, resposta a estímulos extrínsecos, a fusão da membrana plasmática, segregação cromossômica, etc. Explorando a levedura ciclo sexual para estudar esses fenômenos traz os benefícios da genética poderosos do sistema modelo, bem estabelecida abordagens de alto rendimento e de microscopia sofisticado. Sexo em levedura é um evento heterotípica entre uma célula e um P-célula M de tipos de cruzamento distintos. Os dois tipos de células expressam diferencialmente uma série de genes de 1,2, incluindo aqueles para a produção do ácido P- segregada e M-feromonas,-receptores de feromonas map3 e Mam2 bem como feromona-Proteases Sxa1 e Sxa2. Homotálico estirpes, tais como a estirpe H90 comumente utilizado, transportar a informação genética para os dois tipos de acasalamento em um único genoma e as células sofrem um padrão complexo de tipo de acasalamento de comutação ao longo do ciclo de vida do mitótico (revisto em Ref. 3). Vários isolados de levedura heterotálicas que raramente ou nunca mudar tipo de acasalamento também são comumente utilizados 4, o mais proeminente o h + N (P-tipo) e as cepas h S (M-tipo).
Em levedura, a entrada no ciclo de vida sexual está sob regulação nutricional rigorosa. Apenas células de levedura de fissão deficientes em nitrogênio prender reprodução mitótico e produzir feromônios difus�eis para sinalizar a presença de um parceiro de acasalamento e promover novas etapas do ciclo sexual (revisto em Ref. 5). privação de azoto de-reprime o regulador transcricional chave de Ste11 de acoplamento que funciona como um interruptor de desenvolvimento e promove expression de acasalamento genes específicos, incluindo o receptor de feromônio e o feromônio genes de produção de 6,7. Engajamento-receptor de feromônio ativa a proteína-acoplado receptor G-alfa e de sinalização MAPK a jusante que aumenta ainda mais Ste11 atividade transcricional 8-10, aumentando assim a produção de feromônio em um feedback positivo entre os parceiros de acasalamento. Níveis de feromonas são cruciais para induzir diferentes estados de polarização celular, regulando o organizador mestre da polaridade celular, a Rho-família GTPase Cdc42 11. Após a exposição a baixas concentrações de feromonas, Cdc42 activo é visualizado em manchas dinâmicos explorando a periferia da célula, e nenhum crescimento de células é observada nesta fase. níveis de feromônio aumento promover a estabilização da actividade Cdc42 a uma única zona e crescimento de uma projeção polarizada, denominado o shmoo, que traz células parceiras em contato. Posteriormente, os dois parceiros de acasalamento haplóide fundir para formar um zigoto diplóide. Um trabalho recente revela the existência de uma estrutura nova actina essencial para a fusão que é montado pela formin induzida por acasalamento FUS1 12. Este enfoque de fusão concentra processos dependentes tipo V-miosina e posiciona a maquinaria degradação da parede celular, permitindo, assim, a remodelação da parede celular para permitir o contacto da membrana plasmática, sem lise celular 12. Após a fusão célula-célula, os núcleos entram em contato e passam por cariogamia. Um movimento de vai-e-vem dependente da dineína proeminente dentro do núcleo do zigoto (o movimento do cavalo-cauda), em seguida, promove o emparelhamento de homólogos do cromossoma 13,14, que é seguido por meiose. Finalmente, os quatro produtos de meiose são embalados em esporos individuais durante a esporulação.
Devido à sua complexidade e os numerosos passos envolvidos, monitoramento detalhado do acasalamento tem sido um desafio. Duas dificuldades notáveis são que todo o processo leva bem mais de 15 horas e que as células são difíceis de sincronizar. estes difficulties são contornadas por abordagens de microscopia de uma única célula. Aqui um protocolo geral para investigar o ciclo de vida sexual na levedura de fissão é apresentado. Com pequenos ajustes, este protocolo permite o estudo de todas as diferentes etapas do processo, ou seja, a indução de produto do gene de acasalamento, a polarização celular e emparelhamento entre irmãos células após tipo de acasalamento de comutação e entre os parceiros não-irmã, a fusão célula-célula, e pós-fusão horse-tail movimento, a meiose e esporulação. Este método permite 1) visualizar facilmente fluorescente etiquetado proteínas ao longo do tempo pré, durante e pós-fusão; 2) discriminar o comportamento das células do tipo de cruzamento oposto; e 3) medir e quantificar parâmetros como shmooing, mating, fusão ou eficiência esporulação.
Protocolo
análise de microscopia de reprodução sexual levedura
1. Preparação de Meios
- Prepare meio de esporulação Mínimo (MSL-N) 15 por mistura dos seguintes componentes: Glucose: 10 g / l, KH 2 PO 4: 1 g / L, NaCl: 0,1 g / L, MgSO4 · 7H 2 O: 0,2 g / EU. Adicionar oligoelementos (10.000x): 100 uL / L, vitaminas (1.000X): 1 mL / L, e 0,1 M de CaCl2 ml / L. Filtro-esterilizar utilizando um filtro de tamanho de poro de 0,22 e armazenar a temperatura ambiente (RT).
- Utilize a seguinte Vitaminas (1.000x) da: Pantotenato: 1 g / L, ácido nicotínico: 10 g / l, inositol: 10 g / L, Biotina: 10 mg / L. Filtro-esterilizar utilizando um filtro de tamanho de poro de 0,22 um e armazenar a 4 ° C.
- Use os seguintes elementos-traço (10.000 vezes) inventário: Ácido Bórico: 5 g / L, MnSO4: 4 g / L, ZnSO4 · 7H 2 O: 4 g / L, FeCl 2 · 6H 2 O: 2 g / l , MoO 3: 0,4 g / L, KI: 1 g / L, CuSO4· 5H 2 O: 0,4 g / l, ácido cítrico a 10 g / L. Filtro-esterilizar utilizando um filtro de tamanho de poro de 0,22 um e armazenar a 4 ° C.
- Prepare MSL-N de agarose a 2% (utilizado para fazer câmaras bloco de agarose) combinando 10 ml de N-MSL com 0,2 g de agarose. Derreta para ~ 2 min em alta potência em um forno de microondas até dissolver agarose e alíquotas de 0,5 ml em tubos de microcentrífuga. Armazenar à temperatura ambiente.
- Prepare meio de esporulação mínima com azoto (MSL + N) do MSL-N através da adição de (NH 4) 2 SO 4: 1 g / L, leucina: 0,225 g / L, adenina: 0,225 g / L, uracilo: 0,225 g / L . Filtro-esterilizar utilizando um filtro de tamanho de poro de 0,22 um. Armazenar à temperatura ambiente.
Nota: leucina, adenina e uracilo são adicionados a este meio para permitir o crescimento de estirpes auxotróficas. Suplemento de amino-ácido adicional deve ser incluído se a cepa utilizada carrega uma auxotrofia distinta (por exemplo his3Δ). Observe também que o trabalho com cepas plenamente prototrófica é recomendado, já que apenastais estirpes vai permitir alta eficiência de acoplamento. - Prepare 200 ml valap para vedação de câmara. Numa proveta de adicionar pesos iguais, de lanolina, vaselina (ou outro vaselina), e parafina. mistura de calor a baixa temperatura e mexa ocasionalmente até ficar bem misturado. Alíquota da mistura em vários pequenos pratos de petri. Armazenar à temperatura ambiente.
2. Cepas A cultura de fissão de levedura para Experimentos de acoplamento (Figura 1).
- Dia 1, Evening:
Inocular estirpes recém-listradas de meios sólidos em tubos de cultura contendo 3 ml de MSL + N. Use tubos de fundo plano de diâmetro de cerca de 2,5 cm. Use outros tubos de cultura ou de frascos de cultura com um volume adaptado. Incubar durante a noite (O / N) com agitação a 25 ° C, 200 rpm. Se trabalhar com linhagens heterotálicas, inocular separadamente.- Dilui-se suspensões de células em meios na manhã seguinte para assegurar que as culturas possuem uma densidade óptica medida a 600 nm (DO600) de 0,4-0,8 durante a noite.
Nota:OD 600 medições como um proxy de concentração de células de levedura são lineares no intervalo de cerca de 0,1-1,0. Para o nosso espectrofotómetro OD 600 = 0,1 corresponde a 1,4 x 10 6 culas por ml. Assim, se OD inicial de 600 leituras são fora deste intervalo amostras precisa ser diluído / concentrada para medições confiáveis.
- Dilui-se suspensões de células em meios na manhã seguinte para assegurar que as culturas possuem uma densidade óptica medida a 600 nm (DO600) de 0,4-0,8 durante a noite.
- Dia 2, Evening:
Dilui-se as células em 20 ml de meio MSL + N para DO600 = 0,025 em frascos de 100 ml. Incubar estirpes de O / N a 30 ° C, 200 rpm.
Nota: culturas de células do tipo selvagem deve chegar a OD 600 ~ 0,8 na manhã seguinte (15 horas depois). Se estiver a trabalhar com estirpes com maior tempo de geração ajustar diluição em conformidade. - Dia 3, Manhã:
Medida OD600 para verificar que as culturas têm densidade celular de OD600 ~ 0,8. Se trabalhar com linhagens heterotálicas, misture um número igual de células parceiras. células de pelotas em 1000 xg e transferir para um 1,5 mltubo. Lave as células três vezes em 1 ml de meio MSL-N. Re-suspender as células em 3 ml de meio MSL-N e diluir as células a OD 600 = 1,5.- Para monitorar o acasalamento entre as células irmã células montar diretamente para geração de imagens (ver Protocolo Secção 2.4). Use estirpes H90 homotálico, em que tipo de acasalamento de comutação terá lugar durante as divisões mitóticas que ocorrem após a privação de azoto. montagem imediata de células sobre a almofada de agarose assegura que, após a divisão celular, associado células permanecer ao lado do outro.
- Para monitorar a polarização celular (dinâmica exploratórios e shmooing) incubar 1-3 ml de cultura de células a 30 ° C, 200 rpm durante 3-4 h antes de células de montagem para imagiologia. Dentro destas 3-4 horas, terá ocorrido a última divisão mitótica. Algumas células vão ter iniciado a polarização, mas a maioria só vai estar começando sua dinâmica de polarização exploratórios.
- Para monitorizar a fusão célula-célula incubar 1-3 ml de cultura de células a 30 ° C, 200 rpm durante 4-6 h priou a células de montagem para imagiologia.
- Monitorar eventos de fusão pós-incubar 1-3 ml de culturas celulares a 30 ° C, 200 rpm, durante 8 h antes de células de montagem para imagiologia.
- Para monitorar a resposta a uma concentração de feromonas específicas (apenas para estirpes heterotálicas) incubar 3 ml de cultura de células a 30 ° C, 200 rpm durante 3-4 h antes de células de montagem para imagiologia.
- Retire o tubo de microcentrífuga MSL-N contendo a partir do bloco de calor C 95 ° (ver secção Protocolo 2.4.1. Abaixo). Adicionar P-factor ou factor-M na concentração desejada directamente na agarose MSL-N derretido. Misture bem em vortex antes da preparação pad imediata.
- Após a montagem da célula, a almofada incubar durante 15-30 min a 25 ° C antes da imagiologia. -Factor P e factor-M feromonas foram usadas a partir de uma solução stock de 1 mg / ml em metanol.
Nota: Se o trabalho com estirpes mutantes tempos de incubação podem variar. A aglomeração das células pode ocorrer após incubação prolongada em m líquidaEDIA e pode ser particularmente forte em algumas estirpes mutantes. células aglutinados não podem ser manchadas sobre almofadas de agarose em uma única camada e, assim, são difíceis de focagem automática e imagem. Em caso de extenso aglutinação celular células em almofadas de agarose montagem imediatamente após lavagens e re-suspensão em meios-falta de azoto (como no protocolo Secção 2.3.1.) E incubar a 30 ° C antes da imagiologia.
- Montagem Cells for Imaging:
- Prepare MSL-N almofadas de agarose a 16 por fusão de uma alíquota num bloco de calor a-95 ° C durante 10-15 min e adicionar 200 ul entre duas lâminas de vidro separadas por espaçadores (Figura 1B). Use espaçadores com uma espessura de 0,5 mm ~. Para fazer os espaçadores, de uso tiras cortadas de cartão, como a que está fornecido com enzimas de restrição.
- Pellet 100 ul de células a 1000 x g durante 1 min, remover o sobrenadante e as células em meio de 2-4 ul residual re-suspender. Não re-suspensão em meio fresco em que atrasaacasalamento.
- Após 2-3 min remova cuidadosamente os espaçadores e a lâmina de vidro superior. Se várias cepas são para ser montado, prepare a célula se concentra antes de preparar a almofada de agarose.
- Adicionar 1 ml de células para a almofada e esperar até a queda começa secagem (~ 1 min) antes de cobrir com tampa de deslizamento e selando com valap.
- Deixe que a almofada de se sentar durante pelo menos 30 min antes de imagem a 25 ° C ou TA.
- Para se obter uma mistura de células em vários estágios de acasalamento, fazer uma almofada imediatamente após lavagens em MSL-N (ver secção 2.3.) E incuba-se a 18 ° CO / N (~ 15 h). Essa abordagem é útil para geração de imagens de células em fases distintas de acasalamento com alta resolução temporal ou amostras com sinal fraco.
Imagem 3. Em células vivas de células de levedura de acoplamento
- Ajustar as Definições de aquisição.
Nota: As configurações de aquisição de imagem aqui apresentados foram otimizados para a plataforma DeltaVision composto por uma personalização Olympus IX-71microscópio invertido com o Plano de Apo 60X / 1,42 NA ou U-Plano de Apo 100X / 1,4 objectivos de NA, uma câmera CoolSnap HQ2 e um 7 cores introspecção SSI unidade combinada iluminador. O equipamento é controlado por softWoRx v4.1.2 que também permite a auto-focagem digital.- Assegure-se que os intervalos de focagem automática não excedam 15 min uma vez que o Z-tração sobre um tempo mais longo pode ultrapassar a capacidade do sistema de auto-focagem de software. Se estiver usando um sistema de focagem baseada em hardware, use intervalos maiores.
- Ajuste o intervalo de imagem. Captar imagens a cada 10 minutos para ~ 15 hr como ponto de partida quando se trabalha com uma proteína fluorescente etiquetado pela primeira vez. Este intervalo fornece uma boa visão geral de todo o processo de acasalamento, sem branqueamento extensivo.
- Imagem com intervalos de 5 min ou mais curtas para mais precisamente eventos de tempo, como a fusão. intervalos mais curtos exigem fluoróforos fortes que permitam baixos tempos de exposição e pouco branqueamento. Para geração de imagens com intervalos inferiores a microscopia de 1 min evitar O / Ne em vez disso se preparar uma mistura de todas as fases de acoplamento tal como detalhado na Secção 2.4.6 Protocolo.
- Ajustar a imagem tempo de exposição. tempos de exposição de teste entre 50 e 300 ms. Destinam-se a estabelecer um equilíbrio entre a relação sinal-ruído e fotodegradação de alcançar um grande número de pontos de tempo com um sinal perceptível (normalmente mais de 100).
- Ajustar Z-seccionamento. Secções cada 0,3 pm, cobrindo 5 uM fornecer uma boa profundidade da imagem. Note-se que aumenta ainda mais foto-lesão de corte Z, que podem ser minimizados através da utilização do OAI (integração eixo óptico - aquisição de um único varrimento da profundidade total da amostra). Bom sistema de foco automático reduz a necessidade de muitas Z-seções e é altamente recomendado.
- Dicas para estudar comportamentos específicos-Type Acasalamento:
- Para as estirpes heterotálicas, usar H- e H + células expressando fluoróforos diferentes, de modo que os dois tipos de células podem ser distinguidas. Use qualquer fluoropho geneticamente codificadoestá expresso como uma versão citosólica ou fusão de uma proteína endógena, embora tenhamos tido um bom sucesso com sfGFP, uma variante de dobrar rápida de GFP 17. Proteínas endógenas são geralmente etiquetado no seu local genómico endógeno por recombinação homóloga 14.
- Para as estirpes homotálico, expressar uma proteína citosólica fluorescente geneticamente codificado sob o controlo de promotores específicos do tipo de acasalamento, tais como os dos genes de receptores de feromonas map3 e mam2 para conduzir a expressão em células P e M, respectivamente. Os promotores de map3 e mam2 estão inativas durante o crescimento vegetativo e são induzidas mediante privação de nitrogênio 18,19. Constructos de condução da expressão de GFP citosólico ou mCherry sob o controlo de um destes promotores são tipicamente integrados num locus genómico (ura4, Leu1) que não interfere com a progressão normal do ciclo de vida sexual 12.
- Use tipo de acasalamento fluoróforos citosólicas específicas (como na Seção Protocolo 3.2.2) para determinar o sincronismo preciso de fusão celular visualizado como a transferência de sinal fluorescente de uma célula parceiro para o outro.
4. Quantificação de acasalamento e fusão Eficiências
- Para quantificar a eficiência de fusão e de acoplamento 11,12, células no local directamente após MSL-N de lavagem sobre MSL-N almofadas de agarose, tal como no passo 2.3.1, supra, e deixar durante 24 horas a 25 ° C antes da imagiologia (Figura 1A). Usando este protocolo um tipo selvagem estirpe eficiência de acoplamento homotálico ~ atinge 60% e a eficiência de fusão de 99%. Para testar se qualquer redução nestes valores observados em estirpes mutantes reflectir um fenótipo terminal ou um atraso, repetir a experiência com um tempo de incubação 36 h.
- Calcular a eficiência de acasalamento como
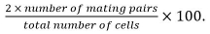 pares de acasalamento incluem zigotos, asco, e pares de células não fundidas identificados a partir desua posição e crescimento para cada um dos outros.
pares de acasalamento incluem zigotos, asco, e pares de células não fundidas identificados a partir desua posição e crescimento para cada um dos outros. - Calcular a eficiência de fusão como
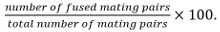
Nota: pares de acasalamento fundidas são identificados pela sua capacidade de formar esporos, se for conhecido que o mutante sob estudo não influencia a esporulação. Se a esporulação não pode ser utilizado como leitura para fora, a fusão é determinada através da observação da propagação de um marcador citosólica expressa em apenas um dos parceiros de acoplamento em ambos os parceiros.
Resultados
Fissão crescimento do fermento e Acasalamento Dynamics após a remoção da fonte de nitrogênio
Como privação de nitrogênio é um pré-requisito para o início da reprodução sexual na levedura de fissão, estirpe de tipo selvagem H90 homotálico foi monitorada mediante mudança de para médio privado de azoto rico em nitrogênio (Figura 2), seguindo o protocolo apresentado na Figura 1. Resumidamente, as células foram cultivadas O ...
Discussão
condições ambientais e disponibilidade de nutrientes em particular, afetam fortemente a fisiologia da levedura de fissão. Privação de nitrogênio é necessário para compromisso com a reprodução sexual e, inicialmente, leva a mudanças marcantes na progressão do ciclo celular mitótico (Ref. 21 e Figura 2). Após a remoção do azoto população em crescimento exponencial, o tamanho das células em divisão diminui rapidamente (Figura 2C) e a maioria das células dete...
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
AV foi apoiado por uma bolsa de pós-doutorado de longo prazo EMBO. Pesquisa no laboratório de Martin é financiado por uma bolsa ERC Starting (GeometryCellCycle) e uma subvenção Science Foundation Nacional Suíço (31003A_155944) para SGM.
Materiais
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
Referências
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados