Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microscopía de la levadura de fisión del ciclo de vida sexual
* Estos autores han contribuido por igual
En este artículo
Resumen
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Resumen
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Introducción
Aunque el intercambio genético entre dos células es el evento central en la reproducción sexual, que se basa en una cadena de eventos que promueven la diferenciación celular, permiten la elección de pareja, llevan a cabo la fusión célula-célula y mantener la estabilidad genómica. Así, el ciclo de vida sexual se presenta como un sistema modelo para estudiar una serie de cuestiones biológicas en conmutación de desarrollo, respuesta a estímulos extrínsecos, la fusión de la membrana plasmática, la segregación de cromosomas, etc. Exploración de la levadura de fisión ciclo sexual para estudiar estos fenómenos aporta los beneficios de la poderosos genética del modelo de sistema, bien establecidos enfoques de alto rendimiento y microscopía sofisticado. Sexo en la levadura de fisión es un evento heterotípicos entre una célula P y una de las células M de los tipos de apareamiento diferentes. Los dos tipos de células expresan diferencialmente una serie de genes, incluidos los 1,2 para la producción del P- secretada y M-feromonas, receptores de feromonas y map3 MAM2 así como feromonas proteases Sxa1 y Sxa2. Cepas homotálicos, tales como la cepa H90 de uso común, llevan la información genética para los dos tipos de apareamiento en un único genoma y las células se someten a un complejo patrón de conmutación de tipo de apareamiento en todo el ciclo de vida mitótico (revisado en Ref. 3). Varias cepas de levadura de fisión heterotálico que cambian rara vez o nunca tipo de apareamiento también se utilizan comúnmente 4, lo más prominente de H + N (tipo P) y h -S (M-tipo) de las cepas.
En la levadura de fisión, la entrada en el ciclo de vida sexual es bajo una estricta regulación nutricional. Sólo las células de levadura de fisión nitrógeno hambre detienen la reproducción mitótico y producen feromonas difusibles para indicar la presencia de una pareja sexual y promover nuevas medidas del ciclo sexual (revisado en Ref. 5). privación de nitrógeno de-reprime el regulador transcripcional clave de Ste11 de acoplamiento que actúa como un interruptor de desarrollo y promueve eXpression de apareamiento genes específicos que incluyen el receptor de feromonas y la feromona genes de producción de 6,7. El compromiso de feromonas-receptor activa la proteína del receptor acoplado a G-alfa y la señalización de MAPK aguas abajo que mejora aún más la actividad de transcripción Ste11 8-10, lo que aumenta la producción de feromonas en una retroalimentación positiva entre compañeros de apareamiento. Los niveles de feromonas son cruciales para inducir diferentes estados de polarización de células, regulando el organizador principal de la polaridad celular, la Rho GTPasa Cdc42 familiar 11. Tras la exposición a bajas concentraciones de feromonas, activa Cdc42 se visualiza en parches dinámicos que exploran la periferia de la célula, y no el crecimiento celular se observa en esta etapa. Aumento de los niveles de feromonas promueven la estabilización de la actividad Cdc42 a una sola zona y el crecimiento de una proyección polarizada, denominado el shmoo, que trae las células asociadas en contacto. Posteriormente, los dos socios de apareamiento haploides se fusionan para formar un cigoto diploide. Un trabajo reciente revela THe existencia de una estructura de actina novela esencial para la fusión que se monta por el formin apareamiento inducida FUS1 12. Este enfoque de fusión concentra procesos dependientes de tipo V de miosina y posiciona la maquinaria de degradación de la pared celular, lo que permite la remodelación de la pared celular para permitir el contacto de la membrana plasmática sin lisis celular 12. Tras la fusión célula-célula, los núcleos entran en contacto y se someten a la cariogamia. Un prominente movimiento hacia atrás y hacia adelante dineína dependiente del núcleo dentro del cigoto (el movimiento de la cola de caballo), entonces promueve el emparejamiento de cromosomas homólogos 13,14, que es seguido por meiosis. Por último, los cuatro productos de la meiosis se empaquetan en esporas individuales durante la esporulación.
Debido a su complejidad y los numerosos pasos a seguir, un seguimiento detallado de acoplamiento ha sido un reto. Dos dificultades notables son que todo el proceso se lleva bien más de quince horas y que las células son difíciles de sincronizar. estos droblemas son eludidas por los enfoques de microscopía de una sola célula. Aquí un protocolo general para investigar se presenta el ciclo de vida sexual en la levadura de fisión. Con ajustes menores, este protocolo permite el estudio de todos los diferentes pasos del proceso, a saber, la inducción de producto génico de apareamiento, la polarización celular y el apareamiento entre hermanos células tras el cambio al tipo de apareamiento y entre los socios no hermanas, la fusión célula-célula, y después de la fusión de la cola de caballo movimiento, la meiosis y esporulación. Este método permite a 1) visualizar fácilmente las proteínas etiquetadas con fluorescencia con el tiempo antes, durante y después de la fusión; 2) discriminar el comportamiento de las células de tipo de apareamiento opuesto; y 3) la medida y cuantificación de parámetros tales como shmooing, el apareamiento, la fusión o la eficiencia esporulación.
Protocolo
análisis de microscopía de la reproducción sexual levadura de fisión
1. Preparación de Medios
- Preparar medio de esporulación mínima (MSL-N) 15 mediante la mezcla de los siguientes componentes: glucosa: 10 g / L, KH 2 PO 4: 1 g / L, NaCl: 0,1 g / L, MgSO 4 · 7H 2 O: 0,2 g / L. Añadir elementos traza (10.000 veces): 100 l / L, vitaminas (1,000x): 1 ml / L y 0,1 M de CaCl2 ml / L. Filtrar esterilizar utilizando un filtro de 0,22 micras de tamaño de poro y se almacena a temperatura ambiente (RT).
- Utiliza el siguiente Vitaminas (1,000x) stock: pantotenato: 1 g / l, ácido nicotínico: 10 g / L, inositol: 10 g / l, Biotina: 10 mg / L. Filtrar esterilizar utilizando un filtro de 0,22 micras de tamaño de poro y se almacena a 4 ° C.
- Utilice los siguientes elementos traza (10,000x) stock: Ácido bórico: 5 g / l, MnSO4: 4 g / L, ZnSO4 · 7H 2 O: 4 g / L, FeCl2 · 6H 2 O: 2 g / L , MoO3: 0,4 g / l, KI: 1 g / L, CuSO4· 5H 2 O: 0,4 g / L, ácido cítrico: 10 g / L. Filtrar esterilizar utilizando un filtro de 0,22 micras de tamaño de poro y se almacena a 4 ° C.
- Preparar MSL-N de agarosa al 2% (utilizado para hacer las cámaras del cojín de agarosa) mediante la combinación de 10 ml de MSL-N con 0,2 g de agarosa. Derretir de ~ 2 minutos a alta potencia en un horno de microondas hasta que se disuelva agarosa y alícuotas de 0,5 ml en tubos de microcentrífuga. Almacenar a temperatura ambiente.
- Preparar medio de esporulación mínimo con nitrógeno (MSL + N) de MSL-N mediante la adición de (NH 4) 2 SO 4: 1 g / L, leucina: 0,225 g / L, adenina: 0,225 g / L, uracilo: 0,225 g / L . Filter-esterilizar utilizando un filtro de tamaño de poro 0,22 micras. Almacenar a temperatura ambiente.
Nota: leucina, adenina y uracilo se añaden a este medio para permitir el crecimiento de las cepas auxotróficas. Suplemento de aminoácidos adicional debe incluirse si la cepa utilizada lleva una auxotrofıa distinta (por ejemplo his3Δ). Tenga en cuenta también que el trabajo con cepas totalmente prototroph se recomienda, ya que sólotales cepas permitirán una alta eficiencia de acoplamiento. - Preparar 200 ml valap para el sellado de la cámara. En un vaso de precipitados añadir pesos iguales de lanolina, vaselina (u otra jalea de petróleo), y la parafina. Calentar la mezcla a baja temperatura y se agita de vez en cuando hasta que se mezclen bien. Alícuota de la mezcla en varias pequeñas placas de Petri. Almacenar a temperatura ambiente.
2. El cultivo de fisión cepas de levadura para experimentos de apareamiento (Figura 1).
- Día 1, de noche:
Inocular cepas recién rayadas de medios sólidos en tubos de cultivo que contenían 3 ml de N + MSL. Utilice tubos de fondo plano de un diámetro de unos 2,5 cm. Utilizar otros tubos de cultivo o frascos con volumen de cultivo adaptado. Incubar durante la noche (O / N) con agitación a 25 ° C, 200 rpm. Si se trabaja con cepas heterotálicas, inocular por separado.- Diluir las suspensiones de células en medios de la mañana siguiente para asegurarse de que los cultivos tienen una densidad óptica medida a 600 nm (OD 600) de 0,4-,8 por la noche.
Nota:OD 600 mediciones como un proxy de la concentración celular de la levadura de fisión son lineales en el intervalo de aproximadamente 0,1 a 1,0. Para nuestro OD espectrofotómetro 600 = 0,1 corresponde a 1,4 x 10 6 células por ml. Por lo tanto, si se lee DO inicial 600 se encuentran fuera de este rango de muestras necesitan ser diluidas / concentrada para mediciones fiables.
- Diluir las suspensiones de células en medios de la mañana siguiente para asegurarse de que los cultivos tienen una densidad óptica medida a 600 nm (OD 600) de 0,4-,8 por la noche.
- Día 2, de noche:
Diluir las células en 20 ml de MSL + N los medios de comunicación a OD 600 = 0,025 en matraces de 100 ml. Incubar las cepas O / N a 30 ° C, 200 rpm.
Nota: Los cultivos de células de tipo salvaje deben llegar a OD 600 ~ 0,8 a la mañana siguiente (15 horas después). Si se trabaja con cepas con tiempo de generación ya ajustar dilución en consecuencia. - Día 3, por la mañana:
Medir OD 600 para verificar que las culturas tienen densidad celular de OD 600 ~ 0,8. Si se trabaja con cepas heterotálicas, mezclar el mismo número de células asociadas. Precipitar las células a 1.000 xg y transferir a un 1,5 mltubo. Lavar las células tres veces en 1 ml de medio MSL-N. Células Vuelva a suspender en 3 ml de medio de MSL-N y diluir las células a OD 600 = 1,5.- Para supervisar el apareamiento entre las células hijas se montan directamente en las células de formación de imágenes (véase el Protocolo Sección 2.4). Utilizar cepas H90 homotálicos, en el que se llevará a cabo el apareamiento tipo de conmutación durante las divisiones mitóticas que se producen después de la privación de nitrógeno. montaje inmediata de las células en la almohadilla de agarosa asegura que, después de la división celular, la hermana células se mantienen uno junto al otro.
- Para controlar la polarización celular (dinámica de exploración y shmooing) incubar 1-3 ml de cultivo celular a 30 ° C, 200 rpm durante 3-4 horas antes de la células de montaje para la imagen. Dentro de estos 3-4 horas, se habrá producido la última división mitótica. Unas pocas células se han puesto en marcha la polarización, pero la mayoría solo pueden iniciar sus dinámicas de polarización exploratorios.
- Para supervisar la fusión célula-célula se incuba 1-3 ml de cultivo celular a 30 ° C, 200 rpm durante 4-6 hr prio a las células de montaje para la imagen.
- Para supervisar eventos post-fusión incuban 1-3 ml de cultivos de células a 30 ° C, 200 rpm durante 8 horas antes de las células de montaje para la imagen.
- Para controlar la respuesta a una concentración de feromona específica (sólo para las cepas heterotálica) incubar 3 ml de cultivo celular a 30 ° C, 200 rpm durante 3-4 horas antes de la células de montaje para la imagen.
- Retire el tubo de microcentrífuga MSL-N que contiene desde el bloque de calor 95 ° C (véase la sección 2.4.1 Protocolo. Abajo). Añadir P-factor o factor M a la concentración deseada directamente en la agarosa MSL-N derretido. Mezclar bien por agitación antes de la preparación de la almohadilla inmediata.
- Después de montar celular, incubar la almohadilla durante 15-30 minutos a 25 ° C antes de la imagen. Factor P y M-factor de feromonas se utilizaron a partir de una solución madre de 1 mg / ml en metanol.
Nota: Si se trabaja con cepas mutantes tiempos de incubación pueden variar. Agrupación de células puede ocurrir después de una incubación prolongada en m líquidaedios y puede ser particularmente fuerte en algunas cepas mutantes. células agrupadas no se pueden observar en las almohadillas de agarosa en una sola capa y por lo tanto son difíciles de enfoque automático y la imagen. En el caso de la formación de grumos de células extensa montar células en agarosa almohadillas inmediatamente después de los lavados y resuspensión en medios que carecen de nitrógeno (como en el Protocolo de la sección 2.3.1.) Y incubarlos a 30 ° C antes de la imagen.
- Las células para el montaje de imagen:
- Preparar MSL-N agarosa almohadillas 16 por la fusión de una parte alícuota en un calor de bloque 95 ° C durante 10-15 minutos y la adición de 200 l entre dos placas de vidrio separadas por espaciadores (Figura 1B). Utilice espaciadores con un espesor de ~ 0,5 mm. Para hacer espaciadores, bandas Uso cortan de cartón, tal como el suministrado con enzimas de restricción.
- Se precipitan 100 l de células a 1.000 xg durante 1 min, eliminar el sobrenadante y las células en medio residual de 2-4 l volver a suspender. No vuelva a suspender en medio fresco ya que retrasaapareamiento.
- Después de 2-3 minutos y retirar con cuidado los separadores de la placa de vidrio superior. Si varias cepas se van a montar, preparar la célula se concentra antes de la preparación de la almohadilla de agarosa.
- Añadir 1 l de células a la plataforma y esperar hasta que la gota se inicia el secado (~ 1 min) antes de ponerse la hoja de la cubierta y de sellado con valap.
- Deje que la almohadilla reposar durante al menos 30 minutos antes de exponer a 25 ° C o RT.
- Para obtener una mezcla de células en diversas etapas de apareamiento, hacer una almohadilla inmediatamente después de lavados en MSL-N (véase la Sección 2.3.) Y se incuba a 18 ° CO / N (~ 15 h). Este enfoque es útil para obtener imágenes de las células en las etapas de acoplamiento distintos con alta resolución temporal o muestras con señal débil.
Imagen 3. Células vivas de células de levadura de apareamiento
- Ajuste de los ajustes de adquisición.
Nota: Los valores de adquisición de imágenes que aquí se presentan han sido optimizados para la plataforma DeltaVision compuesto por una personalizada Olympus IX-71microscopio invertido con el Plan Apo 60X / 1.42 NA o U-Plan Apo 100X / 1.4 NA objetivos, una cámara y un CoolSNAP HQ2 Insight SSI 7 colores unidad combinada iluminador. El hardware es controlado por SoftWorx v4.1.2 que también permite un enfoque automático digital.- Asegúrese de que los intervalos de autoenfoque no excedan de 15 minutos desde que el Z-deriva con el tiempo más largo puede superar la capacidad del sistema de enfoque automático de software. Si se utiliza un sistema de enfoque automático basado en hardware, usar intervalos más grandes.
- Ajustar el intervalo de imagen. Tomar imágenes cada 10 min durante ~ 15 h como punto de partida cuando se trabaja con un etiquetado con fluorescencia de proteína por primera vez. Este intervalo proporciona una buena visión general de todo el proceso de apareamiento sin blanquear extensa.
- Imagen con intervalos de 5 minutos o menos a los acontecimientos del tiempo con mayor precisión como la fusión. intervalos más cortos requieren fluoróforos fuertes que permiten tiempos de exposición bajos y poco blanqueo. Para imágenes con intervalos de por debajo de 1 min evitar O / N microscopíay en lugar de preparar una mezcla de todas las etapas de acoplamiento tal como se detalla en la Sección 2.4.6 Protocolo.
- Ajustar el tiempo de exposición de la imagen. tiempos de exposición de prueba entre 50 y 300 ms. Trate de encontrar un equilibrio entre la razón y photobleaching-señal-ruido que se consiga un gran número de puntos de tiempo con una señal discernible (generalmente más de 100).
- Ajuste Z-seccionamiento. Las secciones que cubren cada 0,3 micras 5 micras proporcionan una buena profundidad de imagen. Tenga en cuenta que seccionamiento Z nuevos aumentos foto-daño, que puede ser minimizado mediante el uso de la OAI (integración eje óptico - una única adquisición de barrido de la profundidad de la muestra total). Buen sistema de enfoque automático reduce la necesidad de muchos Z-secciones y es muy recomendable.
- Consejos para estudiar comportamientos de acoplamiento específicas del tipo:
- Para las cepas heterotálica, use h- y H + células que expresan fluoróforos distintos, de modo que los dos tipos de células se pueden distinguir. Utilice cualquier fluoropho codificado genéticamentere expresado como una versión citosólica o fusión de una proteína endógena, aunque hemos tenido buen éxito con sfGFP, una variante de plegado rápido de GFP 17. Proteínas endógenas son generalmente etiquetados en su locus genómico endógeno por recombinación homóloga 14.
- Para las cepas homotálicos, expresar una proteína fluorescente citosólica genéticamente codificado bajo el control de promotores específicos de tipo de apareamiento, tales como los de los genes de los receptores de feromonas map3 y MAM2 para conducir la expresión en las células P y M, respectivamente. Los promotores de map3 y MAM2 están inactivos durante el crecimiento vegetativo y se inducen a la inanición de nitrógeno 18,19. Las construcciones que impulsan la expresión de GFP citosólica o mCherry bajo el control de estos promotores están típicamente integrados en un locus genómico (ura4, leu1) que no interfiera con la progresión normal del ciclo de vida sexual 12.
- Uso de tipo de apareamiento fluoróforos citosólicas específicos (como en la Sección 3.2.2 Protocolo) para determinar la sincronización exacta de la fusión celular visualizado como la transferencia de la señal fluorescente de una célula a la otra pareja.
4. Cuantificación de acoplamiento y fusión Eficiencias
- Para cuantificar el apareamiento y la eficiencia de fusión 11,12, células contado directamente después de MSL-N lavar a MSL-N agarosa almohadillas, como en el paso 2.3.1 anterior, y se deja durante 24 horas a 25 ° C antes de la imagen (Figura 1A). El uso de este protocolo homothallic una de tipo salvaje cepa eficiencia de acoplamiento alcanza ~ 60% y la eficacia de la fusión el 99%. Para probar si cualquier reducción de estos valores observados en cepas mutantes reflejan un fenotipo terminal o un retraso, repetir el experimento con un tiempo de incubación 36 h.
- Calcular la eficiencia de acoplamiento como
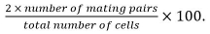 parejas de apareamiento incluyen cigotos, ascos y parejas de células no fusionadas identificados a partir desu posición y crecimiento hacia los demás.
parejas de apareamiento incluyen cigotos, ascos y parejas de células no fusionadas identificados a partir desu posición y crecimiento hacia los demás. - Calcular la eficiencia de fusión como
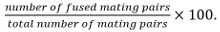
Nota: apareamiento de pares fusionadas se identifican por su capacidad de formar esporas si se sabe que el mutante en estudio no influye en la esporulación. Si la esporulación no se puede utilizar como lectura de, la fusión se determina mediante la observación de la difusión de un marcador citosólico expresado en una sola pareja de acoplamiento en ambos socios.
Resultados
La fisión crecimiento de la levadura y el apareamiento Dinámica Tras la eliminación de una fuente de nitrógeno
Como el hambre de nitrógeno es un requisito previo para el inicio de la reproducción sexual en la levadura de fisión, cepa de tipo salvaje H90 homothallic se controló a cambio de rico en nitrógeno a un medio de nitrógeno-privada (Figura 2), siguiendo el protocolo descrito en la Figura 1. Brevemente, las células se cult...
Discusión
Las condiciones ambientales, y la disponibilidad de nutrientes, en particular, afectan en gran medida la fisiología de la levadura de fisión. Hambre de nitrógeno es necesaria para el compromiso de la reproducción sexual e inicialmente da lugar a notables cambios en la progresión del ciclo celular mitótico (Ref. 21 y Figura 2). Tras la eliminación de nitrógeno de crecimiento exponencial de la población, el tamaño de celda en la división disminuye rápidamente (Figura 2C)
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
AV fue apoyado por una beca postdoctoral largo plazo EMBO. La investigación en el laboratorio de Martin está financiado por una subvención de inicio del CEI (GeometryCellCycle) y una subvención Swiss National Science Foundation (31003A_155944) para SGM.
Materiales
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
Referencias
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados