Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikroskopie von Fission Yeast Sexual Lifecycle
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Zusammenfassung
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Einleitung
Obwohl genetische Austausch zwischen zwei das zentrale Ereignis in der sexuellen Fortpflanzung ist es, Zellen, stützt sie sich auf eine Kette von Ereignissen, die Zelldifferenzierung fördern, ermöglichen die Partnerwahl durchführen Zell-Zell-Fusion und genomische Stabilität aufrechtzuerhalten. So ist die sexuelle Lebenszyklus selbst als Modellsystem stellt eine Reihe von biologischen Fragen in Bezug auf Entwicklungs Schalter, als Reaktion auf extrinsische Reize, Plasmamembranfusion, die Chromosomensegregation zu studieren, usw. Erforschung der Spalthefe Sexualzyklus , diese Phänomene zu studieren , bringt die Vorteile der Modellsystem leistungsstarke Genetik, gut etablierte High-Throughput-Ansätze und anspruchsvolle Mikroskopie. Sex in Spalthefe ist ein heterotypic Ereignis zwischen einer P-Zelle und einer M-Zelle von unterschiedlichen Paarungstypen. Die beiden Zelltypen differentiell eine Reihe von Genen 1,2 einschließlich der für die Produktion des sekretierten P- und M-Pheromonen, Pheromon-Rezeptoren Map3 und MAM2 sowie Pheromon-protea auszudrückenses Sxa1 und Sxa2. Homothallischen Stämmen wie den H90 - Stamm häufig verwendet, tragen die genetische Information für beide Paarungstypen in einem einzigen Genom und Zellen durchlaufen ein komplexes Muster von Paarungstyp Schalt ganzen Lebenszyklus mitotische ( zusammengefasst in Ref. 3). Mehrere Isolate von heterothallisch Spalthefe , die selten oder nie Paarungstyp wechseln werden auch häufig 4, am deutlichsten die h + N (P-Typ) und h -S (M-Typ) Stämme verwendet.
In Spalthefe, Eintritt in den sexuellen Lebenszyklus ist unter strengen Ernährungs Regulierung. Nur verhaften Stickstoff verhungert Spalthefezellen mitotischen Reproduktion und produzieren diffusionsfähig Pheromone Anwesenheit eines Paarungspartner zu signalisieren , und weitere Schritte des Sexualzyklus fördern ( beschrieben in Ref. 5). Stickstoffentzug de-reprimiert den Schlüssel Transkriptionsregulator der Paarung Ste11, die als Entwicklungs Schalter wirkt und fördert expression spezifischer Gene einschließlich des Pheromon - Rezeptor - Paarung und dem Pheromon Produktion Gene 6,7. Pheromon-Rezeptor Engagement aktiviert den Rezeptor-gekoppelten Protein G-alpha und Downstream - MAPK - Signalisierung , die eine weitere Verbesserung Ste11 Transkriptionsaktivität 8-10, somit Pheromonproduktion in einer positiven Rückkopplung zwischen Paarungspartner zu erhöhen. Pheromone Ebenen sind von entscheidender Bedeutung verschiedener Zellpolarisationszustände zu induzieren , indem die Master - Organisator der Zellpolarität Regulierung der Rho-Familie GTPase Cdc42 11. Bei Exposition gegenüber niedrigen Konzentrationen Pheromon ist aktiv Cdc42 in dynamischen patches visualisiert der Zellperipherie Erkundung und kein Zellwachstum in diesem Stadium beobachtet werden. Erhöhte Pheromon Ebenen, um die Stabilisierung der Cdc42-Aktivität zu einer einzigen Zone und das Wachstum eines polarisierten Projektion fördern, zu bezeichnen die shmoo, die Partnerzellen in Kontakt bringt. Anschließend verschmelzen die beiden haploiden Paarungspartnern einen diploiden Zygote zu bilden. Die jüngsten Arbeiten zeigt the Existenz eines neuartigen Aktin Struktur essentiell für die Fusion, die durch die Paarung induzierten formin Fus1 12 zusammengebaut ist. Dieses Fusions Fokus konzentriert Typ-V - Myosin abhängige Prozesse und positioniert die Abbaumaschinen Zellwand, wodurch Remodellierung der Zellwand ermöglicht 12 Plasmamembran Kontakt ohne Zell - Lyse zu ermöglichen. Bei der Zell-Zell-Fusion, kommen die Kerne in Kontakt und Karyogamie unterziehen. Ein prominentes dynein abhängigen Hin- und Her - Bewegung des Kerns in der Zygote (die Pferdeschwanzbewegung) fördert dann die Paarung von Chromosom Homologe 13,14, die durch Meiose folgt. Schließlich werden die vier Produkte der Meiose in einzelne Sporen während der Sporulation verpackt.
Aufgrund seiner Komplexität und der zahlreichen Schritte, die eine detaillierte Überwachung der Paarung wurde herausfordernd. Zwei bemerkenswerte Schwierigkeiten sind, dass der gesamte Prozess dauert mehr als 15 Stunden und die Zellen sind schwierig zu synchronisieren. Diese difficulties werden durch Einzelzell-Mikroskopie Ansätze umgangen. Hier ein allgemeines Protokoll der sexuellen Lebenszyklus in Spalthefe zu untersuchen, wird präsentiert. Mit kleineren Anpassungen, dieses Protokoll die Studie über die verschiedenen Schritte des Verfahrens ermöglicht, nämlich die Induktion von Paarungs Genprodukts, Zellpolarisation und Paarung zwischen Schwester-Zellen nach der Paarungstyp Schalten und zwischen Nicht-Schwester Partner, Zell-Zell-Fusion, und nach der Fusion Pferdeschwanzbewegung, Meiose und Sporulation. Dieses Verfahren ermöglicht auf 1) leicht sichtbar fluoreszent markierte Proteine im Laufe der Zeit vor, während und nach der Fusion; 2) unterscheiden, die das Verhalten von Zellen des entgegengesetzten Paarungstyps; und 3) messen und zu quantifizieren Parameter wie shmooing, Paarung, Fusion oder Sporulationseffizienz.
Protokoll
Mikroskopie Analyse von Spalthefe geschlechtliche Fortpflanzung
1. Medienvorbereitung
- Bereiten Minimum Sporulationsmedium (MSL-N) 15 durch Vermischen der folgenden Komponenten: Glucose: 10 g / L, KH 2 PO 4: 1 g / l, NaCl: 0,1 g / L, MgSO 4 · 7H 2 O: 0,2 g / L. Hinzufügen Spurenelemente (10.000X): 100 & mgr; l / L, Vitamine (1,000x): 1 ml / L und 0,1 M CaCl 2 ml / L. Filter-sterilisieren einen 0,22 um Porengröße Filter und Speicher unter Verwendung von bei Raumtemperatur (RT).
- Verwenden Sie die folgenden Vitamine (1,000x) Lager: Pantothenate: 1 g / l, Nicotinsäure: 10 g / l, Inositol: 10 g / l, Biotin: 10 mg / l. Filter-sterilisieren einen 0,22 um Porengröße Filter und Speicher unter Verwendung bei 4 ° C.
- Verwenden Sie die folgenden Spurenelemente (10.000fach) Lager: Borsäure: 5 g / l, MnSO 4: 4 g / l, ZnSO 4 · 7 H 2 O: 4 g / l, FeCl 2 · 6 H 2 O: 2 g / L , MoO 3: 0,4 g / L, KI: 1 g / l, CuSO 4· 5H & sub2 ; O: 0,4 g / L, Zitronensäure: 10 g / L. Filter-sterilisieren einen 0,22 um Porengröße Filter und Speicher unter Verwendung bei 4 ° C.
- Bereiten MSL-N 2% Agarose (Agarose verwendet pad Kammern bilden) durch Kombinieren von 10 ml MSL-N mit 0,2 g Agarose. Schmelzen Sie für ~ 2 min bei hoher Leistung in einem Mikrowellenofen bis Agarose löst und aliquote 0,5 ml in Mikrozentrifugenröhrchen. Lagern Sie bei RT.
- Bereiten Minimum Sporulationsmedium mit Stickstoff (MSL + N) aus MSL-N durch Zugabe von (NH 4) 2 SO 4: 1 g / L, Leucin: 0.225 g / L, Adenin: 0,225 g / l, Uracil: 0.225 g / L . Filter-sterilisieren einen 0,22 um Porengröße Filter. Lagern Sie bei RT.
Anmerkung: Leucine, Adenin und Uracil werden in diesem Medium zugesetzt, um das Wachstum von auxotrophen Stämmen zu ermöglichen. Zusätzliche Aminosäure Ergänzung sollte aufgenommen werden , wenn die verwendete Stamm einen deutlichen Auxotrophie trägt (zum Beispiel his3Δ). Bitte beachten Sie auch mit voll Prototroph Stämme, dass die Arbeit beachten wird empfohlen, da nursolche Stämme werden hohe Paarungseffizienz ermöglichen. - Bereiten Sie 200 ml VALAP für Kammerdichtung. In einem Becher hinzufügen gleichen Gewichten von Lanolin, Vaseline (oder andere Vaseline) und Paraffin. Wärme Mischung bei niedriger Temperatur und umrühren, bis sie gründlich vermischt. Aliquot der Mischung in mehrere kleine Petrischalen. Lagern Sie bei RT.
2. Anzucht Fission Hefestämmen für Mating Experimente (Abbildung 1).
- 1. Tag, Abend:
Impfen frisch ausgestrichenen Stämme aus festen Medien in Kulturröhrchen mit 3 ml MSL + N. Verwenden Sie Flachbodenröhrchen von etwa 2,5 cm Durchmesser. Verwenden Sie andere Kulturröhrchen oder Flaschen mit angepassten Kulturvolumen. Inkubieren über Nacht (O / N) mit bei 25 ° C Schütteln, 200 UpM. Wenn mit heterothallisch Stämme arbeiten, impfen getrennt.- Verdünnte Zellsuspensionen in Medien am nächsten Morgen um sicherzustellen , dass Kulturen optische Dichte bei 600 nm (OD 600) von 0,4 bis 0,8 am Abend , gemessen.
Hinweis:OD 600 Messungen als Proxy der Zellkonzentration für Spalthefe sind linear im Bereich von etwa 0,1-1,0. Für unsere Spektrophotometer OD 600 = 0,1 entspricht 1,4 x 10 6 Zellen pro ml. Wenn also Anfangs - OD 600 liest sind außerhalb dieses Bereichs Proben müssen für zuverlässige Messungen verdünnt / konzentriert werden.
- Verdünnte Zellsuspensionen in Medien am nächsten Morgen um sicherzustellen , dass Kulturen optische Dichte bei 600 nm (OD 600) von 0,4 bis 0,8 am Abend , gemessen.
- Tag 2, Abend:
Verdünnte Zellen in 20 ml MSL + N Medien 600 = 0,025 in 100 ml - Kolben zu Od. Inkubieren Stämme O / N bei 30 ° C, 200 Umdrehungen pro Minute.
Hinweis: Wildtyp - Zellkulturen sollte OD 600 ~ 0,8 am nächsten Morgen (15 Stunden später) zu erreichen. Bei der Arbeit mit den Stämmen mit längeren Generationszeit entsprechend anpassen Verdünnung. - Tag 3, Morgen:
Messen Sie 600 OD , um zu überprüfen , dass Kulturen Zelldichte von OD 600 ~ 0,8 haben. Wenn mit heterothallisch Stämme arbeiten, die gleiche Anzahl von Partnerzellen mischen. Pellet-Zellen bei 1000 × g und in ein 1,5 mlTube. Wasche die Zellen dreimal in 1 ml MSL-N-Medium. Re-suspendieren Zellen in 3 ml MSL-N Medium und Zellen zu verdünnen 600 = 1,5 bis Od.- Zur Paarung zwischen Schwesterzellen Zellen direkt für die Bildgebung Halter (siehe Protokoll Abschnitt 2.4) zu überwachen. Verwenden Sie homothallisch H90 - Stämme, bei dem Paarungstyp Schalten findet während der mitotischen Teilungen nehmen nach dem Stickstoffentzug auftreten. Sofortige Montage von Zellen auf der Agarose-Pad ist sichergestellt, dass nach der Zellteilung, Schwester-Zellen nebeneinander bleiben.
- Zellpolarisation (Sondierungsdynamik und shmooing) inkubieren 1-3 ml Zellkultur für die Bildgebung bei 30 ° C, 200 Upm für 3-4 Stunden vor der Montage Zellen zu überwachen. Innerhalb dieser 3-4 Stunden wird sich die letzte mitotische Teilung aufgetreten. Einige Zellen haben Polarisation eingeleitet, aber die meisten werden nur ihre Sondierungspolarisationsdynamik beginnen.
- Zur Überwachung der Zell-Zell-Fusion 1-3 ml Zellkultur bei 30 ° C, 200 Upm für 4-6 h pri inkubierenoder an Zellen für die Bildgebung Montage.
- Zu überwachen post-Fusionsereignisse inkubieren 1-3 ml der Zellkulturen bei 30 ° C, 200 Upm für 8 Stunden vor der Zellen für die Bildgebung Montage.
- Zur Überwachung Reaktion auf eine bestimmte Pheromonkonzentration (nur für heterothallisch Stämme) inkubieren 3 ml der Zellkultur bei 30 ° C, 200 Upm für 3-4 Stunden vor der Zellen für die Bildgebung Montage.
- Entfernen Sie die MSL-N-haltige Mikrozentrifugenröhrchen aus dem 95 ° C Wärmeblock (siehe Protokoll Abschnitt 2.4.1. Unten). In P-Faktor oder M-Faktor bei der direkt im geschmolzenen MSL-N Agarose gewünschte Konzentration. Gut mischen durch Vortexen bevor sofortige Pad Vorbereitung.
- Nach der Zellmontage, Inkubation vor der Bildgebung das Pad für 15-30 min bei 25 ° C. P-Faktor und Faktor M-Pheromone wurden aus einer Stammlösung von 1 mg / ml in Methanol verwendet.
Hinweis: Wenn mit mutierten Arbeits Stämme Inkubationszeiten variieren. Verklumpung der Zellen kann nach längerer Inkubation in flüssiger m auftretenedia und kann besonders stark sein, in einigen mutierten Stämmen. Verklumpten Zellen können nicht auf Agarose-Pads in einer einzigen Schicht gesichtet werden und somit schwer zu Autofokus und Bild. Bei umfangreichen Zelle Verklumpung Halterung Zellen auf Agarose-Pads sofort nach Waschungen und Resuspension in Stickstoff-fehlt-Medien (wie im Protokoll Abschnitt 2.3.1.) Und inkubieren bei 30 ° C vor der Bildgebung.
- Montagezellen für Imaging:
- Bereiten MSL-N Agarose Kissen 16 , indem ein Aliquot in einem 95 ° C-Wärmeblock für 10-15 min Aufschmelzen und Zugabe von 200 & mgr; l zwischen zwei Glasobjektträger getrennt durch Abstandshalter (1B). Verwenden Abstandshalter mit einer Dicke von ~ 0,5 mm. Um Verbreiterungen machen, aus Pappe, wie die Verwendung Streifen mit Restriktionsenzymen geliefert geschnitten.
- Pellet 100 ul Zellen bei 1.000 × g für 1 min, um den Überstand zu entfernen und erneut zu suspendieren Zellen in Rest 2-4 & mgr; l Medium. Sie NICHT in frischem Medium erneut zu suspendieren, wie es verzögertPaarung.
- Nach 2-3 min sorgfältig Abstandhalter entfernen und die obere Glasträger. Wenn mehrere Stämme zu montieren sind, bereiten die Zelle konzentriert sich vor der Agarose-Pad vor.
- 1 & mgr; l der Zellen mit dem Pad und warten, bis der Tropfen Trocknen beginnt (~ 1 min), bevor sie mit Deckglas bedeckt und Abdichten mit VALAP.
- Lassen Sie die Unterlage für mindestens 30 min vor der Bilderzeugung bei 25 ° C oder RT sitzen.
- Zu einer Mischung von Zellen in verschiedenen Stadien der Paarung zu erhalten, machen Sie ein Pad sofort nach Waschungen in MSL-N (siehe Abschnitt 2.3.) Und Inkubation bei 18 ° CO / N (~ 15 h). Dieser Ansatz ist nützlich für die Zellen an unterschiedlichen Paarungs Phasen mit hoher zeitlicher Auflösung oder Proben mit schwachem Signal Bildgebung.
3. Bildgebung lebender Zellen von Mating-Hefezellen
- Justieren Sie Bildaufnahme-Einstellungen.
Hinweis: Die Bildaufnahme-Einstellungen hier vorgestellt wurden für die Deltavision-Plattform optimiert, bestehend aus einem maßgeschneiderten Olympus IX-71inverses Mikroskop mit Plan Apo 60x / 1,42 NA oder U-Plan Apo 100X / 1.4 NA Ziele, eine CoolSNAP HQ2 Kamera und einen Einblick SSI 7 Farbe kombinierte Einheit Illuminator. Die Hardware wird durch Softworx V4.1.2 gesteuert, die auch digital Autofokus ermöglicht.- Sicherzustellen, dass die Autofokus-Intervalle nicht überschreiten 15 min, da die Z-Drift über längere Zeit die Kapazität der Software Autofokussierungssystem übertreffen können. Bei Verwendung eines Hardware-basierten Autofokus-System, verwenden Sie größere Intervalle.
- Stellen Sie Imaging-Intervall. Nehmen Sie Bilder alle 10 Minuten für ~ 15 Stunden als Ausgangspunkt, wenn sie mit einem fluoreszierend markierten Proteins zum ersten Mal arbeiten. Dieses Intervall bietet einen guten Überblick über den gesamten Paarung ohne umfangreiche Bleichen.
- Bild mit 5-Minuten-Intervallen oder zu verkürzen, genauer Zeitereignisse wie Fusion. Kürzere Intervalle erfordern starke Fluorophore ermöglicht niedrige Belichtungszeiten und wenig Bleichen. Für die Bildgebung mit Abständen von weniger als 1 min vermeiden O / N-Mikroskopieund stattdessen eine Mischung aller Paarungsstufen herzustellen, wie in Protokoll Abschnitt 2.4.6 beschrieben.
- Passen Sie die Bildbelichtungszeit. Test-Belichtungszeiten zwischen 50 und 300 ms. Richten Sie ein Gleichgewicht zwischen dem Signal-zu-Rausch-Verhältnis und Photobleaching zu schlagen, wie eine große Anzahl von Zeitpunkten mit einem wahrnehmbaren Signal (in der Regel mehr als 100) zu erreichen.
- Stellen Sie Z-Schnitte. Abschnitte alle 0,3 & mgr; m Abdeckung 5 & mgr; m bieten eine gute Bildtiefe. Beachten Sie, dass Z-sectioning weitere Erhöhungen photo Schäden, die durch Verwendung der OAI (optische Achse Integration - eine einzige Sweep Erwerb der gesamten Probentiefe) minimiert werden kann. Gute Autofokus-System reduziert die Notwendigkeit von vielen Z-Abschnitte und ist sehr zu empfehlen.
- Tipps Paarungstyp-spezifischen Verhaltensweisen zu studieren:
- Für heterothallisch Stämme verwenden h- und h + Zellen unterschiedliche Fluorophore exprimieren, so daß die zwei Zelltypen unterschieden werden können. Verwenden Sie eine beliebige genetisch kodierte fluorophowieder als cytosolische Version oder Fusion an ein endogenes Protein exprimiert, obwohl wir mit sfGFP guten Erfolg gehabt haben, eine schnelle Faltungs Variante von GFP 17. Endogene Proteine werden in der Regel an ihren endogenen genomischen Locus durch homologe Rekombination 14 markiert.
- Für homothallischen Stämmen exprimieren, jeweils eine genetisch kodierte cytosolischen fluoreszierendes Protein unter der Kontrolle des Paarungstyp spezifischen Promotoren , wie jene der Pheromon - Rezeptor - Gene map3 und MAM2 die Expression in P und M - Zellen zu treiben. Die Promotoren von map3 und MAM2 inaktiv sind während des vegetativen Wachstums und zeichnen sich bei Stickstoffmangel 18,19 induziert. Konstrukten Antreiben der Expression der cytosolischen GFP oder mCherry unter der Kontrolle dieser Promotoren werden typischerweise in einer genomischen Locus (ura4, leu1) integriert ist, die nicht mit dem normalen Verlauf des Sexuallebens Zyklus 12 nicht stört.
- Verwendung Paarungstyp spezifischen zytosolischen Fluorophore (wie in Abschnitt 3.2.2 Protocol) genaue Zeitpunkt der Zellfusion als die Übertragung von Fluoreszenzsignals von einer Partnerzelle zur anderen sichtbar zu bestimmen.
4. Quantifizierung der Paarung und Fusion Effizienzen
- Paarung und Fusionseffizienzen 11,12, Spot - Zellen direkt nach der MSL-N waschen auf MSL-N Agarose - Pads, wie in Schritt 2.3.1 oben, und lassen Sie für 24 Stunden bei 25 ° C vor der Bildgebung (Abbildung 1A) zu quantifizieren. Unter Verwendung dieses Protokolls ein homothallisch Wildtyp-Stamm Paarungseffizienz ~ 60% und Fusionseffizienz von 99% erreicht. Um zu testen, ob eine Reduzierung dieser in mutierten Stämmen beobachteten Werte spiegeln ein Terminal Phänotyp oder eine Verzögerung, wiederholen Sie den Versuch mit einer 36 Stunden Inkubationszeit.
- Berechnen Paarungseffizienz als
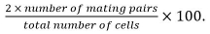 Mating Paare umfassen Zygoten, Asci, und nicht fusionierten Zellpaare identifiziert ausihre Position und das Wachstum gegenüber der jeweils anderen.
Mating Paare umfassen Zygoten, Asci, und nicht fusionierten Zellpaare identifiziert ausihre Position und das Wachstum gegenüber der jeweils anderen. - Berechnen Fusionseffizienz als
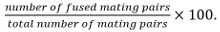
Anmerkung: Fused Paarungspaare durch ihre Fähigkeit identifiziert werden, Sporen zu bilden, wenn bekannt ist, dass die Mutante zu untersuch nicht Sporulation nicht beeinflusst. Wenn Sporulation nicht als Auslesen verwendet werden, Fusion wird durch die Beobachtung der Ausbreitung eines cytosolischen Marker in nur einem Paarungspartner in die beiden Partner bestimmt.
Ergebnisse
Fission Yeast Wachstum und Mating Dynamics nach der Entfernung einer Stickstoffquelle
Als Stickstoffmangel eine Voraussetzung für die Einleitung der sexuellen Fortpflanzung in Spalthefe ist, wurde Wildtyp homothallisch H90 - Stamm bei Verschiebung von stickstoffreichen bis 1 Stickstoff entzogen Medium (Abbildung 2), nach dem Protokoll skizziert in Abbildung überwacht. Kurz gesagt, Zellen O / N wurden auf exponentiellen ...
Diskussion
Umweltbedingungen und Nährstoffverfügbarkeit insbesondere beeinflussen stark die Spalthefe Physiologie. Stickstoffmangel ist notwendig , um Engagement für die sexuelle Fortpflanzung und zunächst führt zu spektakulären Veränderungen in der mitotischen Zellzyklus - Progression (Ref. 21 und Abbildung 2). Bei Stickstoffentfernung aus exponentiell wachsenden Bevölkerung, bei Teilung der Zellgröße schnell abnimmt (2C) und die Mehrzahl der Zellen verhaften mitotischen Prog...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
AV wurde durch ein EMBO langfristigen Postdoc-Stipendium unterstützt. Die Forschung im Labor Martin wird durch einen ERC Starting Grant (GeometryCellCycle) und einer Schweizerischen National Science Foundation Grant (31003A_155944) zu SGM finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
Referenzen
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten