需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
裂殖酵母性生命周期的显微镜
摘要
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
摘要
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
引言
虽然两个小区之间的基因交换是有性繁殖中心事件,它依赖于促进细胞分化,允许合作伙伴的选择,进行细胞 - 细胞融合和维持基因组稳定性的事件链。因而性生命周期呈现本身作为一个模型系统以研究了许多关于发育开关生物学问题,响应于外在刺激,质膜融合,染色体分离等探索裂殖酵母性周期来研究这些现象带来的好处模型系统强大的基因,建立了完善的高通量的方法和先进的显微镜。性裂殖酵母是P细胞和不同交配类型的M-细胞之间的异型事件。两种细胞类型中差异表达许多基因1,2-包括那些用于生产分泌P-的和M-外激素,信息素受体MAP3和Mam2以及信息素山龙眼的SES Sxa1和Sxa2。同宗配合菌株,如常用的H90株,携带两种交配型的遗传信息在单个基因组和细胞经历的交配型开关在整个分裂周期(在文献3中综述)的复杂模式。异宗裂殖酵母的多个分离物很少或从不切换交配型也是常用的4,最突出的是H + N(P型)和h -S(M型)的菌株。
在裂殖酵母,进入生命周期中的性正在严格的营养调控。只有氮饥饿裂殖酵母细胞有丝分裂逮捕繁殖和产生扩散信息素信号交配伴侣的存在和推广性周期(参考文献5审查)的进一步措施。氮剥夺脱阻抑交配Ste11的关键转录调节充当发育开关并促进È交配特定基因,包括信息素受体 和信息素产生的基因6,7的表达。信息素受体 参与激活受体偶联蛋白G-alpha和下游MAPK信号进一步增强Ste11转录活性8-10,从而增加交配伙伴之间的正反馈信息素的生产。信息素水平是通过调节细胞极性,卢家族GTP酶Cdc42的11的主组织者诱发不同的细胞极化状态至关重要。在暴露于低信息素浓度,活性的Cdc42被可视动态补丁探索细胞外围,并且没有细胞生长在此阶段观察到。增加信息素水平促进Cdc42活性的稳定到一个区和一个偏振投影的生长,称为SHMOO,这使伴侣细胞在接触。随后,两人单倍体交配伴侣融合形成二倍体合子。最近的研究表明日Ë存在一个新颖的肌动蛋白结构融合基本是由配合诱导formin FUS1 12组装的。这种融合焦点集中型-V的肌球蛋白依赖性过程并定位细胞壁降解机械,从而使细胞壁重塑,以允许无细胞裂解12质膜接触。在细胞 - 细胞融合,核所接触并进行核融合。受精卵(马尾巴的运动)的内部核心的一个突出动力蛋白依赖的背部和往复运动进而促进染色体同源13,14,随后是减数分裂的配对。最后,四款产品减数分裂的孢子时打包成单个孢子。
由于其复杂性和所涉及的许多步骤中,交配的详细监测已具有挑战性。两个显着的困难是,整个过程需要以及超过十五小时,使细胞难以同步。这些ðifficulties由单细胞显微镜方法规避。在这里,一般的协议,调查裂殖酵母的性周期呈现。用小的调整,此协议允许的所有不同的步骤的过程中,配合基因产物,交配型切换之后姐妹细胞非姐姐伙伴之间和之间细胞极化和配对,细胞 - 细胞融合的即感应的研究,和后融合的马尾巴的运动,减数分裂和孢子。此方法允许1)轻松地可视化荧光标记的蛋白随着时间的推移售前,售中和融合后; 2)鉴别相反交配型的细胞的行为;和3)测量和量化参数,如什穆,交配,融合或孢子形成的效率。
研究方案
裂殖酵母的有性繁殖的显微镜分析
1.媒体准备
- 葡萄糖:10克/升,KH 2 PO 4:1克/升,氯化钠:通过混合以下组分制备的最小孢子形成培养基(MSL-N),15为0.1g / L时,用MgSO 4·7H 2 O 0.2克/ L.添加痕量元素(10000):100微升/升,维生素(1000倍)1毫升/升,和0.1M的CaCl 2 毫升/升。过滤消毒用0.22微米孔径的过滤器,并储存于室温(RT)。
- 使用下面的维生素(1000倍)的股票:泛酸钙1克/升,烟酸:10克/升,肌醇:10克/升,生物素:10毫克/升。过滤消毒用0.22微米孔径的过滤器和储存在4℃。
- 使用下面的微量元素(10000)股票:硼酸5克/ L,硫酸锰4:4克/升,硫酸锌4·7H 2 O:4克/升,氯化铁2·6H 2 O:2克/升,的MoO 3:0.4克/升,碘化钾1克/升, 硫酸铜·5H 2 O:0.4克/升,柠檬酸:10克/升。过滤消毒用0.22微米孔径的过滤器和储存在4℃。
- 10毫升MSL-N与0.2克琼脂糖结合准备MSL-N琼脂糖2%(用来制造的琼脂糖凝胶垫室)。熔融一种用于在微波炉中于高功率〜2分钟,直到琼脂糖溶解并等份0.5毫升在微量离心管中。存放在室温下。
- 制备用氮气(MSL + N)从MSL-N的最小孢子形成培养基中加入(NH 4)2 SO 4:1克/升,亮氨酸:0.225克/升,腺嘌呤:0.225克/ L尿嘧啶:0.225克/升。过滤消毒使用0.22微米孔径的过滤器。存放在室温下。
注意:亮氨酸,腺嘌呤和尿嘧啶加入到该培养基中,以允许营养缺陷型菌株的生长。附加氨基酸补充应包括如果所使用的菌株携带不同的营养缺陷型(例如his3Δ)。请注意具有完全养型菌株的工作建议,因为只有这种菌株将允许高效率的交配。 - 准备200毫升VALAP为室的封闭。在烧杯中添加羊毛脂,凡士林(或其它凡士林)和石蜡的相等权重。在低温热混合并搅拌,直到偶尔充分混合。分装组合成几个小的培养皿中。存放在室温下。
2.培养裂殖酵母的菌株进行交配实验(图1)。
- 每日1次,晚上:
从接种固体培养基新鲜的划线株到装有3毫升的MSL + N培养管。使用约2.5厘米直径的平底管。使用其他培养管或瓶用适合培养体积。孵育过夜(O / N),在25℃,200rpm振荡。如果有异宗株工作,分别接种。- 稀释细胞悬液媒体第二天早晨,确保文化都有光密度在晚上的0.4-0.8 600纳米(OD 600)测量。
注意:OD 600测量的细胞浓度为裂殖酵母的代理都在大约0.1-1.0的范围内呈线性关系。对于我们的分光光度计OD 600 = 0.1对应于每毫升1.4×10 6个细胞。因此,如果初始OD 600读取该范围外的样品需要稀释/浓缩对可靠的测量。
- 稀释细胞悬液媒体第二天早晨,确保文化都有光密度在晚上的0.4-0.8 600纳米(OD 600)测量。
- 第2天,晚上:
稀释细胞在20ml的MSL + N媒体来OD 600 = 0.025在100毫升的烧瓶中。株孵育O / N在30℃,200转。
注:野生型细胞培养应达到OD 600〜0.8第二天早上(15小时后)。如果用更长的生成时间株的工作进行相应调整的稀释。 - 3日,上午:
测量外径600来验证的文化有外径600〜0.8的细胞密度。如果有异宗株工作,混合伴侣细胞的数目相等。沉淀的细胞以1000 xg离心并转移到1.5ml的管。洗涤细胞三次在1ml MSL-N培养基。重悬的细胞在3ml MSL-N培养基中并稀释细胞至OD 600 = 1.5。- 为了监测妹妹细胞之间的交配直接安装细胞成像(见协议第2.4节)。使用同宗配合H90株,其中氮剥夺后出现的有丝分裂过程中交配型开关会发生。在琼脂糖垫细胞直接安装确保了细胞分裂后,姐妹细胞保持彼此相邻。
- 监测细胞极化(探索性动力学和什穆)孵育1-3毫升细胞培养物在30℃,200rpm下为3-4安装细胞之前用于成像小时。在这些3-4小时,最后有丝分裂会时有发生。一些细胞会已经开始两极分化,但大部分将只是开始他们探索的极化动态。
- 监测细胞 - 细胞融合孵育1-3毫升细胞培养物在30℃,200rpm下4-6小时PRI或安装细胞成像。
- 监视 融合后事件孵育在30℃下1-3毫升细胞培养物,200转用于安装细胞成像前8小时。
- 并监控响应于特定的信息素浓度(仅用于异宗株)孵育3毫升细胞培养物在30℃,200rpm下3-4小时之前安装细胞成像。
- 请从95℃加热块含有MSL-N-离心管(见协议2.4.1节。下同)。在所需的浓度直接在熔融MSL-N琼脂糖添加的P-因子或M-因子。通过直接垫前的准备涡旋拌匀。
- 电池安装后,在25℃反应垫15-30分钟成像之前。 P-因子和M-因子信息素是从1毫克/毫升在甲醇中的储备液使用。
注意:如果用突变型工作菌株的培养时间可以变化。在液态间延长温育后,可能会发生细胞凝集EDIA并可能在某些突变株特别强。成群细胞不能在单层点样到琼脂糖垫,因此很难进行自动对焦和图像。在广泛的细胞聚集的情况下,安装在琼脂糖垫细胞洗涤之后立即以及在氮缺乏媒体重新悬浮(如在协议第2.3.1。),并在30℃下成像之前孵育它们。
- 安装成像单元格:
- 通过在95℃加热块熔化的等分试样10-15分钟,加入由隔离物( 图1B)分隔开的两个载玻片之间将200μl制备的MSL-N琼脂糖垫16。使用间隔物的厚度约0.5毫米。使间隔件,使用条带切出的纸板,如用限制性酶递送。
- 沉淀100μl的细胞在1,000×g离心1分钟,除去上清液并重新悬浮于剩余的2-4微升培养基的细胞。在新鲜培养基不要再暂停,因为它延缓交配。
- 2-3分钟后小心地取出垫片和顶部的玻璃幻灯片。如果几株要安装,准备准备琼脂糖垫前的细胞集中。
- 加入1μl细胞对垫,等待下跌始于盖玻片覆盖,并与VALAP密封前干燥(约1分钟)。
- 让垫在25℃或RT坐成像前至少30分钟。
- 以获得在交配的不同阶段的细胞的混合物,使一个垫立即在MSL-N(见2.3节)。洗涤后,在18°的CO / N(〜15小时)下孵育。这种方法是在具有高时间分辨率和样品信号弱的不同阶段交配细胞成像有用。
交配的酵母细胞3.活细胞成像
- 调整图像采集设置。
注意:这里介绍的图像采集设置定制奥林巴斯IX-71组成的DeltaVision平台进行了优化倒置显微镜载脂蛋白计划60X / 1.42 NA或U计划阿婆100X / 1.4 NA目标,一个CoolSNAP HQ2照相机和洞察SSI 7种颜色组合单元发光。硬件是由softWoRx V4.1.2也使数字自动对焦控制。- 确保自动对焦间隔不超过15分钟,因为在Z漂移在更长的时间可以超越该软件自动对焦系统的容量。如果使用基于硬件的自动对焦系统,使用较大的区间。
- 调整摄像间隔。用荧光标记蛋白的第一次工作时拍摄图像每10分钟为〜15小时为起点。这个间隔提供整个交配过程中没有广泛漂白一个很好的概述。
- 图像用5分钟间隔或更短更精确的时间的事件,如融合物。更短的间隔需要强大的荧光,从而使低曝光时间和小漂白。对于低于1分钟,避免O / N显微镜成像时间间隔而是准备所有配合阶段的混合物作为在协议第2.4.6节详细描述。
- 调整图像的曝光时间。 50和300毫秒之间测试的曝光时间。旨在撞击信噪比和漂白之间的平衡作为具有可辨别信号(典型地超过100个),以实现大量的时间点。
- 调整Z-切片。每节0.3微米占地5微米提供了良好的成像深度。注意,Z-切片进一步增加光损伤,这可以通过使用OAI(光轴集成 - 单次扫描采集的总样本深度的)最小化。良好的自动对焦系统,减少了许多Z-部分的需求,并强烈推荐。
- 小贴士研究特定型交配行为:
- 为异宗菌株,使用H-和h +细胞表达不同的荧光团,以便两种细胞类型可以区分开来。使用任何基因编码的fluoropho重新表现为胞质版本或融合到一个内源性蛋白,虽然我们曾与sfGFP,GFP 17的快速折叠变种良好的成功。内源性蛋白通常通过同源重组14标记在它们的内源基因组基因座。
- 为同宗配合菌株,表达交配型特异性启动子的控制下的基因编码的胞质荧光蛋白如信息素受体 基因MAP3和mam2的驱动在P和M细胞中的表达,分别。 MAP3和mam2的启动子是营养生长过程中无效,对氮饥饿18,19引起的。构建这些启动子的控制下,驱动胞质GFP或mCherry的表达通常集成在一个基因座(ura4,LEU1)不与性生活周期12的正常进展干扰。
- 使用交配型特异性胞质荧光团(如在协议第3.2.2节)确定形象化为荧光信号从一个伴侣细胞转移到另一个细胞融合的精确定时。
4.配合和融合效率的量化
- 为了后直接MSL-N量化交配和融合的效率11,12,现货细胞洗到MSL-N琼脂糖片,如上面的步骤2.3.1,并在25℃前成像( 图1A)放置24小时。使用这种协议的同宗配合野生型菌株交配效率达到〜60%,融合效率99%。为了测试在突变株观察到的这些值的任何降低是否反映终端表型或延迟,重复使用36小时的培养时间的实验。
- 计算交配效率
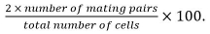 交配对包括受精卵,ASCI,并确定了非融合细胞对他们对彼此的地位和增长。
交配对包括受精卵,ASCI,并确定了非融合细胞对他们对彼此的地位和增长。 - 计算融合效率
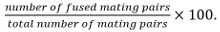
注:熔融接合对由它们如果已知该所研究的突变体不影响芽孢形成孢子的能力来鉴定。如果孢子形成不能被用作读出,融合是通过观察在只有一个配合伙伴表示成两个伙伴胞质标记的扩展来确定。
结果
裂殖酵母生长和配套动力一旦氮源的去除
作为氮饥饿是用于裂殖酵母有性生殖的起始的一个先决条件,野生型同宗配合H90菌株在从氮剥夺介质的富氮( 图2)移位监视,以下在图1中所概述的协议。简言之,将细胞在MSL + N培养基中生长的O / N至指数期(OD 600 = 0.5),收集,洗涤并再悬浮于MSL-N液体培养基至最终OD 600 = 1.5。...
讨论
环境条件和养分有效性,特别是强烈地影响裂殖酵母生理学。氮饥饿是必要的承诺有性生殖,最初导致在有丝分裂细胞周期进展引人注目的变化(参考文献21和图2)。在从指数增长的人口脱氮,在分裂细胞体积迅速降低( 图2C)和大部分细胞有丝分裂逮捕比进展新生成倍增长的细胞(参考文献21和图2D)的长度短。由于对面交配类型的细胞有?...
披露声明
The authors declare that they have no competing financial interests.
致谢
AV是由EMBO长期博士后奖学金支持。研究马丁实验室由ERC启动赠款(GeometryCellCycle)和瑞士国家科学基金会资助(31003A_155944),以SGM资助。
材料
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
参考文献
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。