Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bölünme Maya Cinsel Yaşam Döngüsü Mikroskopi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
We provide a reproducible basic method for the long-term microscopy of the fission yeast sexual lifecycle. With minor adjustments described, the presented protocol allows research focus on different steps of the reproductive process.
Özet
The fission yeast Schizosaccharomyces pombe has been an invaluable model system in studying the regulation of the mitotic cell cycle progression, the mechanics of cell division and cell polarity. Furthermore, classical experiments on its sexual reproduction have yielded results pivotal to current understanding of DNA recombination and meiosis. More recent analysis of fission yeast mating has raised interesting questions on extrinsic stimuli response mechanisms, polarized cell growth and cell-cell fusion. To study these topics in detail we have developed a simple protocol for microscopy of the entire sexual lifecycle. The method described here is easily adjusted to study specific mating stages. Briefly, after being grown to exponential phase in a nitrogen-rich medium, cell cultures are shifted to a nitrogen-deprived medium for periods of time suited to the stage of the sexual lifecycle that will be explored. Cells are then mounted on custom, easily built agarose pad chambers for imaging. This approach allows cells to be monitored from the onset of mating to the final formation of spores.
Giriş
İki hücre arasındaki genetik değişim eşeyli üreme merkezi olay olmasına rağmen, hücre farklılaşmasını teşvik ortağı seçimi için izin hücre-hücre füzyonu yürütmek ve genomik istikrarı korumak olaylar zincirinin dayanmaktadır. Böylece cinsel yaşam döngüsü gelişimsel anahtarları ile ilgili biyolojik bir dizi soru incelemek için bir model sistem olarak kendini göstermektedir, fisyon maya bu olguları incelemek için cinsel döngüsü keşfetmek vb dışsal uyaranlara, plazma membran füzyon, kromozom ayrımı, yanıt faydalarını getirir Model sisteminin güçlü genetik, yüksek verimli yaklaşımları ve sofistike mikroskopi köklü. fisyon maya Sex P-hücre ve farklı çiftleşme tipleri M-hücre arasında bir heterotypic olaydır. İki hücre tipleri farklı olarak salgılanan P- üretim ve M-feromonlar, feromon-reseptörleri map3 ve Mam2 yanı sıra feromon-protea için olanlar da dahil olmak üzere genlerin 1,2 bir dizi ifadeses Sxa1 ve Sxa2. Bu yaygın olarak kullanılan H90 suşu olarak Homothallic suşlar, tek genomunda her iki geçme tip genetik bilgi taşıyan ve hücreler (Ref. 3 gözden) mitotik yaşam döngüsü boyunca birleşme tipi anahtarlama karmaşık bir desen geçer. Nadiren veya hiç çiftleşme türünü değiştirmek heterothallic fisyon maya Çoklu izolatlar da yaygın en belirgin, h + N (P-tipi) ve h -S (M-tipi) suşları 4 kullanılmaktadır.
fizyon maya, cinsel yaşam döngüsü içine giriş katı besin yönetmelik altındadır. Sadece azot hasret fisyon maya hücreleri mitotik üreme tutuklama ve bir çiftleşme partneri varlığına işaret ve (Ref. 5 gözden) cinsel döngünün ilave adımlar teşvik etmek yayılabilir feromonlar üretir. Azot yoksunluk gelişimsel anahtarı olarak görev yapar ve e-teşvik çiftleşme Ste11 anahtar transkripsiyonel regülatör de-bastıranferomon reseptörü ve Ferromon üretim genleri 6,7 dahil olmak üzere belirli genleri çiftleşme XPression. Feromon-reseptör nişan ayrıca böylece çiftleşme ortakları arasında pozitif geribildirim feromon üretimin artırılması, Ste11 transkripsiyonel aktivitesini 8-10 artırır reseptör-birleştiğinde protein G-alfa ve aşağı MAPK sinyallerini harekete geçirir. Feromon seviyeleri hücre polarite, Rho-aile GTPaz Cdc42 11 master organizatörü düzenleyerek farklı hücre polarizasyon durumları ikna etmek için çok önemlidir. Düşük feromon konsantrasyonlarına maruz kaldıktan sonra, aktif Cdc42 hücre kenarına keşfetmek dinamik yamalar görüntülenmiştir, ve hücre büyümesi, bu aşamada görülmektedir. Artan feromon düzeyleri tek bölge ve polarize projeksiyon büyümesine Cdc42 aktivitesinin istikrar teşvik temas ortak hücrelerini getiren Shmoo olarak adlandırılan. Daha sonra, iki haploid çiftleşme ortakları diploid zigot oluşturmak için sigorta. Son çalışmalar th ortayaçiftleşme kaynaklı formin FUR1 12 tarafından monte edilir füzyon için gerekli yeni bir aktin yapısının e varlığı. Bu füzyon odak böylece hücre lizizi 12 olmadan plazma zarı temasa izin hücre duvarının biçimlenme sağlayan tip V miyosin sürece bağlı olarak, konsantre ve hücre duvarı bozunma amaçlı konumlandırır. Hücre-hücre füzyon üzerine, çekirdekler temas ve karyogamy geçer. Zigot (at kuyruğu hareket) içindeki çekirdeğin önde gelen bir dynein bağımlı ve geri ileri hareketi daha sonra mayoz tarafından takip edilir kromozom homologlarının 13,14, eşleştirme teşvik etmektedir. Son olarak, mayoz dört ürün sporlanma sırasında bireysel sporların içine paketlenir.
Çünkü onun karmaşıklığı ve ilgili sayısız adımlar, çiftleşme detaylı izleme zorlu olmuştur. İki önemli zorluklar tüm süreci iyi on beş saatten fazla sürdüğünü ve hücrelerin senkronize etmek zor olmasıdır. bu difficulties tek hücreli mikroskopi yaklaşımlarla hile vardır. İşte genel bir protokol fisyon maya cinsel yaşam döngüsü sunulmaktadır araştırmak. küçük ayarlamalar ile, bu protokol sürecinin tüm farklı aşamalarında, çiftleşme gen ürünü olmayan kardeş ortakları çiftleşme tipi anahtarlama sonra kardeş hücreler arasında ve hücre kutuplaşma ve eşleştirme, hücre-hücre füzyon yani indüksiyon çalışmasına izin verir, ve post-füzyon at kuyruğu hareket, mayoz ve sporulasyon. Bu yöntem kolayca görselleştirmek floresan sırasında ve sonrasında füzyon, zaman önceden üzerinde etiketli proteinlerin) 1 olanak sağlar; 2) karşıt çiftleşme Çeşidi hücrelerin davranışını ayırt; ve 3) ölçü ve shmooing, çiftleşme, füzyon ya da sporlaşma verimliliği gibi parametreleri ölçmek.
Protokol
fizyon maya eşeyli üreme Mikroskopi analizi
1. Medya Hazırlık
- Glukoz: 10 g / L, KH 2 PO 4: 1 g / L, NaCl: birbirine karıştırılmasıyla az sporlaşma ortamının (MSL-H) 15 Hazırlama 0.1 g / L, MgSO 4 · 7H 2 A: 0.2 g / L. Ekleme Eser elementler (10,000X): 100 ul / L, vitaminler (1,000x): 1 ml / l ve 0.1 M CaCl2 mL / L. oda sıcaklığında (RT) 0.22 mikron gözenek boyutu filtre ve mağaza kullanarak Filtre sterilize.
- Aşağıdaki Vitaminler kullanarak (1,000x) hazır: Pantotenat: 1 g / L nikotinik asit: 10 g / L, inozitol: 10 g / L, Biyotin: 10 mg / l. 4 ° C de 0.22 mikron gözenek boyutlu filtre ve mağaza kullanılarak filtre-sterilize edin.
- Borik Asit: 5 g / L, MnSO 4: 4 g / L, ZnSO 4 · 7H 2 O: 4 g / L, FeCl 2 · 6H 2 O: 2 g / L aşağıdaki İz elementler (10,000X) stok kullanın MoO 3: 0.4 g / L, ki: 1 g / L, CuSO 4· 5H 2 A: 0.4 g / L, Sitrik asit: 10 g / L. 4 ° C de 0.22 mikron gözenek boyutlu filtre ve mağaza kullanılarak filtre-sterilize edin.
- Agaroz 0.2 g MSL-10 ml N birleştirerek MSL-N agaroz (agaroz pedi odaları yapmak için kullanılan)% 2 hazırlayın. mikrosantrifüj tüpleri içinde agaroz çözünene ve kısım 0.5 ml kadar mikrodalga fırında yüksek güçte yaklaşık 2 dakika boyunca eritin. Oda sıcaklığında saklayın.
- 1 g / L, Lösin: 0.225 g / L adenin: 0.225 g / L, urasil: (NH4) 2 SO4 eklenerek nitrojen MSL-N (MSL + H) En az sporlaşma ortamının hazırlanması 0.225 g / l . 0.22 mikron gözenek boyutu filtre kullanarak filtre sterilize edin. Oda sıcaklığında saklayın.
Not: Lösin, adenin ve urasil oksotropik türlerinin büyümesini sağlamak için bu ortama eklenir. Kullanılan soy (örneğin his3Δ için) ayrı bir oksotrofi taşıyan, ek amino asit takviyesi dahil edilmelidir. Ayrıca tamamen Prototrofuna suşları ile bu işi lütfen unutmayın yalnızca, tavsiye edilirBu tür suşlar yüksek çiftleşme verimlilik sağlayacaktır. - kamara sızdırmazlık için 200 ml valap hazırlayın. beher Lanolin, vazelin (ya da diğer vazelin) ve Parafin eşit ağırlık eklemek. İyice karışana kadar ısı, düşük sıcaklıkta Karışım ara sıra karıştırıldı. Birkaç kültür kaplarına karışımı kısım. Oda sıcaklığında saklayın.
Çiftleşme Deney 2. Kültürleme Fizyon maya cinsleri (Şekil 1).
- 1. Gün, Akşam:
MSL + N 3 ml içeren kültür tüplerine katı ortamdan taze çizgili suşları aşılamak. yaklaşık 2.5 cm çapında düz tabanlı tüpler kullanın. adapte kültür hacmi ile diğer kültür tüpleri veya şişeleri kullanın. gece boyunca inkübe (O / N), 25 ° C, 200 rpm'de çalkalayarak. heterothallic suşları ile çalışıyorsanız, ayrı ayrı aşılamak.- Kültürler optik yoğunluk akşam 0.4-0.8 600 nm (OD 600) ölçülen sahip olmasını sağlamak için ertesi sabah medyada hücre süspansiyonları sulandırmak.
Not:OD fisyon maya hücre konsantrasyonunun bir vekil olarak 600 ölçümleri yaklaşık 0.1-1.0 aralığında doğrusaldır. Bizim spektrofotometre OD 600 = 0.1 ml başına 1.4 x 10 6 hücre karşılık gelir. İlk OD 600 okur Böylece, eğer numuneler güvenilir ölçümler için konsantre / seyreltilmiş gereken bu aralığın dışında bulunmaktadır.
- Kültürler optik yoğunluk akşam 0.4-0.8 600 nm (OD 600) ölçülen sahip olmasını sağlamak için ertesi sabah medyada hücre süspansiyonları sulandırmak.
- 2. Gün, Akşam:
100 ml'lik şişelere 600 = 0.025 OD MSL + N ortam, 20 ml hücreleri seyreltilir. 30 ° C, 200 rpm'de suşları O / N inkübe edin.
Not: Yabani tip hücre kültürleri, OD 600 -0.8 Ertesi sabah (15 saat sonra) ulaşması gerekir. uzun nesil zamanla suşları ile çalışma buna göre seyreltme ayarlayın. - 3. Gün, Sabah:
Kültürler OD 600 ~ 0.8 hücre yoğunluğuna sahip olduğunu doğrulamak için OD 600 ölçün. heterothallic suşları ile çalışıyorsanız, ortak hücrelerinin eşit sayıda karıştırın. 1.5 ml 1.000 xg ve transferi de Pelet hücreleritüp. MSL-N, 1 ml aracı hücreleri üç kez yıkayın. MSL-N orta 3 ml hücreleri yeniden askıya ve = 1.5 OD 600 hücreleri sulandırmak.- doğrudan görüntüleme için hücreler monte kardeş hücreler arasındaki çiftleşme izlemek (Protokol bakın Bölüm 2.4). Çiftleşme tipi anahtarlama azot yoksunluğu sonra meydana gelen mitoz bölünmeler sırasında gerçekleşecek olan homothallic H90 suşları kullanın. agaroz pad üzerinde hücrelerin acil montaj hücre bölünmesi sonrası, kardeş-hücreleri yanyana kalır sağlar.
- Hücre polarizasyon (keşif dinamikleri ve shmooing) monitör 30 ° C, görüntüleme için önceden monte hücrelere 3-4 saat boyunca 200 rpm'de hücre kültürü 1-3 ml kuluçkalanması. Bu 3-4 saat içinde, son mitoz bölünme gerçekleşmiş olacak. Birkaç hücreler kutuplaşma başlatmış, ancak sadece kendi keşif polarizasyon dinamiklerini başlangıç olacaktır çoğu.
- Hücre-hücre füzyon 30 ° C'de hücre kültürü 1-3 ml inkübe izlemek için, 200 rpm'de 4-6 saat PRI içinveya görüntüleme için hücrelerin montaj.
- Ekran Füzyon sonrası olaylar, 30 ° C 'de hücre kültürleri 1-3 ml önce görüntüleme için hücrelerin montaj 8 saat 200 rpm'de inkübe edin.
- (Sadece heterothallic suşlar için) belirli bir feromon konsantrasyonuna yanıtını izlemek için 30 ° C'de hücre kültürü 3 ml inkübe 200 rpm'de 3-4 st için görüntüleme için hücrelerin montaj öncesinde.
- 95 ° C ısıya blok MSL-N-içeren ependorf tüp çıkarın (Protokol bölüm 2.4.1 bakın. Aşağıda). eritilmiş MSL-N agaroz doğrudan istenilen konsantrasyonda P-faktörü veya M-faktörü ekleyin. acil ped hazırlanmasından önce vorteks ile iyice karıştırın.
- Hücre monte edildikten sonra, önce görüntüleme 25 ° C'de 15-30 dakika boyunca pedi inkübe edin. P-faktörü ve M faktörü feromon metanol içinde 1 mg / ml'lik bir stok çözeltisinden kullanılmıştır.
Not: mutant ile çalışan kuluçka süreleri değişebilir suşları edin. hücrelerin Topaklanma sıvı m uzun süreli kuluçkadan sonra ortaya çıkabiliredya ve bazı mutant özellikle güçlü olabilir. Clumped hücreler tek bir katmanda agaroz pabuçlarına gördü ve böylece otofokus ve görüntü zordur edilemez. Kapsamlı hücre topaklanma durumunda hemen yıkamadan sonra agaroz pedleri hücreleri monte ve yeniden süspansiyon azot eksik medya (Protokol Bölüm 2.3.1 gibi.) ve önceki görüntüleme 30 ° C'de inkübe.
- Görüntüleme Hücreleri Montaj:
- 10-15 dakika boyunca 95 ° C ısıya-blok bir kısım eritilmesi ve aralama (Şekil 1B) ile ayrılmış iki cam slaytlar arasında 200 ul ilave edilerek MSL-N- agaroz pedleri 16 hazırlayın. ~ 0.5 mm bir kalınlığı olan tutucular kullanın. ara parçalar yapmak için, kullanım şeritleri gibi kısıtlama enzimleri ile teslim edilene, karton kesip.
- 1 dakika boyunca 1.000 xg'de hücrelerin 100 ul Pelet süpernatant kaldırmak ve artık 2-4 ul ortamda hücrelerin yeniden askıya. o gecikmeler olarak yapmayın taze ortamda yeniden askıyaçiftleşme.
- 2-3 dakika sonra dikkatlice spacers ve üst cam slayt kaldırmak. birçok suşu monte edilecek ise, hücre agaroz pedi hazırlamadan önce konsantre hazırlanır.
- pad Hücrelerin 1 ul ekleyin ve açılan kapak kayma ile kaplama ve valap ile sızdırmazlık önce (~ 1 dk) kurutma başlayana kadar bekleyin.
- ped 25 ° C veya oda sıcaklığında görüntüleme önce en az 30 dakika bekletin.
- Çiftleşme çeşitli aşamalarında bir hücre karışımı elde edilir, MSL-N- (Bölüm 2.3.) 'de yıkamadan sonra hemen ped yapmak ve 18 ° CO / N (~ 15 saat) inkübe edilir. Bu yaklaşım zayıf sinyal ile yüksek temporal çözünürlük veya örnekleri ile farklı çiftleşme aşamalarında görüntüleme hücreleri için yararlıdır.
Çiftleşme Maya Hücreleri 3. Canlı hücre Görüntüleme
- Resim Alma Ayarları ayarlayın.
Not: Burada sunulan görüntü alma ayarları özelleştirilmiş Olympus IX-71 oluşan DeltaVision platformu için optimize edildiPlanı Apo 60X / 1.42 NA veya U-Planı Apo 100X / 1.4 NA hedefleri, bir CoolSnap HQ2 kamera ve bir Insight SSI 7 renk kombine ünite aydınlatıcı ile inverted mikroskop. Donanım aynı zamanda dijital otofokus sağlayan softWoRx v4.1.2 tarafından kontrol edilir.- uzun süre boyunca Z-sürüklenme yazılım otomatik odaklama sisteminin kapasitesini aşacak beri otomatik netleme aralıkları 15 dakika aşmamasını emin olun. Bir donanım tabanlı otomatik netleme sistemi kullanıyorsanız, büyük aralıkları kullanın.
- Görüntüleme aralığını ayarlayın. floresan ilk kez protein etiketlenmiş bir ile çalışırken bir başlangıç noktası olarak 15 saat ~ için görüntüleri her 10 dakika sürer. Bu aralık geniş beyazlatma olmadan tüm çiftleşme sürecinin iyi bir bakış sağlar.
- Böyle füzyon olarak daha doğrusu zaman olaylara 5 dk aralıklarla veya daha kısa Image. Kısa aralıklarla düşük pozlama süreleri ve küçük ağartma sağlayan güçlü fluorophores gerektirir. 1 dk önlemek O / N mikroskobu altında aralıklarla görüntülemeProtokol, Bölüm 2.4.6 ayrıntılı olarak ve bunun yerine tüm birleşme aşamalarının bir karışım hazırlanması.
- görüntü pozlama süresini ayarlayın. 50 ile 300 milisaniye arasında test poz süreleri. (Tipik olarak 100'ün üzerinde) bir ayırt sinyali ile zaman noktalarında çok sayıda elde etmek için sinyal-gürültü oranı ve photobleaching arasında bir denge amaçlamaktadır.
- Z-bölümlendirilmeleri ayarlayın. Bölümler her 0,3 mikron kapsayan 5 mikron iyi bir görüntüleme derinliği sağlamak. (- Toplam örnek derinliğinin tek süpürme toplama optik eksen entegrasyonu) OAI kullanılarak minimize edilebilir Z-kesit daha da artar foto-hasar, unutmayın. İyi otomatik odaklama sistemi birçok Z-bölümleri ihtiyacını azaltır ve şiddetle tavsiye edilir.
- İpuçları Çiftleşme Tipi özgü Davranışları Eğitim için:
- Heterothallic suşlar için, H-kullanımı ve iki hücre türünün ayırt edilebilir şekilde, H + hücreleri, tat florofor ifade. herhangi bir genetik olarak kodlanmış fluoropho kullanınBiz sfGFP, GFP 17 hızlı bir katlama varyantı ile iyi bir başarı elde ettiler ama, bir endojen protein sitozolik sürümü veya füzyon olarak ifade yeniden. Endojen proteinler genellikle homolog rekombinasyon 14 kendi endojen genomik loküsündeki etiketlenir.
- Homothallic suşlar için sırasıyla P ve M hücrelerinde ekspresyonu hızlandırmak için bu feromon reseptör genleri MAP3 ve mam2 olanlar gibi birleşme tipi özel promotörlerin kontrolü altında bir genetik olarak kodlanmış sitosolik floresan proteini ifade eder. Map3 ve mam2 destekleyicileri vejetatif büyüme sırasında etkin değildir ve azot açlık 18,19 üzerine uyarılmaktadır. Bu promoterlerin kontrolü altında sitosolik GFP veya mCherry ekspresyonunu yapılar genel olarak cinsel ömrü 12 normal ilerlemesine müdahale etmeyen genomik lokus (ura4, leu1) entegre edilir.
- (Protokol Bölüm 3.2.2 gibi) kullanın çiftleşme tipi özel sitozolik fluorophores diğer bir ortak hücresinden floresan sinyal verme olarak görüntülenmiştir hücre füzyonu hassas zamanlama belirlemek için.
Çiftleşme ve Fusion Efficiencies 4. sayısallaştırılması
- Yukarıda adım 2.3.1 deki gibi, MSL-N agaroz pabuçlarına yıkama doğrudan MSL-N sonra çiftleşme ve füzyon verimliliği 11,12, nokta hücrelerini ölçmek ve 25 ° C öncesinde görüntüleme (Şekil 1A) 24 saat bırakın. Bu homothallic vahşi tip suşu birleşme etkinliği ulaşır protokolü ~% 60 füzyon etkinliğini% 99 kullanılması. mutant gözlenen bu değerlerde herhangi bir azalma bir terminal fenotip veya gecikme yansıtmak olmadığını test etmek için bir 36 saat inkübasyon süresi ile deneyi tekrar.
- olarak çiftleşme verimliliğini hesaplamak
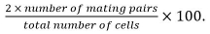 Çiftleşme çiftleri identifiye zigot, asci, ve kaynaşmamış hücre çiftleri içerirHer başkalarına karşı kendi konumunu ve büyüme.
Çiftleşme çiftleri identifiye zigot, asci, ve kaynaşmamış hücre çiftleri içerirHer başkalarına karşı kendi konumunu ve büyüme. - gibi füzyon etkinliğini hesaplayın
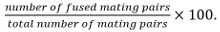
Not: bitişik eşleşme çiftleri çalışma altında mutant sporulasyonunu etkilemediğini biliniyorsa spor oluşturmayan kabiliyetleri ile tanımlanır. sporülasyon okuma olarak kullanılamaz ise füzyon her iki partner içine sadece bir birleşme ortağı ile ifade sitozolik markör yayılmasını gözlemleyerek belirlenmiştir.
Sonuçlar
Bir Azot Kaynak çıkarması üzerine Fisyon Maya Büyüme ve Çiftleşme Dinamikleri
Azot açlık füzyon maya cinsel üreme başlatılması için bir ön koşul olarak, vahşi tip homothallic H90 suşu, Şekil 1 'de tarif edilen protokol izlenerek, azot bakımından zengin azot yoksun ortama (Şekil 2) kayması üzerine izlenmiştir. Kısaca açıklamak gerekirse hücreler MSL + N ortam içerisinde üstel faz (OD = 0.5 600)
Tartışmalar
Çevresel koşullar, ve besin kullanılabilirlik, özellikle güçlü fisyon maya fizyolojisini etkiler. Azot açlık eşeyli üreme bağlılık için gerekli olan ve başlangıçta mitoz hücre döngüsü ilerlemesinde çarpıcı değişiklikler (Ref. 21 ve Şekil 2) yol açar. Katlanarak büyüyen nüfus azot giderimi üzerine, bölünme sırasında hücre boyutu hızla (Şekil 2C) azalır ve hücrelerin çoğunluğu yeni doğmuş katlanarak büyüdü hücreleri (Ref. ...
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
AV bir EMBO uzun vadeli doktora sonrası burs tarafından desteklenmiştir. Martin laboratuarda araştırma bir ERC Başlangıç hibe (GeometryCellCycle) ve SGM bir İsviçre Ulusal Bilim Vakfı hibe (31003A_155944) tarafından finanse edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8270-10KG | |
| KH2PO4 | Sigma-Aldrich | 1.05108.0050 | |
| NaCl | Sigma-Aldrich | 71381 | |
| MgSO4•7H2O | Sigma-Aldrich | 63140 | |
| CaCl2 | Sigma-Aldrich | 12095 | |
| Pantothenate | AppliChem | A2088,0025 | |
| Nicotinic Acid | AppliChem | A0963,0100 | |
| Inositol | AppliChem | A1716,0100 | |
| Biotin | AppliChem | A0967,0250 | |
| Boric Acid | Sigma-Aldrich | B6768-1KG | |
| MnSO4 | AppliChem | A1038,0250 | |
| ZnSO4•7H2O | Sigma-Aldrich | Z4750 | |
| FeCl2•6H2O | AppliChem | A3514,0250 | |
| Molybdenum oxide (VI) (MoO3) | Sigma-Aldrich | 69850 | |
| KI | AppliChem | A3872,0100 | |
| CuSO4•5H2O | AppliChem | A1034,0500 | |
| Citric Acid | AppliChem | A2344,0500 | |
| Agarose | Promega | V3125 | |
| (NH4)2SO4 | Merck | 1.01217.1000 | |
| L-Leucine | Sigma-Aldrich | L8000-100G | |
| Adenine Hemisulfat Salt, mini 99% | Sigma-Aldrich | A9126-100G | |
| Uracil | Sigma-Aldrich | U0750 | |
| Lanolin | Sigma-Aldrich | L7387 | |
| Vaseline | Reactolab | 92045-74-4 | |
| Paraffin | Reactolab | 7005600 |
Referanslar
- Mata, J., Bahler, J. Global roles of Ste11p, cell type, and pheromone in the control of gene expression during early sexual differentiation in fission yeast. Proc Natl Acad Sci U S A. 103 (42), 15517-15522 (2006).
- Xue-Franzen, Y., Kjaerulff, S., Holmberg, C., Wright, A., Nielsen, O. Genomewide identification of pheromone-targeted transcription in fission yeast. BMC Genomics. 7, 303 (2006).
- Klar, A. J. Lessons learned from studies of fission yeast mating-type switching and silencing. Annu Rev Genet. 41, 213-236 (2007).
- Beach, D. H., Klar, A. J. Rearrangements of the transposable mating-type cassettes of fission yeast. EMBO J. 3 (3), 603-610 (1984).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: how yeast cells do it. Open Biol. 3 (3), 130008 (2013).
- Mochizuki, N., Yamamoto, M. Reduction in the intracellular cAMP level triggers initiation of sexual development in fission yeast. Mol Gen Genet. 233 (1-2), 17-24 (1992).
- Sugimoto, A., Iino, Y., Maeda, T., Watanabe, Y., Yamamoto, M. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development. Genes Dev. 5 (11), 1990-1999 (1991).
- Kjaerulff, S., Lautrup-Larsen, I., Truelsen, S., Pedersen, M., Nielsen, O. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals ste11 as a mitogen-activated protein kinase target. Mol Cell Biol. 25 (5), 2045-2059 (2005).
- Obara, T., Nakafuku, M., Yamamoto, M., Kaziro, Y. Isolation and characterization of a gene encoding a G-protein alpha subunit from Schizosaccharomyces pombe: involvement in mating and sporulation pathways. Proc Natl Acad Sci U S A. 88 (13), 5877-5881 (1991).
- Toda, T., Shimanuki, M., Yanagida, M. Fission yeast genes that confer resistance to staurosporine encode an AP-1-like transcription factor and a protein kinase related to the mammalian ERK1/MAP2 and budding yeast FUS3 and KSS1 kinases. Genes Dev. 5 (1), 60-73 (1991).
- Bendezu, F. O., Martin, S. G. Cdc42 explores the cell periphery for mate selection in fission yeast. Curr Biol. 23 (1), 42-47 (2013).
- Dudin, O., et al. A formin-nucleated actin aster concentrates cell wall hydrolases for cell fusion in fission yeast. J Cell Biol. 208 (7), 897-911 (2015).
- Chikashige, Y., et al. Telomere-led premeiotic chromosome movement in fission yeast. Science. 264 (5156), 270-273 (1994).
- Bahler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Egel, R., Willer, M., Kjaerulff, S., Davey, J., Nielsen, O. Assessment of pheromone production and response in fission yeast by a halo test of induced sporulation. Yeast. 10 (10), 1347-1354 (1994).
- Tran, P. T., Marsh, L., Doye, V., Inoue, S., Chang, F. A mechanism for nuclear positioning in fission yeast based on microtubule pushing. J Cell Biol. 153 (2), 397-411 (2001).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Kitamura, K., Shimoda, C. The Schizosaccharomyces pombe mam2 gene encodes a putative pheromone receptor which has a significant homology with the Saccharomyces cerevisiae Ste2 protein. EMBO J. 10 (12), 3743-3751 (1991).
- Tanaka, K., Davey, J., Imai, Y., Yamamoto, M. Schizosaccharomyces pombe map3+ encodes the putative M-factor receptor. Mol Cell Biol. 13 (1), 80-88 (1993).
- Motegi, F., Arai, R., Mabuchi, I. Identification of two type V myosins in fission yeast, one of which functions in polarized cell growth and moves rapidly in the cell. Mol Biol Cell. 12 (5), 1367-1380 (2001).
- Sajiki, K., Pluskal, T., Shimanuki, M., Yanagida, M. Metabolomic analysis of fission yeast at the onset of nitrogen starvation. Metabolites. 3 (4), 1118-1129 (2013).
- Miyawaki, A., Nagai, T., Mizuno, H. Mechanisms of protein fluorophore formation and engineering. Curr Opin Chem Biol. 7 (5), 557-562 (2003).
- Dyer, J. M., et al. Tracking shallow chemical gradients by actin-driven wandering of the polarization site. Curr Biol. 23 (1), 32-41 (2013).
- Beta, C., Bodenschatz, E. Microfluidic tools for quantitative studies of eukaryotic chemotaxis. Eur J Cell Biol. 90 (10), 811-816 (2011).
- Lee, S. S., et al. Quantitative and dynamic assay of single cell chemotaxis. Integr Biol (Camb). 4 (4), 381-390 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır