A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أنيونية البلمرة من كوبوليمر محبة للجهتين لإعداد كتلة كوبوليمر المذيلات استقرت بواسطة تفاعلات التراص π-π
In This Article
Summary
ووصف الخطوات الرئيسية ليعيش البلمرة الأيونية الأثير فينيل glycidyl (PheGE) على غليكول ميثوكسي البولي اثيلين (MPEG-ب -PPheGE). تم تحميل الناتجة المذيلات كتلة من البوليمرات (BCMs) مع دوكسوروبيسين 14٪ (٪ بالوزن) وإطلاق سراح متواصلة من المخدرات على مدى 4 أيام تحت الناحية الفسيولوجية تم الحصول عليها الشروط ذات الصلة.
Abstract
في هذه الدراسة، تم تصنيعه من البوليمرات محبة للجهتين يتضمن كتلة تشكيل النواة مع مجموعة الفينيل من قبل الذين يعيشون البلمرة الأيونية الأثير فينيل glycidyl (PheGE) على غليكول ميثوكسي البولي اثيلين (MPEG-ب -PPheGE). كشفت توصيف البوليمرات توزيع ضيق الجزيئي (PDI <1.03)، وأكد على درجة البلمرة من MPEG 122 - ب - (PheGE) 15. تم تقييم تركيز مذيلة حاسم من البوليمرات باستخدام طريقة مضان القائم مع سلوك التجميع تقييمها من قبل تشتت الضوء الحيوي وانتقال المجهر الإلكتروني. تم تقييم إمكانات مجموعة من البوليمرات لاستخدامها في تطبيقات تسليم المخدرات بطريقة الأولية بما في ذلك في المختبر توافق مع الحياة والتحميل والافراج عن مكافحة السرطان دوكسوروبيسين المخدرات مسعور (DOX). وأعدت صياغة مذيلة مستقرة من DOX مع مستويات تحميل المخدرات تصل إلى 14٪ (٪ بالوزن)، تحميل الدواء efficiencies> 60٪ (ث / ث) والمستدام الإفراج عن المخدرات أكثر من 4 أيام في ظل الظروف ذات الصلة من الناحية الفسيولوجية (الرقم الهيدروجيني الحمضية والمعتدلة، ووجود الزلال). ويعزى المستوى تحميل عالية المخدرات وإطلاق متواصل لتحقيق الاستقرار في التفاعلات π π بين DOX وكتلة تشكيل جوهر المذيلات.
Introduction
في الوسط المائي، بوليمرات كتلة محبة للجهتين تجميع لتشكيل المذيلات كتلة كوبوليمر نانو الحجم (BCMs) التي تتكون من نواة مسعور محاطة قذيفة ماء أو الهالة. جوهر مذيلة يمكن أن تكون بمثابة خزان للإدماج المخدرات مسعور. في حين، الهالة ماء يوفر واجهة بين جوهر والوسط الخارجي. بولي (جلايكول الإثيلين) (PEG) ومشتقاته هي واحدة من الطبقات أهم البوليمرات واحدة من الأكثر استخداما على نطاق واسع في صياغة المخدرات. وقد أثبتت 1-3 BCMs أن تكون جديرة منصة تسليم المخدرات مع العديد من الصيغ التي تعتمد على هذا التكنولوجيا الآن في مرحلة متأخرة السريرية التنمية. 4 الأكثر شيوعا، وتتألف كتلة مسعور من البوليمرات من polycaprolactone، بولي (D، L-lactide)، وبولي (أكسيد البروبيلين) أو بولي (β-البنزيل-L-اسبارتاتي). 5 -9
حققت مجموعة كاتاوكا في المذيلات كروية تشكلت من PEO- ب -PBLA وبولي (أكسيد الاثيلين) - ب - (polyaspartic دوكسوروبيسين حمض مترافق) للتسليم من دوكسوروبيسين (DOX) 10،11 في تقاريرها، أنها تقدمت لتفاعلات π و- ð بين المخدرات البوليمر مترافق أو PBLA وخالية DOX العمل على استقرار الأساسية مذيلة مما أدى إلى زيادة في تحميل المخدرات والاحتفاظ بهم. ثبت أن التوافق أو التفاعلات بين الأدوية والكتلة المكونة الأساسية هي محددات المعايير الأساسية المتعلقة بالأداء. 12 بالإضافة إلى DOX، عددا من علاجات السرطان تشمل الحلقات العطرية داخل بنية الأساسية الخاصة بهم (على سبيل المثال، ميثوتريكسات، olaparib، SN -38).
ونتيجة لذلك هناك اهتمام كبير في تركيب البوليمرات المشتركة التي تشمل حلقات البنزيل في كتل تشكيل الأساسية. انيوني عصابة فتح بلمرة PEG ومشتقاته تمكن من السيطرة على الوزن الجزيئي ويؤدي في المواد من التشتت المتعدد انخفاض في المحصول جيد. 13،14 Ethyleأكسيد شمال شرق مع الأثير فينيل glycidyl (PheGE) أو أكسيد الستايرين (SO) يمكن أن يكون (شارك) بلمرة لتشكيل كتلة بوليمرات التي تشكل المذيلات للذوبان من المخدرات مسعور 15-18 ويصف التقرير الحالي الخطوات اللازمة للعيش البلمرة الأيونية للفينيل glycidyl مونومر الأثير على MPEG-OH كما macroinitiator (الشكل 1). ثم تتميز الناتجة من البوليمرات كتلة والركام من حيث الخصائص ذات الصلة لاستخدامها في توصيل الدواء.
Access restricted. Please log in or start a trial to view this content.
Protocol
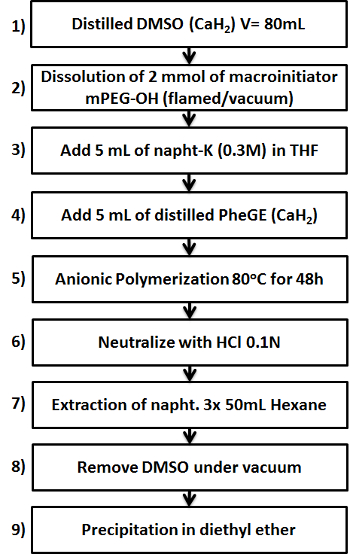
الشكل 1. تخطيطي يبين الخطوات الرئيسية التسعة في إعداد MPEG-ب -PPheGE من البوليمرات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد الكواشف تحت الظروف الجافة
- إعداد الكواشف.
- تزن 15 غراما من MPEG-5K (M ن = 5400 جم / مول، PDI 1.03) والمكان عند 50 درجة مئوية في فرن تحت فراغ لمدة 48 ساعة قبل استخدامها.
- الجافة 200 مل من ثنائي ميثيل سلفوكسيد (DMSO) على هيدريد الكالسيوم (CAH 2) (~ 1 غرام)، في ظل فراغ لمدة 30 دقيقة، تطهير تحت الأرجون ويحرك المزيج لمدة 48 ساعة قبل استخدامها.
- ضع 50 مل من مونومر PheGE في قارورة جافة ونظيفة (100 مل)، إضافة 1 غرام من CAH 2، وختم في ظل فراغ لمدة 15 دقيقة على الجليد، تطهير تحت الأرجونوتترك ليقلب لمدة 24 ساعة تحت الأرجون قبل استخدامها.
2. إعداد والبوتاسيوم النفثالين
- بعناية، وقطع أجزاء صغيرة من الصوديوم (~ 1.5 غرام) المجففة مع الهكسان لإزالة الزيوت المعدنية الزائدة وإضافة إلى قارورة المستديرة التي تحتوي على رباعي هيدرو الفوران (THF) (ت = 500 مل).
ملاحظة: يجب ألا تتعرض أجزاء من الصوديوم في الهواء لفترة طويلة نظرا لخطر الحريق. - إضافة بينزفينون (~ 5 ز)، تطهير مع الأرجون وختم قارورة مستديرة (2 رقاب) مع سدادات الزجاج.
- وبعد اثارة تحت الأرجون لمدة 24 ساعة، توصيل القارورة ذهابا والسفلي للجهاز التقطير (الشكل 2)، استخلاص حل الظلام تحت الأرجون في حين التكثيف الراجع (أي ارتداد نحو فترة 2 ساعة بعد حل اللون الأزرق). البدء في جمع حجم المطلوب ~ 150 مل من THF عن طريق إغلاق صمام اليسار (وجدت في منتصف جهاز التقطير).
ملاحظة: إذا لم يكن هذا الحل بدوره الزرقاء، ووقف استخلاصlation، يبرد في درجة حرارة الغرفة (RT)، وإضافة المزيد من بينزفينون أو الصوديوم وإعادة التقطير. هذا هو إشارة إلى أن THF لا يزال يحتوي على الماء. - في مخروطي الجافة، إضافة THF المقطر (ت = 100 مل)، وحل 3.9 غرام من النفتالين.
ملاحظة: إيقاف التقطير، تهدئة في RT وفتح صمام المناسب لنقل حجم THF. - كما هو موضح في النقطة 2.1، وقطع أجزاء صغيرة من البوتاسيوم (1.1 غرام) وإضافة إلى محلول يحتوي على النفثالين (تركيز نهائي ~ 0.3 مول / لتر). ختم مخروطي مع محول التنظيف (T) (تشغيل / إيقاف) مع الحاجز في الجزء العلوي وتطهير مع الأرجون.
- وبعد اثارة تحت الأرجون لمدة 24 ساعة، ومراقبة المحلول الناتج من قاعدة النفثالين البوتاسيوم كلون خضراء داكنة متجانسة.
- في ظل ظروف الخاملة، وإزالة قسامة 5 مل من محلول الأساسي من القارورة مع حقنة وإضافة إلى 10 مل من الماء المقطر. وفي وقت لاحق إضافة 1-2 قطرات من مؤشر الفينول لهذا الحل،الأمر الذي يجعل حل لون ضارب الى الحمرة.
- استخدام السحاحة إلى يعاير الحل النفثالين البوتاسيوم مع حل معيار الهيدروكلوريك حمض (0.1 N) حتى يتحول الحل عديم اللون.
3. المواد والاحتياطات اللازمة لفعالية المعيشة أنيوني البلمرة
- الأرجون / نظام فراغ متعددة.
ملاحظة: كما هو موضح في الشكل رقم 2، يتم استخدام متعددة الزجاج المزدوج مع الصمامات الزجاج جوفاء للتبديل بين تسليم الأرجون والفراغ الأوضاع في الأواني الزجاجية.- ربط خزان من الأرجون (مع مقياس ضغط الدم) إلى عمود المجففة الجافة وخط المتعددة باستخدام خامل أنابيب مطاطية. في أقصى الآخر من الخط الأرجون، وتوصيل الفوار (التي تحتوي على الزيوت المعدنية).
- إلى الصمامات الزجاج، وربط الأنابيب والإبر خاملة مرنة. على خط آخر من مشعب، ربط فخ زجاج مغمورة في قارورة ديوار الباردة (مليئة الجليد / الماء أو النيتروجين السائل) إلى مضخة فراغ عالية.
- جهاز لتقطير مونومر وDMSO.
ملاحظة: مريحة (أي، الكل في واحد) جهاز لارتفاع التقطير الفراغ وتوظيف (الشكل 2). ويتكون الأواني الزجاجية الجاف مع صمامات فراغ عالية، والمكثفات بنيت في مع رئيس المبرد الداخلي.- تواصل تدفق المياه من خلال مدخل (A) ومخرج (ب) من وحدة التبريد (الرسالة). ربط مدخل آخر / منفذ (C) إلى مشعب المزدوج لحام الأرغون / فراغ. إضافة وختم الحاجز (الأسلاك المعدنية) في التسليم / ميناء استخراج وتوصيل قنية الفولاذ المقاوم للصدأ لنقل السوائل الحساسة الهواء (D) (في الجزء العلوي / حلقة).
- قبل البلمرة، واستخلاص PheGE وDMSO على عباءات التدفئة نصف كروية في 100 درجة مئوية و 70 درجة مئوية، على التوالي، لمدة 2 ساعة في ظل فراغ مع التحريك. نقطة الغليان مونومر PheGE هي 254 درجة مئوية في حين أن درجة الغليان لDMSO هي 189 درجة مئوية في (1 الصراف الآلي).
- زجاجيات لpolymerizat أنيونيةأيون.
- بالإضافة إلى نظام التقطير، وتستخدم فقط عالية فراغ الأواني الزجاجية مقاومة بما في ذلك جولة قوارير السفلية (مصدقة من قبل الشركة المصنعة)، واسطوانات تخرج (لنقل كميات من المذيبات، قاعدة وأحادية)، قنية، حواجز وأسلاك معدنية لاغلاق الحاجز.
ملاحظة: للحصول على البلمرة، حرارة يعيشون بعناية (تحت فراغ) وتهدئة كل الأواني الزجاجية تحت تدفق الأرجون قبل استخدامها. الحفاظ على بندقية الحرارة على مسافة ~ 10 سم من الأواني الزجاجية.
- بالإضافة إلى نظام التقطير، وتستخدم فقط عالية فراغ الأواني الزجاجية مقاومة بما في ذلك جولة قوارير السفلية (مصدقة من قبل الشركة المصنعة)، واسطوانات تخرج (لنقل كميات من المذيبات، قاعدة وأحادية)، قنية، حواجز وأسلاك معدنية لاغلاق الحاجز.
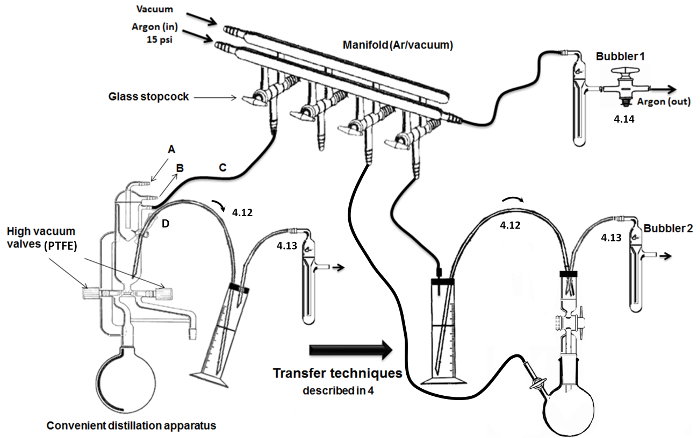
الشكل 2. الجمعية وخطوات رئيسية التقطير / نقل. الرجاء النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
4. وصف الخطوات الرئيسية المعيشة أنيوني البلمرة: التقطير ونقل
- تزن MPEG-5K (2 ملمول، 10 غرام) في و الجافةآسك / Schlenk (فرن) التي تحتوي على بقضيب وختم محول التنظيف (T) (تشغيل / إيقاف) مع الحاجز في الأعلى.
- ربط القارورة إلى مشعب وتطهير قارورة لمدة 2-3 دقائق مع الإحمرار الأرجون. تحويل صمام لموقف فراغ لتطهير القارورة.
- تدوير القارورة يدويا وتجفيف وعاء التفاعل متجانس مع مجفف ضربة (بندقية الحرارة) حتى يذوب MPEG-5K.
ملاحظة: حافظ على بندقية الحرارة على مسافة 10 سم ~ من القارورة. - بعد 1 دقيقة، وكسر الفراغ من خلال تحويل صمام على مشعب نحو موقف الأرجون مع العديد من اللقطات السريعة.
ملاحظة: هناك تدفق مستمر الأرجون لابد من ملاحظتها في الفوار. عندما تدفق مستمر، وصمام يبقى على موقف الأرجون. كرر التدفئة والتبريد الخطوات مرتين لإزالة كل أثر للرطوبة. - الحفاظ على macroinitiator البوليمر تحت فراغ ل~ 2 ساعة وتحت الأرجون قبل أن يبدأ رد الفعل.
- جبل اثنين عالية الفراغ أجهزة التقطير تحت غطاء محرك السيارة (الشكللدى عودتهم 2)؛ واحد لتقطير DMSO واحد لتقطير مونومر (PheGE).
- توصيل قوارير منفصلة تحتوي على DMSO ومونومر إلى الأجهزة اثنين وتثبيت كل على عباءة التدفئة نصف كروية (أو في حمام الزيت). توصيل الماء البارد على رأس جهاز (داخل / خارج)، ومشعب (الأرجون / فراغ).
- تأكد من أن كل جهاز آمنة ومغلقة جيدا. إشراك الفراغ عن طريق صمام.
ملاحظة: كما هو موضح في الخطوة 3.3، كرر الخطوات من التدفئة والتبريد مرتين لإزالة كل أثر للرطوبة. - تعيين التدفئة عن طريق وحدة تحكم في درجة الحرارة وبدء تحريك الحلول. بعد 2 ساعة من التداول / تقطير DMSO، أغلق صمام فراغ عالية (وجدت في منتصف جهاز التقطير) لجمع حوالي 20 مل من محلول (لغسل داخل الجهاز). ثم، والإفراج عن جزء في قارورة وتكرار العملية مرة أخرى للتأكد من نقاء جزء المطلوب الذي هو جollected في وقت لاحق.
- تسخين قارورة تحتوي على MPEG-5K (تحت فراغ) مع بندقية الحرارة حتى البوليمر (MPEG-5K) يذوب. تطهير مرة أخرى مع الأرجون.
ملاحظة: إن الإجراء يساعد على حل بعد نقل DMSO. - بعد 2 ساعة، وإغلاق صمام فراغ عالية وجمع حجم المذيب (V DMSO = ~ 100 مل). توقف التدفئة وكسر الفراغ من مشعب. الافراج عن الأرجون (من الطقات) في غرفة كما هو موضح أعلاه.
- تحت ضغط إيجابي من الأرجون وربط جانب واحد من قنية (عقد في محبس الجهاز) إلى الاسطوانة أو مباشرة إلى قارورة تحتوي على MPEG-5K (إذا كان جهاز تقطير ديه التخرج)، وتزج الطرف الآخر بعناية في جزء المقطر الطازجة.
- عن طريق الضغط الأرجون، ودفع DMSO من خلال قنية في قارورة التفاعل. توصيل الفوار إضافية إلى قارورة (أو اسطوانة إذا لزم الأمر لقياس)، وإغلاق محبس الزجاج متصلة ثالبريد الفوار على الجانب الآخر من مشعب.
ملاحظة: عند إزالة جانب واحد من قنية لنقل، تأكد من أن يتم تطبيق الضغط الأرجون إيجابي. - لتجنب أي حوادث ناجمة عن الضغوط الأرجون، وفتح محبس الزجاج لمدة 1-2 ثانية وreclose أن يستمر تدفق DMSO (كرر مرة واحدة في 0.5 دقيقة) حتى يتم الانتهاء من نقل كامل. إعادة فتح محبس عند الانتهاء.
ملاحظة: يجب أن يتبع الإجراء نفسه الآن لتقطير وجمع من مونومر. المذيب ومونومر لا يمكن جمعها في نفس الوقت. - نقل 5 مل من البوتاسيوم 0.3 M النفثالين عبر إقناء؛ إدخال القنية في الاسطوانة مختومة من قبل الحاجز مع قنية إدراجها (حلقة).
ملاحظة: نفس الاحتياطات كما هو موضح في ملاحظة 4.13. يجب الحفاظ إيجابي الضغط الأرجون أول من القارورة النفثالين البوتاسيوم إلى الاسطوانة ومن ثم من الاسطوانة إلى قارورة التفاعل لتجنب تلوث الهواء / الماء. - إدراج إبرة أخرى من manifoدينار في الاسطوانة (الأرجون). إزالة قنية المتصلة بنظام التقطير بعناية وإدراج بسرعة إلى دورق التفاعل.
ملاحظة: استخدم هذا الأسلوب لنقل قاعدة ومونومر. - إضافة قطرة قاعدة قطرة حتى يصبح حل الظلام. بعد اختفاء بطء اللون، إضافة جزء آخر حتى يظهر اللون الداكن مرة أخرى، وكرر حتى نقل كامل.
- نقل حجم المطلوب من مونومر (V PheGE = 5 مل) للوصول إلى درجة البلمرة من PPheGE ~ ن = 18-20.
- ترك رد فعل لمدة 48 ساعة على 80 درجة مئوية تحت جو الأرجون مع التحريك المستمر لضمان البلمرة كاملة.
- إخماد رد فعل عن طريق إضافة قطرات من حمض الهيدروكلوريك 1 N في الميثانول (تقاس باستخدام ورقة عباد الشمس (الرقم الهيدروجيني محايدة)) والتي لاحظها اختفاء اللون.
- استخراج النفثالين من الحل DMSO مع الهكسان (3 × 50 مل). إزالة DMSO عن طريق التقطير تحت التفريغ ~ 70 مل (نفس الجهاز). سجعل أسفل حل الطين وإضافة 50 مل من THF.
- إزالة الملح من حل الطين بواسطة الطرد المركزي في 5000 x ج لمدة 10 دقيقة. نقل طاف، وإضافة قطرة من الحكمة إلى 500 مل من ايثر البارد.
- جمع راسب عن طريق الترشيح أو الطرد المركزي (اكرر مرتين) وجافة في ظل فراغ عند 30 درجة مئوية لمدة 24-48 ساعة (تسفر عن 85٪).
ملاحظة: إن مجموعة من البوليمرات هي الآن جاهزة للتوصيف.
5. توصيف البوليمر
- تزن 5-10 ملغ من البوليمرات (رقم قياسي الكتلة الفعلية) في عموم عينة الألومنيوم وختم بإحكام مع غطاء الألومنيوم. تحميل عينة عموم والقومية المرجعية (فارغة) في المسعر التفاضلي المسح.
- برنامج طريقة ( "الحرارة / تبريد / الحرارة") دورة: 1) الحرارة من 40 درجة مئوية إلى 100 درجة مئوية في 10 ° C / دقيقة، 2) باردة إلى -70 درجة مئوية في 10 ° C / دقيقة، 3) الحرارة إلى 100 درجة مئوية في 10 ° C / دقيقة. كرر 2) و 3) مرتين. تحديد نقطة انصهار (T م)، crystallization (T ج) ودرجة حرارة التحول الزجاجي (ت غ)، وحرارة انصهار (ΔH و) من آثار حرارية من الدورة الثالثة (إن وجدت).
- حل البوليمرات في THF (2 ملغ / مل) وتصفية من خلال مرشح PTFE 0.2 ميكرون. حقن العينة إلى نظام الههلامي (50 ميكرولتر) واستخدام الوقت الاحتفاظ لعينة ومنحنى المعايرة أنتجت باستخدام مجموعة من المعايير البوليسترين لتحديد الوزن الجزيئي للبوليمر 19
- حل (شارك) البوليمرات (15 ملغ / مل) في د 6 DMSO ل1 التحليل الطيفي H NMR 19
- تحديد تركيز مذيلة الحرج (CMC) من البوليمرات باستخدام 1،6-ثنائي-1،3،5-hexatriene ([دف])، وتحقيق مضان. 9
- يعد حل الأسهم DPH في THF (2.32 ملجم / لتر) في الظلام، وإضافة 100 ميكرولتر من هذا المحلول إلى كل من سلسلة من قوارير.
- استعداداتإعادة محلول المخزون من البوليمرات في THF وإضافة aliquots من حجم مساو (2 مل) إلى سلسلة من قوارير (تحتوي كل منها على قسامة من الحل الأسهم DPH) مما أدى إلى تركيزات من البوليمرات النهائية التي تتراوح من 0.01 إلى 1000 ميكروغرام من البوليمرات / مل.
- وفي وقت لاحق، دوامة الحلول كوبوليمر-DPH وإضافة قطرة قطرة إلى 10 مل من الماء المقطر المزدوج مع التحريك بار. ثم يجب أثار الحلول بقوة في الظلام لمدة 48 ساعة تحت تيار من النيتروجين للسماح التبخر بطيئة من THF. التركيز النهائي من DPH في كل حل هو 0.232 ملغم / لتر.
- قياس الانبعاثات مضان من العينات في 430 نانومتر (λ السابق = 350 نانومتر) باستخدام المسح الضوئي المزدوج صفيحة الطيفي ومضان مؤامرة مقابل تسجيل [البوليمر]. اعتراض بين اثنين من سفوح الخطية يوفر قيمة CMC لمجموعة من البوليمرات.
6. إجراءات تحميل دوكسوروبيسين إلى BCMs
- حل 12 ملغ من DOX في 1 مل من الآسtonitrile، إضافة 10 ميكرولتر من ثلاثي الإيثيلامين والسماح للضجة الحل في الظلام لمدة 2 ساعة.
- حل مجموعة من البوليمرات (45 ملغ) في 1 مل من THF ويحرك المزيج لنفس الفترة من الزمن. إضافة محاليل البوليمرات المشتركة في حل DOX وشطف القارورة التي تحتوي على مجموعة من البوليمرات المتبقية مع حجم إضافي من THF (0.5 مل).
- يضاف خليط من البوليمرات المخدرات (2.5 مل) قطرة قطرة إلى قارورة (20 مل) تحتوي على 15 مل من المياه المالحة 0.9٪ (كلوريد الصوديوم) مع التحريك.
- نقل الحل إلى كيس غسيل الكلى (3.5 كيلو دالتون قطع إيقاف) وdialyze ضد المالحة 0.9٪ (500 مل).
ملاحظة: تغيير المالحة الخارجية بعد 6 ساعات والسماح يستمر غسيل الكلى لمدة 24 ساعة مع التحريك في الظلام في RT. - نقل ديالة لأنبوب 50 مل وأجهزة الطرد المركزي في 5000 x ج لمدة 15 دقيقة.
- نقل طاف لنظام الترشيح الفائق (بسعة 10 مل) الذي يحتوي على غشاء غسيل الكلى (قطع 10 كيلو دالتون). وضع محول اثارة في النظام الفائق، إغلاق الغطاء ومفتوحة لكماtream من النيتروجين.
- التركيز على حل BCM إلى وحدة تخزين من 4 مل وإضافة 6 مل من المياه المالحة الطازجة وكرر الإجراء مرتين.
- التركيز على حل BCM إلى 4 مل، وشطف الغرفة مع 0.5 مل من المياه المالحة وإضافة إلى الحل. متجر في قارورة البني في RT في الظلام قبل استخدامها مرة أخرى.
7. تقييم دوكسوروبيسين تحميل في DOX-BCMs
- حل DOX-BCM في ثنائي ميثيل الفورماميد (100 ميكرولتر في 400 ميكرولتر) لتعطيل المذيلات وتمييع في محلول مائي حمض الهيدروكلوريك (0.1 N) قبل تقييم (100 ميكرولتر في 900 ميكرولتر حمض الهيدروكلوريك 0.1 N).
- قياس تحميل المخدرات في 490 نانومتر باستخدام نظام الفوق صفيحة طيفية. استخدام المعادلات التالية لتحديد قدرة التحميل المخدرات (DLC) وكفاءة التحميل المخدرات (DLE):
DLC (٪ بالوزن) = (وزن المخدرات تحميل / الوزن الكلي للBCMs) × 100٪
DLE (٪) = (وزن المخدرات تحميل / وزن المخدرات في العلف) × 100٪
8. تقييمفي المختبر الإفراج عن DOX من DOX-BCMs
- التحقيق في إطلاق سراح DOX من BCMs عند 37 درجة مئوية في 0.1 M الفوسفات مخزنة المالحة (PBS، ودرجة الحموضة 7.4) ضد برنامج تلفزيوني 7.4 درجة الحموضة التي تحتوي على 0.1٪ (ث / ت) توين 80، BCMs + BSA (50 ملغ / مل) ضد برنامج تلفزيوني ودرجة الحموضة 7.4 و 0.1 M خلات العازلة في درجة الحموضة = 5.5. 20،21
- تمييع صياغة BCM-DOX (700 ميكرولتر) في المخزن المؤقت المحدد (2.3 مل) أن يؤدي إلى المبلغ الإجمالي لل≈ 0،6-0،7 ملغ من DOX في كيس غسيل الكلى.
- وضع الحل في كيس غسيل الكلى، وختم مع لقطات وتزج الحقيبة إلى 200 مل من وسائل الإعلام الخارجية المعنية.
- إزالة 2 مل من محلول الخارجي للكيس غسيل الكلى في نقطة زمنية محددة سلفا واستبدالها مع نفس الحجم من العازلة الطازجة.
- تخزين قسامات إزالتها في -20 درجة مئوية قبل التحليل الطيفي للأشعة فوق البنفسجية فيس (عبس 490 نانومتر). ويمكن حساب النسبة المئوية التراكمية من المخدرات صدر (E ص) باستخدام المعادلة التالية:

ملاحظة: أين يمثل م DOX كمية DOX في BCMs، V 0 هو الحجم الكلي للسائل الاعلام اطلاق سراح (200 مل)، والخامس ر هو حجم وسائل الإعلام استبدال (V ر = 2 مل)، تسى هو تركيز قبل التصحيح، وC ن يمثل تركيز DOX في العينة.
Access restricted. Please log in or start a trial to view this content.
النتائج
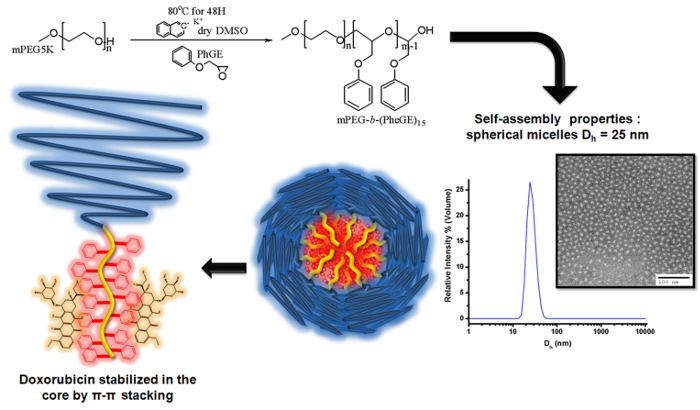
الشكل 3. رسم توضيحي لالبلمرة الأيونية للفينيل glycidyl الأثير على MPEG macroinitiator لإنتاج ب MPEG-- (PheGE) 15 لإعداد المذيلات كتلة من البوليمرات لتحميل دوكسوروبيسين
Access restricted. Please log in or start a trial to view this content.
Discussion
ويرجع ذلك إلى السيطرة الجيدة التي توفر البلمرة الأيونية أكثر من الوزن الجزيئي أنها واحدة من أكثر العمليات التطبيقية في الصناعة لإعداد البوليمرات على أساس أحادية oxirane (PEG وإندستريز). يجب استخدام الظروف المثلى وصارمة لبلمرة ناجحة لتحقيقه. تنقية صارمة من جميع الكواشف و?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
References
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved