Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анионной полимеризации амфифильного Сополимер по подготовке блоксополимера мицелл, стабилизированных π-л стэкинг-взаимодействий
В этой статье
Резюме
Основные этапы живой анионной полимеризации фенилглицидиловый эфира (PheGE) на метокси-полиэтиленгликоль (MPEG- б) -PPheGE описаны. Результирующие блок-сополимера мицеллы (BCMS) загружались с доксорубицином 14% (мас%) и замедленное высвобождение лекарственного средства в течение 4-х дней при физиологически получали соответствующие условия.
Аннотация
В этом исследовании, амфифильный сополимер , который включает в себя базовую образующий блок с фенильными группами, синтезировали живой анионной полимеризации фенилглицидиловый эфир (PheGE) на метокси-полиэтиленгликоль (MPEG- б -PPheGE). Определение характеристик сополимера показал узкое молекулярно -массовое распределение (PDI <1,03) и подтвердили степень полимеризации мПЭГ 122 - B - (PheGE) 15. Критическая концентрация мицелл сополимера оценивали с использованием установленного способа флуоресценции с поведением агрегации оценивали с помощью динамического рассеяния света и передачи электронной микроскопии. Потенциал сополимера для использования в приложениях для доставки лекарственных средств оценивали в предварительном порядке , включая в пробирке биосовместимость, загрузка и высвобождения гидрофобного противоракового препарата доксорубицина (DOX). Стабильная рецептура мицелл DOX был подготовлен с уровнем загрузки лекарственного средства до 14% (мас%), погрузка наркотиков efficiencies> 60% (вес / вес) и замедленное высвобождение препарата в течение 4-х дней при физиологически соответствующих условиях (кислых и нейтральных рН, присутствие альбумина). Уровень загрузки высокого наркотиков и замедленным высвобождением приписывается стабилизирующих π-pi; взаимодействия между DOX и центральным блоком формирования мицелл.
Введение
В водной среде, амфифильные блок-сополимеры, собираются, чтобы сформировать нано-размера блок-сополимера мицелл (BCMS), которые состоят из гидрофобной сердцевины, окруженной оболочкой гидрофильных или короны. Ядро мицеллы может служить в качестве резервуара для включения гидрофобных лекарственных средств; в то время как гидрофильный коронный обеспечивает интерфейс между ядром и внешней средой. Поли (этиленгликоль) (ПЭГ) и его производные являются одним из наиболее важных классов полимеров , и один из наиболее широко используемых в лекарственной композиции. 1-3 BCMS оказались достойной платформой для доставки лекарственных средств с несколько составов , опираясь на этот технологии в настоящее время в поздней стадии клинической разработки. 4 Чаще всего, гидрофобный блок - сополимера состоит из поликапролактон, поли (D, L-лактида), поли (пропиленоксид) или поли (β-бензил-L-аспартат). 5 -9
Группа Катаока исследовала сферические мицеллы , образованные из ПЭО б -PBLA И поли (окись этилена) - б . - (Доксорубицин полиаспарагиновой кислоты с сопряженными) для доставки доксорубицина (DOX) 10,11 В своих докладах они выдвинули , что π-pi ; взаимодействие между препаратом полимерконъюгированных или PBLA и свободный DOX действовать, чтобы стабилизировать ядро мицеллы, что приводит к увеличению нагрузки и удержания лекарственного средства. Установлено , что совместимость или взаимодействие между лекарственным средством и блок основного формирования являются определяющими ключевых параметров , связанных с производительностью. 12 В дополнение к DOX, ряд терапии рака включают ароматические кольца в пределах своей основной структуры (например, метотрексат, olaparib, С.Н. -38).
В результате существует значительный интерес к синтезу сополимеров, которые включают бензиловый кольца в их основных образующих блоков. Анионные полимеризация с раскрытием кольца ПЭГ и его производных позволяют контролировать молекулярной массой и привести к материалам с низкой полидисперсностью с хорошим выходом. 13,14 EthyleОксид пе с фенилглицидиловый эфиром (PheGE) или оксид стирола (SO) может быть (со) полимеризуется с образованием блок - сополимеров , которые образуют мицеллы для солюбилизации гидрофобных лекарственных средств. 15-18 В настоящем докладе описываются необходимые шаги для живой анионной полимеризации фенил глицидилэфир мономера на Mpeg-ОН , как макроинициатора (Рисунок 1). Полученный блок-сополимер и его агрегаты затем охарактеризованы с точки зрения свойств релевантности для использования в доставке лекарств.
Access restricted. Please log in or start a trial to view this content.
протокол
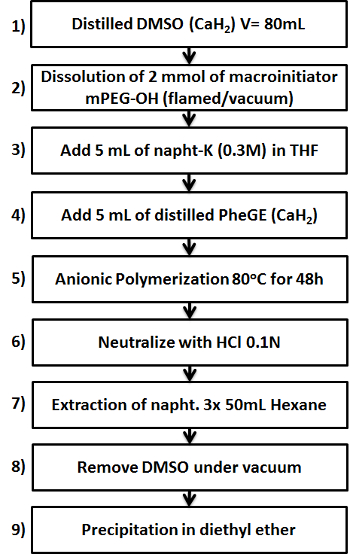
Рисунок 1. Схема , показывающая девять ключевых шагов в подготовке б -PPheGE сополимера MPEG-. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
1. Приготовление реагентов в сухих условиях
- Приготовление реагентов.
- Взвешивают 15 г Mpeg-5К (Мn = 5,400 г / моль, PDI 1,03) и место при 50 ° С в печи под вакуумом в течение 48 ч перед использованием.
- Сухие 200 мл диметилсульфоксида (ДМСО) в течение гидрид кальция (CAH 2) (~ 1 г), место под вакуумом в течение 30 мин, продувку в атмосфере аргона и перемешивают в течение 48 часов перед использованием.
- Поместите 50 мл в PheGE мономера в сухую и чистую колбу (100 мл), добавляют 1 г CaH 2, уплотнение под вакуумом в течение 15 мин на льду, продувку в атмосфере аргонаи оставить перемешиваться в течение 24 ч в атмосфере аргона до использования.
2. Подготовка калия нафталина
- Осторожно, нарезать небольшими кусками натрия (~ 1,5 г) высушивают с гексаном, чтобы удалить избыток минерального масла и добавить в круглую колбу, содержащую тетрагидрофуран (ТГФ) (V = 500 мл).
Примечание: Куски натрия не должны подвергаться воздействию воздуха для долго из-за риска возникновения пожара. - Добавить бензофенон (~ 5 г) продувку аргоном и запечатать круглую колбу (2 шеями) со стеклянными пробками.
- После перемешивания в атмосфере аргона в течение 24 ч, соединить колбу с круглым дном в перегонный аппарат (рисунок 2), перегонку темного раствора в атмосфере аргона в то время как кипячения с обратным холодильником (т.е., рефлюкс в течение приблизительно в течение 2 ч после того, как раствор становится синим). Начинают собирать желаемый объем ~ 150 мл ТГФ, закрыв левый клапан (находится в середине перегонного аппарата).
Примечание: Если это решение не синеет, остановить Distilтаже, остывать при комнатной температуре (RT) и добавляют больше бензофенон или натрий, и перезапустить дистилляцию. Это указывает на то, что до сих пор ТГФ содержит воду. - В сухом Эрленмейера, добавляют дистиллированную ТГФ (V = 100 мл) и растворить 3,9 г нафталина.
Примечание: Остановить дистилляцию, остыть при комнатной температуре и откройте правую клапан для передачи объема ТГФ. - Как описано в пункте 2.1, нарезать небольшими кусками калия (1,1 г) и добавляют к раствору, содержащему Нафталин (конечная концентрация ~ 0,3 моль / л). Уплотнение Эрленмейера с адаптером промывочного (T) (вкл / выкл) с перегородкой в верхней и продувают аргоном.
- После перемешивания в атмосфере аргона в течение 24 ч, наблюдать полученный раствор калий-нафталина на основание в виде однородного темно-зеленого цвета.
- В инертных условиях, удалить 5 мл аликвоты основного раствора из колбы с помощью шприца и добавляют к 10 мл дистиллированной воды. Затем добавляют 1-2 капли индикатора фенолфталеина к этому раствору,который превращает раствор фуксия цвет.
- С помощью бюретки титровать калий-нафталина раствора со стандартным раствором соляной кислоты (0,1 N) до тех пор, пока раствор не станет бесцветным.
3. Материалы и необходимые меры для эффективного живой анионной полимеризации
- Система аргон / вакуумный коллектор.
Примечание: Как описано на рисунке 2, двойное остекление многообразие с полыми стеклянными кранами используется для переключения между подачей аргона и вакуума в стеклянной посуде.- Подключите бак аргона (с манометром) в сухой колонке абсорбентом и к коллектору линии с использованием инертного резиновой трубки. На другом конце линии аргона, соединить барботер (содержащий минеральное масло).
- Для стеклянных кранами, соедините гибкие инертные трубки и иглы. К другой линии коллектора, соединить стеклянную ловушку погружают в холодную сосуд Дьюара (заполненный льдом / водой или жидким азотом) в насос высокого вакуума.
- Аппарат для перегонки мономера и ДМСО.
Примечание: Удобный (то есть, все в одном) аппарат для высокой вакуумной перегонки используют (рисунок 2). Сухой стеклянной посуды производится с высокими вакуумными клапанами, а также встроенные конденсаторы с внутренним охлажденном головы.- Подключение поток воды через входное отверстие (А) и на выходе (В) охлаждающего устройства (буква). Подключите другой вход / выход (C) к двойственной коллектора для аргона / вакуума. Добавление и запечатать перегородку (металлические провода) в порту доставки / извлечения и соединить стальной канюлю из нержавеющей стали для передачи чувствительных воздушных жидкостей (D) (в верхнем / цикле).
- До полимеризации перегонку PheGE и ДМСО на полусферических колбонагреватели при 100 ° С и 70 ° С, соответственно, в течение 2 ч под вакуумом при перемешивании. Точка кипения В PheGE мономер составляет 254 ° С, тогда как температура кипения для ДМСО 189 ° С при (1 атм).
- Стеклянная посуда в анионной polymerizatиона.
- В дополнение к системе дистилляции, используйте только высокий вакуум стойкую стеклянной посуды в том числе с круглым дном колбы (сертифицировано производителем), градуированные цилиндры (для переноса объемов растворителя, основания и мономеров), канюль, перегородках и металлической проволоки для уплотнения перегородками.
Примечание: Для получения тщательно живой полимеризации, тепло (под вакуумом) и охлаждают всю стеклянную посуду в потоке аргона до использования. Держите тепловые пушки на расстоянии ~ 10 см от стеклянной посуды.
- В дополнение к системе дистилляции, используйте только высокий вакуум стойкую стеклянной посуды в том числе с круглым дном колбы (сертифицировано производителем), градуированные цилиндры (для переноса объемов растворителя, основания и мономеров), канюль, перегородках и металлической проволоки для уплотнения перегородками.
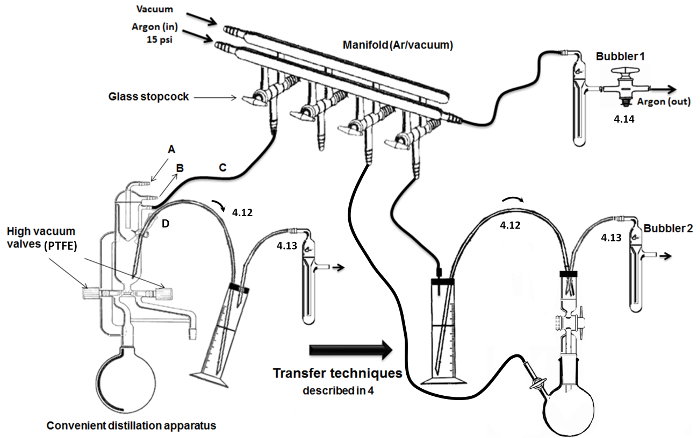
Рисунок 2. Сборка и основные этапы перегонки / передачи. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Описание ключевых шагов живой анионной полимеризации: дистилляция и передачи
- Взвесить Mpeg-5K (2 ммоль, 10 г) в сухом Fласк / Шленка (печь), содержащий мешалку и запечатать адаптер гиперемию (T) (вкл / выкл) с перегородкой в верхней части.
- Соедините колбу с коллектором и очистить колбу в течение 2-3 мин с флешей аргона. Поверните клапан в вакуумном состоянии очистить колбу.
- Поверните колбу вручную и высушить реакционный сосуд с однородно фена (тепловая пушка) до Mpeg-5K не растает.
Примечание: Держите тепловые пушки на расстоянии ~ 10 см от колбы. - Через 1 мин, перерыв вакуума, поворачивая клапан на коллекторе в направлении позиции аргона с несколькими быстрыми защелками.
ПРИМЕЧАНИЕ: Непрерывный поток аргона должен наблюдаться в барботер. Когда поток непрерывен, клапан остается в положении аргона. дважды Повторные нагрева и охлаждения шаги, чтобы удалить все следы влаги. - Хранить полимерный макроинициатор в вакууме в течение ~ 2 ч и в атмосфере аргона до начала реакции.
- Маунт два высокого вакуума ректификационные аппараты под капотом (рисЮр 2); один для дистилляции ДМСО и один для отгонки мономера (PheGE).
- Соединить отдельные колбы, содержащие ДМСО и мономера к двум устройствам и установить каждый на полусферической греющим кожухом (или в масляной ванне). Подключение холодной воды к верхней части аппарата (вход / выход) и многообразию (аргон / вакуум).
- Убедитесь в том, что каждое устройство является безопасным и хорошо запечатаны. Engage вакуум через клапан.
Примечание:. Как описано в шаге 3.3, повторите нагрев и стадий охлаждения в два раза, чтобы удалить все следы влаги. - Установите нагрев с помощью регулятора температуры и начать перемешивания растворов. Через 2 ч циркуляционного / перегонки ДМСО, закрыть клапан высокого вакуума (находится в середине перегонном аппарате) для сбора приблизительно 20 мл раствора (для очистки внутренней части аппарата). Затем отпустить фракцию в колбу и повторить операцию еще раз, чтобы гарантировать чистоту желаемой фракции, которая представляет собой Сollected позже.
- Нагревают колбу, содержащую Mpeg-5K (под вакуумом) с тепловой пушки пока полимер (мПЭГ-5K) плавится. снова продувают аргоном.
Примечание: Эта процедура поможет растворению после передачи ДМСО. - Через 2 часа, закрыть клапан высокого вакуума и собирают объем растворителя (V DMSO = ~ 100 мл). Прекратите нагрев и сломать вакуум от коллектора. Выпуск аргон (по защелками) в камеру, как описано выше.
- При положительном давлении аргона, соединить одну сторону канюли (Удерживать на запорный кран аппарата) в градуированный цилиндр или непосредственно в колбу, содержащую Mpeg-5K (если перегонный аппарат имеет выпускной) и погружают другой конец осторожно в свежеперегнанного фракции.
- Использование аргона давление, привод ДМСО через канюлю в реакционную колбу. Подключите дополнительный барботер в колбу (или цилиндр, если это необходимо для измерения) и закройте стекло кран, соединенный с йе барботера на противоположной стороне коллектора.
Примечание: Когда одна сторона канюли удаляется для передачи, убедитесь, что применяется положительное давление аргона. - Для того, чтобы избежать каких-либо аварий, вызванных давлением аргона, открыть стеклянную запорного крана в течение 1-2 сек и запечатать, чтобы продолжить поток ДМСО (повторяли один раз за 0,5 мин) до момента получения полной передачи не будет завершено. Повторное открытие запорного крана, когда закончите.
Примечание: Теперь же процедура должна применяться для дистилляции и сбора мономера. Растворитель и мономер не может быть собрана в то же время. - Передача 5 мл 0,3 М нафталина калия через канюлю в градуированный цилиндр уплотнен перегородке с канюлю (контур).
Примечание: Такие же меры предосторожности, как описано в примечании 4.13. Положительное давление аргона должно поддерживаться первым из колбы калий-нафталина в цилиндр, а затем из цилиндра в реакционную колбу, чтобы избежать загрязнения воздуха / воды. - Вставьте другую иглу из manifoЛД в цилиндр (аргон). Удалите канюлю, соединенную с системой перегонки осторожно и быстро вставить в реакционную колбу.
Примечание: Используйте этот метод для переноса базы и мономера. - Добавьте базовую по капле до тех пор, пока раствор не станет темной. После медленного исчезновения цвета, добавьте еще одну порцию, пока темный цвет снова не появится, и повторять до полной передачи.
- Перенести желаемый объем мономера (V PheGE = 5 мл) , чтобы достичь степени полимеризации PPheGE ~ п = 18-20.
- Оставьте реакционную смесь в течение 48 ч при 80 ° С в атмосфере аргона при постоянном перемешивании, чтобы обеспечить полную полимеризацию.
- Гасят реакцию добавлением капли HCl 1 н в метаноле (измеренный с помощью лакмусовой бумаги (нейтральный рН)) и наблюдают цветного исчезновения.
- Извлечение нафталин из ДМСО раствора с гексаном (3 × 50 мл). Удалить ДМСО путем перегонки под вакуумом ~ 70 мл (тот же аппарат). ворковатьл раствора вниз шлама и добавляют 50 мл ТГФ.
- Удаления соли из раствора суспензии путем центрифугирования при 5000 х г в течение 10 мин. Передача супернатант, и добавьте по каплям к 500 мл холодного диэтилового эфира.
- Собирают осадок фильтрованием или центрифугированием (повтор дважды) и сушили под вакуумом при 30 ° С в течение 24-48 ч (выход 85%).
Примечание: Сополимер теперь готов к характеристике.
5. Определение характеристик Сополимеры
- Взвесьте 5-10 мг сополимера (записи фактической массы) в алюминиевом образце сковороду и запечатать герметически с алюминиевой крышкой. Загрузите образец панорамирование и опорный поддон (пусто) в дифференциальной сканирующей калориметрии.
- Программа метод ( "нагрев / охлаждение / нагрев") цикл: 1) высокая температура от 40 ° C до 100 ° C со скоростью 10 ° С / мин, 2) охлаждают до -70 ° С со скоростью 10 ° С / мин, 3) тепла до 100 ° с со скоростью 10 ° с / мин. Повторите 2) и 3) дважды. Определить точку плавления (Т м), кристallization (T c) и температуры стеклования (Т г) и теплота плавления (H е) от тепловых следов от третьего цикла (если это применимо).
- Растворение полимеров в ТГФ (2 мг / мл) и фильтруют через фильтр из ПТФЭ 0,2 мкм. Вводят пробы в систему гель - проникающей хроматографии (50 мкл) и использовать время удерживания для образца и калибровочную кривую производится с использованием ряда полистирольных стандартов для определения молекулярной массы полимера. 19
- Растворите (со) полимеров (15 мг / мл) в ДМСО d 6 для 1 анализа спектроскопии ЯМР Н. 19
- Определение критической концентрации мицеллообразования (ККМ) сополимера с использованием 1,6-дифенил-1,3,5-гексатриен (DPH) в качестве флуоресцентного зонда. 9
- Приготовьте DPH маточного раствора в ТГФ (2,32 мг / л) в темноте, и добавить 100 мкл этого раствора в каждую из серии флаконов.
- Подготовительномповторно сополимером маточного раствора в ТГФ и добавляют аликвоты равного объема (2 мл) к серии ампул (каждая из которых содержит аликвоты исходного раствора DPH), что приводит к образованию конечных концентраций сополимера, что в диапазоне от 0,01 до 1000 мкг / мл сополимера.
- Впоследствии вихревые растворы и добавляют по каплям к 10 мл дважды дистиллированной воды при перемешивании бар сополимер-DPH. Растворы должны быть затем энергично перемешивают в темноте в течение 48 ч в токе азота, чтобы обеспечить медленное испарение ТГФ. Конечная концентрация DPH в каждом растворе составляет 0,232 мг / л.
- Измерьте излучение флуоресценции образцов при длине волны 430 нм (λ ех = 350 нм) с использованием двойного сканирования микропланшетов спектрофлуориметре и участок флуоресценции от входа [полимер]. Отрезок между двумя линейными склонами обеспечивает значение ККМ для сополимера.
6. Процедура Загрузка доксорубицин в BCMS
- Растворите 12 мг DOX в 1 мл асеtonitrile, добавить 10 мкл триэтиламина и пусть размешать раствор в темноте в течение 2 часов.
- Растворить сополимер (45 мг) в 1 мл ТГФ и перемешивают в течение того же периода времени. Добавьте сополимер раствора к раствору DOX и промыть флакон, содержащий остаточный сополимер с дополнительным объемом ТГФ (0,5 мл).
- Добавьте смесь-сополимер-лекарство (2,5 мл) по каплям в пробирку (20 мл), содержащий 15 мл физиологического раствора 0,9% (NaCl) при перемешивании.
- Перенесите раствор в диализный мешок (3,5 кД отрезать) и диализ против физиологического раствора 0,9% (500 мл).
Примечание: Изменение внешнего физиологический раствор через 6 ч, и пусть диализ продолжают в течение 24 ч при перемешивании в темноте при комнатной температуре. - Передача диализата в 50 мл пробирку и центрифугируют при 5000 х г в течение 15 мин.
- Передача супернатант на систему ультрафильтрации (емкостью 10 мл), который содержит диализной мембраны (отрезать 10 кДа). Вставьте адаптер перемешивания в систему ультрафильтрации, закройте крышку и открыта какTream азота.
- Концентрат ВСМ раствора до объема 4 мл и добавляют 6 мл свежего солевого раствора и повторите процедуру дважды.
- Концентрат ВСМ раствора до 4 мл, ополоснуть камеру с 0,5 мл физиологического раствора и добавляют к раствору. Хранить в коричневых флаконах при комнатной температуре в темноте до дальнейшего использования.
7. Оценка доксорубицина Загрузка в DOX-BCMS
- Растворите DOX-BCM в диметилформамиде (100 мкл в 400 мкл), чтобы нарушить мицеллы и разбавляют в водном растворе HCl (0,1 N) до оценки (по 100 мкл в 900 мкл HCl 0,1 N).
- Мера загрузки лекарственного средства при 490 нм с использованием системы Benchtop микропланшет спектрофотометрического. Используйте следующие уравнения для определения способности загрузки лекарственного средства (DLC) и эффективность загрузки лекарственного средства (DLE):
DLC (вес%) = (вес препарата, погруженных / общий вес BCMS) х 100%
СКД (%) = (масса лекарственного средства, погруженных / вес препарата в корме) х 100%
8. Оценкаэкстракорпорального Выпуск DOX от DOX-BCMS
- Исследовать высвобождение DOX из BCMS при 37 ° С в 0,1 М фосфатно-солевом буфере (PBS, рН 7,4) против PBS, рН 7,4, содержащего 0,1% (вес / об) твина 80, BCMS + БСА (50 мг / мл) против PBS рН 7,4 и 0,1 М ацетат-буфер при рН = 5,5. 20,21
- Разбавить рецептуру БЦМ-DOX (700 мкл) в выбранном буфере (2,3 мл), чтобы привести к общей сумме ≈ 0,6-0,7 мг DOX в диализной мешке.
- Поместите раствор в диализной мешке, запечатать с клипами и погрузить пакет в 200 мл соответствующих внешних носителей.
- Удалите 2 мл раствора вне диализного мешка в заранее заданные моменты времени и заменяют тем же объемом свежего буфера.
- Хранить аликвот удалены при -20 ° C до проведения анализа с помощью UV-VIS спектрофотометрии (абс 490 нм). Кумулятивный процент высвобожденного лекарственного вещества (Е г) можно рассчитать по следующей формуле:

ПРИМЕЧАНИЕ: Если м DOX представляет количество DOX в BCMS, V 0 представляет собой общий объем средств массовой информации высвобождения (200 мл), V т является объем замененных носителя (V T = 2 мл), Ci концентрация до коррекции, и с N представляет собой концентрацию DOX в образце.
Access restricted. Please log in or start a trial to view this content.
Результаты
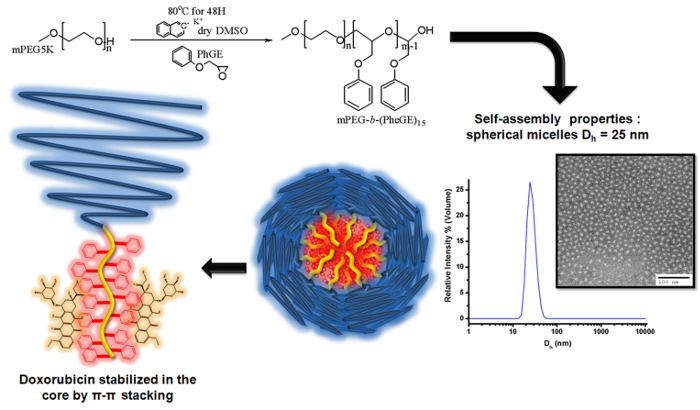
Рисунок 3. Иллюстрация анионной полимеризации фенилглицидиловый эфира на мПЭГ макроинициатора для получения видеоданных MPEG - B - (PheGE) 15 для получения блок - сополимеров мице...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В связи с хорошим контролем, что анионной полимеризации обеспечивает более молекулярным весом является одним из наиболее прикладных процессов в промышленности для получения полимеров на основе оксиэтиленовых мономеров (ПЭГ и ППГ). Оптимальные и жесткие условия должны быть использов?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
Ссылки
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены