Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Anionique Polymérisation d'un copolymère amphiphile pour la préparation du copolymère bloc micelles Stabilisé par π-tc Interactions Stacking
Dans cet article
Résumé
Les principales étapes de polymérisation anionique vivante de l' éther glycidylique de phényle (PheGE) sur méthoxy-polyéthylène glycol (mPEG b -PPheGE) sont décrits. Les micelles de copolymère séquence résultant (SMCA) ont été chargés de doxorubicine 14% (% en poids) et une libération prolongée du médicament pendant 4 jours dans des conditions physiologiquement pertinentes ont été obtenus.
Résumé
Dans cette étude, un copolymère amphiphile comprenant un bloc de formation de noyau avec des groupes phényle a été synthétisé par polymérisation anionique vivante d'éther glycidylique de phényle (PheGE) le méthoxy-polyéthylène glycol (mPEG b -PPheGE). Caractérisation du copolymère a révélé une distribution moléculaire étroite (PDI <1,03) et a confirmé le degré de polymérisation de mPEG 122 - b - (PheGE) 15. La concentration micellaire critique du copolymère a été évaluée en utilisant une méthode de fluorescence établie avec le comportement d'agrégation évaluée par diffusion dynamique de la lumière et microscopie électronique à transmission. Le potentiel du copolymère pour une utilisation dans des applications d'administration de médicaments a été évalué de façon préliminaire , y compris in vitro biocompatibilité, le chargement et la libération du médicament anticancéreux doxorubicine hydrophobe (DOX). Une formulation micellaire stable de DOX a été préparé avec des niveaux stupéfiants de chargement jusqu'à 14% (% en poids), la charge de médicament efficiEncies> 60% (p / p) et la libération prolongée du médicament pendant 4 jours dans des conditions physiologiquement pertinentes (pH acide et neutre, la présence d'albumine). Le niveau de charge élevée de la drogue et la libération prolongée est attribuée à la stabilisation des interactions tc-π entre DOX et le bloc de formation de noyau des micelles.
Introduction
En milieu aqueux, les copolymères à blocs amphiphiles se réunissent pour former des micelles de copolymères à blocs de taille nanométrique (SMCA) qui se composent d'un noyau hydrophobe entouré d'une enveloppe hydrophile ou couronne. Le noyau micellaire peut servir de réservoir pour l'incorporation de médicaments hydrophobes; tandis que la couronne hydrophile fournit une interface entre le noyau et le milieu extérieur. Le poly (éthylène glycol) (PEG) et ses dérivés sont l' une des plus importantes classes de polymères et l' un des plus largement utilisés dans la formulation des médicaments. 1-3 BCMs se sont révélés être une plate - forme de délivrance de médicament digne avec plusieurs formulations reposant sur ce la technologie actuellement en développement clinique de stade tardif. 4 le plus souvent, le bloc hydrophobe du copolymère est constitué par la polycaprolactone, le poly (D, l-lactide), le poly (oxyde de propylène) ou le poly (β-benzyl-l-aspartate). 5 -9
Le groupe de Kataoka étudié micelles sphériques formés à partir de PEO b -PBLA Et de poly (oxyde d'éthylène) - b -. (Doxorubicine conjuguée à l' acide aspartique) pour la livraison de la doxorubicine (DOX) 10,11 Dans leurs rapports, ils ont mis en avant que les interactions π-tc entre le médicament conjugué à un polymère ou PBLA et sans DOX agir pour stabiliser le noyau micellaire entraînant une augmentation de la charge de médicament et de rétention. Il est établi que la compatibilité ou des interactions entre un médicament et le bloc formant noyau sont des déterminants de paramètres de performance liés à clé 12 En plus de la DOX. Un certain nombre de traitements anti - cancéreux comprennent des cycles aromatiques dans leur structure de base (par exemple, le methotrexate, olaparib, SN -38).
En conséquence, il existe un intérêt considérable dans la synthèse de copolymères qui comprennent des cycles de benzyle dans les blocs formant noyau. Polymérisation par ouverture de cycle Anionique de PEG et ses dérivés permettent le contrôle de la masse moléculaire et le résultat dans les matériaux de faible polydispersité avec un bon rendement. 13,14 Ethyleoxyde de ne avec de l' éther glycidylique de phényle (PheGE) ou d' oxyde de styrène (SO) peut être (co) polymérisé pour former des copolymères à blocs qui forment des micelles pour la solubilisation des médicaments hydrophobes. 15-18 Le présent rapport décrit les étapes nécessaires à la polymérisation anionique vivante de phényle l' éther glycidylique monomère sur le mPEG-OH en tant que macroinitiateur (figure 1). Le copolymère séquence résultant et ses agrégats sont ensuite caractérisés en termes de propriétés de la pertinence à utiliser dans l'administration de médicaments.
Access restricted. Please log in or start a trial to view this content.
Protocole
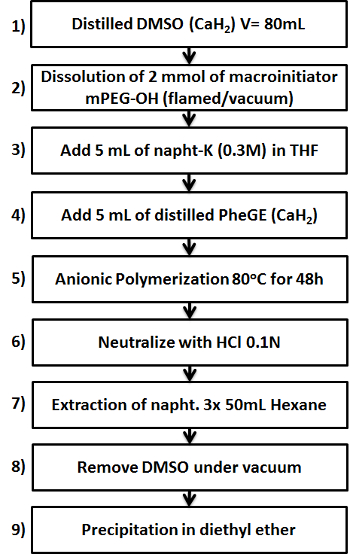
Figure 1. Schéma montrant les neuf étapes clés dans la préparation du copolymère b -PPheGE mPEG. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
1. Préparation des réactifs dans des conditions sèches
- Préparation des réactifs.
- Peser 15 g de mPEG-5K (M n = 5400 g / mol, PDI 1,03) et lieu à 50 ° C dans un four sous vide pendant 48 heures avant utilisation.
- Sec 200 ml de diméthylsulfoxyde (DMSO) sur de l' hydrure de calcium (CaH 2) (~ 1 g), lieu sous vide pendant 30 min, purge sous argon et agiter pendant 48 heures avant utilisation.
- Placer 50 ml du monomère PheGE dans un flacon propre et sec (100 ml), ajouter 1 g de CaH 2, joint sous vide pendant 15 min sur la glace, purge sous argonet laisser agiter pendant 24 heures sous argon avant utilisation.
2. Préparation du naphtalène potassium
- Avec précaution, couper des petits morceaux de sodium (~ 1,5 g) séchée avec de l'hexane pour éliminer l'huile minérale en excès et ajouter au ballon contenant le tétrahydrofurane (THF) (v = 500 ml).
NOTE: Les morceaux de sodium ne doivent pas être exposés à l'air pendant longtemps en raison de risques d'incendie. - Ajouter benzophénone (~ 5 g), purge avec de l'argon et sceller le ballon (2 cols) de bouchons en verre.
- À la suite de l' agitation , sous argon , pendant 24 heures, raccorder le ballon à fond rond à un appareil de distillation (figure 2) distiller la solution foncée sous atmosphère d' argon tout en chauffant au reflux (c. -à reflux pendant environ une période de 2 heures après que la solution vire au bleu). Commencer à recueillir le volume désiré ~ 150 ml de THF, en fermant la valve gauche (qui se trouve au milieu de l'appareil de distillation).
NOTE: Si cette solution ne devient pas bleu, arrêter le distillation, refroidir à la température ambiante (RT) et ajouter plus de benzophénone ou de sodium et redémarrez la distillation. Ceci est une indication que le THF contient encore de l'eau. - Dans un Erlenmeyer sec, ajouter du THF distillé (V = 100 ml) et on dissout 3,9 g de naphtalène.
REMARQUE: Arrêter la distillation, refroidir à température ambiante et ouvrir la valve droite pour transférer le volume de THF. - Comme décrit dans le point 2.1, couper des petits morceaux de potassium (1,1 g) et ajouter à la solution contenant le naphtalène (concentration finale ~ 0,3 mol / L). Sceller le Erlenmeyer avec un adaptateur de rinçage (T) (on / off) avec un septum en haut et purger avec de l'argon.
- Après agitation sous argon pendant 24 heures, observer la solution résultante de la base de naphtalène de potassium comme une couleur vert foncé homogène.
- Dans des conditions inertes, retirer une aliquote de 5 ml de la solution basique du flacon avec une seringue et ajouter 10 ml d'eau distillée. ajouter ensuite 1-2 gouttes d'indicateur phénolphtaléine à cette solution,qui transforme la solution d'une couleur fuchsia.
- Utiliser une burette pour titrer la solution de naphtalène de potassium avec une solution titrée d'acide chlorhydrique (0,1 N) jusqu'à ce que la solution devienne incolore.
3. Matériaux et précautions nécessaires pour la vie efficace Anionique Polymérisation
- Système d'argon / dépression du collecteur.
NOTE: Comme décrit dans la figure 2, un collecteur double verre avec robinets en verre creux est utilisé pour basculer entre la livraison d'argon et de vide conditions dans la verrerie.- Connecter le réservoir d'argon (avec manomètre) à une colonne de desséchant sec et à la ligne de collecteur en utilisant un tube de caoutchouc inerte. A l'autre extrémité de la ligne d'argon, raccorder un barboteur (contenant de l'huile minérale).
- Pour les robinets de verre, raccorder des tubes et des aiguilles inertes flexibles. Pour l'autre ligne du collecteur, connectez un piège en verre immergé dans un flacon à froid Dewar (rempli de glace / eau ou de l'azote liquide) à une pompe à vide.
- Appareil pour la distillation du monomère et du DMSO.
NOTE: Une pratique (ie, tout en un) appareil de distillation sous vide élevé est utilisé (Figure 2). La verrerie sèche est faite avec des vannes à vide poussé, et condenseurs intégré avec une tête réfrigérée intérieure.- Connecter le débit d'eau à travers l'entrée (A) et la sortie (B) de l'unité de refroidissement (lettre). Connectez l'autre entrée / sortie (C) à la double collecteur pour l'argon / vide. Ajouter et sceller un septum (fils métalliques) à la livraison / port d'extraction et de connecter une canule en acier inoxydable pour le transfert de liquides sensibles à l'air (D) (en haut / boucle).
- Avant la polymérisation, distillent PheGE et du DMSO sur le chauffe-ballons hémisphérique à 100 ° C et 70 ° C, respectivement, pendant 2 heures sous vide, sous agitation. Le point d'ébullition du monomère PheGE est 254 ° C, tandis que le point d'ébullition du DMSO est de 189 ° C à (1 atm).
- Verrerie à polymerizat anioniqueion.
- En plus du système de distillation, utiliser uniquement haute verrerie résistant à vide, y compris autour de flacons de fond (certifiés par le fabricant), cylindres graduée (pour le transfert de volumes de solvant, de base et des monomères), canules, septa et des fils métalliques pour sceller les cloisons.
NOTE: Pour la polymérisation vivante, la chaleur avec précaution (sous vide) et refroidir toute la verrerie sous flux d'argon avant utilisation. Gardez le pistolet à air chaud à une distance ~ 10 cm de la verrerie.
- En plus du système de distillation, utiliser uniquement haute verrerie résistant à vide, y compris autour de flacons de fond (certifiés par le fabricant), cylindres graduée (pour le transfert de volumes de solvant, de base et des monomères), canules, septa et des fils métalliques pour sceller les cloisons.
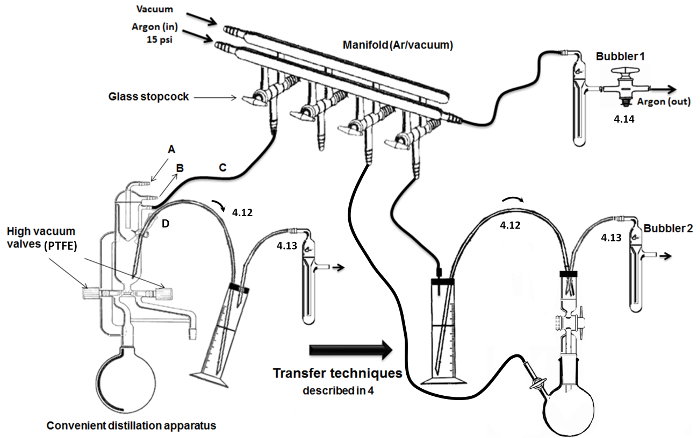
Figure 2. Assemblée et les principales étapes de distillation / transfert. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
4. Description des étapes clés de la vie Anionique Polymérisation: Distillation et le transfert
- Peser mPEG-5K (2 mmol, 10 g) dans un f seclask / Schlenk (four) contenant une barre d'agitation et de sceller l'adaptateur de rinçage (T) (on / off) avec un septum en haut.
- Raccorder le ballon à collecteur et purger le ballon pendant 2-3 min avec des bouffées d'argon. Tourner la vanne à la position de vide pour purger le flacon.
- Faites tourner le ballon manuellement et sécher le récipient de réaction homogène avec un séchoir à cheveux (pistolet à air chaud) jusqu'à mPEG-5K fond.
NOTE: Gardez le pistolet thermique à une distance ~ 10 cm du ballon. - Après 1 min, casser le vide en tournant le robinet sur le collecteur vers la position d'argon avec plusieurs clichés rapides.
NOTE: Un débit d'argon continu doit être observé dans le barboteur. Lorsque l'écoulement est continu, le clapet reste sur la position de l'argon. deux fois chauffage et de refroidissement Répétez les étapes pour éliminer toute trace d'humidité. - Gardez le macroamorceur polymère sous vide pendant ~ 2 h et sous argon avant le début de la réaction.
- Monter deux appareils de distillation sous vide poussé sous le capot (Figure 2); une pour la distillation de DMSO et l'autre pour la distillation du monomère (PheGE).
- Relier les fioles séparées contenant le DMSO et le monomère aux deux dispositifs et installer chacun sur une enveloppe chauffante hémisphérique (ou dans un bain d'huile). Connecter l'eau froide à la partie supérieure de l'appareil (entrée / sortie) et le collecteur (argon / vide).
- Veiller à ce que chaque appareil est sécurisé et bien scellé. Engager le vide par l'intermédiaire de la vanne.
NOTE:. Comme décrit dans l'étape 3.3, répétez étapes de chauffage et de refroidissement deux fois pour éliminer toute trace d'humidité. - Régler le chauffage par l'intermédiaire d'un régulateur de température et commencer l'agitation des solutions. Après 2 heures de circulation / distillation du DMSO, fermer la vanne de vide élevé (qui se trouve au milieu de l'appareil de distillation) pour recueillir environ 20 ml de solution (pour laver l'intérieur de l'appareil). Ensuite, relâchez la fraction dans le flacon et répéter l'opération une fois de plus pour assurer la pureté de la fraction souhaitée qui est collected plus tard.
- Chauffer le flacon contenant le mPEG-5K (sous vide) avec le pistolet à air chaud jusqu'à ce que le polymère (mPEG-5K) fond. Purger à nouveau avec de l'argon.
REMARQUE: La procédure contribuera à la dissolution après le transfert du DMSO. - Après 2 heures, fermer le robinet à vide poussé et de recueillir le volume de solvant (V DMSO = ~ 100 ml). Arrêter le chauffage et casser le vide du collecteur. Libérer l'argon (par boutons-pression) dans la chambre, comme décrit ci-dessus.
- Sous une pression positive d'argon, connecter un côté de la canule (cale au robinet d'arrêt de l'appareil) à une éprouvette graduée ou directement dans le ballon contenant le mPEG-5K (si l'appareil de distillation a graduation), et immerger l'autre extrémité, avec précaution dans la fraction fraîchement distillée.
- En utilisant une pression d'argon conduire le DMSO à travers la canule dans le ballon de réaction. Connecter un barboteur supplémentaire dans le ballon (ou cylindre si nécessaire pour la mesure) et, fermer le robinet de verre relié à the barboteur sur le côté opposé du collecteur.
NOTE: Quand un côté d'une canule est retirée pour le transfert, assurez-vous que la pression d'argon positive est appliquée. - Afin d'éviter tout accident causé par la pression d'argon, ouvrir le robinet de verre pour 1-2 sec et réenclencher pour continuer l'écoulement du DMSO (répété une fois par 0,5 min) jusqu'à ce que le transfert complet est terminé. Rouvrir le robinet lorsque vous avez terminé.
NOTE: La même procédure doit maintenant être suivie pour la distillation et la collecte du monomère. Le solvant et le monomère ne peuvent pas être recueillies en même temps. - Transférer 5 ml de 0,3 M de naphtalène potassium via une canule dans une éprouvette graduée fermée par une cloison avec une canule insérée (boucle).
REMARQUE: Même précaution comme décrit dans NOTE 4.13. une pression positive d'argon doit être maintenue d'abord à partir du flacon de naphtalène de potassium dans le cylindre, puis du cylindre vers le récipient de réaction afin d'éviter / contamination de l'eau de l'air. - Insérez une autre aiguille de la manifold dans le cylindre (argon). Retirer la canule reliée au système de distillation avec précaution et insérer rapidement dans le ballon de réaction.
REMARQUE: Utilisez cette technique pour le transfert de la base et de monomère. - Ajouter la baisse de base à goutte jusqu'à ce que la solution devient sombre. Suite à la lente disparition de la couleur, ajouter une autre partie jusqu'à ce que la couleur sombre apparaît à nouveau, et répéter jusqu'à ce que le transfert complet.
- Transférer le volume souhaité de monomère (V = PheGE 5 ml) pour atteindre un degré de polymérisation de PPheGE ~ n = 18-20.
- Laisser le mélange réactionnel pendant 48 heures à 80 ° C sous atmosphère d'argon avec agitation constante pour assurer une polymérisation complète.
- Stopper la réaction par l'addition de gouttes de HCl 1 N dans du methanol (mesurée en utilisant du papier de tournesol (pH neutre)) et observées par la disparition de la couleur.
- Extraire le naphtalène à partir de la solution de DMSO avec de l'hexane (3 x 50 ml). Éliminer le DMSO par distillation sous vide (~ 70 ml) même appareil. Roucoulerl bas de la solution de suspension et ajouter 50 ml de THF.
- Enlever le sel de la solution en suspension par centrifugation à 5000 xg pendant 10 min. Transférer le surnageant et ajouter goutte à goutte à 500 ml d'éther diéthylique froid.
- Recueillir le précipité par filtration ou centrifugation (répéter deux fois) et sèche sous vide à 30 ° C pendant 24-48 h (rendement 85%).
NOTE: Le copolymère est maintenant prêt pour la caractérisation.
5. Caractérisation des copolymères
- Peser 5-10 mg de copolymère (enregistrement de la masse réelle) dans une coupelle en aluminium et sceller hermétiquement avec le couvercle en aluminium. pan de l'échantillon de charge et pan de référence (vide) dans le calorimètre différentiel à balayage.
- Programme méthode du cycle ( "chaud / froid / chaleur»): 1) la chaleur de 40 ° C à 100 ° C à 10 ° C / min, 2) refroidir à -70 ° C à 10 ° C / min, 3) la chaleur à 100 ° C à 10 ° C / min. Répéter 2) et 3) deux fois. Déterminer le point de fusion (T m), cristallization (T c) et une température de transition vitreuse (T g), et la chaleur de fusion (AHf) à partir des traces thermiques du troisième cycle ( le cas échéant).
- Dissoudre les polymères dans du THF (2 mg / ml) et filtrer à travers un filtre en PTFE de 0,2 pm. Injecter l'échantillon dans un système de chromatographie par perméation de gel (50 ul) et en utilisant le temps de rétention de l'échantillon et d' une courbe d'étalonnage produite en utilisant une gamme de standards de polystyrène pour déterminer le poids moléculaire du polymère. 19
- Dissoudre les (co) polymères (15 mg / ml) dans du DMSO d6 pour RMN 1 H analyse par spectroscopie. 19
- Déterminer la concentration micellaire critique (CMC) du copolymère en utilisant le 1,6-diphényl-1,3,5-hexatriène (DPH) sous forme d' une sonde à fluorescence. 9
- Préparer une solution DPH stock dans le THF (2,32 mg / L) dans l'obscurité et ajouter 100 pi de cette solution mère à chacun d'une série de flacons.
- Prepare une solution de copolymère d'actions dans le THF et ajoute des parties aliquotes de volume égal (2 ml) à la série de flacons (chacun contenant une aliquote de la solution mère DPH) conduisant à des concentrations finales de copolymère allant de 0,01 à 1000 ug de copolymère / ml.
- Par la suite, vortex solutions copolymère-DPH et ajouter goutte à goutte à 10 ml d'eau distillée deux fois avec une barre d'agitation. Les solutions doivent ensuite être agité vigoureusement dans l'obscurité pendant 48 heures sous un courant d'azote pour permettre l'évaporation lente de THF. La concentration finale de DPH dans chaque solution est de 0,232 mg / L.
- Mesurer l'émission de fluorescence des échantillons à 430 nm (λ ex = 350 nm) en utilisant une microplaque spectrofluorimètre à double balayage et la fluorescence de la parcelle en fonction de log [polymère]. L'intersection entre les deux pentes linéaires fournit la valeur CMC pour le copolymère.
6. Procédure de chargement de doxorubicine dans BCMs
- Dissoudre 12 mg de DOX dans 1 ml d'astonitrile, ajouter 10 ul de triéthylamine et de laisser le bruit de la solution dans l'obscurité pendant 2 heures.
- On dissout le copolymère (45 mg) dans 1 ml de THF et on agite pendant la même période de temps. Ajouter la solution de copolymère à la solution de DOX et rincer le flacon contenant un copolymère résiduel avec un volume supplémentaire de THF (0,5 ml).
- Ajouter le mélange copolymère-médicament (2,5 ml) goutte à goutte à une fiole (20 ml) contenant 15 ml de solution saline à 0,9% (NaCl) sous agitation.
- Transférer la solution dans un sac de dialyse (3,5 kDa coupée) et dialyser contre une solution saline à 0,9% (500 ml).
NOTE: Changez la solution saline externe après 6 h et laisser la dialyse continue pendant 24 heures sous agitation dans l'obscurité à la température ambiante. - Transférer le dialysat dans un tube de 50 ml et on centrifuge à 5000 g pendant 15 min.
- Transférer le surnageant dans un système d'ultrafiltration (d'une capacité de 10 ml) contenant une membrane de dialyse (coupure 10 kDa). Mettez l'adaptateur sous agitation dans le système d'ultrafiltration, fermer le couvercle et ouvert commetream d'azote.
- Concentrer la solution BCM à un volume de 4 ml et on ajoute 6 ml d'une solution saline fraîche et répéter la procédure deux fois.
- Concentrer la solution de BCM à 4 ml, rincer la chambre avec 0,5 ml de solution saline et ajouter à la solution. Conserver dans des flacons bruns à la température ambiante dans l'avant utilisation ultérieure sombre.
7. Évaluation de doxorubicine Chargement en DOX-BCMs
- Dissoudre DOX-BCM dans le diméthylformamide (100 pi à 400 pi) de perturber les micelles et diluer dans une solution aqueuse de HCl (0,1 N) avant l'évaluation (100 pi dans 900 ul de HCl 0,1 N).
- Mesurer la charge de médicament à 490 nm en utilisant un système de paillasse microplaques spectrophotométrique. Utilisez les équations suivantes pour déterminer la capacité de chargement de médicament (DLC) et l'efficacité de chargement de médicament (DLE):
DLC (% en poids) = (poids du médicament chargé / poids total de BCMs) x 100%
DLE (%) = (poids de médicament chargé / poids de la drogue dans les aliments) x 100%
8. Evaluationde Libération in vitro de la DOX de DOX-BCMs
- Étudier la libération de la DOX à partir BCMs à 37 ° C dans 0,1 M de tampon phosphate salin (PBS, pH 7,4) contre du PBS pH 7,4 contenant 0,1% (p / v) de Tween 80, BCMs + BSA (50 mg / ml) contre du PBS pH 7,4 et 0,1 M d' acétate-tampon à pH = 5,5. 20,21
- Diluer la formulation BCM-DOX (700 ul) dans le tampon sélectionné (2,3 ml) pour donner une quantité totale de ≈ 0,6-0,7 mg de DOX dans le sac de dialyse.
- Placer la solution dans le sac de dialyse, sceller avec clips et plonger le sac dans 200 ml de médias externes respectifs.
- Enlever 2 ml de la solution à l'extérieur du sac de dialyse à des points de temps prédéterminés et le remplacer par le même volume de tampon frais.
- Conserver les aliquotes retirées à -20 ° C avant l'analyse par spectrophotométrie UV-Vis (Abs 490 nm). Le pourcentage cumulé de médicament libérée (E r) peut être calculée en utilisant l'équation suivante:

REMARQUE: Lorsque m DOX représente la quantité de DOX dans le BCMs, V 0 est le volume total du milieu de libération (200 ml), V t est le volume du milieu remplacé (V t = 2 ml), Ci est la concentration avant la correction, et C n représente la concentration de la DOX dans l'échantillon.
Access restricted. Please log in or start a trial to view this content.
Résultats
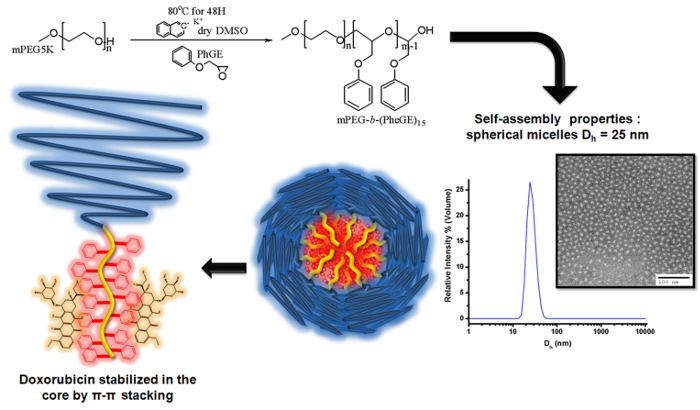
Figure 3. Illustration de la polymérisation anionique de glycidyléther de phényle sur mPEG macroamorceur pour produire b mPEG - (PheGE) 15 pour la préparation de micelles de copolymère séquence pour un chargement de doxorubicine Le schéma illustre la déprotonation du grou...
Access restricted. Please log in or start a trial to view this content.
Discussion
En raison de la bonne maîtrise que la polymérisation anionique fournit plus de poids moléculaire, il est l'un des processus les plus appliqués dans l'industrie pour la préparation de polymères à base de monomères oxirane (PEG et PPG). des conditions optimales et rigoureuses doivent être utilisées avec succès pour la polymérisation à atteindre. purification rigoureuse de tous les réactifs et appareils appropriés sont essentiels pour le caractère vivant de la synthèse. Limitations de la configurat...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
Références
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon