需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一个两亲性共聚物的阴离子聚合通过π-π堆积作用稳定嵌段共聚物胶束的制备
摘要
生活在甲氧基聚乙二醇(MPEG-b -PPheGE)苯基缩水甘油醚(PheGE)的阴离子聚合的关键步骤进行说明。将所得嵌段共聚物胶束(带宽模型)的下生理学上得到有关条件装载阿霉素14%(重量%)和药物的持续释放超过4天。
摘要
在这项研究中,包括与苯基成形芯嵌段的两亲共聚物由甲氧基聚乙二醇(MPEG-b -PPheGE)活苯基缩水甘油醚(PheGE)的阴离子聚合来合成。该共聚物的表征揭示了窄的分子量分布(PDI <1.03),并确认的mPEG 122的聚合度- B - (PheGE)15。使用具有通过动态光散射和透射电子显微镜计算的聚集行为建立荧光法,共聚物的临界胶束浓度进行评价。该共聚物为在药物输送应用中使用的潜力,它初步包括体外生物相容性,装载和疏水性抗癌药物多柔比星(DOX)的释放进行评价。阿霉素的稳定胶束制剂与载药量高达14%(重量%),载药effici制备encies> 60%(W / W)4天以上生理学相关条件(酸性和中性pH值,白蛋白的存在)根据药物的和持续释放。高载药量水平和持续释放归因于稳定DOX和胶束的形成芯块之间的π-π相互作用。
引言
在含水介质中,两亲性嵌段共聚物组装形成纳米尺寸的嵌段共聚物胶束(带宽模型),该组成由亲水壳或电晕包围的疏水核。胶束核心可作为疏水性药物的结合的贮存器;同时,亲水电晕提供核心和外部介质之间的界面。聚(乙二醇)(PEG)和其衍生物是聚合物的最重要的一个类和最广泛使用的药物制剂之一。1-3带宽模型已经被证明是一个值得药物递送平台,靠这个几个配方现在在后期临床开发技术。4最常见的,该共聚物的疏水性嵌段包含聚己内酯,聚(D,L-丙交酯),聚(环氧丙烷)或聚(β-苄基-L-天门冬氨酸)的5 -9
片冈的研究小组调查了来自PEO-b形成球形胶束 -PBLA和聚(环氧乙烷) - B -用于递送阿霉素(DOX)10,11在他们的报告中(聚天冬氨酸共轭多柔比星),他们提出了在聚合物缀合的药物或PBLA之间的π-π相互作用和游离DOX用于稳定导致在药物装载和保留增加胶束芯。它建立了药物和成芯块之间的相容性或相互作用是关键性能相关的参数的决定因素。12除了DOX,一些癌症治疗包括其核心结构( 例如 ,甲氨蝶呤,olaparib,SN内芳环-38)。
其结果存在这样包括在其芯成形块苄环共聚物的合成显著兴趣。 PEG和其衍生物的阴离子开环聚合使以上分子量的控制,导致以良好的收率低多分散性的材料。13,14 Ethyle与苯基缩水甘油醚(PheGE)或氧化苯乙烯NE氧化物(SO)可以是(共)聚合以形成形成胶束为疏水性药物溶解嵌段共聚物。15-18目前的报告描述了活苯基的阴离子聚合的必要步骤缩水甘油基上的mPEG-OH醚单体作为大分子引发剂( 图1)。然后将所得嵌段共聚物和它的聚集体的特征在于相关于药物递送用的特性方面。
Access restricted. Please log in or start a trial to view this content.
研究方案
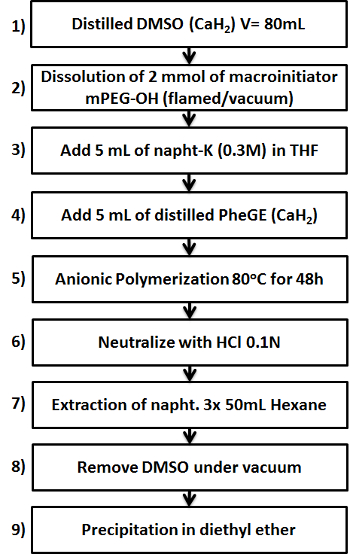
图1.示意图,显示了MPEG-b -PPheGE共聚物的制备九个关键步骤。 请点击此处查看该图的放大版本。
1.受干燥天气影响的试剂准备
- 试剂的制备。
- 在烘箱中在50℃下称重15克的mPEG-5K(M N =5400克/摩尔,PDI 1.03)和地点的真空下,使用前48小时。
- 在真空下干燥200毫升二甲基亚砜(DMSO)氢化钙(CAH 2)(约1克),代替30分钟,在氩气下吹扫和搅拌在使用前48小时。
- 取50毫升PheGE单体在干燥,清洁的瓶(100毫升),在氩气冰真空下添加1克氢化钙2,密封15分钟,清洗和离开搅拌在使用前在氩气下24小时。
2.萘钾的制备
- 小心,切断与己烷干燥钠(〜1.5克)的小块以除去过量的矿物油,并添加到含有四氢呋喃(THF)(V = 500毫升)中的圆底烧瓶中。
注:钠的块不能被暴露在空气中长时间因火灾的危险。 - 添加二苯甲酮(〜5克),吹扫用氩气并密封圆底烧瓶(2颈)玻璃塞。
- 以下在氩气下搅拌24小时后,将圆底烧瓶连接到蒸馏装置( 图2),在氩气下蒸馏深色溶液,同时回流( 即,回流约2小时的时间内后的溶液变成蓝色)。首先关闭左阀(在蒸馏装置的中部中)以收集所需要的体积〜150毫升THF中。
注:如果此解决方案不变成蓝色,停止,夹带特征研,冷却在室温(RT),并增加更多的二苯甲酮或钠,然后重新启动蒸馏。这是THF中仍含有水的指示。 - 在干燥的锥形,加入蒸馏过的THF(V = 100ml)和溶解3.9克萘。
注:停止蒸馏,在RT冷却并打开右阀转移THF中的体积。 - 如在点2.1描述的,切钾(1.1克)的小块,并加入到含有萘(终浓度〜0.3摩尔/升)的溶液中。密封该锥形与在顶部的隔膜的冲洗适配器(T)(开/关)并用氩气吹扫。
- 以下在氩气下搅拌24小时后,观察所得的萘钾碱溶液作为均相深绿颜色。
- 在惰性条件下,除去从烧瓶用注射器碱性溶液的5ml的等分试样,并添加至10毫升蒸馏水。接着添加酚酞指示剂1-2滴至该溶液中,果然解决一个紫红色。
- 使用滴定管滴定用标准盐酸溶液(0.1N),直至溶液变为无色的萘钾溶液。
3.材料和有效活性阴离子聚合必要的预防措施
- 系统氩气/真空装置。
注意: 如图2中所述,中空玻璃旋塞双层玻璃歧管用于在玻璃器皿氩递送和真空条件之间切换。- 氩气(用压力计)的罐连接到一个干干燥剂柱,并使用惰性橡胶管的歧管线。在氩线的另一端,连接鼓泡器(含有矿物油)。
- 玻璃旋塞,连接灵活惰性管和针头。到歧管的另一行,浸入冷杜瓦瓶(装满冰/水或液态氮)的玻璃阱连接到高真空泵。
- 装置单体和DMSO的升华。
注意:一个方便( 即,在同一个),用于在高真空蒸馏装置,采用( 图2)。干燥的玻璃器皿与高真空阀门制成,并内置冷凝器与内冷藏头。- 通过冷却单元(字母)的入口(A)和出口(B)的连接的水流。另一入口/出口(C)连接到氩/真空双歧管。添加并密封在输送/抽取端口隔膜(金属线)和连接的不锈钢插管用于空气敏感的液体转移(D)的(在顶部/循环)。
- 在聚合之前,蒸馏PheGE和DMSO上半球形加热套在100℃和70℃,分别为在真空下2小时同时搅拌。该PheGE单体的沸点是254℃,而对于DMSO中的沸点是在(1个大气压)189℃。
- 玻璃器皿阴离子polymerizat离子。
- 除了蒸馏系统,仅使用高耐真空玻璃器皿包括圆底烧瓶(由生产商认证),量筒(为溶剂,碱和单体的量的转移),插管,隔膜和金属线以密封隔垫。
注:对于仔细活性聚合,热(在真空下),并冷却下,使用前氩气流所有玻璃器皿。保持热风枪在距离约10厘米的玻璃器皿。
- 除了蒸馏系统,仅使用高耐真空玻璃器皿包括圆底烧瓶(由生产商认证),量筒(为溶剂,碱和单体的量的转移),插管,隔膜和金属线以密封隔垫。
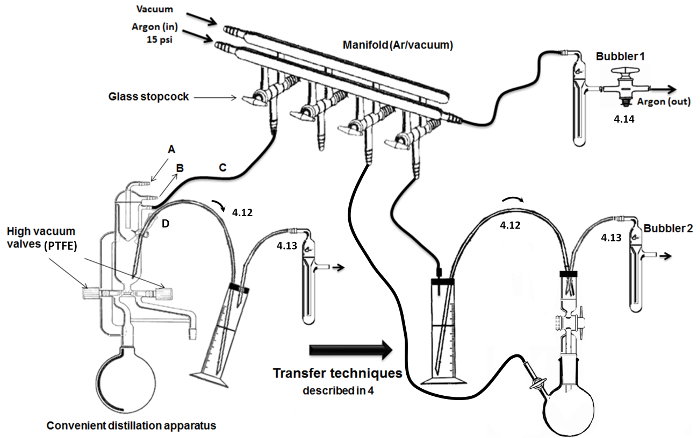
图2.装配和关键蒸馏/传送步骤。 请点击此处查看该图的放大版本。
4.活性阴离子聚合的关键步骤描述:蒸馏和转让
- 在干燥˚F称重的mPEG-5K(2毫摩尔,10克)拉斯克/舒伦克(烤箱)含有搅拌棒和密封冲洗适配器(T)(开/关),顶部隔膜。
- 将烧瓶连接到歧管和吹扫烧瓶2-3分钟用氩气冲洗。转阀至真空位置吹扫烧瓶。
- 手动旋转烧瓶中,并用吹风烘干机(热风枪),直到的mPEG-5K熔化均匀干燥反应容器中。
注意:保持热风枪在距离约10厘米的烧瓶中。 - 1分钟后,通过对几个快速捕捉氩位置歧管旋转阀破坏真空。
注:连续氩气流量在起泡待观察。当流动是连续的,在阀停留在氩气的位置。两次重复加热和冷却步骤,以除去水分的所有痕迹。 - 保持聚合大分子引发剂在真空下为〜2小时,在氩气下将反应开始之前。
- 安装在引擎盖下两高真空蒸馏装置( 图URE 2);一个用于DMSO中蒸馏和一个用于单体(PheGE)的蒸馏。
- 含DMSO和单体的分开的烧瓶连接到两个装置和安装的每个上的半球形加热套(或在油浴)。冷水连接到该装置的顶部(进/出),并在歧管(氩/真空)。
- 保证每个设备是安全的,良好的密封。接合通过阀的真空。
注意:由于在步骤3.3中所述,重复加热和冷却步骤两次,以除去水分的所有痕迹。 - 设置通过温度控制器的加热,并开始搅拌该溶液。后的DMSO循环/蒸馏2小时,关闭高真空阀(在蒸馏装置的中部中)以收集大约20毫升溶液(以洗涤装置的内部)。然后,松开馏分到烧瓶中并重复该操作一次,以确保所期望的级分的纯度是为c后来ollected。
- 加热用热枪直至聚合物含有的mPEG-5K(真空下)的烧瓶(MPEG-5K)熔化。再次用氩气吹扫。
注:DMSO转移手续后,将有助于溶解。 - 2小时后,关闭高真空阀和收集的溶剂的体积(V DMSO =〜100毫升)中。停止加热,打破从歧管的真空。如上所述释放氩(由卡扣)到腔室。
- 在氩气下的正压力,(在该装置的活塞保持)套管的一侧连接到量筒或直接到包含的mPEG-5K(如果该蒸馏装置具有刻度)和烧瓶,浸入的另一端小心翼翼地走进新蒸馏部分。
- 使用氩压力,通过套管驱动DMSO到反应烧瓶中。 (如果需要为测量或气缸)连接一个附加的鼓泡到该烧瓶中,并关闭连接为th玻璃旋塞阀在歧管的相对侧ë起泡。
注意:当套管的一侧为转移除去,确保施加正氩气压。 - 以避免由于氩气压任何事故,打开玻璃旋塞阀1-2秒,并重新关闭直到全部传输完成继续DMSO中的流量(每0.5分钟重复一次)。完成后重新打开水龙头。
注:同样的程序,现在必须遵循的单体蒸馏和收集。溶剂和单体不能同时被收集。 - 传递通过插管5毫升0.3M的萘钾的用套管隔膜插入(循环)密封的量筒。
注:同预防如附注4.13所述。正氩气压,必须首先从萘钾烧瓶到气缸,然后保持从汽缸到反应烧瓶中,以避免空气/水的污染。 - 从manifo插入另一针LD到气缸(氩气)。除去仔细连接到蒸馏系统插管并迅速插入到反应烧瓶中。
注意:使用此技术基础和单体的转移。 - 由滴添加碱下降直至溶液变暗。以下颜色缓慢消失,加入另一部分,直到深色再次出现,并重复直到全部转移。
- 传送单体的期望体积(V PheGE = 5毫升)以达到一定程度的PPheGE〜聚合N = 18-20。
- 离开48小时,在80℃在恒定搅拌下在氩气氛下的反应,以确保完全聚合。
- 淬火通过加入在甲醇中的HCl 1N的滴(使用石蕊试纸(中性pH)测量),并通过一个颜色消失观察到的反应。
- 从用己烷(3×50毫升)的DMSO溶液中提取萘。通过真空蒸馏除去DMSO〜70毫升(相同的装置)。鸪鸪声l倒浆料溶液,并添加50ml THF中。
- 在5000 xg离心除去通过离心从料浆溶液中的盐为10分钟。转移上清液,并加入滴至500ml冷乙醚中。
- 收集通过过滤或离心(重复两次)和在真空下干燥该沉淀物在30℃下24-48小时(产率85%)。
注:该共聚物现在可以用于表征。
5.表征共聚物的
- 在铝样品盘中称量5-10毫克共聚物(记录实际质量),并与铝盖气密地密封。负载样品盘和参考锅(空)到差示扫描量热计。
- 程序的方法("热/冷/热")循环:1)从40℃加热至100℃以10℃/分钟,2)在10℃/分钟冷却至-70℃,3)热以10℃/分钟100℃。重复两次2)和3)。确定熔点(T M),crystallization(T c)和玻璃化转变温度(T g)和融合(ΔHf)对热从第三循环的热迹线(如果适用)。
- 溶解在THF中的聚合物(2毫克/毫升),并通过一个0.2μm的PTFE过滤器进行过滤。将样品注入凝胶渗透色谱系统(50微升),并使用保留时间用于样品和利用一系列聚苯乙烯标准来确定该聚合物的分子量的校准曲线产生。19
- 溶解(共)聚合物(15毫克/毫升)在D 6 DMSO中进行1 H-NMR波谱分析。19
- 确定使用1,6-二苯基-1,3,5-己三烯(DPH),为荧光探针共聚物的临界胶束浓度(CMC)。9
- 制备在THF在黑暗中DPH原液(2.32毫克/升),并添加100μl的这种储备溶液到每一个串联小瓶的。
- 准备工作再在THF共聚物原液,并添加等体积(2ml)中的等分试样与串联小瓶(各自含有DPH原液的等分试样),导致最终共聚物的浓度范围从0.01至1000微克共聚物/毫升。
- 接着,旋涡共聚物-DPH溶液和逐滴加入至10ml的双蒸水,搅拌棒。该溶液然后必须大力在黑暗中在氮气流下搅拌48小时以允许THF中缓慢蒸发。 DPH在每个溶液中的最终浓度为0.232毫克/升。
- 测量采用了双扫描微孔板分光光度计和情节的荧光在430nm处(λ= 前 350纳米)样品的荧光发射与日志[聚合物。两个线性斜坡之间的截距提供了共聚物的CMC值。
6.程序加载到阿霉素带宽模型
- 解散12毫克DOX在1ml王牌tonitrile,在黑暗中加入10微升三乙胺,让该溶液搅拌2小时。
- 溶解在1ml THF中的共聚物(45毫克)和搅拌的时间相同的周期。加入共聚物溶液的DOX溶液和冲洗含有残余共聚物与THF中的一个额外的体积(0.5毫升)的小瓶中。
- 共聚物 - 药物混合物(2.5毫升)逐滴添加到含搅拌15毫升盐水0.9%(NaCl)中的小瓶(20ml)中。
- 转移溶液至透析袋中(3.5 kDa的切断)和透析针对盐水0.9%(500毫升)。
注:更改外部生理盐水后6小时,让透析继续24小时与在室温在黑暗中搅拌。 - 转移的透析到50ml管中并离心以5,000 xg离心15分钟。
- 传递携带渗析膜(切断10 kDa)的上清的超滤系统(用10毫升容量)。把搅拌适配器插入超滤系统,盖上盖子,并公开为氮tream。
- 浓缩BCM溶液4毫升体积以及加6毫升新鲜的生理盐水,并重复该过程两次。
- 浓缩BCM溶液4毫升,冲洗用0.5ml盐水的腔室,并加入到该溶液中。商店中在RT在黑暗中之前进一步使用棕色小瓶中。
7.多柔比星装载在DOX-BCM之评估
- 溶解于二甲基甲酰胺DOX-BCM(100微升400微升)扰乱胶束并在评估之前,盐酸水溶液(0.1N)稀释(900微升0.1盐酸N 100微升)。
- 使用台式微量分光系统在490nm处测量载药量。使用下面的方程式来确定药物装载容量(DLC)和药物装载效率(DLE):
DLC(重量%)=(重量药物的装载BCM之/总重量)×100%
DLE(%)=(重量药物的装载/重量在饲料药物)×100%
8.评估。 在从DOX-带宽模型DOX 体外释放
- 调查DOX的从带宽模型,在37℃的释放在0.1M磷酸盐缓冲对PBS的pH的盐水(PBS,pH 7.4)中7.4含有0.1%(重量/体积)吐温80,带宽模型+ BSA(50毫克/毫升)对PBS pH为7.4和pH为0.1M乙酸缓冲液= 5.5。20,21
- 稀释BCM-DOX制剂(700微升)在所选择的缓冲器(2.3毫升)以导致在透析袋中≈0.6-0.7毫克阿霉素的总量。
- 放置在透析袋中的溶液,用夹子密封和浸入袋入200ml相应的外部介质。
- 在预定的时间点除去将2ml溶液的透析袋的外面,并用相同体积的新鲜缓冲液代替。
- 储存在-20℃通过UV-Vis分光光度法分析前除去等分试样(绝对490纳米 )。药物的释放(E r)的累积百分比可以使用下列公式计算:

注意:其中,m DOX表示DOX的在带宽模型的量,V 0是释放介质(200毫升)的总体积,V t是替换介质的体积(V t = 2 时毫升)中,Ci为浓度修正前,和C n表示DOX的样品中的浓度。
Access restricted. Please log in or start a trial to view this content.
结果
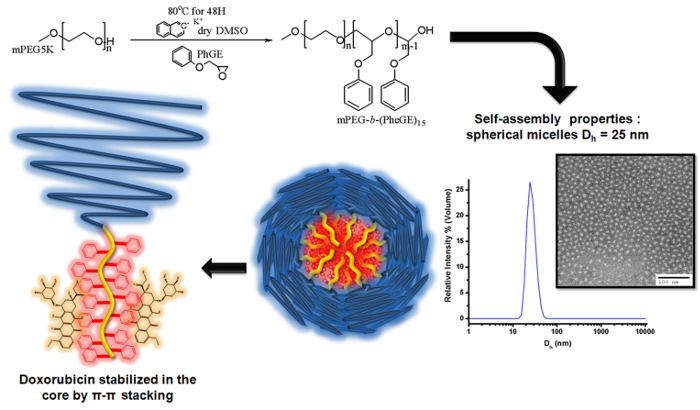
图3. 苯基缩水甘油醚的基于MPEG大分子引发剂阴离子聚合的插图制作MPEG- 期 B - (PheGE)15 制备嵌段共聚物胶束的阿霉素的装载示意图使用萘钾说明了羟基的mPEG的去质子化。作为自由基阴离子,其次是苯基缩水甘油醚(PheGE)单体?...
Access restricted. Please log in or start a trial to view this content.
讨论
由于良好的控制了阴离子聚合提供了对分子量它是业界最实用的流程的基础上环氧乙烷单体(PEG和PPG)聚合物的制备方法之一。必须使用最佳和严格的条件为,以实现成功的聚合。所有试剂和适当的装置的严格纯化是用于合成的活性质至关重要。当前设置的限制大多与依赖于插管传输技术相关。使用适当的压力,插管是为学术设置一个安全的实验室规模的技术。施加这些预防措施将提供更好的在?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
参考文献
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。