É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aniônico polimerização de um copolímero anfifílicas para Preparação de copolímero em bloco As micelas estabilizada por interacções de empilhamento π-¸
Neste Artigo
Resumo
Os principais passos da vida polimerização aniônica de éter fenil glicidílico (PheGE) sobre metoxi-polietileno glicol (MPEG-b -PPheGE) são descritos. As micelas de copolímero em bloco resultante (SGCN) foram carregados com doxorrubicina 14% (% em peso) e de libertação sustentada de fármaco durante 4 dias sob condições f isiologicamente relevantes foi obtido.
Resumo
Neste estudo, um copolímero anfifílico que inclui um bloco de formação de núcleo, com grupos fenilo foi sintetizado por polimerização aniónica vivo de éter fenil glicidílico (PheGE) em metoxi-polietileno-glicol (MPEG-b -PPheGE). Caracterização do copolímero revelou uma distribuição estreita molecular (PDI <1,03) e confirmado o grau de polimerização de mPEG 122 - b - (PheGE) 15. A concentração crítica de micelas de copolimero foi avaliada usando um método de fluorescência estabelecida com o comportamento de agregação avaliada por dispersão dinâmica de luz e microscopia electrónica de transmissão. O potencial do copolímero para o uso em aplicações de distribuição de droga foi avaliada de uma forma preliminar, incluindo biocompatibilidade in vitro, o carregamento e a libertação da doxorrubicina hidrofóbico de drogas anti-cancro (DOX). Uma formulação micelar estável de DOX foi preparado com níveis de carga de fármaco até 14% (% em peso), carga de fármaco efficiacetatos> 60% (w / w) e de libertação sustentada de fármaco durante 4 dias sob condições f isiologicamente relevantes (pH ácido e neutro, a presença de albumina). O nível de carga elevada de droga de libertação sustida e é atribuída a estabilizar as interacções entre π ¸-DOX e o bloco de formação de núcleo das micelas.
Introdução
Em meios aquosos, copolímeros em bloco anfifílicos montar para formar micelas de copolímeros de blocos de tamanho nano (SGCN) que consistem de um núcleo hidrófobo rodeado por uma camada hidrófila ou corona. O núcleo da micela pode servir como um reservatório para a incorporação de fármacos hidrófobos; enquanto, a coroa hidrofílica fornece uma interface entre o núcleo e o meio externo. Poli (etileno glicol) (PEG) e seus derivados são uma das mais importantes classes de polímeros e um dos mais amplamente utilizados na formulação de fármaco. 1-3 BCMs provaram ser uma plataforma de entrega de droga digno com várias formulações contando com este tecnologia agora em desenvolvimento clínico de fase tardia. 4 Mais vulgarmente, o bloco hidrofóbico do copolímero é constituído por poli-caprolactona, poli (D, L-lactido), poli (óxido de propileno) ou poli (β-benzil-L-aspartato). 5 -9
O grupo de Kataoka investigado micelas esféricas formadas a partir de b PEO- -PBLA E poli (óxido de etileno) - b -. (Doxorrubicina conjugado-ácido poliaspártico) para entrega da doxorrubicina (DOX) 10,11 Em seus relatórios, eles dizem que as interações π-¸ entre a droga polímero conjugado ou PBLA e DOX livre actuar para estabilizar o núcleo micelar resultando em aumentos da carga e retenção da droga. É estabelecido que a compatibilidade ou interações entre uma droga e o bloco formando-core são determinantes de parâmetros-chave relacionados com o desempenho 12 Além de DOX., Uma série de cancro terapêutica incluem anéis aromáticos dentro da sua estrutura de núcleo (por exemplo, metotrexato, olaparib, SN -38).
Como resultado, existe um interesse significativo na síntese de copolímeros que incluem anéis de benzilo em seus blocos de formação de núcleo. Polimerização de PEG e os seus derivados aniónicos de abertura de anel permitir o controlo sobre o peso molecular e resulta em materiais de baixa polidispersão com um bom rendimento. 13,14 éthyleóxido de ne com éter fenil glicidílico (PheGE) ou óxido de estireno (SO) pode ser (co) polimerizado para formar copolímeros em bloco que formam micelas para a solubilização de fármacos hidrofóbicos. 15-18 O presente relatório descreve os passos necessários para viver polimerização aniônica de fenil glicidil monómero de éter em mPEG-OH como macroiniciador (Figura 1). O copolímero em bloco resultante e seus agregados são então caracterizados em termos de propriedades relevantes para a utilização na entrega da droga.
Access restricted. Please log in or start a trial to view this content.
Protocolo
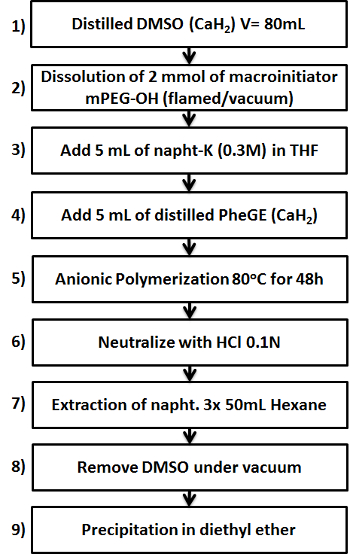
Figura 1. Diagrama esquemático mostrando os nove passos fundamentais na preparação do copolímero b -PPheGE MPEG. Por favor clique aqui para ver uma versão maior desta figura.
1. Preparação dos reagentes sob condições secas
- Preparação dos reagentes.
- Pesar 15 g de mPEG-5K (Mn = 5400 g / mol, 1,03 PDI) e colocar a 50 ° C num forno sob vácuo durante 48 horas antes da utilização.
- Secas 200 ml de sulfóxido de dimetilo (DMSO) sobre hidreto de cálcio (CaH2) (~ 1 g), coloca-se sob vácuo durante 30 min, purga de árgon e sob agitação durante 48 h antes da utilização.
- Colocar 50 ml do monómero PheGE num balão limpo e seco (100 ml), adicionar 1 g de CaH 2, selo sob vácuo durante 15 minutos em gelo, sob atmosfera de árgon purgae deixar a agitar durante 24 hr sob árgon antes do uso.
2. Preparação do naftaleno de potássio
- Cuidadosamente, cortou pequenos pedaços de sódio (~ 1,5 g) secou-se com hexano para remover o óleo mineral e o excesso de adicionar ao balão de fundo redondo contendo o tetra-hidrofurano (THF) (V = 500 ml).
NOTA: Os pedaços de sódio não deve ser exposto ao ar por muito tempo devido ao risco de incêndio. - Adicionar benzofenona (~ 5 g), purga com árgon e selar o frasco redondo (2 pescoços) de rolhas de vidro.
- Após agitação sob árgon durante 24 h, ligar o balão de fundo redondo com um aparelho de destilação (Figura 2), destilar a solução escura ao refluxo, sob árgon, enquanto (por exemplo, refluxo durante cerca de um período de 2 horas após a solução torna-se azul). Comece a recolher o volume pretendido ~ 150 ml de THF, fechando a válvula esquerda (encontrada no meio do aparelho de destilação).
NOTA: Se esta solução não ficar azul, parar a destilarlação, arrefecer à temperatura ambiente (RT) e adicionar mais benzofenona ou sódio e reiniciar a destilação. Esta é uma indicação de que THF ainda contém água. - Em um Erlenmeyer seco, adicionar THF destilado (V = 100 ml) e dissolvem-se 3,9 g de naftaleno.
NOTA: Pare a destilação, arrefecer à temperatura ambiente e abra a válvula direito de transferir o volume de THF. - Conforme descrito no ponto 2.1, cortar pequenos pedaços de potássio (1,1 g) e adicionar à solução contendo o naftaleno (concentração final ~ 0,3 mol / L). Selar o Erlenmeyer com um adaptador de flushing (T) (on / off) com um septo no topo e purgar com árgon.
- Após agitação sob árgon durante 24 h, observar a solução resultante da base de naftaleno de potássio como uma cor verde escura homogénea.
- Sob condições inertes, remover uma alíquota de 5 ml da solução de base a partir do frasco com uma seringa e adicionar 10 ml de água destilada. Subsequentemente adicionar 1-2 gotas de indicador fenolftaleína, a esta solução,que transforma a solução uma cor fúcsia.
- Use uma bureta para titular a solução de naftaleno de potássio com uma solução padrão de ácido clorídrico (0,1 N) até que a solução se torne incolor.
3. Materiais e precauções necessárias para a efetiva estar Aniônicos Polimerização
- Sistema de árgon / colector de vácuo.
NOTA: Como descrito na Figura 2, um colector de vidro duplo com torneiras de vidro oco é usado para alternar entre as condições de entrega de argônio e de vácuo no vidro.- Conecte o tanque de árgon (com manómetro) a uma coluna dessecante seco e para a linha de colector utilizando tubos de borracha inerte. Na outra extremidade da tubagem de árgon, ligar um borbulhador (contendo óleo mineral).
- Para as torneiras de vidro, conecte tubos inertes flexíveis e agulhas. Para a outra linha do colector, ligar uma armadilha de vidro imerso num frasco de Dewar frio (cheio com gelo / água ou azoto líquido) a uma bomba de alto vácuo.
- Aparelho de destilação de monómero e DMSO.
NOTA: Um conveniente (isto é, todos em um) aparelho para destilação sob vácuo elevado é empregue (Figura 2). O material de vidro seco é feita com válvulas de alto vácuo e condensadores built-in com uma cabeça refrigerado interior.- Ligue o fluxo de água através da entrada (A) e de saída (B) da unidade de arrefecimento (carta). Ligue a outra entrada / saída (C) para o colector de dupla por árgon / vácuo. Adicionar e selar um septo (fios de metal) no orifício de distribuição / extracção e conectar de uma cânula de aço inoxidável para a transferência de líquidos sensíveis ao ar (D) (no topo / ciclo).
- Antes da polimerização, destilar PheGE e DMSO em mantos de aquecimento hemisféricas a 100 ° C e 70 ° C, respectivamente, durante 2 horas sob vácuo com agitação. O ponto de ebulição do monómero PheGE é 254 ° C, enquanto que o ponto de ebulição de DMSO é de 189 ° C a (1 atm).
- Copos para polymerizat aniônicaíon.
- Em adição ao sistema de destilação, utilizar apenas alta artigos de vidro resistente ao vácuo incluindo rodada balões de fundo (autenticadas pelo fabricante), formou-se cilindros (para a transferência de volumes de solvente, de base e de monómeros), cânulas, septos e fios de metal para selar a septos.
NOTA: Para a polimerização, o calor de estar cuidadosamente (sob vácuo) e arrefecer o material de vidro sob fluxo de árgon antes de ser utilizado. Manter a pistola de ar quente a uma distância de 10 cm ~ a partir do material de vidro.
- Em adição ao sistema de destilação, utilizar apenas alta artigos de vidro resistente ao vácuo incluindo rodada balões de fundo (autenticadas pelo fabricante), formou-se cilindros (para a transferência de volumes de solvente, de base e de monómeros), cânulas, septos e fios de metal para selar a septos.
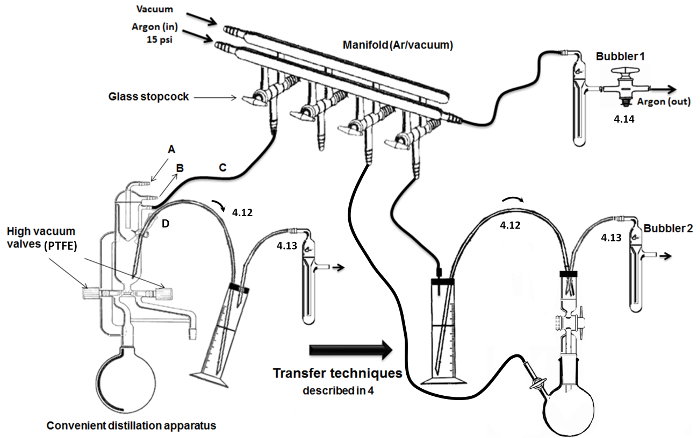
Figura 2. Montagem e principais etapas de destilação / transferência. Por favor clique aqui para ver uma versão maior desta figura.
4. Descrição das principais etapas de estar Aniônicos Polimerização: Destilação e Transferência
- Pesar-mPEG 5K (2 mmol, 10 g) em um F secolask / Schlenk (forno), contendo uma barra de agitação e selar o adaptador de flushing (T) (on / off) com um septo no topo.
- Ligar o balão ao colector e purgar o balão durante 2-3 min com ondas de argônio. Girar a válvula para a posição de vácuo para purgar o balão.
- Rodar o balão manualmente e secar o recipiente de reacção de forma homogénea com um secador de sopro (pistola de calor) até mPEG 5K-derrete.
NOTA: Manter a pistola de ar quente a uma distância ~ 10 cm do balão. - Após 1 min, quebrar o vácuo, rodando a válvula do distribuidor na direcção da posição de árgon com vários fechos rápidos.
NOTA: Um fluxo de árgon contínua tem de ser observado no borbulhador. Quando o fluxo é contínuo, a válvula fica na posição de árgon. aquecimento e refrigeração Repita os passos duas vezes para remover todos os vestígios de humidade. - Manter o macroiniciador polimérico sob vácuo durante ~ 2 horas e sob atmosfera de árgon antes da reacção começar.
- Mount dois aparelhos de destilação de alto vácuo sob o capô (Figure 2); uma para a destilação de DMSO e um para a destilação do monómero (PheGE).
- Ligar os frascos separados contendo o DMSO e o monómero para os dois aparelhos e instalar cada um em uma manta de aquecimento hemisférica (ou em um banho de óleo). Ligação de água fria à parte superior do aparelho (entrada / saída) e ao colector (árgon / vácuo).
- Certifique-se de que cada aparelho é seguro e bem selada. Envolver o vácuo através da válvula.
NOTA:. Conforme descrito na etapa 3.3, repita os passos de aquecimento e arrefecimento duas vezes para remover todos os vestígios de humidade. - Definir o aquecimento por meio de um controlador de temperatura e iniciar agitação as soluções. Após 2 horas de circulação / destilação de DMSO, fecha a válvula de vácuo elevado (que se encontra no meio do aparelho de destilação) para recolher cerca de 20 ml de solução (para lavar o interior do aparelho). Em seguida, libertar a fracção para o balão e repetir a operação mais uma vez para assegurar a pureza da fracção desejada que é collected mais tarde.
- Aquecer o balão contendo o mPEG-5K (sob vácuo) com a pistola de calor até que o polímero (mPEG-5K) derrete. Purga-se com árgon novamente.
Nota: O procedimento irá ajudar a a dissolução, após a transferência do DMSO. - Após 2 h, fechar a válvula de alto vácuo e recolher o volume de solvente (DMSO V = ~ 100 ml). Parar o aquecimento e quebrar o vácuo do colector. Libertar árgon (por encaixe) para dentro da câmara, como descrito acima.
- Sob uma pressão positiva de árgon, ligar um lado da cânula (preensão na torneira de passagem do dispositivo) para um cilindro graduado ou directamente para o balão contendo o mPEG-5K (se o aparelho de destilação tem graduação) e, mergulhar a outra extremidade cuidadosamente na fracção de destilado de fresco.
- Usando a pressão de árgon, a unidade de DMSO através da cânula para o balão de reacção. Ligue um bubbler extra para o frasco (ou cilindro se necessário para a medição) e, feche a torneira de vidro conectado ao the borbulhador, no lado oposto da conduta de distribuição.
NOTA: Quando um lado de uma cânula é retirada para a transferência, certifique-se de que a pressão de árgon positiva é aplicada. - Para evitar acidentes causados por pressão de árgon, abrir a torneira de vidro durante 1-2 segundos e religar para continuar o fluxo de DMSO (repetido uma vez por cada 0,5 min) até à transferência completa é concluída. Reabrir a torneira quando terminar.
NOTA: O mesmo procedimento deve agora ser seguido para destilação e recolha do monômero. O solvente e o monómero não pode ser recolhida ao mesmo tempo. - Transferência de 5 ml de potássio 0,3 M naftaleno via canulação em um cilindro graduado selado por um septo com cânula inserida (loop).
NOTA: A mesma precaução conforme descrito na nota 4.13. pressão de árgon positiva deve ser mantido primeiro a partir do balão de naftaleno de potássio, para o cilindro e, em seguida, a partir do cilindro para o balão de reacção para evitar a contaminação de ar / água. - Insira outro agulha do manifold para dentro do cilindro (árgon). Remover a cânula ligada ao sistema de destilação cuidadosamente e inserir-se rapidamente no balão de reacção.
NOTA: Use esta técnica para a transferência de base e monômero. - Adicionar gota a base de a gota, até a solução torna-se escura. Seguindo o lento desaparecimento de cor, adicionar uma outra parte até que a cor escura aparece novamente, e repita até que a transferência total.
- Transferir o volume desejado de monómero (V PheGE = 5 mL) para atingir um grau de polimerização de PPheGE ~ N = 18-20.
- Deixar a mistura reaccional durante 48 h a 80 ° C sob atmosfera de árgon, com agitação constante para assegurar uma polimerização completa.
- Extingue-se a reacção por adição de gotas de HCl 1 N em metanol (medido usando papel de tornassol (pH neutro)) e observadas por um desaparecimento de cor.
- Extrair o naftaleno a partir da solução de DMSO com hexano (3 x 50 ml). Remover o DMSO por destilação a vácuo ~ 70 ml (mesmo aparelho). arrulharl para baixo a solução pasta e adicionar 50 ml de THF.
- Remover o sal a partir da solução de lama por centrifugação a 5000 xg durante 10 min. Transferir o sobrenadante e adicionar gota a gota a 500 ml de éter dietílico frio.
- Recolhe-se o precipitado por filtração ou centrifugação (repetir duas vezes) e seco sob vácuo a 30 ° C durante 24-48 horas (rendimento de 85%).
NOTA: O copolímero está agora pronto para caracterização.
5. Caracterização dos copolímeros
- Pesar 5-10 mg de copolímero (registro a massa real) em um prato de amostra de alumínio e selar hermeticamente com a tampa de alumínio. prato de amostra de carga e pan de referência (vazia) na calorimetria exploratória diferencial.
- Programa de um método ( "calor / frio / calor") ciclo: 1) aquecimento de 40 ° C a 100 ° C a 10 ° C / min, 2) arrefecer a -70 ° C a 10 ° C / min, 3) de calor a 100 ° C a 10 ° C / min. Repetir 2) e 3) duas vezes. Determinar o ponto de fusão (T m), crystallization (T C) e temperaturas de transição vítrea (Tg), e calor de fusão (AH f) a partir de vestígios térmica a partir do terceiro ciclo (se aplicável).
- Dissolver os polímeros em THF (2 mg / ml) e filtrar através de um filtro de PTFE de 0,2 mm. Injectar a amostra num sistema de cromatografia de permeação em gel (50 ul) e usar o tempo de retenção para a amostra e uma curva de calibração produzida usando uma variedade de padrões de poliestireno para determinar o peso molecular do polímero. 19
- Dissolve-se os (co) polímeros (15 mg / ml) em DMSO d 6 para uma análise de espectroscopia de H-RMN. 19
- Determinar a concentração micelar crítica (CMC) do copolímero utilizando 1,6-difenil-1,3,5-hexatrieno (DPH) como uma sonda de fluorescência 9.
- Prepara-se uma solução stock de DPH em THF (2,32 mg / L) no escuro e adicionar 100 ul desta solução de estoque de cada um de uma série de tubos de ensaio.
- Prepare uma solução de copolímero em THF e adicionar aliquotas de volume igual (2 ml) para a série de tubos de ensaio (cada uma contendo uma alíquota da solução-mãe DPH), resultando em concentrações finais que variam de copolímero de 0,01 a 1000 ^ g de copolímero / ml.
- Subsequentemente, o copolímero de vórtice-DPH soluções e adicionar gota a gota a 10 ml de água duplamente destilada com agitação bar. As soluções devem ser, em seguida, agitou-se vigorosamente no escuro durante 48 h sob uma corrente de azoto para permitir evaporação lenta de THF. A concentração final de DPH em cada solução é 0,232 mg / L.
- Medir a emissão de fluorescência das amostras a 430 nm (λ ex = 350 nm) utilizando um espectrofluorómetro de microplacas dupla de varrimento de trama e de fluorescência em função de log [polímero]. A intercepção entre as duas pistas lineares fornece o valor de CMC para o copolímero.
6. procedimento para carregar doxorrubicina em BCMs
- Dissolve-se 12 mg de DOX em 1 ml de acetonitrile, adicionar 10 ul de trietilamina e deixar a agitar solução no escuro durante 2 horas.
- Dissolve-se o copolímero (45 mg) em 1 ml de THF e agita-se durante o mesmo período de tempo. Adicionar a solução de copolímero à solução de DOX e enxaguar o frasco contendo copolímero residual com um volume adicional de THF (0,5 ml).
- Adicionar a mistura de copolímero-medicamento (2,5 ml) gota a gota a um frasco (20 ml) contendo 15 ml de solução salina a 0,9% (NaCl) com agitação.
- Transferir a solução para um saco de diálise (3,5 kDa cortado) e diálise contra solução salina a 0,9% (500 ml).
NOTA: Alterar a solução salina externo depois de 6 horas e deixou a diálise continuar durante 24 horas com agitação no escuro a RT. - Transferir o dialisado para um tubo de 50 ml e centrifugar a 5000 xg durante 15 min.
- Transferir o sobrenadante para um sistema de ultraf iltração (com uma capacidade de 10 ml) que contém uma membrana de diálise (cut off 10 kDa). Coloque o adaptador mexendo no sistema de ultrafiltração, feche a tampa e aberta ao maiortream de nitrogênio.
- Concentra-se a solução de BCM para um volume de 4 ml e adicionar 6 mL de solução salina fresca e repetir o procedimento duas vezes.
- Concentra-se a solução de BCM para 4 ml, lavar a câmara com 0,5 ml de soro fisiológico e adiciona-se à solução. Loja em frascos castanhos a RT no antes de posterior utilização escuro.
7. Avaliação da doxorrubicina Carregando no DOX-BCMs
- Dissolve-DOX BCM em dimetilformamida (100 uL em 400 uL) para romper as micelas e dilui-se em solução aquosa de HCl (0,1 N) antes da avaliação (100 uL em 900 uL de HCl 0,1 N).
- Medir a carga de droga a 490 nm, utilizando um sistema de bancada de microplacas espectrofotométrico. Use as seguintes equações para determinar a capacidade de carga de fármaco (DLC) e a eficiência de carga de fármaco (DLE):
DLC (% em peso) = (peso de droga carregada / peso total de BCMs) x 100%
DLE (%) = (peso de droga carregada / peso de droga na alimentação) x 100%
8. Avaliaçãode libertação in vitro de DOX de DOX-BCMs
- Investigar a libertação de DOX do BCMs a 37 ° C em solução salina 0,1 M tamponada com fosfato (PBS, pH 7,4) contra PBS pH 7,4 contendo 0,1% (w / v) de Tween 80, BCMs + BSA (50 mg / ml) contra PBS pH 7,4, e acetato-tampão a pH 0,1 H = 5,5. 20,21
- Dilui-se a formulação BCM-DOX (700 ul) em tampão escolhido (2,3 ml) para resultar numa quantidade total de 0,6-0,7 Å mg de DOX no saco de diálise.
- Colocar a solução no saco de diálise, selar com clipes e mergulhar o saco em 200 ml de os respectivos meios externos.
- Retirar 2 ml da solução do lado de fora do saco de diálise em pontos de tempo predeterminados e substituir com o mesmo volume de tampão fresco.
- Armazenar as alíquotas retiradas a -20 ° C antes da análise por espectrometria de UV-Vis (Abs 490 nm). A percentagem cumulativa de fármaco libertado (E R) pode ser calculada usando a seguinte equação:

NOTA: Onde m DOX representa a quantidade de DOX nas BCMs, V 0 é o volume total do meio de libertação (200 ml), V t é o volume dos meios de comunicação substituídos (Vt = 2 ml), Ci é a concentração antes da correcção, e C N representa a concentração de DOX na amostra.
Access restricted. Please log in or start a trial to view this content.
Resultados
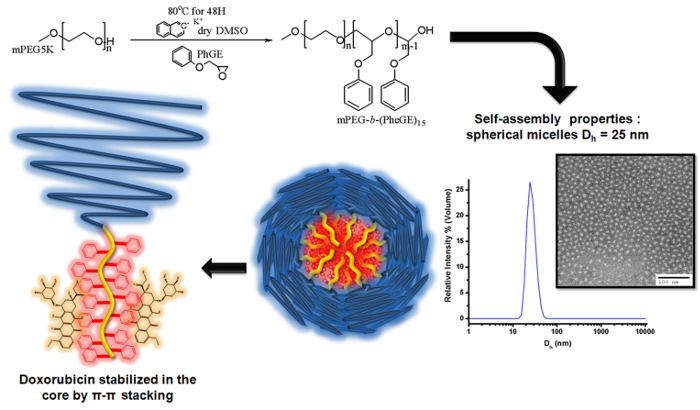
Figura 3. Ilustração da polimerização aniónica de éter de glicidilo de mPEG fenil macroiniciador para produzir MPEG-b - (PheGE) 15 para a preparação de micelas de copolímero em bloco para o carregamento de doxorrubicina O esquema ilustra a desprotonação do grupo hidroxilo de mPEG utilizando naftaleno de potáss...
Access restricted. Please log in or start a trial to view this content.
Discussão
Devido a um bom controlo de polimerização aniónico que proporciona sobre o peso molecular, é um dos processos mais utilizados na indústria para a preparação de polímeros à base de monómeros oxirano (PEG e PPG). As condições óptimas e rigorosas deve ser utilizado para a polimerização com êxito para ser conseguida. purificação rigorosa de todos os reagentes e aparelhos adequados são essenciais para o personagem vivo da síntese. Limitações da configuração atual está geralmente associada à técnica...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
Referências
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados